2.3 第2课时 化学反应的限度 课件 (共63张PPT)
文档属性
| 名称 | 2.3 第2课时 化学反应的限度 课件 (共63张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-20 00:00:00 | ||
图片预览










文档简介
(共63张PPT)
0
第2章 化学键 化学反应规律
第3节 化学反应的快慢和限度
第2课时 化学反应的限度
核心素养 学业要求
发展对化学变化的微观认识,认识化学反应是有一定限度的,培养变化观念与平衡思想。 1.了解可逆反应的含义,知道可逆反应在一定条件下能达到化学平衡。
2.理解化学平衡的特征与标志,能够判断平衡状态。
3.通过探究温度对2NO2(g) N2O4(g)的化学平衡的影响,理解化学平衡的移动及条件对化学平衡的影响。
学生自主学习
01
课时作业
03
目录
CONTENTS
课堂互动探究
02
学生自主学习
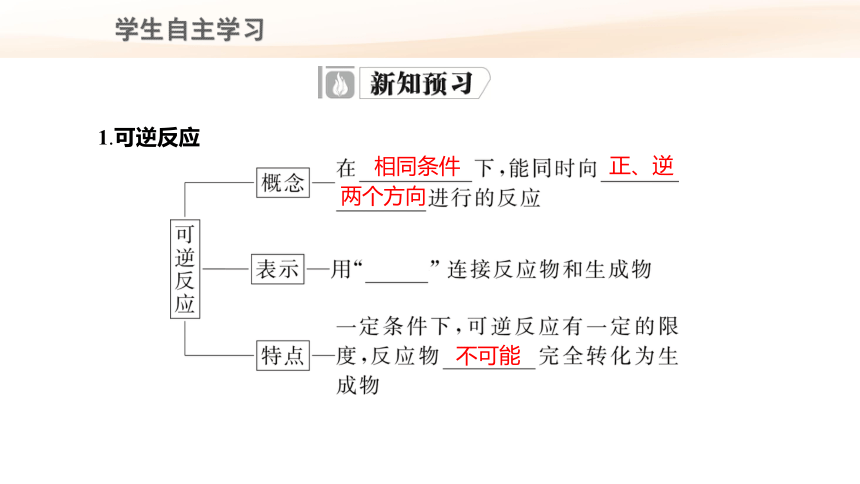
1.可逆反应
相同条件
正、逆
不可能
两个方向
一个对象 一个条件 一个相等 一个不变
____________ 一定条件 ___________________________相等 ______________________不再随时间的延长而发生变化
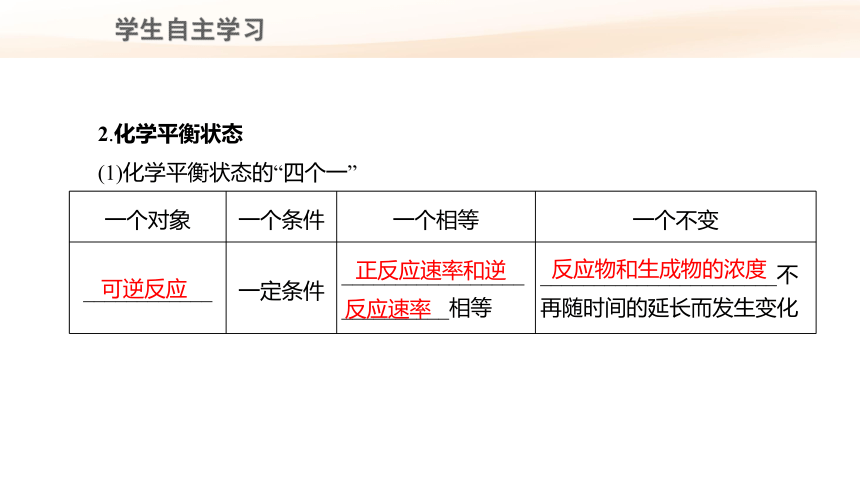
2.化学平衡状态
(1)化学平衡状态的“四个一”
可逆反应
正反应速率和逆反应速率
反应物和生成物的浓度
(2)特征
①化学平衡是一种_______平衡,即在平衡状态时化学反应仍在进行,但反应混合物的组成保持不变。
②当外界条件改变时,原化学平衡状态_________,在新的条件下会达到________________。
③化学平衡状态通常会受到__________________等因素的影响,了解并调控化学平衡对于化工生产来说具有十分重要的意义。
动态
被破坏
新的平衡状态
浓度、温度、压强
1.判断正误,正确的打“√”,错误的打“×”。
(1)对任何化学反应,只要一种反应物过量,就可以将另一种反应物完全转化为生成物。( )
(2)将2 mol SO2和1 mol O2在一定条件下充分反应,反应后体系中只存在2 mol SO3。( )
(3)可逆反应达到平衡时,各组分的浓度都相同。( )
(4)可逆反应达到平衡时,反应就停止了。( )
×
×
×
×
(5)在一定条件下,当反应2SO2(g)+O2(g) 2SO3(g)达到平衡时,反应混合物中SO2、O2、SO3的物质的量之比一定为2∶1∶2。( )
(6)当一个可逆反应达到化学平衡状态,其根本原因是v正=v逆。( )
(7)一定条件下发生的可逆反应,当各物质的物质的量或物质的量分数不再变化时,该可逆反应一定达到了化学平衡状态。( )
√
×
√
3.反应H2(g)+I2(g) 2HI(g)为可逆反应,在一定条件下,向密闭容器中充入1 mol H2和3 mol的I2蒸气,充分反应后,该容器内( )
A.1 mol H2已耗尽 B.3 mol I2已耗尽
C.HI的物质的量为2 mol D.HI的物质的量少于2 mol
4.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度相等
C.达到化学平衡时,正反应和逆反应的速率都为0
D.达到化学平衡时,3v正(N2)=v逆(H2)
解析 当1 mol N≡N键断裂的同时,必然有3 mol H—H键断裂,而现在有3 mol H—H键形成,故H—H键断裂和形成的量相等,则H2的物质的量不改变,一定为平衡状态,故A正确。
课堂互动探究
探究一 化学反应的限度
1.可逆反应的特点
2.化学平衡
(1)化学平衡的建立
用图表示如下:
(2)化学平衡的特征
1.下列关于化学平衡的说法中,不正确的是( )
A.当可逆反应达到平衡时,正、逆反应速率都为零
B.当可逆反应达到化学平衡时,正、逆反应速率一定相等
C.当可逆反应达到化学平衡后,改变某些条件可以使平衡破坏
D.当可逆反应达到平衡时,正、逆反应都还在进行,各物质的浓度不再改变
2.在一密闭容器中进行反应2SO2(g)+O2(g) 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.6 mol·L-1、0.3 mol·L-1、0.6 mol·L-1,当反应至正、逆反应速率相等时,可能存在的状态是( )
A.SO2为1.2 mol·L-1、O2为0.6 mol·L-1
B.SO2为0.75 mol·L-1
C.SO2、SO3均为0.45 mol·L-1
D.SO3为1.2 mol·L-1
解析 由题意可知若SO3全部转化为SO2和O2,则SO2、O2的浓度分别为1.2 mol·L-1、0.6 mol·L-1;而若SO2和O2全部化合成SO3,则SO3的浓度为1.2 mol·L-1。因为该反应是可逆反应,三种物质必须同时存在(即可逆反应中的物质均不可能100%转化),因此,体系中SO3、SO2、O2的浓度范围分别是0~1.2 mol·L-1、0~1.2 mol·L-1、0~0.6 mol·L-1,很显然,A、D是不可能的;根据硫原子守恒,C项表示SO2和SO3同时消耗而减少,这是绝对不可能的。
(1)对化学平衡状态的判断,从不同角度出发可以得到多种判断依据,如物质的量、浓度、压强、体积分数、温度、密度、 、颜色等,但最终都体现v正=v逆,各组分浓度保持不变。
(2)若一定条件下的可逆反应在建立平衡的过程中,某物理量(如总体积、总压强、总物质的量、体系的密度、混合气体的平均相对分子质量等)是一个变量,当该变量不再变化时,说明可逆反应已经达到平衡状态。简而言之,变量不变,建立平衡。
探究二 化学平衡的移动
1.化学平衡移动的含义
对于一个化学平衡,当条件改变时,原来的化学平衡被破坏,并在新的条件下建立起新的化学平衡,这种化学平衡的变化叫作化学平衡的移动。化学平衡的移动也就是可逆反应进行的限度发生了变化。
2.影响化学平衡移动的因素
大量的科学实验证明,化学平衡的移动通常受到温度、反应物浓度、气体压强等因素的影响。
(1)温度:其他条件不变时,升高温度平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动。
(2)浓度:其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,平衡向逆反应方向移动。
(3)压强:其他条件不变时,增大压强,平衡向气体体积缩小的方向移动;减小压强,平衡向气体体积增大的方向移动。对反应前后气体体积不变的反应,压强改变,v(正)、v(逆)改变的程度相同,平衡不移动。
(4)催化剂:催化剂能够同等程度地改变v(正)和v(逆),所以催化剂不能使化学平衡发生移动。
化学平衡移动的实质及研究化学平衡移动的意义
(1)化学平衡移动过程可表示为
由于化学反应中的固体和纯液体物质的量的改变都不能改变反应速率,催化剂能同等程度地改变可逆反应的正、逆反应的速率,因此,改变化学平衡体系中固体或纯液体物质的量及催化剂使用与否,都不影响化学平衡状态。
3.引起化学平衡移动的根本原因是( )
A.浓度的改变 B.压强的改变
C.使用了催化剂 D.正、逆反应速率的改变程度不同
化学平衡移动的本质是不同程度地改变了v正和v逆,只有条件改变后v正≠v逆,平衡才发生移动。
(1)v正>v逆 平衡正向移动。
(2)v正(3)v正、v逆同时改变,若v正=v逆 平衡不移动。
本课小结
课时作业
一、选择题(每小题只有1个选项符合题意)
1.下列对于可逆反应的理解不正确的是( )
A.可逆反应是指既能向正反应方向进行,又能向逆反应方向进行的反应
B.可逆反应的反应物与生成物之间只能用可逆号,而不能用等号
C.可逆反应的正反应和逆反应条件完全相同
D.可逆反应中,反应物不能全部转化为生成物
解析 可逆反应向正反应方向和逆反应方向进行时,必须在相同的条件下,A错误。
2.下列反应不属于可逆反应的是( )
A.Cl2溶解于水
B.氨气溶解于水
C.工业合成氨
D.水电解生成H2和O2与H2在O2中燃烧生成H2O
解析 D项中氢气与氧气反应需要点燃,水分解需要通电,反应条件不同,不是可逆反应。
3.已知SO2和O2反应生成4 mol SO3时放出的热量为Q kJ,那么2 mol SO2和1 mol O2在一有催化剂的密闭容器中发生反应时,放出的热量为( )
A.大于Q kJ B.等于Q kJ
C.小于0.5Q kJ D.无法确定
解析 加压时(体积变小),正、逆反应速率都增大,平衡逆向移动;保持体积不变,加入N2O4,正反应速率增大,平衡正向移动,NO2浓度增大,平衡时颜色变深;体积不变,升高温度,平衡正向移动,NO2浓度增大,平衡时颜色变深。
解析 反应正向进行过程中,X、Y均为反应物,单位时间内消耗X和Y的物质的量之比始终为1∶2,不能作为反应达到平衡状态的标志;由于该可逆反应为反应前后气体体积(或物质的量)不变的反应,故容器内压强(或气体物质的量)不变不能作为反应达到平衡状态的标志;反应物或生成物的物质的量不变是判断反应达到平衡状态的标志。
解析 反应前后气体的物质的量发生变化,容器中压强不变,说明反应达到平衡状态;该反应中有固体参加,混合气体质量不再发生变化,说明反应达到平衡状态;反应中物质的物质的量之比等于对应的化学计量数之比不能说明反应达到平衡状态;生成n mol CO的同时生成n mol H2O(g),正逆反应速率相等,说明反应达到平衡状态。
7.在一定温度下,将一定量的气体通入体积为2 L的密闭容器中发生反应,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
A.该反应的化学方程式为3Z===3X+2Y
B.t0时,X、Y、Z的质量不再改变
C.t0时,Z的浓度为1.2 mol/L
D.t0时,反应停止,反应速率为零
8.某同学为探究FeCl3与KI反应是否存在反应限度,设计了如下实验方案(FeCl3溶液、KI溶液浓度均为0.1 mol·L-1),最合理的方案是( )
A.方案1
B.方案2
C.方案3
D.方案4
解析 KI溶液和FeCl3溶液发生氧化还原反应生成Fe2+和I2,反应的离子方程式为2Fe3++2I-===2Fe2++I2,Fe3+少量时,向反应后的溶液中加入CCl4,若下层呈紫红色,则说明生成碘,取少量上层清液向其中滴加KSCN溶液,溶液显血红色,说明Fe3+没有反应完,则反应存在限度,故方案4合理。
解析 A项,升温时正、逆反应速率均增大,错误;C项,升温平衡逆向移动,增大压强平衡正向移动,错误;D项,降温平衡正向移动,减小压强平衡逆向移动,错误。
解析 A、B项均为同一反应方向的速率,不能判断平衡状态;该反应中有固体生成且为恒容条件,故混合气体密度不变表示达到平衡状态;浓度的比值不能判断是否达到平衡状态。
时间/s 0 1 2
n(NO)/mol 0.020 0.010 0.008
时间/s 3 4 5
n(NO)/mol 0.007 0.007 0.007
(1)如图表示NO2的变化的曲线是______。用O2表示0~2 s内
该反应的平均速率v=______________________。
(2)能说明该反应已达到平衡状态的是______。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是______。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
b
1.5×10-3 mol·L-1·s-1
bc
c
时间/s 0 1 2
n(NO)/mol 0.020 0.010 0.008
时间/s 3 4 5
n(NO)/mol 0.007 0.007 0.007
(2)不知道正、逆反应速率情况,v(NO2)=2v(O2),不能作
为平衡状态的标志;因该反应为气体体积不等的反应,故压强
不变可作为平衡状态的标志;由v逆(NO)=2v正(O2),可推出v逆
(NO)=v正(NO),说明反应已达到平衡状态;由于平衡体系中全
是气体,容器容积固定,故任意状态下密度不变。
(3)及时分离出NO2气体,只能使平衡向正反应方向移动,不能增大反应速率;因该反应为放热反应,适当升高温度,虽使反应速率增大,但平衡向逆反应方向移动;增大O2的浓度既能增大反应速率,又能使平衡向正反应方向移动;催化剂只能增大反应速率,不能影响化学平衡的移动。
13.(1)一定温度下,在密闭容器内进行某化学反应,
气体X、Y的物质的量随反应时间变化的曲线如图所示。
①写出该反应的化学方程式:_________________。
②在t1和t2时正反应速率分别为v1和v2,则二者大小
关系为v1______v2(填“>”“<”或“=”)。
③在t1、t2和t3三个时刻中,反应程度最大的是________(填“t1”“t2”或“t3”)。
>
t3
AE
②若起始时向容器中充入10 mol·L-1的N2和15 mol·L-1的H2,10 min时测得容器内NH3的浓度为1.5 mol·L-1。10 min内用N2表示的反应速率为____________ ____________;此时H2的转化率为________。
0.075 mol·
15%
L-1·min-1
(2)①反应前后气体计量数之和不相等,密闭容器
体积固定,未平衡时随反应进行,气体总物质的量变化
导致压强变化,因此容器内的压强不变时,说明反应达
到平衡;各组分都是气体,气体总质量始终保持不变,
容器为恒容状态,密度保持恒定,因此密度不变不能
说明反应达到平衡状态;H—H键断裂和N—H键形成都说明反应向正反应方向进行,因此不能说明反应达到平衡;开始时通入量未知,因此已知物质的量浓度之比,不能判断是否达到平衡;根据化学平衡状态的定义,NH3的质量分数不变,说明反应达到平衡。
14.某温度时在2 L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
(1)该反应的化学方程式为:_______________。
(2)反应开始至2 min,用Z表示的平均反应速率为__________________。
0.05 mol/(L·min)
(3)下列叙述能说明上述反应达到化学平衡状态的是________(填字母)。
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3 mol X,同时生成2 mol Z
D.混合气体的总质量不随时间的变化而变化
AB
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+Y(g)===2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”“减小”或“不变”)
①降低温度:______;②恒容通入氦气:______;③使用催化剂:______。
减小
不变
增大
(4)①温度越高,反应速率越快,所以降低温度,反应速率减小;②保持容器体积不变,充入不参加反应的惰性气体,反应体系中各物质的量浓度不变,反应速率不变;③使用催化剂,正逆反应速率均增大。
0
第2章 化学键 化学反应规律
第3节 化学反应的快慢和限度
第2课时 化学反应的限度
核心素养 学业要求
发展对化学变化的微观认识,认识化学反应是有一定限度的,培养变化观念与平衡思想。 1.了解可逆反应的含义,知道可逆反应在一定条件下能达到化学平衡。
2.理解化学平衡的特征与标志,能够判断平衡状态。
3.通过探究温度对2NO2(g) N2O4(g)的化学平衡的影响,理解化学平衡的移动及条件对化学平衡的影响。
学生自主学习
01
课时作业
03
目录
CONTENTS
课堂互动探究
02
学生自主学习
1.可逆反应
相同条件
正、逆
不可能
两个方向
一个对象 一个条件 一个相等 一个不变
____________ 一定条件 ___________________________相等 ______________________不再随时间的延长而发生变化
2.化学平衡状态
(1)化学平衡状态的“四个一”
可逆反应
正反应速率和逆反应速率
反应物和生成物的浓度
(2)特征
①化学平衡是一种_______平衡,即在平衡状态时化学反应仍在进行,但反应混合物的组成保持不变。
②当外界条件改变时,原化学平衡状态_________,在新的条件下会达到________________。
③化学平衡状态通常会受到__________________等因素的影响,了解并调控化学平衡对于化工生产来说具有十分重要的意义。
动态
被破坏
新的平衡状态
浓度、温度、压强
1.判断正误,正确的打“√”,错误的打“×”。
(1)对任何化学反应,只要一种反应物过量,就可以将另一种反应物完全转化为生成物。( )
(2)将2 mol SO2和1 mol O2在一定条件下充分反应,反应后体系中只存在2 mol SO3。( )
(3)可逆反应达到平衡时,各组分的浓度都相同。( )
(4)可逆反应达到平衡时,反应就停止了。( )
×
×
×
×
(5)在一定条件下,当反应2SO2(g)+O2(g) 2SO3(g)达到平衡时,反应混合物中SO2、O2、SO3的物质的量之比一定为2∶1∶2。( )
(6)当一个可逆反应达到化学平衡状态,其根本原因是v正=v逆。( )
(7)一定条件下发生的可逆反应,当各物质的物质的量或物质的量分数不再变化时,该可逆反应一定达到了化学平衡状态。( )
√
×
√
3.反应H2(g)+I2(g) 2HI(g)为可逆反应,在一定条件下,向密闭容器中充入1 mol H2和3 mol的I2蒸气,充分反应后,该容器内( )
A.1 mol H2已耗尽 B.3 mol I2已耗尽
C.HI的物质的量为2 mol D.HI的物质的量少于2 mol
4.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度相等
C.达到化学平衡时,正反应和逆反应的速率都为0
D.达到化学平衡时,3v正(N2)=v逆(H2)
解析 当1 mol N≡N键断裂的同时,必然有3 mol H—H键断裂,而现在有3 mol H—H键形成,故H—H键断裂和形成的量相等,则H2的物质的量不改变,一定为平衡状态,故A正确。
课堂互动探究
探究一 化学反应的限度
1.可逆反应的特点
2.化学平衡
(1)化学平衡的建立
用图表示如下:
(2)化学平衡的特征
1.下列关于化学平衡的说法中,不正确的是( )
A.当可逆反应达到平衡时,正、逆反应速率都为零
B.当可逆反应达到化学平衡时,正、逆反应速率一定相等
C.当可逆反应达到化学平衡后,改变某些条件可以使平衡破坏
D.当可逆反应达到平衡时,正、逆反应都还在进行,各物质的浓度不再改变
2.在一密闭容器中进行反应2SO2(g)+O2(g) 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.6 mol·L-1、0.3 mol·L-1、0.6 mol·L-1,当反应至正、逆反应速率相等时,可能存在的状态是( )
A.SO2为1.2 mol·L-1、O2为0.6 mol·L-1
B.SO2为0.75 mol·L-1
C.SO2、SO3均为0.45 mol·L-1
D.SO3为1.2 mol·L-1
解析 由题意可知若SO3全部转化为SO2和O2,则SO2、O2的浓度分别为1.2 mol·L-1、0.6 mol·L-1;而若SO2和O2全部化合成SO3,则SO3的浓度为1.2 mol·L-1。因为该反应是可逆反应,三种物质必须同时存在(即可逆反应中的物质均不可能100%转化),因此,体系中SO3、SO2、O2的浓度范围分别是0~1.2 mol·L-1、0~1.2 mol·L-1、0~0.6 mol·L-1,很显然,A、D是不可能的;根据硫原子守恒,C项表示SO2和SO3同时消耗而减少,这是绝对不可能的。
(1)对化学平衡状态的判断,从不同角度出发可以得到多种判断依据,如物质的量、浓度、压强、体积分数、温度、密度、 、颜色等,但最终都体现v正=v逆,各组分浓度保持不变。
(2)若一定条件下的可逆反应在建立平衡的过程中,某物理量(如总体积、总压强、总物质的量、体系的密度、混合气体的平均相对分子质量等)是一个变量,当该变量不再变化时,说明可逆反应已经达到平衡状态。简而言之,变量不变,建立平衡。
探究二 化学平衡的移动
1.化学平衡移动的含义
对于一个化学平衡,当条件改变时,原来的化学平衡被破坏,并在新的条件下建立起新的化学平衡,这种化学平衡的变化叫作化学平衡的移动。化学平衡的移动也就是可逆反应进行的限度发生了变化。
2.影响化学平衡移动的因素
大量的科学实验证明,化学平衡的移动通常受到温度、反应物浓度、气体压强等因素的影响。
(1)温度:其他条件不变时,升高温度平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动。
(2)浓度:其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,平衡向逆反应方向移动。
(3)压强:其他条件不变时,增大压强,平衡向气体体积缩小的方向移动;减小压强,平衡向气体体积增大的方向移动。对反应前后气体体积不变的反应,压强改变,v(正)、v(逆)改变的程度相同,平衡不移动。
(4)催化剂:催化剂能够同等程度地改变v(正)和v(逆),所以催化剂不能使化学平衡发生移动。
化学平衡移动的实质及研究化学平衡移动的意义
(1)化学平衡移动过程可表示为
由于化学反应中的固体和纯液体物质的量的改变都不能改变反应速率,催化剂能同等程度地改变可逆反应的正、逆反应的速率,因此,改变化学平衡体系中固体或纯液体物质的量及催化剂使用与否,都不影响化学平衡状态。
3.引起化学平衡移动的根本原因是( )
A.浓度的改变 B.压强的改变
C.使用了催化剂 D.正、逆反应速率的改变程度不同
化学平衡移动的本质是不同程度地改变了v正和v逆,只有条件改变后v正≠v逆,平衡才发生移动。
(1)v正>v逆 平衡正向移动。
(2)v正
本课小结
课时作业
一、选择题(每小题只有1个选项符合题意)
1.下列对于可逆反应的理解不正确的是( )
A.可逆反应是指既能向正反应方向进行,又能向逆反应方向进行的反应
B.可逆反应的反应物与生成物之间只能用可逆号,而不能用等号
C.可逆反应的正反应和逆反应条件完全相同
D.可逆反应中,反应物不能全部转化为生成物
解析 可逆反应向正反应方向和逆反应方向进行时,必须在相同的条件下,A错误。
2.下列反应不属于可逆反应的是( )
A.Cl2溶解于水
B.氨气溶解于水
C.工业合成氨
D.水电解生成H2和O2与H2在O2中燃烧生成H2O
解析 D项中氢气与氧气反应需要点燃,水分解需要通电,反应条件不同,不是可逆反应。
3.已知SO2和O2反应生成4 mol SO3时放出的热量为Q kJ,那么2 mol SO2和1 mol O2在一有催化剂的密闭容器中发生反应时,放出的热量为( )
A.大于Q kJ B.等于Q kJ
C.小于0.5Q kJ D.无法确定
解析 加压时(体积变小),正、逆反应速率都增大,平衡逆向移动;保持体积不变,加入N2O4,正反应速率增大,平衡正向移动,NO2浓度增大,平衡时颜色变深;体积不变,升高温度,平衡正向移动,NO2浓度增大,平衡时颜色变深。
解析 反应正向进行过程中,X、Y均为反应物,单位时间内消耗X和Y的物质的量之比始终为1∶2,不能作为反应达到平衡状态的标志;由于该可逆反应为反应前后气体体积(或物质的量)不变的反应,故容器内压强(或气体物质的量)不变不能作为反应达到平衡状态的标志;反应物或生成物的物质的量不变是判断反应达到平衡状态的标志。
解析 反应前后气体的物质的量发生变化,容器中压强不变,说明反应达到平衡状态;该反应中有固体参加,混合气体质量不再发生变化,说明反应达到平衡状态;反应中物质的物质的量之比等于对应的化学计量数之比不能说明反应达到平衡状态;生成n mol CO的同时生成n mol H2O(g),正逆反应速率相等,说明反应达到平衡状态。
7.在一定温度下,将一定量的气体通入体积为2 L的密闭容器中发生反应,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
A.该反应的化学方程式为3Z===3X+2Y
B.t0时,X、Y、Z的质量不再改变
C.t0时,Z的浓度为1.2 mol/L
D.t0时,反应停止,反应速率为零
8.某同学为探究FeCl3与KI反应是否存在反应限度,设计了如下实验方案(FeCl3溶液、KI溶液浓度均为0.1 mol·L-1),最合理的方案是( )
A.方案1
B.方案2
C.方案3
D.方案4
解析 KI溶液和FeCl3溶液发生氧化还原反应生成Fe2+和I2,反应的离子方程式为2Fe3++2I-===2Fe2++I2,Fe3+少量时,向反应后的溶液中加入CCl4,若下层呈紫红色,则说明生成碘,取少量上层清液向其中滴加KSCN溶液,溶液显血红色,说明Fe3+没有反应完,则反应存在限度,故方案4合理。
解析 A项,升温时正、逆反应速率均增大,错误;C项,升温平衡逆向移动,增大压强平衡正向移动,错误;D项,降温平衡正向移动,减小压强平衡逆向移动,错误。
解析 A、B项均为同一反应方向的速率,不能判断平衡状态;该反应中有固体生成且为恒容条件,故混合气体密度不变表示达到平衡状态;浓度的比值不能判断是否达到平衡状态。
时间/s 0 1 2
n(NO)/mol 0.020 0.010 0.008
时间/s 3 4 5
n(NO)/mol 0.007 0.007 0.007
(1)如图表示NO2的变化的曲线是______。用O2表示0~2 s内
该反应的平均速率v=______________________。
(2)能说明该反应已达到平衡状态的是______。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是______。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
b
1.5×10-3 mol·L-1·s-1
bc
c
时间/s 0 1 2
n(NO)/mol 0.020 0.010 0.008
时间/s 3 4 5
n(NO)/mol 0.007 0.007 0.007
(2)不知道正、逆反应速率情况,v(NO2)=2v(O2),不能作
为平衡状态的标志;因该反应为气体体积不等的反应,故压强
不变可作为平衡状态的标志;由v逆(NO)=2v正(O2),可推出v逆
(NO)=v正(NO),说明反应已达到平衡状态;由于平衡体系中全
是气体,容器容积固定,故任意状态下密度不变。
(3)及时分离出NO2气体,只能使平衡向正反应方向移动,不能增大反应速率;因该反应为放热反应,适当升高温度,虽使反应速率增大,但平衡向逆反应方向移动;增大O2的浓度既能增大反应速率,又能使平衡向正反应方向移动;催化剂只能增大反应速率,不能影响化学平衡的移动。
13.(1)一定温度下,在密闭容器内进行某化学反应,
气体X、Y的物质的量随反应时间变化的曲线如图所示。
①写出该反应的化学方程式:_________________。
②在t1和t2时正反应速率分别为v1和v2,则二者大小
关系为v1______v2(填“>”“<”或“=”)。
③在t1、t2和t3三个时刻中,反应程度最大的是________(填“t1”“t2”或“t3”)。
>
t3
AE
②若起始时向容器中充入10 mol·L-1的N2和15 mol·L-1的H2,10 min时测得容器内NH3的浓度为1.5 mol·L-1。10 min内用N2表示的反应速率为____________ ____________;此时H2的转化率为________。
0.075 mol·
15%
L-1·min-1
(2)①反应前后气体计量数之和不相等,密闭容器
体积固定,未平衡时随反应进行,气体总物质的量变化
导致压强变化,因此容器内的压强不变时,说明反应达
到平衡;各组分都是气体,气体总质量始终保持不变,
容器为恒容状态,密度保持恒定,因此密度不变不能
说明反应达到平衡状态;H—H键断裂和N—H键形成都说明反应向正反应方向进行,因此不能说明反应达到平衡;开始时通入量未知,因此已知物质的量浓度之比,不能判断是否达到平衡;根据化学平衡状态的定义,NH3的质量分数不变,说明反应达到平衡。
14.某温度时在2 L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
(1)该反应的化学方程式为:_______________。
(2)反应开始至2 min,用Z表示的平均反应速率为__________________。
0.05 mol/(L·min)
(3)下列叙述能说明上述反应达到化学平衡状态的是________(填字母)。
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3 mol X,同时生成2 mol Z
D.混合气体的总质量不随时间的变化而变化
AB
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+Y(g)===2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”“减小”或“不变”)
①降低温度:______;②恒容通入氦气:______;③使用催化剂:______。
减小
不变
增大
(4)①温度越高,反应速率越快,所以降低温度,反应速率减小;②保持容器体积不变,充入不参加反应的惰性气体,反应体系中各物质的量浓度不变,反应速率不变;③使用催化剂,正逆反应速率均增大。
