6.3 课时1 化学能转化为电能 课件 (共25张PPT) 2024-2025学年苏教版高上化学必修第二册
文档属性
| 名称 | 6.3 课时1 化学能转化为电能 课件 (共25张PPT) 2024-2025学年苏教版高上化学必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-20 00:00:00 | ||
图片预览




文档简介
(共25张PPT)
专题6 化学反应与能量变化
化学能转化为电能
1.通过实验探究认识化学能转化为电能的原理。
2.从电子转移的角度理解化学能向电能转化的本质及原电池的构成条件,发展证据推理与模型认知的核心素养。
卫星电源
飞机电源
电动汽车电源
笔记本电源
手机电源
手表电源
常见的化学电源
思考
化学电源是如何对外提供电能的呢?
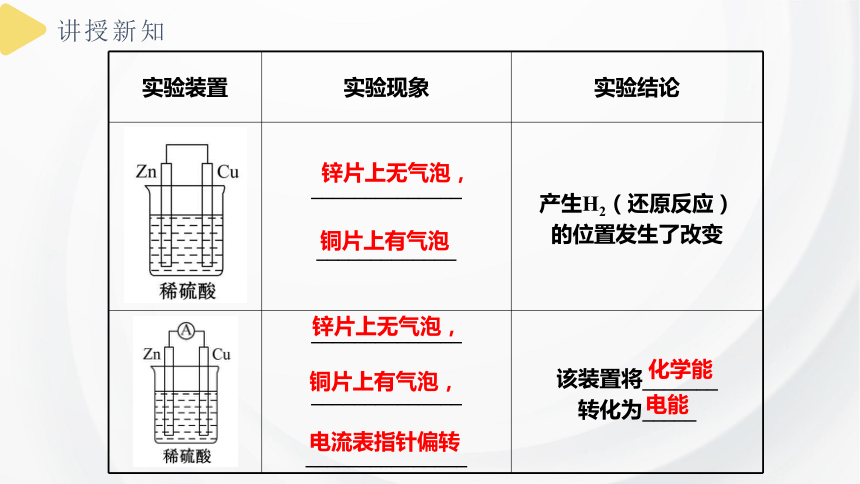
实验装置 实验现象 实验结论
______________ _____________ 锌与稀硫酸_____,
铜与稀硫酸_______
锌片上有气泡,
铜片上无气泡
反应
不反应
实验装置 实验现象 实验结论
______________ _____________ 产生H2(还原反应)
的位置发生了改变
______________ ______________ _______________ 该装置将_______
转化为_____
锌片上无气泡,
铜片上有气泡
锌片上无气泡,
铜片上有气泡,
电流表指针偏转
化学能
电能
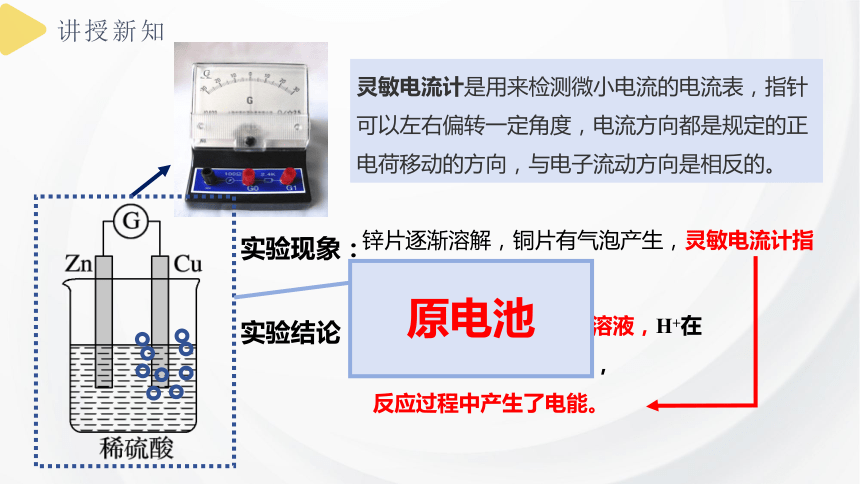
实验现象:
实验结论:
锌片逐渐溶解,铜片有气泡产生,灵敏电流计指针发生偏转
锌失电子,变成Zn2+进入溶液,H+在铜片上得到电子生成氢气,
反应过程中产生了电能。
灵敏电流计是用来检测微小电流的电流表,指针可以左右偏转一定角度,电流方向都是规定的正电荷移动的方向,与电子流动方向是相反的。
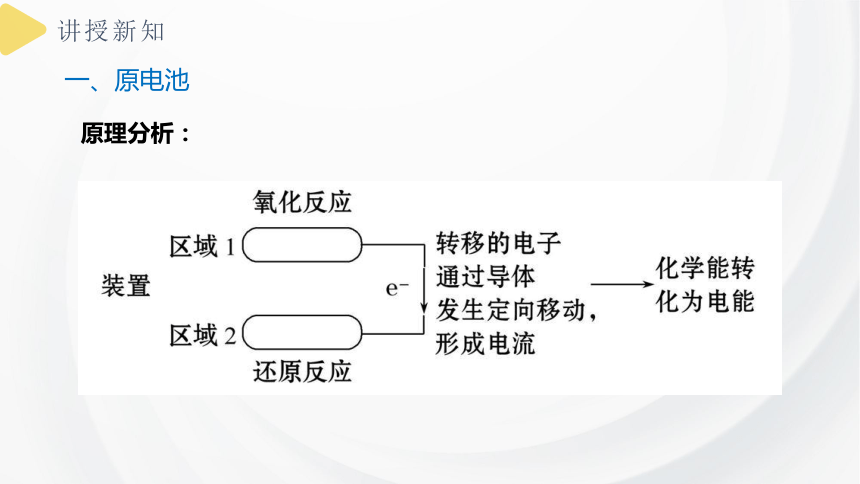
原电池
原理分析:
一、原电池
一、原电池
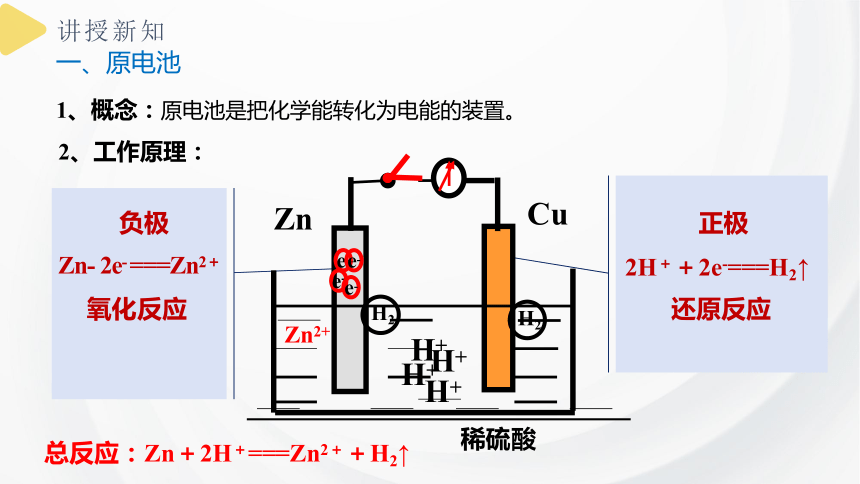
1、概念:原电池是把化学能转化为电能的装置。
Zn
Zn2+
H+
H+
Cu
e-
e-
e-
e-
H2
H+
H+
H2
稀硫酸
正极
还原反应
2H++2e-===H2↑
总反应:Zn+2H+===Zn2++H2↑
负极
氧化反应
Zn- 2e- ===Zn2+
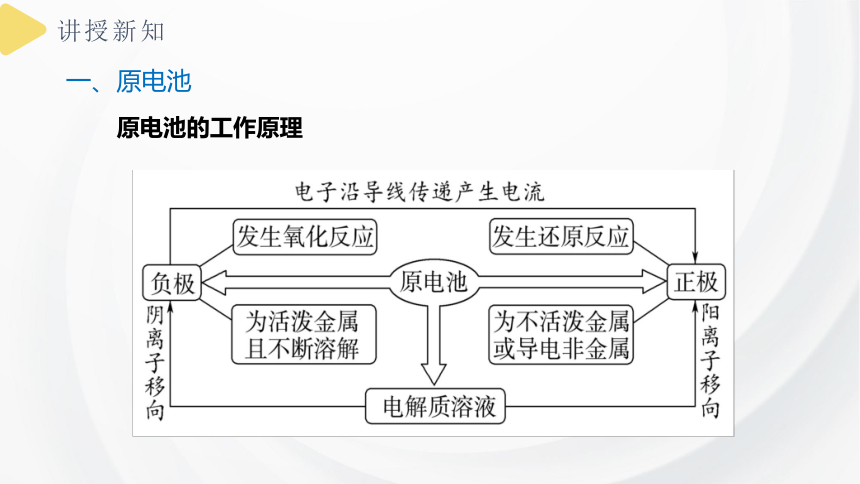
2、工作原理:
一、原电池
原电池的工作原理
一、原电池
3、原电池的构成条件:
3、形成闭合回路
4、氧化还原反应能自发进行
2、两电极插入电解质溶液中
1、两种活泼性不同的金属(或另一种为非金属导体)构成电极
原电池
一、原电池
注意:
构成原电池的两电极材料不一定都是金属,
正极材料可以为导电的非金属,例如石墨。
两极材料可能参与反应,也可能不参与反应。
两个活泼性不同的金属电极用导线连接,
共同插入电解质溶液中不一定构成原电池,
必须有一个能自发地发生氧化还原反应。
在判断原电池正负极时,既要考虑金属活泼的强弱也要考虑电解质溶液的性质。
如Mg—Al—HCl溶液构成的原电池中,负极为Mg;
但是Mg—Al—NaOH溶液构成的原电池中,负极为Al,
正极为Mg。
一、原电池
一、原电池
思考
在铜—锌—稀硫酸原电池中,电子是怎样移动的?
电子能否通过电解质溶液?离子如何移动?
1、由于金属锌比铜活泼,锌失去电子,电子通过导线流向铜片;
2、电子不能通过电解质溶液;
3、在稀硫酸中H+移向铜片, SO42-移向锌片;
一、原电池
总结
原电池中:
电解质溶液中,阳离子向正极移动, 阴离子向负极移动。
电子的移动方向:
离子的移动方向:
从负极流出,经导线流向正极。
口诀
电子不下水,离子不上岸
一、原电池
多数情况下
解答有关原电池问题的思维流程如下:
一、原电池
典例解析
C
二、原电池工作原理的应用
1.加快氧化还原反应的速率
原理:原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
思考
实验室制氢气,用纯锌还是粗锌(含碳)好?
粗锌放入稀硫酸中构成原电池,化学反应速率增大。
如果只有纯锌,处理才能加快反应速率?
可滴入几滴硫酸铜溶液,形成原电池,加快反应速率。
二、原电池工作原理的应用
2.比较金属活泼性强弱
原理:
负极
活泼金属作负极
发生氧化反应
反应中质量减少
正极
不活泼金属作正极
发生还原反应
质量不发生变化
二、原电池工作原理的应用
(1)潮湿的空气里钢铁容易生锈
原理:
负极反应: ;
正极反应: ;
总反应:2Fe+ O2 + 2H2O =2Fe(OH) 2
4Fe(OH) 2+O2 + 2H2O =4Fe(OH) 3
2Fe-4e-=2Fe2+
O2+2H2O+4e-=4OH-
3.解释生活中的现象
二、原电池工作原理的应用
3.解释生活中的现象
(2)暖贴
主要成分:铁粉、碳、食盐、水、吸水布(吸水棉)
使用方法:撕开后进入空气(提供氧气,供吸氧腐蚀用)
原理:
负极反应: 正极反应: ;
总反应:2Fe+ O2 + 2H2O =2Fe(OH) 2
4Fe(OH) 2+O2 + 2H2O =4Fe(OH) 3
在此反应过程中放热,因此成为“暖宝宝”“热敷袋”
2Fe-4e-=2Fe2+ O2+2H2O+4e-=4OH-
二、原电池工作原理的应用
4.设计原电池
(1)依据:
已知一个氧化还原反应,首先分析找出氧化剂、还原剂,
一般还原剂为负极材料(或在负极上被氧化),
氧化剂(即电解质溶液中的阳离子)在正极上被还原。
(2)选择合适的材料
①电极材料:电极材料必须导电。负极材料一般选择较活泼的金属材料,或者在该氧化还原反应中,本身失去电子的材料。
②电解质溶液:电解质溶液一般能与负极反应。
典例解析
C
C
负
铜
Cu-2e-===Cu2+
O2+4H++4e-===2H2O
专题6 化学反应与能量变化
化学能转化为电能
1.通过实验探究认识化学能转化为电能的原理。
2.从电子转移的角度理解化学能向电能转化的本质及原电池的构成条件,发展证据推理与模型认知的核心素养。
卫星电源
飞机电源
电动汽车电源
笔记本电源
手机电源
手表电源
常见的化学电源
思考
化学电源是如何对外提供电能的呢?
实验装置 实验现象 实验结论
______________ _____________ 锌与稀硫酸_____,
铜与稀硫酸_______
锌片上有气泡,
铜片上无气泡
反应
不反应
实验装置 实验现象 实验结论
______________ _____________ 产生H2(还原反应)
的位置发生了改变
______________ ______________ _______________ 该装置将_______
转化为_____
锌片上无气泡,
铜片上有气泡
锌片上无气泡,
铜片上有气泡,
电流表指针偏转
化学能
电能
实验现象:
实验结论:
锌片逐渐溶解,铜片有气泡产生,灵敏电流计指针发生偏转
锌失电子,变成Zn2+进入溶液,H+在铜片上得到电子生成氢气,
反应过程中产生了电能。
灵敏电流计是用来检测微小电流的电流表,指针可以左右偏转一定角度,电流方向都是规定的正电荷移动的方向,与电子流动方向是相反的。
原电池
原理分析:
一、原电池
一、原电池
1、概念:原电池是把化学能转化为电能的装置。
Zn
Zn2+
H+
H+
Cu
e-
e-
e-
e-
H2
H+
H+
H2
稀硫酸
正极
还原反应
2H++2e-===H2↑
总反应:Zn+2H+===Zn2++H2↑
负极
氧化反应
Zn- 2e- ===Zn2+
2、工作原理:
一、原电池
原电池的工作原理
一、原电池
3、原电池的构成条件:
3、形成闭合回路
4、氧化还原反应能自发进行
2、两电极插入电解质溶液中
1、两种活泼性不同的金属(或另一种为非金属导体)构成电极
原电池
一、原电池
注意:
构成原电池的两电极材料不一定都是金属,
正极材料可以为导电的非金属,例如石墨。
两极材料可能参与反应,也可能不参与反应。
两个活泼性不同的金属电极用导线连接,
共同插入电解质溶液中不一定构成原电池,
必须有一个能自发地发生氧化还原反应。
在判断原电池正负极时,既要考虑金属活泼的强弱也要考虑电解质溶液的性质。
如Mg—Al—HCl溶液构成的原电池中,负极为Mg;
但是Mg—Al—NaOH溶液构成的原电池中,负极为Al,
正极为Mg。
一、原电池
一、原电池
思考
在铜—锌—稀硫酸原电池中,电子是怎样移动的?
电子能否通过电解质溶液?离子如何移动?
1、由于金属锌比铜活泼,锌失去电子,电子通过导线流向铜片;
2、电子不能通过电解质溶液;
3、在稀硫酸中H+移向铜片, SO42-移向锌片;
一、原电池
总结
原电池中:
电解质溶液中,阳离子向正极移动, 阴离子向负极移动。
电子的移动方向:
离子的移动方向:
从负极流出,经导线流向正极。
口诀
电子不下水,离子不上岸
一、原电池
多数情况下
解答有关原电池问题的思维流程如下:
一、原电池
典例解析
C
二、原电池工作原理的应用
1.加快氧化还原反应的速率
原理:原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
思考
实验室制氢气,用纯锌还是粗锌(含碳)好?
粗锌放入稀硫酸中构成原电池,化学反应速率增大。
如果只有纯锌,处理才能加快反应速率?
可滴入几滴硫酸铜溶液,形成原电池,加快反应速率。
二、原电池工作原理的应用
2.比较金属活泼性强弱
原理:
负极
活泼金属作负极
发生氧化反应
反应中质量减少
正极
不活泼金属作正极
发生还原反应
质量不发生变化
二、原电池工作原理的应用
(1)潮湿的空气里钢铁容易生锈
原理:
负极反应: ;
正极反应: ;
总反应:2Fe+ O2 + 2H2O =2Fe(OH) 2
4Fe(OH) 2+O2 + 2H2O =4Fe(OH) 3
2Fe-4e-=2Fe2+
O2+2H2O+4e-=4OH-
3.解释生活中的现象
二、原电池工作原理的应用
3.解释生活中的现象
(2)暖贴
主要成分:铁粉、碳、食盐、水、吸水布(吸水棉)
使用方法:撕开后进入空气(提供氧气,供吸氧腐蚀用)
原理:
负极反应: 正极反应: ;
总反应:2Fe+ O2 + 2H2O =2Fe(OH) 2
4Fe(OH) 2+O2 + 2H2O =4Fe(OH) 3
在此反应过程中放热,因此成为“暖宝宝”“热敷袋”
2Fe-4e-=2Fe2+ O2+2H2O+4e-=4OH-
二、原电池工作原理的应用
4.设计原电池
(1)依据:
已知一个氧化还原反应,首先分析找出氧化剂、还原剂,
一般还原剂为负极材料(或在负极上被氧化),
氧化剂(即电解质溶液中的阳离子)在正极上被还原。
(2)选择合适的材料
①电极材料:电极材料必须导电。负极材料一般选择较活泼的金属材料,或者在该氧化还原反应中,本身失去电子的材料。
②电解质溶液:电解质溶液一般能与负极反应。
典例解析
C
C
负
铜
Cu-2e-===Cu2+
O2+4H++4e-===2H2O
