3.2硫的转化(共23张ppt)化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.2硫的转化(共23张ppt)化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 487.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-21 10:56:00 | ||
图片预览







文档简介
(共23张PPT)
第
节
2
硫的转化
第3章
学习目标
1、认识硫的物理性质,掌握硫的化学性质。
2、掌握二氧化硫的化学性质。
一、自然界中的硫
火山爆发
火山口的硫
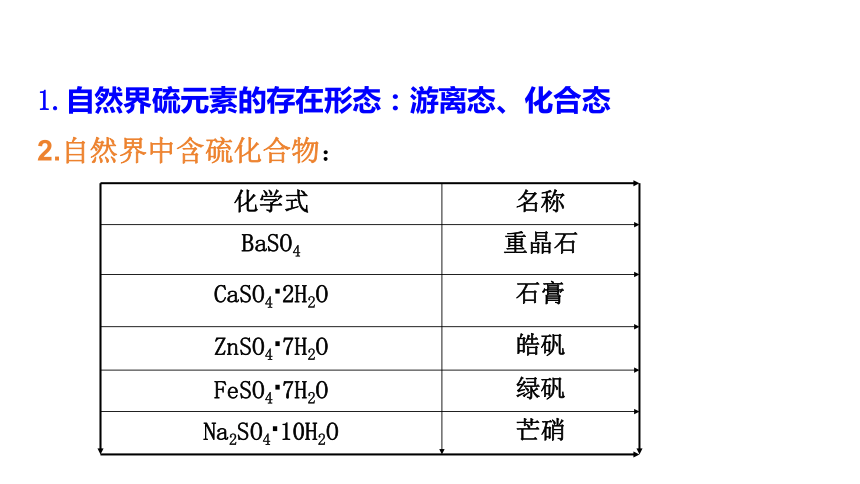
1.自然界硫元素的存在形态:游离态、化合态
2.自然界中含硫化合物:
化学式 名称
BaSO4 重晶石
CaSO4·2H2O 石膏
ZnSO4·7H2O 皓矾
FeSO4·7H2O 绿矾
Na2SO4·10H2O 芒硝
色
态 熔沸点
熔沸点较低
溶解性
同素 异形体
黄色或淡黄色
固体、很脆
不溶于水、微溶于酒精、易溶于CS2
斜方硫、单斜硫
3、硫的物理性质
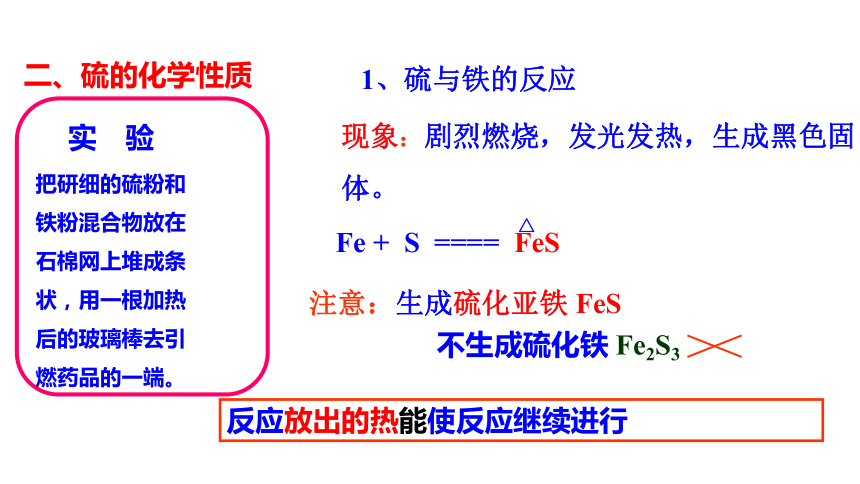
实 验
把研细的硫粉和
铁粉混合物放在
石棉网上堆成条
状,用一根加热
后的玻璃棒去引
燃药品的一端。
1、硫与铁的反应
现象:剧烈燃烧,发光发热,生成黑色固体。
注意:生成硫化亚铁 FeS
Fe + S ==== FeS
△
不生成硫化铁 Fe2S3
反应放出的热能使反应继续进行
二、硫的化学性质
2Cu + S ==== Cu2S
△
Fe + S ==== FeS
△
Cu + Cl2 === CuCl2
点燃
2Fe + 3Cl2 ==== 2FeCl3
点燃
[讨论]硫和氯气都能分别与铜、铁反应,试比较反应有何异同。
结论:氯气的氧化性比硫强
+1
+2
+2
+3
2、硫与非金属的反应
S + O2 ==== SO2
点燃
0
+4
硫作为还原剂
具有还原性
H2 + S == H2S
△
0
-2
硫作为氧化剂,具有氧化性。
硫在氧气中燃烧
注意:硫在空气中燃烧、纯氧中燃烧的现象;硫在氧气中的燃烧产物只能是二氧化硫SO2。
例1下列说法中正确的是 ( )
A.硫单质与金属铁反应生成硫化亚铁,体现了硫单质的氧化性
B.硫单质在常温下不与任何物质反应SO3由O2与SO2反应得到
C.硫单质与非金属单质反应只能做还原剂
D.硫单质在空气中燃烧得到二氧化硫,在纯氧中燃烧却得到三氧化硫
【解析】 硫单质得电子做氧化剂,只能将金属铁氧化为+2价,该反应中硫单质体现氧化性,A正确。
常温下,硫单质可以和汞等物质反应,B不正确。
硫单质与氧化性强的非金属单质(如O2)反应时化合价可升高,做还原剂,但与氧化性弱的非金属单质(如H2)反应时化合价可降低,做氧化剂,C不正确。
硫单质无论在空气中还是在纯氧中燃烧,都只得到二氧化硫,只不过在空气中燃烧发出淡蓝色火焰,而在纯氧中燃烧发出蓝紫色火焰,D不正确。
A
变式1 下列说法错误的是 ( )
A.残留在试管内壁上的硫可用CS2溶解除去,也可用热的NaOH溶液除去
B.硫单质与变价金属反应时一般生成低价态金属硫化物
C.汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理
D.单质硫燃烧时,氧气少量时生成SO2,氧气足量时生成SO3
D
变式2不能由单质直接化合而制得的物质是 ( )
A. Cu2S B. FeS
C. FeCl3 D. CuS
D
(一)、物理性质
无色、有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(常温常压下,1体积水能溶解40体积的二氧化硫,即1:40).
二氧化硫(SO2)
1:具有酸性氧化物的通性(和CO2性质一样)
⑴与H2O反应: SO2+H2O H2SO3(亚硫酸)
⑵与碱反应
SO2不足时:SO2+2NaOH=Na2SO3+H2O
⑶与碱性氧化物反应:
SO2+Na2O==Na2SO3 (亚硫酸钠)
SO2 +CaO==CaSO3 (亚硫酸钙)
(二) SO2的化学性质:
SO2过量时:SO2+ NaOH=NaHSO3
实验室制取SO2,可选择碱液吸收尾气,防止空气污 染。
(除去燃煤中的SO2)
2、氧化性
2SO2 + O2 2SO3(可逆反应)
3、还原性
SO2 +2H2S=3S+2H2O
SO2使酸性高锰酸钾溶液褪色,表现还原性。
工业上就是利用上述性质将硫先转化为SO2,
再转化为SO3,最后制取硫酸
+4
+6
SO2使氯水褪色,表现有还原性。
SO2+Cl2+2H2O==H2SO4+2HCl
有淡黄色固体生成,或有浑浊生成。
SO2使品红溶液退色加热后又恢复原色。
原理:SO2跟某些有色物质化合生成的 无色不稳定物质,受热恢复原来颜色。
应用:实验室常用此检验二氧化硫!
4. SO2的漂白性
具 有 漂 白 性 的 物 质 物质 HClO、O3、H2O2、Na2O2 SO2 木炭
实质 氧化漂白 化合漂白 物理吸附
效果 永久性 暂时性 永久性
范围 可漂白大多数有色物质,能使紫色石蕊褪色 可漂白某些有色物质,不能使石蕊试液褪色 可吸附某些有色物质的分子
几种具有漂白性物质的性质比较:
思考:
SO2可以使高锰酸钾褪色和SO2使品红褪色
原理一样吗?分别体现了SO2的什么性质?
前者是表现还原性,后者是表现漂白性。
2. 将Cl2通入紫色石蕊试液中和将SO2通入紫色石蕊试液中,现象相同吗?
前者:溶液先变红后褪色;后者:溶液只变红。
3.将等物质的量的SO2与Cl2一起通入品红中是否褪色?为什么?
答:不褪色。SO2+Cl2+2H2O=H2SO4+2HCl
4.把SO2通入到NaOH(滴加酚酞)溶液中,会有什么现象发生?
现象:溶液由红色变为无色
原因:SO2 + 2NaOH = Na2SO3 + H2O
5.如何鉴别SO2和CO2?
6.能否用澄清的石灰水来鉴别SO2和CO2
注意:酸性:H2SO3(中强酸)> H2CO3(弱酸)
7.怎样除去CO2中的SO2
方法:用饱和的NaHCO3溶液除去CO2中的SO2.
原理:SO2+2NaHCO3=Na2SO3+2CO2+H2O
8.将SO2通入到BaCl2溶液中,有何现象?
再通入Cl2呢 请写出相关化学方程式。
SO2+Cl2+2H2O=H2SO4+2HCl
H2SO4+ BaCl2=BaSO4↓+2HCl
例2 下列说法正确的是 ( )
A.二氧化硫和漂白粉能使溴水和高锰酸钾溶液褪色,体现了二者的漂白性
B.过氧化钠和二氧化硫都具有漂白作用,它们都能使品红溶液褪色
C.二氧化硫和氯气都具有漂白作用,它们都能使石蕊溶液先变红再褪色
D.盐酸能使滴有酚酞的氢氧化钠溶液褪色,所以盐酸也有漂白性
【解析】 二氧化硫使溴水和高锰酸钾溶液褪色是因为其具有还原性,A错误。
过氧化钠和二氧化硫都具有漂白性,都能使品红褪色,B正确。
二氧化硫不能漂白指示剂,只能使石蕊溶液变红色,不会褪色,C错误。
盐酸与氢氧化钠溶液反应,消耗了氢氧化钠而使酚酞褪色,说明盐酸有酸性,D错误。
B
变式2 下列溶液中能够区别SO2和CO2的是 ( )
①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④氯水 ⑤品红溶液
A.①②③ B.②③④
C.除①以外 D.全部
C
三、三氧化硫的性质
三氧化硫在标准状况下是一种无色固体,熔沸点低。与水反应生成硫酸,并放出大量的热
SO3+H2O=H2SO4
SO3+2NaOH=Na2SO4+H2O
第
节
2
硫的转化
第3章
学习目标
1、认识硫的物理性质,掌握硫的化学性质。
2、掌握二氧化硫的化学性质。
一、自然界中的硫
火山爆发
火山口的硫
1.自然界硫元素的存在形态:游离态、化合态
2.自然界中含硫化合物:
化学式 名称
BaSO4 重晶石
CaSO4·2H2O 石膏
ZnSO4·7H2O 皓矾
FeSO4·7H2O 绿矾
Na2SO4·10H2O 芒硝
色
态 熔沸点
熔沸点较低
溶解性
同素 异形体
黄色或淡黄色
固体、很脆
不溶于水、微溶于酒精、易溶于CS2
斜方硫、单斜硫
3、硫的物理性质
实 验
把研细的硫粉和
铁粉混合物放在
石棉网上堆成条
状,用一根加热
后的玻璃棒去引
燃药品的一端。
1、硫与铁的反应
现象:剧烈燃烧,发光发热,生成黑色固体。
注意:生成硫化亚铁 FeS
Fe + S ==== FeS
△
不生成硫化铁 Fe2S3
反应放出的热能使反应继续进行
二、硫的化学性质
2Cu + S ==== Cu2S
△
Fe + S ==== FeS
△
Cu + Cl2 === CuCl2
点燃
2Fe + 3Cl2 ==== 2FeCl3
点燃
[讨论]硫和氯气都能分别与铜、铁反应,试比较反应有何异同。
结论:氯气的氧化性比硫强
+1
+2
+2
+3
2、硫与非金属的反应
S + O2 ==== SO2
点燃
0
+4
硫作为还原剂
具有还原性
H2 + S == H2S
△
0
-2
硫作为氧化剂,具有氧化性。
硫在氧气中燃烧
注意:硫在空气中燃烧、纯氧中燃烧的现象;硫在氧气中的燃烧产物只能是二氧化硫SO2。
例1下列说法中正确的是 ( )
A.硫单质与金属铁反应生成硫化亚铁,体现了硫单质的氧化性
B.硫单质在常温下不与任何物质反应SO3由O2与SO2反应得到
C.硫单质与非金属单质反应只能做还原剂
D.硫单质在空气中燃烧得到二氧化硫,在纯氧中燃烧却得到三氧化硫
【解析】 硫单质得电子做氧化剂,只能将金属铁氧化为+2价,该反应中硫单质体现氧化性,A正确。
常温下,硫单质可以和汞等物质反应,B不正确。
硫单质与氧化性强的非金属单质(如O2)反应时化合价可升高,做还原剂,但与氧化性弱的非金属单质(如H2)反应时化合价可降低,做氧化剂,C不正确。
硫单质无论在空气中还是在纯氧中燃烧,都只得到二氧化硫,只不过在空气中燃烧发出淡蓝色火焰,而在纯氧中燃烧发出蓝紫色火焰,D不正确。
A
变式1 下列说法错误的是 ( )
A.残留在试管内壁上的硫可用CS2溶解除去,也可用热的NaOH溶液除去
B.硫单质与变价金属反应时一般生成低价态金属硫化物
C.汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理
D.单质硫燃烧时,氧气少量时生成SO2,氧气足量时生成SO3
D
变式2不能由单质直接化合而制得的物质是 ( )
A. Cu2S B. FeS
C. FeCl3 D. CuS
D
(一)、物理性质
无色、有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(常温常压下,1体积水能溶解40体积的二氧化硫,即1:40).
二氧化硫(SO2)
1:具有酸性氧化物的通性(和CO2性质一样)
⑴与H2O反应: SO2+H2O H2SO3(亚硫酸)
⑵与碱反应
SO2不足时:SO2+2NaOH=Na2SO3+H2O
⑶与碱性氧化物反应:
SO2+Na2O==Na2SO3 (亚硫酸钠)
SO2 +CaO==CaSO3 (亚硫酸钙)
(二) SO2的化学性质:
SO2过量时:SO2+ NaOH=NaHSO3
实验室制取SO2,可选择碱液吸收尾气,防止空气污 染。
(除去燃煤中的SO2)
2、氧化性
2SO2 + O2 2SO3(可逆反应)
3、还原性
SO2 +2H2S=3S+2H2O
SO2使酸性高锰酸钾溶液褪色,表现还原性。
工业上就是利用上述性质将硫先转化为SO2,
再转化为SO3,最后制取硫酸
+4
+6
SO2使氯水褪色,表现有还原性。
SO2+Cl2+2H2O==H2SO4+2HCl
有淡黄色固体生成,或有浑浊生成。
SO2使品红溶液退色加热后又恢复原色。
原理:SO2跟某些有色物质化合生成的 无色不稳定物质,受热恢复原来颜色。
应用:实验室常用此检验二氧化硫!
4. SO2的漂白性
具 有 漂 白 性 的 物 质 物质 HClO、O3、H2O2、Na2O2 SO2 木炭
实质 氧化漂白 化合漂白 物理吸附
效果 永久性 暂时性 永久性
范围 可漂白大多数有色物质,能使紫色石蕊褪色 可漂白某些有色物质,不能使石蕊试液褪色 可吸附某些有色物质的分子
几种具有漂白性物质的性质比较:
思考:
SO2可以使高锰酸钾褪色和SO2使品红褪色
原理一样吗?分别体现了SO2的什么性质?
前者是表现还原性,后者是表现漂白性。
2. 将Cl2通入紫色石蕊试液中和将SO2通入紫色石蕊试液中,现象相同吗?
前者:溶液先变红后褪色;后者:溶液只变红。
3.将等物质的量的SO2与Cl2一起通入品红中是否褪色?为什么?
答:不褪色。SO2+Cl2+2H2O=H2SO4+2HCl
4.把SO2通入到NaOH(滴加酚酞)溶液中,会有什么现象发生?
现象:溶液由红色变为无色
原因:SO2 + 2NaOH = Na2SO3 + H2O
5.如何鉴别SO2和CO2?
6.能否用澄清的石灰水来鉴别SO2和CO2
注意:酸性:H2SO3(中强酸)> H2CO3(弱酸)
7.怎样除去CO2中的SO2
方法:用饱和的NaHCO3溶液除去CO2中的SO2.
原理:SO2+2NaHCO3=Na2SO3+2CO2+H2O
8.将SO2通入到BaCl2溶液中,有何现象?
再通入Cl2呢 请写出相关化学方程式。
SO2+Cl2+2H2O=H2SO4+2HCl
H2SO4+ BaCl2=BaSO4↓+2HCl
例2 下列说法正确的是 ( )
A.二氧化硫和漂白粉能使溴水和高锰酸钾溶液褪色,体现了二者的漂白性
B.过氧化钠和二氧化硫都具有漂白作用,它们都能使品红溶液褪色
C.二氧化硫和氯气都具有漂白作用,它们都能使石蕊溶液先变红再褪色
D.盐酸能使滴有酚酞的氢氧化钠溶液褪色,所以盐酸也有漂白性
【解析】 二氧化硫使溴水和高锰酸钾溶液褪色是因为其具有还原性,A错误。
过氧化钠和二氧化硫都具有漂白性,都能使品红褪色,B正确。
二氧化硫不能漂白指示剂,只能使石蕊溶液变红色,不会褪色,C错误。
盐酸与氢氧化钠溶液反应,消耗了氢氧化钠而使酚酞褪色,说明盐酸有酸性,D错误。
B
变式2 下列溶液中能够区别SO2和CO2的是 ( )
①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④氯水 ⑤品红溶液
A.①②③ B.②③④
C.除①以外 D.全部
C
三、三氧化硫的性质
三氧化硫在标准状况下是一种无色固体,熔沸点低。与水反应生成硫酸,并放出大量的热
SO3+H2O=H2SO4
SO3+2NaOH=Na2SO4+H2O
