华师大版 初科 九上 1.1 化学方程式 第1课时 同步练习(含解析)
文档属性
| 名称 | 华师大版 初科 九上 1.1 化学方程式 第1课时 同步练习(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 641.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-06-24 08:39:50 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
华师大版 初科 九上 1.1 化学方程式 第1课时 同步练习(含解析)
一、单选题
1.1784年,科学家卡文迪许演示了“人工空气”的燃烧,发现燃烧产物只有水。据此判断“人工空气”可能是( )
A.氢气 B.氮气
C.二氧化碳 D.氧气
2.下列四个化学反应中,符合此漫画情景的是( )
A.Fe +CuSO4=FeSO4+ Cu B.CuO+COCu+CO2
C.H2 +CuOCu+ H2O D.Fe+H2SO4=FeSO4+ H2↑
3.木炭在耐高温的容器中(内含足量空气)密封加热,下列各图中,能正确表示容器中所盛的物质总质量变化的是( )
A. B.
C. D.
4.水通电分解成氢气和氧气的反应前后,发生改变的是( )
A.元素种类 B.原子种类 C.分子种类 D.原子数量
5.在化学反应2A+5B=C+3D中,A、B两种物质恰好完全反应时的质量比为4:3,若生成C和D共21 g,则反应消耗B的质量为( )
A.6g B.9g C.12g D.16g
6.一种新型纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇(CH3OH),其微观示意图如图所示,下列说法正确的是
A.甲是单质,乙、丁均为氧化物
B.在反应前后分子的个数不变
C.参加反应的甲和乙的分子个数比为2 : 1
D.生成物丙中碳、氢原子个数比为1 : 3
7.科技人员成功研制出一种新型催化剂,可将二氧化碳转化成液体燃料,反应的微观示意图如下图。有关该反应的说法正确的是( )
A.反应的生成物既有单质又有化合物
B.反应前碳元素的化合价为+2价
C.生成物中有可用化学式C2H2O2表示的物质
D.参加反应的两物质的分子个数比为1:1
8.化学方程式是重要的化学用语。下列化学方程式书写正确的是( )
A.2KMnO4 K2MnO4+MnO2+O2↑
B.P+O2=P2O5
C.4Fe+3O2 2Fe2O3
D.C+O2 CO2↑
9.已知反应X+3O2 2CO2+2H2O,则X的化学式为( )
A.C2H6 B.C2H4 C.C2H2 D.C2H6O
10.三氧化铬(CrO3)常用于金属镀铬。工业上用重铬酸钠(Na2Cr2O7)制造三氧化铬,反应的化学方程式为Na2Cr2O7+X=2CrO3+Na2SO4+H2O,其中X的化学式是( )
A.H2S B.SO2 C.H2SO3 D.H2SO4
二、填空题
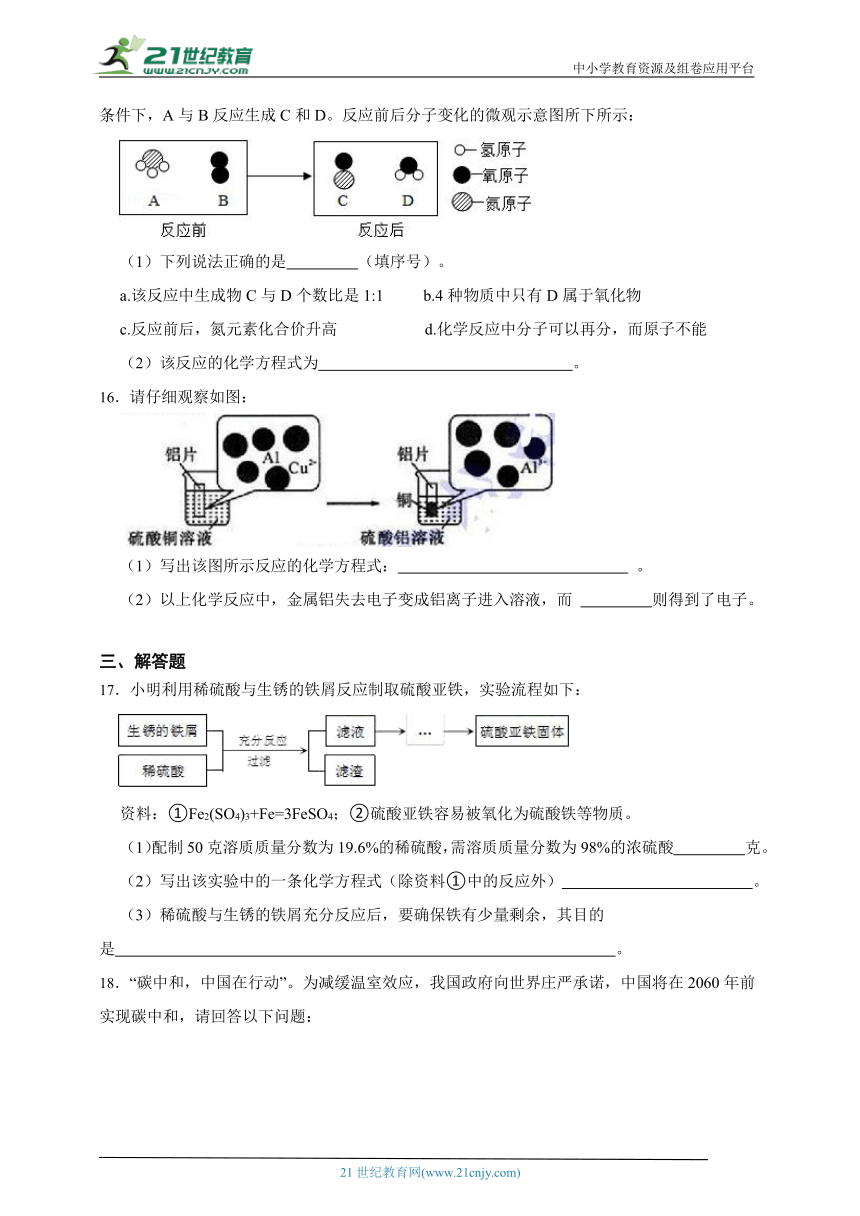
11.科学中有许多概念,不同概念之间常有直接或间接的联系。如图为绿色植物的相关概念图。其中Ⅰ、Ⅱ分别表示植物的两种生理作用,①、②分别表示两种物质。根据所学知识回答:
(1)物质①主要通过植物叶片表皮上的 (填结构),以蒸腾作用的方式进入空气中。
(2)根据图中生理作用Ⅰ、Ⅱ的物质变化和质量守恒定律可推测,物质②中一定含有 元素。
12.植物的光合作用可表示为水+二氧化碳淀粉+氧气,由此可推断淀粉一定含有 元素,可能含 元素。
13.质量守恒定律的发现对化学的发展做出了重要贡献。
(1)通过称量下列各组试剂在密闭容器内混合前后的总质量,能验证质量守恒定律的是 。
A.蔗糖和水
B.氯化钠溶液和硝酸钾溶液
C.氢氧化钠溶液和硫酸铜溶液
(2)在氧气中点燃红磷的实验过程,固体质量变化如图所示。从燃烧条件分析,固体质量在t1前没有发生变化的主要原因是 。
14.金不与稀硫酸反应,真金不怕火炼(灼烧时不被氧化)。已知某金制品中混有铜,小李的检验步骤为:①在酒精灯上灼烧金制品;②将灼烧后的金制品在稀硫酸中浸一段时间。
则步骤①、②发生反应的化学方程式是分别是 、 。
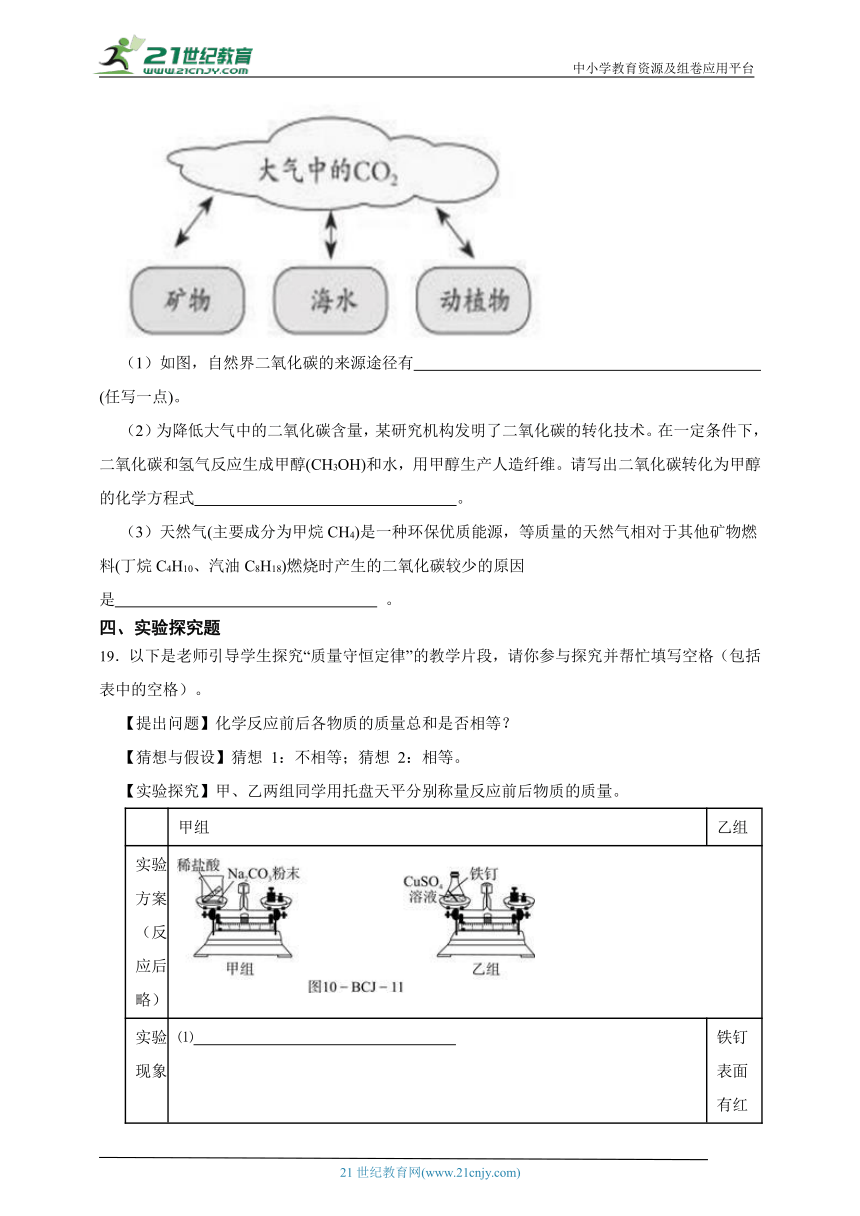
15.质量守恒定律是化学反应中的重要规律,我能运用此规律解答下列问题:在催化剂并加热的条件下,A与B反应生成C和D。反应前后分子变化的微观示意图所下所示:
(1)下列说法正确的是 (填序号)。
a.该反应中生成物C与D个数比是1:1 b.4种物质中只有D属于氧化物
c.反应前后,氮元素化合价升高 d.化学反应中分子可以再分,而原子不能
(2)该反应的化学方程式为 。
16.请仔细观察如图:
(1)写出该图所示反应的化学方程式: 。
(2)以上化学反应中,金属铝失去电子变成铝离子进入溶液,而
则得到了电子。
三、解答题
17.小明利用稀硫酸与生锈的铁屑反应制取硫酸亚铁,实验流程如下:
资料:①Fe2(SO4)3+Fe=3FeSO4;②硫酸亚铁容易被氧化为硫酸铁等物质。
(1)配制50克溶质质量分数为19.6%的稀硫酸,需溶质质量分数为98%的浓硫酸 克。
(2)写出该实验中的一条化学方程式(除资料①中的反应外) 。
(3)稀硫酸与生锈的铁屑充分反应后,要确保铁有少量剩余,其目的是 。
18.“碳中和,中国在行动”。为减缓温室效应,我国政府向世界庄严承诺,中国将在2060年前实现碳中和,请回答以下问题:
(1)如图,自然界二氧化碳的来源途径有 (任写一点)。
(2)为降低大气中的二氧化碳含量,某研究机构发明了二氧化碳的转化技术。在一定条件下,二氧化碳和氢气反应生成甲醇(CH3OH)和水,用甲醇生产人造纤维。请写出二氧化碳转化为甲醇的化学方程式 。
(3)天然气(主要成分为甲烷CH4)是一种环保优质能源,等质量的天然气相对于其他矿物燃料(丁烷C4H10、汽油C8H18)燃烧时产生的二氧化碳较少的原因是 。
四、实验探究题
19.以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
【提出问题】化学反应前后各物质的质量总和是否相等?
【猜想与假设】猜想 1:不相等;猜想 2:相等。
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 乙组
实验方案 (反应后略)
实验现象 ⑴ 铁钉表面有红色物质析出,溶液颜色发生改变,天平指针没有偏转
结论 猜想 1 正确 猜想 2 正确
【反思评价】究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在密闭容器中进行。
【优化装置】⑴同学们对甲组左盘中的反应装置进行了如图所示三种改进,你认为最佳装置是 (填序号),从另外两种装置中任选一种指出其不足 。
【提示信息】2NaOH+CO2═Na2CO3+H2O
20.已知碳酸亚铁在隔绝空气的条件下,受热易分解生成氧化亚铁和二氧化碳。某兴趣小组用下图所示的装置模拟炼铁过程(该装置气密性良好,B中氢氧化钠溶液足量)。
实验过程中,先打开K通入一氧化碳再加热;装置A中固体质量不再减少后,停止加热,待装置A冷却到室温后关闭K。实验测得装置A中固体质量减少了ag,装置B中液体质量增加了bg。回答下列问题:
(1)写出装置A中发生的一个反应的化学方程式 ;
(2)若生成的二氧化碳全部被装置B吸收,不考虑水的蒸发且该样品中所含杂质不参加反应,则A b(填“>”“=”或“<”);
(3)D处为收集尾气的装置,应选择 装置(填“甲”“乙”或“丙”)
答案解析部分
1.【答案】A
【解析】【分析】根据质量守恒定律分析判断。
【解答】“人工空气”与氧气反应,生成水。因为水中只含有碳元素和氧元素,而氧气中只含有氧元素,因此“人工空气”只含有氢元素,即它为氢气,故A正确,而B、C、D错误。
故选A。
2.【答案】A
【解析】【分析】根据图示中物质类别分析。
【解答】由图示可知,该反应是金属与盐的反应生成另一种金属和另一种盐;
故选A。
3.【答案】B
【解析】【分析】根据密闭容器中发生化学反应时物质质量总和保持不变分析。
【解答】 木炭在耐高温的容器中(内含足量空气)密封加热, 反应前后容器中物质总质量保持不变;
故选B。
4.【答案】C
【解析】【分析】化学反应的本质就是分子分解为原子,原子再重新组合成新分子的过程,据此分析判断。
【解答】根据质量守恒定律可知,水通电分解成氢气和氧气的反应前后,元素种类、原子种类、原子数量都保持不变,发生改变的是分子的种类和数量,故C正确,而A、B、D错误。
故选C。
5.【答案】B
【解析】【分析】根据质量守恒定律分析计算。
【解答】根据质量守恒定律可知,A和B的质量和等于C和D的质量和,
则参加反应的B的质量为:
。
故选B。
6.【答案】A
【解析】【分析】根据图片确定物质种类和名称,并写出对应的化学方程式,然后对各个选项进行判断。
【解答】根据图片可知,氢气和二氧化碳反应,生成甲醇和水,则反应的方程式为:
;
A.根据方程式可知,甲氢气为单质,乙CO2和丁H2O都由两种元素组成,其中一种为氧元素,二者为氧化物,故A正确;
B.根据方程式可知,反应前后分子的个数发生改变,故B错误;
C.参加反应的甲和乙的分子个数比为3:1,故C错误;
D.生成物丙中碳、氢原子个数比为:1:6,故D错误。
故选A。
7.【答案】D
【解析】【分析】(1)只由一种元素组成的纯净物叫单质,由多种元素组成的纯净物叫化合物;
(2)根据正负化合价的代数和为零计算;
(3)根据图片分析生成物的化学式;
(4)根据反应的化学方程式判断。
【解答】根据图片可知,其中的2个没有参加反应,将其去掉得到:
二氧化碳和氢气反应,生成甲醇,反应的方程式为:。
A.生成物只有一种,为化合物,故A错误;
B.在反应物CO2中,O的化合价为-2价,则C的化合价为+4价,故B错误;
C.生成物为CH2O2,故C错误;
D.参加反应的二氧化碳和氢气的分子个数之比为1:1,故D正确。
故选D。
8.【答案】A
【解析】【分析】检查方程式书写是否正确时要先看化学式书写是否正确,然后再检查是否配平,最后看是否写清条件标注气体或沉淀符号。
【解答】A、方程式书写正确,符合题意;
B、方程式没有条件、没有配平,不符合题意;
C、方程式中左边反应物有气体,所以有气体生成不标气体符号,不符合题意;
D、铁燃烧生成物为四氧化三铁,生成物化学式书写错误,不符合题意;
故答案为:A。
9.【答案】B
【解析】【分析】根据化学反应前后原子种类和个数不变分析。
【解答】该反应前原子种类及个数为氧原子6个,反应后原子种类及个数为:碳2、氢4、氧6,由反应前后原子种类和个数不变可知,X中含2个碳原子和4个氢原子,化学式为 C2H4 ;
故选B。
10.【答案】D
【解析】【分析】根据反应前后原子种类和个数不变分析。
【解答】由所给方程式可知该反应前原子种类和个数为:钠2、铬2、氧7,反应后为:钠2、铬2、氧11、硫1、氢2,反应前后原子种类和个数不变,则X中含有4个氧原子、1个硫原子和2个氢原子,化学式为 H2SO4 ;
故选D。
11.【答案】(1)气孔
(2)碳、氢
【解析】【分析】本题考查植物的光合作用和呼吸作用。光合作用:二氧化碳+水有机物+氧气,制造有机物,完成无机物转变为有机物,同时维持空气中二氧化碳与氧气平衡;呼吸作用有机物+氧气二氧化碳+水+能量,分解有机物,释放能量。
【解答】根据图表,结合光合呼吸作用的概念不难得出, ① 为水, ② 为有机物,那么过程 Ⅰ为植物的光合作用、过程Ⅱ为植物的呼吸作用。
(1)① 为水,通过蒸腾作用到空气中很明显是通过蒸腾作用完成,水分是通过叶片的气孔而出的;
(2)在反应物中有碳氢氧三种元素,生成物总有氧气,那么根据质量守恒定律可知② 为有机物中一定含有碳氢元素。
故此答案为:(1)气孔;(2)碳、氢
12.【答案】碳、氢;氧
【解析】【分析】根据质量守恒定律分析解答。
【解答】反应物水和二氧化碳中含有氢、氧、碳三种元素,而生成物中氧气只含有氧元素,则淀粉中肯定含有碳、氢元素,可能含有氧元素。
13.【答案】(1)C
(2)温度未达到红磷的着火点
【解析】【分析】(1)根据质量守恒定律为化学变化遵循的规律分析;
(2)根据燃烧需温度达到着火点分析。
【解答】(1)蔗糖和水、氯化钠溶液和硝酸钾溶液不能发生化学变化,不能用于验证质量守恒定律, 氢氧化钠溶液和硫酸铜溶液可发生化学反应,可以验证质量守恒定律,故选C;
(2)红磷燃烧需温度达到着火点,红磷没有发生燃烧前没有与氧气反应,质量未变;
故答案为:(1)C;(2) 温度未达到红磷的着火点 。
14.【答案】2Cu+O2 2CuO;CuO+H2SO4=CuSO4+H2O
【解析】【分析】根据铜在酒精灯上灼烧是铜与氧气反应生成氧化铜,氧化铜与硫酸反应可生成硫酸铜和水分析。
【解答】铜在酒精灯上灼烧是铜与氧气反应生成氧化铜,反应方程式为 2Cu+O2 2CuO ;氧化铜与硫酸反应可生成硫酸铜和水,反应方程式为 CuO+H2SO4=CuSO4+H2O ;
故答案为: 2Cu+O2 2CuO ; CuO+H2SO4=CuSO4+H2O 。
15.【答案】(1)cd
(2)4NH3+5O2 4NO+6H2O
【解析】【分析】(1)①根据质量守恒定律判断;
②由两种元素组成,且其中一种是氧元素的化合物叫氧化物;
③计算出反应前后氮元素的化合价进行比较即可;
④分子是保持物质化学性质的最小微粒,化学变化的过程,其实就是分子分解为原子,原子再重新组合成分子的过程。
(2)根据图片确定反应物和生成物,然后配平写出化学方程式。
【解答】(1)a.反应前有3个氢原子,而反应后只有2个氢原子,可见微观示意图并没有完全反映参加化学反应的分子个数,肯定不是1:1,故a错误;
b.根据和可知,生成物C和D都是氧化物,故b错误;
c.反应前的化学式为NH3,氮元素的化合价为-3价;反应后的化学式为NO,氮元素的化合价为+2价,故c正确;
d.化学反应中分子可以再分,而原子不能,故d正确。
故选cd。
(2)根据示意图可知,氨气和氧气在催化剂和加热的条件下,生成一氧化氮和水,那么反应的方程式为: 4NH3+5O2 4NO+6H2O 。
16.【答案】(1)2Al+3CuSO4=3Cu+Al2(SO4)3
(2)Cu2+
【解析】【分析】根据题中所给的图示及微观粒子图进行分析即可。
【解答】(1)将铝片插入硫酸铜溶液中,铝会与硫酸铜发生置换反应, 反应的化学方程式为:2Al+3CuSO4=3Cu+Al2(SO4)3
(2) 以上化学反应中,金属铝失去电子变成铝离子进入溶液,溶液中的铜离子则得到电子变成铜单质。
故答案为:(1)
2Al+3CuSO4=3Cu+Al2(SO4)3;(2) Cu2+
17.【答案】(1)10
(2)Fe+H2SO4=FeSO4+H2↑
(3)使生成的硫酸铁完全转化为硫酸亚铁;防止生成的硫酸亚铁被氧化
【解析】【分析】(1)根据溶液稀释前后溶质质量不变分析;
(2)根据铁和氧化铁都能与硫酸反应分析;
(3)根据铁能与硫酸铁反应及硫酸亚铁易被氧化的性质分析。
【解答】(1) 配制50克溶质质量分数为19.6%的稀硫酸,需溶质质量分数为98%的浓硫酸 质量为50g×19.6%÷98%=10g;
(2)该实验中有铁与硫酸或氧化铁与硫酸的反应,方程式为Fe+H2SO4=FeSO4+H2↑
或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(3) 为使生成的硫酸铁完全转化为硫酸亚铁,防止生成的硫酸亚铁被氧化,稀硫酸与生锈的铁屑充分反应后,要确保铁有少量剩余;
故答案为:(1)10;(2) Fe+H2SO4=FeSO4+H2↑或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;(3)使生成的硫酸铁完全转化为硫酸亚铁;防止生成的硫酸亚铁被氧化 。
18.【答案】(1)矿物燃料的燃烧“海水中溶解的二氧化碳进入大气或动植物的呼吸作用”
(2)3H2+CO2 CH3OH+H2O
(3)天然气中碳元素的质量分数较小
【解析】【分析】(1)根据图片说明自然界二氧化碳的来源;
(2)确定反应物、反应条件和生成物,据此写出反应的化学方程式;
(3)二氧化碳的质量由燃料中碳元素的质量大小决定,而对于质量相同的不同燃料,碳元素的质量分数越大,则其中碳元素的质量越大,自然生成二氧化碳的质量越大,据此分析解答。
【解答】(1)如图,自然界二氧化碳的来源途径有:矿物燃料的燃烧“海水中溶解的二氧化碳进入大气或动植物的呼吸作用”。
(2)氢气和二氧化碳在一定条件下反应,生成甲醇和水,反应的方程式为: 3H2+CO2 CH3OH+H2O 。
(3)天然气(主要成分为甲烷CH4)是一种环保优质能源,等质量的天然气相对于其他矿物燃料(丁烷C4H10、汽油C8H18)燃烧时产生的二氧化碳较少的原因是:天然气中碳元素的质量分数较小。
19.【答案】有气泡产生,天平指针向右偏转;B A;中碳酸钠与盐酸反应生成二氧化碳,二氧化碳充满气球,使整个装置所受空气浮力增大。因此反应后天平不能平衡(或 C 中碳酸钠粉末与盐酸反应太快,橡皮塞易弹出)
【解析】【分析】根据碳酸钠与盐酸反应产生二氧化碳气体,装置敞口会使质量减少,用气球收集气体时会因气球膨胀受空气浮力变大分析。
【解答】 【实验探究】 碳酸钠与盐酸反应产生二氧化碳气体,使得烧杯内质量减小,所以观察到的现象为有气泡产生,指针偏右;
【优化装置】 A中产生气体使气球变大,气球受空气浮力增大,导致天平不平衡;C中产生气体后不能逸出,会使装置内压强增大, 橡皮塞易弹出 ,所以B装置最佳;
故答案为: 有气泡产生,天平指针向右偏转 ; B ;A 中碳酸钠与盐酸反应生成二氧化碳,二氧化碳充满气球,使整个装置所受空气浮力增大。因此反应后天平不能平衡(或 C 中碳酸钠粉末与盐酸反应太快,橡皮塞易弹出) 。
20.【答案】(1)FeCO3FeO+CO2↑(或FeO+COFe+CO2)
(2)<
(3)乙
【解析】【分析】(1)在装置A中,碳酸亚铁在高温的条件下分解为氧化亚铁和二氧化碳,氧化亚铁再和一氧化碳反应生成铁单质和二氧化碳,据此写出反应的化学方程式;
(2)装置A中固体最终只有铁单质,因此质量减小的量等于其中碳元素和氧元素的质量;而B中吸收的二氧化碳,即包括碳酸亚铁分解得到的,也包括和一氧化碳反应得到的,由于一氧化碳的加入,所以b的质量增大量肯定大于a;
(3)尾气一氧化碳有毒,由于它不溶于水,因此应该从短管进入集气瓶,将水从长管压出瓶外,从而将它收集起来。
【解答】(1) 装置A中发生的一个反应的化学方程式 :
①;②;
(2) 若生成的二氧化碳全部被装置B吸收,不考虑水的蒸发且该样品中所含杂质不参加反应,则 a(3) D处为收集尾气的装置,应选择乙装置。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
华师大版 初科 九上 1.1 化学方程式 第1课时 同步练习(含解析)
一、单选题
1.1784年,科学家卡文迪许演示了“人工空气”的燃烧,发现燃烧产物只有水。据此判断“人工空气”可能是( )
A.氢气 B.氮气
C.二氧化碳 D.氧气
2.下列四个化学反应中,符合此漫画情景的是( )
A.Fe +CuSO4=FeSO4+ Cu B.CuO+COCu+CO2
C.H2 +CuOCu+ H2O D.Fe+H2SO4=FeSO4+ H2↑
3.木炭在耐高温的容器中(内含足量空气)密封加热,下列各图中,能正确表示容器中所盛的物质总质量变化的是( )
A. B.
C. D.
4.水通电分解成氢气和氧气的反应前后,发生改变的是( )
A.元素种类 B.原子种类 C.分子种类 D.原子数量
5.在化学反应2A+5B=C+3D中,A、B两种物质恰好完全反应时的质量比为4:3,若生成C和D共21 g,则反应消耗B的质量为( )
A.6g B.9g C.12g D.16g
6.一种新型纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇(CH3OH),其微观示意图如图所示,下列说法正确的是
A.甲是单质,乙、丁均为氧化物
B.在反应前后分子的个数不变
C.参加反应的甲和乙的分子个数比为2 : 1
D.生成物丙中碳、氢原子个数比为1 : 3
7.科技人员成功研制出一种新型催化剂,可将二氧化碳转化成液体燃料,反应的微观示意图如下图。有关该反应的说法正确的是( )
A.反应的生成物既有单质又有化合物
B.反应前碳元素的化合价为+2价
C.生成物中有可用化学式C2H2O2表示的物质
D.参加反应的两物质的分子个数比为1:1
8.化学方程式是重要的化学用语。下列化学方程式书写正确的是( )
A.2KMnO4 K2MnO4+MnO2+O2↑
B.P+O2=P2O5
C.4Fe+3O2 2Fe2O3
D.C+O2 CO2↑
9.已知反应X+3O2 2CO2+2H2O,则X的化学式为( )
A.C2H6 B.C2H4 C.C2H2 D.C2H6O
10.三氧化铬(CrO3)常用于金属镀铬。工业上用重铬酸钠(Na2Cr2O7)制造三氧化铬,反应的化学方程式为Na2Cr2O7+X=2CrO3+Na2SO4+H2O,其中X的化学式是( )
A.H2S B.SO2 C.H2SO3 D.H2SO4
二、填空题
11.科学中有许多概念,不同概念之间常有直接或间接的联系。如图为绿色植物的相关概念图。其中Ⅰ、Ⅱ分别表示植物的两种生理作用,①、②分别表示两种物质。根据所学知识回答:
(1)物质①主要通过植物叶片表皮上的 (填结构),以蒸腾作用的方式进入空气中。
(2)根据图中生理作用Ⅰ、Ⅱ的物质变化和质量守恒定律可推测,物质②中一定含有 元素。
12.植物的光合作用可表示为水+二氧化碳淀粉+氧气,由此可推断淀粉一定含有 元素,可能含 元素。
13.质量守恒定律的发现对化学的发展做出了重要贡献。
(1)通过称量下列各组试剂在密闭容器内混合前后的总质量,能验证质量守恒定律的是 。
A.蔗糖和水
B.氯化钠溶液和硝酸钾溶液
C.氢氧化钠溶液和硫酸铜溶液
(2)在氧气中点燃红磷的实验过程,固体质量变化如图所示。从燃烧条件分析,固体质量在t1前没有发生变化的主要原因是 。
14.金不与稀硫酸反应,真金不怕火炼(灼烧时不被氧化)。已知某金制品中混有铜,小李的检验步骤为:①在酒精灯上灼烧金制品;②将灼烧后的金制品在稀硫酸中浸一段时间。
则步骤①、②发生反应的化学方程式是分别是 、 。
15.质量守恒定律是化学反应中的重要规律,我能运用此规律解答下列问题:在催化剂并加热的条件下,A与B反应生成C和D。反应前后分子变化的微观示意图所下所示:
(1)下列说法正确的是 (填序号)。
a.该反应中生成物C与D个数比是1:1 b.4种物质中只有D属于氧化物
c.反应前后,氮元素化合价升高 d.化学反应中分子可以再分,而原子不能
(2)该反应的化学方程式为 。
16.请仔细观察如图:
(1)写出该图所示反应的化学方程式: 。
(2)以上化学反应中,金属铝失去电子变成铝离子进入溶液,而
则得到了电子。
三、解答题
17.小明利用稀硫酸与生锈的铁屑反应制取硫酸亚铁,实验流程如下:
资料:①Fe2(SO4)3+Fe=3FeSO4;②硫酸亚铁容易被氧化为硫酸铁等物质。
(1)配制50克溶质质量分数为19.6%的稀硫酸,需溶质质量分数为98%的浓硫酸 克。
(2)写出该实验中的一条化学方程式(除资料①中的反应外) 。
(3)稀硫酸与生锈的铁屑充分反应后,要确保铁有少量剩余,其目的是 。
18.“碳中和,中国在行动”。为减缓温室效应,我国政府向世界庄严承诺,中国将在2060年前实现碳中和,请回答以下问题:
(1)如图,自然界二氧化碳的来源途径有 (任写一点)。
(2)为降低大气中的二氧化碳含量,某研究机构发明了二氧化碳的转化技术。在一定条件下,二氧化碳和氢气反应生成甲醇(CH3OH)和水,用甲醇生产人造纤维。请写出二氧化碳转化为甲醇的化学方程式 。
(3)天然气(主要成分为甲烷CH4)是一种环保优质能源,等质量的天然气相对于其他矿物燃料(丁烷C4H10、汽油C8H18)燃烧时产生的二氧化碳较少的原因是 。
四、实验探究题
19.以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
【提出问题】化学反应前后各物质的质量总和是否相等?
【猜想与假设】猜想 1:不相等;猜想 2:相等。
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 乙组
实验方案 (反应后略)
实验现象 ⑴ 铁钉表面有红色物质析出,溶液颜色发生改变,天平指针没有偏转
结论 猜想 1 正确 猜想 2 正确
【反思评价】究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在密闭容器中进行。
【优化装置】⑴同学们对甲组左盘中的反应装置进行了如图所示三种改进,你认为最佳装置是 (填序号),从另外两种装置中任选一种指出其不足 。
【提示信息】2NaOH+CO2═Na2CO3+H2O
20.已知碳酸亚铁在隔绝空气的条件下,受热易分解生成氧化亚铁和二氧化碳。某兴趣小组用下图所示的装置模拟炼铁过程(该装置气密性良好,B中氢氧化钠溶液足量)。
实验过程中,先打开K通入一氧化碳再加热;装置A中固体质量不再减少后,停止加热,待装置A冷却到室温后关闭K。实验测得装置A中固体质量减少了ag,装置B中液体质量增加了bg。回答下列问题:
(1)写出装置A中发生的一个反应的化学方程式 ;
(2)若生成的二氧化碳全部被装置B吸收,不考虑水的蒸发且该样品中所含杂质不参加反应,则A b(填“>”“=”或“<”);
(3)D处为收集尾气的装置,应选择 装置(填“甲”“乙”或“丙”)
答案解析部分
1.【答案】A
【解析】【分析】根据质量守恒定律分析判断。
【解答】“人工空气”与氧气反应,生成水。因为水中只含有碳元素和氧元素,而氧气中只含有氧元素,因此“人工空气”只含有氢元素,即它为氢气,故A正确,而B、C、D错误。
故选A。
2.【答案】A
【解析】【分析】根据图示中物质类别分析。
【解答】由图示可知,该反应是金属与盐的反应生成另一种金属和另一种盐;
故选A。
3.【答案】B
【解析】【分析】根据密闭容器中发生化学反应时物质质量总和保持不变分析。
【解答】 木炭在耐高温的容器中(内含足量空气)密封加热, 反应前后容器中物质总质量保持不变;
故选B。
4.【答案】C
【解析】【分析】化学反应的本质就是分子分解为原子,原子再重新组合成新分子的过程,据此分析判断。
【解答】根据质量守恒定律可知,水通电分解成氢气和氧气的反应前后,元素种类、原子种类、原子数量都保持不变,发生改变的是分子的种类和数量,故C正确,而A、B、D错误。
故选C。
5.【答案】B
【解析】【分析】根据质量守恒定律分析计算。
【解答】根据质量守恒定律可知,A和B的质量和等于C和D的质量和,
则参加反应的B的质量为:
。
故选B。
6.【答案】A
【解析】【分析】根据图片确定物质种类和名称,并写出对应的化学方程式,然后对各个选项进行判断。
【解答】根据图片可知,氢气和二氧化碳反应,生成甲醇和水,则反应的方程式为:
;
A.根据方程式可知,甲氢气为单质,乙CO2和丁H2O都由两种元素组成,其中一种为氧元素,二者为氧化物,故A正确;
B.根据方程式可知,反应前后分子的个数发生改变,故B错误;
C.参加反应的甲和乙的分子个数比为3:1,故C错误;
D.生成物丙中碳、氢原子个数比为:1:6,故D错误。
故选A。
7.【答案】D
【解析】【分析】(1)只由一种元素组成的纯净物叫单质,由多种元素组成的纯净物叫化合物;
(2)根据正负化合价的代数和为零计算;
(3)根据图片分析生成物的化学式;
(4)根据反应的化学方程式判断。
【解答】根据图片可知,其中的2个没有参加反应,将其去掉得到:
二氧化碳和氢气反应,生成甲醇,反应的方程式为:。
A.生成物只有一种,为化合物,故A错误;
B.在反应物CO2中,O的化合价为-2价,则C的化合价为+4价,故B错误;
C.生成物为CH2O2,故C错误;
D.参加反应的二氧化碳和氢气的分子个数之比为1:1,故D正确。
故选D。
8.【答案】A
【解析】【分析】检查方程式书写是否正确时要先看化学式书写是否正确,然后再检查是否配平,最后看是否写清条件标注气体或沉淀符号。
【解答】A、方程式书写正确,符合题意;
B、方程式没有条件、没有配平,不符合题意;
C、方程式中左边反应物有气体,所以有气体生成不标气体符号,不符合题意;
D、铁燃烧生成物为四氧化三铁,生成物化学式书写错误,不符合题意;
故答案为:A。
9.【答案】B
【解析】【分析】根据化学反应前后原子种类和个数不变分析。
【解答】该反应前原子种类及个数为氧原子6个,反应后原子种类及个数为:碳2、氢4、氧6,由反应前后原子种类和个数不变可知,X中含2个碳原子和4个氢原子,化学式为 C2H4 ;
故选B。
10.【答案】D
【解析】【分析】根据反应前后原子种类和个数不变分析。
【解答】由所给方程式可知该反应前原子种类和个数为:钠2、铬2、氧7,反应后为:钠2、铬2、氧11、硫1、氢2,反应前后原子种类和个数不变,则X中含有4个氧原子、1个硫原子和2个氢原子,化学式为 H2SO4 ;
故选D。
11.【答案】(1)气孔
(2)碳、氢
【解析】【分析】本题考查植物的光合作用和呼吸作用。光合作用:二氧化碳+水有机物+氧气,制造有机物,完成无机物转变为有机物,同时维持空气中二氧化碳与氧气平衡;呼吸作用有机物+氧气二氧化碳+水+能量,分解有机物,释放能量。
【解答】根据图表,结合光合呼吸作用的概念不难得出, ① 为水, ② 为有机物,那么过程 Ⅰ为植物的光合作用、过程Ⅱ为植物的呼吸作用。
(1)① 为水,通过蒸腾作用到空气中很明显是通过蒸腾作用完成,水分是通过叶片的气孔而出的;
(2)在反应物中有碳氢氧三种元素,生成物总有氧气,那么根据质量守恒定律可知② 为有机物中一定含有碳氢元素。
故此答案为:(1)气孔;(2)碳、氢
12.【答案】碳、氢;氧
【解析】【分析】根据质量守恒定律分析解答。
【解答】反应物水和二氧化碳中含有氢、氧、碳三种元素,而生成物中氧气只含有氧元素,则淀粉中肯定含有碳、氢元素,可能含有氧元素。
13.【答案】(1)C
(2)温度未达到红磷的着火点
【解析】【分析】(1)根据质量守恒定律为化学变化遵循的规律分析;
(2)根据燃烧需温度达到着火点分析。
【解答】(1)蔗糖和水、氯化钠溶液和硝酸钾溶液不能发生化学变化,不能用于验证质量守恒定律, 氢氧化钠溶液和硫酸铜溶液可发生化学反应,可以验证质量守恒定律,故选C;
(2)红磷燃烧需温度达到着火点,红磷没有发生燃烧前没有与氧气反应,质量未变;
故答案为:(1)C;(2) 温度未达到红磷的着火点 。
14.【答案】2Cu+O2 2CuO;CuO+H2SO4=CuSO4+H2O
【解析】【分析】根据铜在酒精灯上灼烧是铜与氧气反应生成氧化铜,氧化铜与硫酸反应可生成硫酸铜和水分析。
【解答】铜在酒精灯上灼烧是铜与氧气反应生成氧化铜,反应方程式为 2Cu+O2 2CuO ;氧化铜与硫酸反应可生成硫酸铜和水,反应方程式为 CuO+H2SO4=CuSO4+H2O ;
故答案为: 2Cu+O2 2CuO ; CuO+H2SO4=CuSO4+H2O 。
15.【答案】(1)cd
(2)4NH3+5O2 4NO+6H2O
【解析】【分析】(1)①根据质量守恒定律判断;
②由两种元素组成,且其中一种是氧元素的化合物叫氧化物;
③计算出反应前后氮元素的化合价进行比较即可;
④分子是保持物质化学性质的最小微粒,化学变化的过程,其实就是分子分解为原子,原子再重新组合成分子的过程。
(2)根据图片确定反应物和生成物,然后配平写出化学方程式。
【解答】(1)a.反应前有3个氢原子,而反应后只有2个氢原子,可见微观示意图并没有完全反映参加化学反应的分子个数,肯定不是1:1,故a错误;
b.根据和可知,生成物C和D都是氧化物,故b错误;
c.反应前的化学式为NH3,氮元素的化合价为-3价;反应后的化学式为NO,氮元素的化合价为+2价,故c正确;
d.化学反应中分子可以再分,而原子不能,故d正确。
故选cd。
(2)根据示意图可知,氨气和氧气在催化剂和加热的条件下,生成一氧化氮和水,那么反应的方程式为: 4NH3+5O2 4NO+6H2O 。
16.【答案】(1)2Al+3CuSO4=3Cu+Al2(SO4)3
(2)Cu2+
【解析】【分析】根据题中所给的图示及微观粒子图进行分析即可。
【解答】(1)将铝片插入硫酸铜溶液中,铝会与硫酸铜发生置换反应, 反应的化学方程式为:2Al+3CuSO4=3Cu+Al2(SO4)3
(2) 以上化学反应中,金属铝失去电子变成铝离子进入溶液,溶液中的铜离子则得到电子变成铜单质。
故答案为:(1)
2Al+3CuSO4=3Cu+Al2(SO4)3;(2) Cu2+
17.【答案】(1)10
(2)Fe+H2SO4=FeSO4+H2↑
(3)使生成的硫酸铁完全转化为硫酸亚铁;防止生成的硫酸亚铁被氧化
【解析】【分析】(1)根据溶液稀释前后溶质质量不变分析;
(2)根据铁和氧化铁都能与硫酸反应分析;
(3)根据铁能与硫酸铁反应及硫酸亚铁易被氧化的性质分析。
【解答】(1) 配制50克溶质质量分数为19.6%的稀硫酸,需溶质质量分数为98%的浓硫酸 质量为50g×19.6%÷98%=10g;
(2)该实验中有铁与硫酸或氧化铁与硫酸的反应,方程式为Fe+H2SO4=FeSO4+H2↑
或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(3) 为使生成的硫酸铁完全转化为硫酸亚铁,防止生成的硫酸亚铁被氧化,稀硫酸与生锈的铁屑充分反应后,要确保铁有少量剩余;
故答案为:(1)10;(2) Fe+H2SO4=FeSO4+H2↑或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;(3)使生成的硫酸铁完全转化为硫酸亚铁;防止生成的硫酸亚铁被氧化 。
18.【答案】(1)矿物燃料的燃烧“海水中溶解的二氧化碳进入大气或动植物的呼吸作用”
(2)3H2+CO2 CH3OH+H2O
(3)天然气中碳元素的质量分数较小
【解析】【分析】(1)根据图片说明自然界二氧化碳的来源;
(2)确定反应物、反应条件和生成物,据此写出反应的化学方程式;
(3)二氧化碳的质量由燃料中碳元素的质量大小决定,而对于质量相同的不同燃料,碳元素的质量分数越大,则其中碳元素的质量越大,自然生成二氧化碳的质量越大,据此分析解答。
【解答】(1)如图,自然界二氧化碳的来源途径有:矿物燃料的燃烧“海水中溶解的二氧化碳进入大气或动植物的呼吸作用”。
(2)氢气和二氧化碳在一定条件下反应,生成甲醇和水,反应的方程式为: 3H2+CO2 CH3OH+H2O 。
(3)天然气(主要成分为甲烷CH4)是一种环保优质能源,等质量的天然气相对于其他矿物燃料(丁烷C4H10、汽油C8H18)燃烧时产生的二氧化碳较少的原因是:天然气中碳元素的质量分数较小。
19.【答案】有气泡产生,天平指针向右偏转;B A;中碳酸钠与盐酸反应生成二氧化碳,二氧化碳充满气球,使整个装置所受空气浮力增大。因此反应后天平不能平衡(或 C 中碳酸钠粉末与盐酸反应太快,橡皮塞易弹出)
【解析】【分析】根据碳酸钠与盐酸反应产生二氧化碳气体,装置敞口会使质量减少,用气球收集气体时会因气球膨胀受空气浮力变大分析。
【解答】 【实验探究】 碳酸钠与盐酸反应产生二氧化碳气体,使得烧杯内质量减小,所以观察到的现象为有气泡产生,指针偏右;
【优化装置】 A中产生气体使气球变大,气球受空气浮力增大,导致天平不平衡;C中产生气体后不能逸出,会使装置内压强增大, 橡皮塞易弹出 ,所以B装置最佳;
故答案为: 有气泡产生,天平指针向右偏转 ; B ;A 中碳酸钠与盐酸反应生成二氧化碳,二氧化碳充满气球,使整个装置所受空气浮力增大。因此反应后天平不能平衡(或 C 中碳酸钠粉末与盐酸反应太快,橡皮塞易弹出) 。
20.【答案】(1)FeCO3FeO+CO2↑(或FeO+COFe+CO2)
(2)<
(3)乙
【解析】【分析】(1)在装置A中,碳酸亚铁在高温的条件下分解为氧化亚铁和二氧化碳,氧化亚铁再和一氧化碳反应生成铁单质和二氧化碳,据此写出反应的化学方程式;
(2)装置A中固体最终只有铁单质,因此质量减小的量等于其中碳元素和氧元素的质量;而B中吸收的二氧化碳,即包括碳酸亚铁分解得到的,也包括和一氧化碳反应得到的,由于一氧化碳的加入,所以b的质量增大量肯定大于a;
(3)尾气一氧化碳有毒,由于它不溶于水,因此应该从短管进入集气瓶,将水从长管压出瓶外,从而将它收集起来。
【解答】(1) 装置A中发生的一个反应的化学方程式 :
①;②;
(2) 若生成的二氧化碳全部被装置B吸收,不考虑水的蒸发且该样品中所含杂质不参加反应,则 a
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
