3.3 第2课时 乙酸 课件 (共51张PPT)
文档属性
| 名称 | 3.3 第2课时 乙酸 课件 (共51张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-21 18:06:18 | ||
图片预览










文档简介
(共51张PPT)
0
第3章 简单的有机化合物
第3节 饮食中的有机化合物
第2课时 乙酸
核心素养 学业要求
通过乙酸的学习,体会有机化学反应与无机化学反应在反应条件、反应试剂与生成物等方面的差异,深化“结构决定性质,性质反映结构”“性质决定用途”等学科观念。 1.了解乙酸的组成、物理性质和主要应用。
2.掌握乙酸的主要化学性质,掌握酯化反应的原理和实验操作。
学生自主学习
01
课时作业
03
目录
CONTENTS
课堂互动探究
02
学生自主学习
一、乙酸的物理性质、结构和酸性
1.乙酸的物理性质
乙酸是食醋中的主要有机化合物,故乙酸俗称醋酸。乙酸是一种有_________气味的____色液体,沸点为117.9 ℃,熔点为16.6 ℃;当温度低于16.6 ℃时,乙酸就凝结成像冰一样的晶体,所以无水乙酸又称________。
强烈刺激性
冰醋酸
无
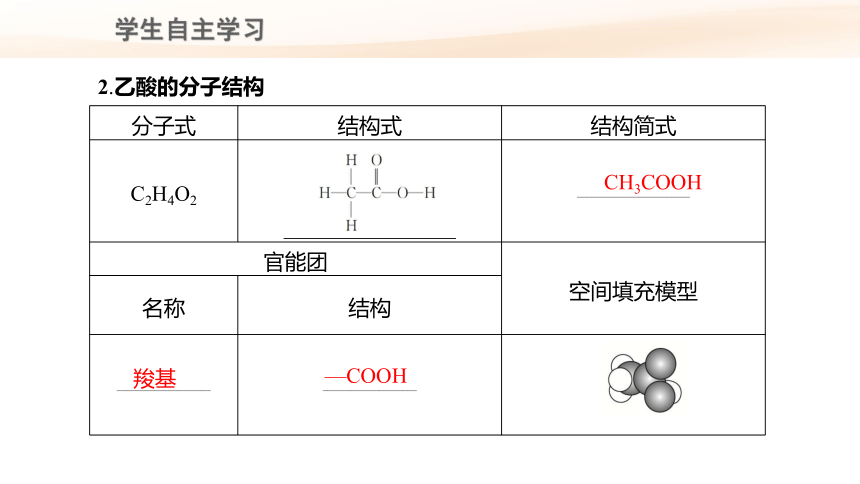
分子式 结构式 结构简式
C2H4O2 ________________ ________________________
官能团 空间填充模型
名称 结构
____________________ ____________________
2.乙酸的分子结构
CH3COOH
羧基
—COOH
3.乙酸的酸性
乙酸是一种常见的有机酸,其酸性弱于硫酸、盐酸等酸的酸性。乙酸具有酸的通性:
(1)能使紫色石蕊试液变_____。
(2)能与活泼金属反应产生_____。
(3)能与NaOH等碱发生_______反应。
二、乙酸的酯化反应
1.酯化反应:酸与醇反应生成________的反应。酯化反应是______的。
红
H2
中和
酯和水
可逆
实验装置
实验现象 a.饱和Na2CO3溶液的液面上有____________________生成
b.闻到_____味
化学方程式 _________________________________________________________________________________________________________________
2.乙酸与乙醇的酯化反应
无色透明的油状液体
香
1.判断正误,正确的打“√”,错误的打“×”。
(1)乙酸俗名为醋酸,食醋为纯净物。( )
(2)可用紫色石蕊溶液鉴别乙醇和乙酸。( )
(3)乙酸的酸性比碳酸强,能和很多碳酸盐反应生成CO2气体。( )
(4)乙酸和乙醇发生酯化反应时,乙酸表现出酸的通性。( )
(5)制乙酸乙酯时,为提高乙酸的转化率,可加入稍过量的乙醇。( )
(6)乙酸和乙醇发生的酯化反应也属于取代反应。( )
×
√
√
×
√
√
2.下列关于乙酸的认识正确的是( )
A.乙酸的分子式是C2H4O,是四元羧酸
B.标准状况下,乙酸为冰状固体
C.普通食醋中乙酸的含量为12%左右
D.乙酸有羧基和甲基两种官能团
解析 —COOH和—OH均可与Na发生置换反应,可实现转化,A正确;醇羟基与NaOH、Na2CO3、NaHCO3均不反应。
4.下列物质不能发生酯化反应的是( )
A.HOCH2—CH==CH—COOH B.CH3CH2COOH
C.乙烷 D.CH3OH
课堂互动探究
探究一 认识乙酸的酸性
2.羟基氢原子的活泼性比较
乙醇 水 碳酸 乙酸
酸碱性 — 中性 弱酸性 弱酸性
电离程度 — 微弱电离 部分电离 部分电离
与Na反应的反应现象 缓和―→剧烈
与NaOH溶液 不反应 不反应 反应 反应
与NaHCO3溶液 不反应 不反应 不反应 反应
羟基氢原子的活泼性 CH3CH2OH弱酸指在溶液中不完全电离的酸,有机酸是弱酸中重要的一类,常见的家用弱有机酸包括醋内的乙酸,柠檬及不少水果内的柠檬酸等;无机酸当中如用作抗菌剂的硼酸,及用在汽水当中的碳酸和磷酸等。
1.下列物质都能与Na反应放出H2,其产生H2的速率由快到慢排列正确的是( )
①C2H5OH ②CH3COOH(溶液) ③H2O
A.①>②>③ B.②>①>③
C.③>①>② D.②>③>①
2.普通的食醋中一般含3%~5%(质量分数)的乙酸,无水乙酸常被称为冰醋酸。
回答下列问题:
(1)乙酸可用于除水垢,写出乙酸与碳酸钙反应的化学方程式:______________________________________________,该反应说明乙酸的酸性比碳酸的________(填“强”或“弱”)。
(2)乙酸能与活泼金属反应,写出乙酸与镁反应的离子方程式:___________________________________________。
(3)乙酸可燃烧,写出乙酸燃烧的化学方程式:________________________
____________。
2CH3COOH+CaCO3―→(CH3COO)2Ca+CO2↑+H2O
强
2CH3COOH+Mg―→Mg2++2CH3COO-+H2↑
—OH、—COOH反应的定量关系
1 mol —OH 1 mol —COOH
Na~H2 1~0.5 mol 1~0.5 mol
NaOH — 1 mol
Na2CO3~CO2 — 0.5~0.5 mol
NaHCO3~CO2 — 1~1 mol
探究二 乙酸的酯化反应
1.酯化反应的实质
即酸脱羟基、醇脱氢。
2.乙酸和乙醇酯化反应实验的注意事项
(1)试剂的加入顺序
先加入乙醇和乙酸,然后沿器壁慢慢加入浓H2SO4(或依次加入乙醇、浓硫酸、乙酸)。
(2)导管末端不能插入饱和Na2CO3溶液中,防止造成溶液倒吸。
(3)浓H2SO4的作用
①催化剂——加快反应速率。
②吸水剂——提高CH3COOH、CH3CH2OH的转化率。
(4)饱和Na2CO3溶液的作用
①溶解挥发出来的乙醇。
②与挥发出来的乙酸反应生成乙酸钠,除去乙酸。
③降低乙酸乙酯的溶解度,使溶液分层,便于分离得到酯。
(5)装置
①长导管的作用:导气兼冷凝。
②碎瓷片的作用:防止暴沸。
(6)产物分离
用分液法分离,上层油状液体为产物乙酸乙酯。
(7)实验中采取的加快反应速率的措施
①加热。
②使用无水乙醇和冰醋酸,增大反应物浓度。
③使用催化剂。
(1)发生酯化反应时,有机羧酸分子断C—O键,醇分子断O—H键。
(2)乙酸乙酯可以看作C2H5OH(或CH3COOH)中的—OC2H5(或CH3CO—)取代了CH3COOH(或C2H5OH)中的—OH(或—OH上的氢原子)而形成的化合物,因此酯化反应属于取代反应。
(3)可与醇发生酯化反应的酸既可以是有机羧酸(由烃基或氢原子和羧基相连构成的有机化合物称为羧酸,饱和一元羧酸的通式是CnH2nO2(n≥1),甲酸是最简单的羧酸),也可以是无机酸,如硝酸、硫酸等。
4.可用如图所示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是_____________________________________________________________________
____________________________________________________________________________________________。
先加入2 mL乙醇和2 mL冰醋酸混合物,然后一边摇动试管一边慢慢地加入2 mL浓硫酸(或先加入2 mL乙醇,然后一边摇动试管一边慢慢加入2 mL浓硫酸,最后加入2 mL乙酸)
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是_______________________________。
(3)实验中加热试管a的目的是:
①_______________________________________________________________;
②________________________________________________________________。
a中反应的化学方程式:____________________________________________。
在试管中加入几块沸石(或碎瓷片)
加快反应速率
及时将产物乙酸乙酯蒸出,提高乙酸乙酯产率
(4)球形干燥管c的作用是_________________,b烧杯中加有饱和Na2CO3溶液,其作用是______________________________________________________________。
(5)若反应前向b中加入几滴酚酞,溶液呈红色,反应结束后b中的现象是__________________________________________________。
冷凝和防止倒吸
吸收蒸出的少量乙酸,溶解蒸出的少量乙醇,降低乙酸乙酯的溶解度
出现分层现象,下层红色变浅,上层是无色的油状液体
制取乙酸乙酯的注意事项
(1)乙酸乙酯的吸收一定注意防止倒吸,且吸收液不能用NaOH代替Na2CO3,因为NaOH溶液碱性很强,会使乙酸乙酯水解。
(2)实验中小火加热保持微沸,不能大火加热,这样有利于产物的生成和蒸发且减少反应物的蒸发。
本课小结
课时作业
一、选择题(每小题只有1个选项符合题意)
1.乙酸是生活中常见的一种有机物,下列关于乙酸的说法中正确的是( )
A.乙酸的官能团为—OH
B.乙酸的酸性比碳酸弱
C.乙酸能够与金属钠反应产生氢气
D.乙酸能使紫色的石蕊试液变蓝
解析 乙酸分子的官能团为—COOH,A错误;乙酸的酸性比碳酸强,B错误;乙酸具有酸的通性,与钠反应产生氢气,C正确;乙酸能使紫色石蕊试液变红,D错误。
2.下列关于乙酸性质的叙述错误的是( )
A.常温下,乙酸是一种有强烈刺激性气味的无色液体
B.冰醋酸是无水乙酸,不是乙酸的水溶液
C.乙酸能跟碳酸钠溶液发生反应产生CO2
D.在发生酯化反应时,乙酸分子中羧基上的氢原子跟醇分子中的羟基结合生成水
解析 酯化反应中羧基“脱羟基”,醇中羟基“脱氢”。
3.下列有关酯化反应的说法正确的是( )
A.醇与酸的反应都是酯化反应
B.酯化反应和中和反应原理一样
C.酯化反应既属于取代反应,也属于可逆反应
D.酯化反应的机理是羧酸去掉氢原子而醇去掉羟基
解析 醇与酸作用生成酯和水的反应才是酯化反应,A错误;中和反应是指酸和碱反应生成盐和水,二者反应原理不同,B错误;酯化反应的机理是羧酸去掉—OH,醇去掉羟基上的H原子,D错误。
4.如图所示是某有机物分子的空间填充模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。则该物质不具有的性质是( )
A.与氢氧化钠反应 B.与稀硫酸反应
C.发生酯化反应 D.使紫色石蕊试液变红
解析 由题给空间填充模型可知,该物质为乙酸(CH3COOH),该物质显酸性,能使紫色石蕊试液变红,能与NaOH反应,能与醇发生酯化反应。
5.实验室用乙酸、乙醇、浓硫酸制取乙酸乙酯,加热后,在饱和Na2CO3溶液的液面上得到无色油状液体,当振荡混合物时,有气泡产生,主要原因可能是( )
A.有部分H2SO4被蒸馏出来
B.有部分未反应的乙醇被蒸馏出来
C.有部分未反应的乙酸被蒸馏出来
D.有部分乙酸乙酯与碳酸钠发生了反应
解析 在酯化反应的实验中,乙酸乙酯、乙醇、乙酸均可被蒸出反应器,H2SO4具有高沸点、难挥发的特性,不易被蒸出反应器,乙醇、乙酸乙酯在常温下不与Na2CO3溶液反应;CH3COOH的酸性强于碳酸,在振荡时可与Na2CO3反应生成CO2气体。
6.莽草酸可用于合成药物达菲,莽草酸的结构简式如图所示。下列关于莽草酸的说法正确的是( )
A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成反应和取代反应
D.在水溶液中羧基和羟基均能电离出H+
解析 由结构简式可知该物质的分子式为C7H10O5,A错误;该分子中含有羧基、羟基和碳碳双键3种官能团,B错误;分子中含有碳碳双键,可发生加成反应,含有羧基、羟基,可发生酯化反应,酯化反应属于取代反应,另外分子中碳环上的氢原子也可被卤素原子取代,C正确;在水溶液中羧基能电离出H+,羟基不能电离,D错误。
7.若乙酸分子中的O都是18O,乙醇分子中的O都是16O,二者在一定条件下反应,生成物中水的相对分子质量为( )
A.22 B.20
C.18 D.19
9.如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
A.向a试管中先加入乙醇,然后边摇动试管边慢慢加入
浓硫酸,再加冰醋酸
B.试管b中导气管下端管口不能浸入液面下的原因是防
止实验过程中发生倒吸现象
C.实验时,加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率
D.可将饱和碳酸钠溶液换成氢氧化钠溶液
解析 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇,同时降低乙酸乙酯的溶解度,而氢氧化钠能与乙酸乙酯反应,故不能用氢氧化钠溶液代替饱和碳酸钠溶液,D错误。
10.分子式为C5H10O2的酸共有(不考虑立体异构)( )
A.2种 B.3种
C.4种 D.5种
解析 C5H10O2可看作C4H9—COOH,即—COOH取代丁烷中的一个H,丁烷的一元取代物有4种,则分子式为C5H10O2的酸有4种。
C4H6O5
33.6
ABCD
(3)苹果酸可能发生的反应是________(填序号)。
A.与NaOH溶液反应
B.与石蕊试液作用
C.与酸性高锰酸钾溶液反应
D.与乙醇在一定条件下发生酯化反应
12.下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采用乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,浓硫酸的作用是____________、____________。
【装置设计】甲、乙、丙三位同学分别设计了如图所示三套实验装置:
催化剂
吸水剂
请从甲、乙两位同学设计的装置中选择一套作为实验室制取乙酸乙酯的装置,应选择的装置是________(填“Ⅰ”或“Ⅱ”)。丙同学将Ⅰ装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是__________。
【实验步骤】(1)按选择的装置组装仪器,在试管①中先加入3 mL乙醇和2 mL冰醋酸,并在摇动下缓缓加入2 mL浓硫酸,再加入2~3块碎瓷片;
(2)将试管固定在铁架上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时停止实验。
Ⅱ
防止倒吸
【问题讨论】a.步骤(1)中组装好实验装置,加入样品前还应____________________。
b.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有______________________________。
c.试管②中饱和Na2CO3溶液的作用是__________、____________、_______________________。
d.从试管②中分离出乙酸乙酯的实验操作是_______。
检查装置的气密性
无色、不溶于水、密度比水小等
溶解乙醇
中和乙酸
降低乙酸乙酯的溶解度
分液
0
第3章 简单的有机化合物
第3节 饮食中的有机化合物
第2课时 乙酸
核心素养 学业要求
通过乙酸的学习,体会有机化学反应与无机化学反应在反应条件、反应试剂与生成物等方面的差异,深化“结构决定性质,性质反映结构”“性质决定用途”等学科观念。 1.了解乙酸的组成、物理性质和主要应用。
2.掌握乙酸的主要化学性质,掌握酯化反应的原理和实验操作。
学生自主学习
01
课时作业
03
目录
CONTENTS
课堂互动探究
02
学生自主学习
一、乙酸的物理性质、结构和酸性
1.乙酸的物理性质
乙酸是食醋中的主要有机化合物,故乙酸俗称醋酸。乙酸是一种有_________气味的____色液体,沸点为117.9 ℃,熔点为16.6 ℃;当温度低于16.6 ℃时,乙酸就凝结成像冰一样的晶体,所以无水乙酸又称________。
强烈刺激性
冰醋酸
无
分子式 结构式 结构简式
C2H4O2 ________________ ________________________
官能团 空间填充模型
名称 结构
____________________ ____________________
2.乙酸的分子结构
CH3COOH
羧基
—COOH
3.乙酸的酸性
乙酸是一种常见的有机酸,其酸性弱于硫酸、盐酸等酸的酸性。乙酸具有酸的通性:
(1)能使紫色石蕊试液变_____。
(2)能与活泼金属反应产生_____。
(3)能与NaOH等碱发生_______反应。
二、乙酸的酯化反应
1.酯化反应:酸与醇反应生成________的反应。酯化反应是______的。
红
H2
中和
酯和水
可逆
实验装置
实验现象 a.饱和Na2CO3溶液的液面上有____________________生成
b.闻到_____味
化学方程式 _________________________________________________________________________________________________________________
2.乙酸与乙醇的酯化反应
无色透明的油状液体
香
1.判断正误,正确的打“√”,错误的打“×”。
(1)乙酸俗名为醋酸,食醋为纯净物。( )
(2)可用紫色石蕊溶液鉴别乙醇和乙酸。( )
(3)乙酸的酸性比碳酸强,能和很多碳酸盐反应生成CO2气体。( )
(4)乙酸和乙醇发生酯化反应时,乙酸表现出酸的通性。( )
(5)制乙酸乙酯时,为提高乙酸的转化率,可加入稍过量的乙醇。( )
(6)乙酸和乙醇发生的酯化反应也属于取代反应。( )
×
√
√
×
√
√
2.下列关于乙酸的认识正确的是( )
A.乙酸的分子式是C2H4O,是四元羧酸
B.标准状况下,乙酸为冰状固体
C.普通食醋中乙酸的含量为12%左右
D.乙酸有羧基和甲基两种官能团
解析 —COOH和—OH均可与Na发生置换反应,可实现转化,A正确;醇羟基与NaOH、Na2CO3、NaHCO3均不反应。
4.下列物质不能发生酯化反应的是( )
A.HOCH2—CH==CH—COOH B.CH3CH2COOH
C.乙烷 D.CH3OH
课堂互动探究
探究一 认识乙酸的酸性
2.羟基氢原子的活泼性比较
乙醇 水 碳酸 乙酸
酸碱性 — 中性 弱酸性 弱酸性
电离程度 — 微弱电离 部分电离 部分电离
与Na反应的反应现象 缓和―→剧烈
与NaOH溶液 不反应 不反应 反应 反应
与NaHCO3溶液 不反应 不反应 不反应 反应
羟基氢原子的活泼性 CH3CH2OH
1.下列物质都能与Na反应放出H2,其产生H2的速率由快到慢排列正确的是( )
①C2H5OH ②CH3COOH(溶液) ③H2O
A.①>②>③ B.②>①>③
C.③>①>② D.②>③>①
2.普通的食醋中一般含3%~5%(质量分数)的乙酸,无水乙酸常被称为冰醋酸。
回答下列问题:
(1)乙酸可用于除水垢,写出乙酸与碳酸钙反应的化学方程式:______________________________________________,该反应说明乙酸的酸性比碳酸的________(填“强”或“弱”)。
(2)乙酸能与活泼金属反应,写出乙酸与镁反应的离子方程式:___________________________________________。
(3)乙酸可燃烧,写出乙酸燃烧的化学方程式:________________________
____________。
2CH3COOH+CaCO3―→(CH3COO)2Ca+CO2↑+H2O
强
2CH3COOH+Mg―→Mg2++2CH3COO-+H2↑
—OH、—COOH反应的定量关系
1 mol —OH 1 mol —COOH
Na~H2 1~0.5 mol 1~0.5 mol
NaOH — 1 mol
Na2CO3~CO2 — 0.5~0.5 mol
NaHCO3~CO2 — 1~1 mol
探究二 乙酸的酯化反应
1.酯化反应的实质
即酸脱羟基、醇脱氢。
2.乙酸和乙醇酯化反应实验的注意事项
(1)试剂的加入顺序
先加入乙醇和乙酸,然后沿器壁慢慢加入浓H2SO4(或依次加入乙醇、浓硫酸、乙酸)。
(2)导管末端不能插入饱和Na2CO3溶液中,防止造成溶液倒吸。
(3)浓H2SO4的作用
①催化剂——加快反应速率。
②吸水剂——提高CH3COOH、CH3CH2OH的转化率。
(4)饱和Na2CO3溶液的作用
①溶解挥发出来的乙醇。
②与挥发出来的乙酸反应生成乙酸钠,除去乙酸。
③降低乙酸乙酯的溶解度,使溶液分层,便于分离得到酯。
(5)装置
①长导管的作用:导气兼冷凝。
②碎瓷片的作用:防止暴沸。
(6)产物分离
用分液法分离,上层油状液体为产物乙酸乙酯。
(7)实验中采取的加快反应速率的措施
①加热。
②使用无水乙醇和冰醋酸,增大反应物浓度。
③使用催化剂。
(1)发生酯化反应时,有机羧酸分子断C—O键,醇分子断O—H键。
(2)乙酸乙酯可以看作C2H5OH(或CH3COOH)中的—OC2H5(或CH3CO—)取代了CH3COOH(或C2H5OH)中的—OH(或—OH上的氢原子)而形成的化合物,因此酯化反应属于取代反应。
(3)可与醇发生酯化反应的酸既可以是有机羧酸(由烃基或氢原子和羧基相连构成的有机化合物称为羧酸,饱和一元羧酸的通式是CnH2nO2(n≥1),甲酸是最简单的羧酸),也可以是无机酸,如硝酸、硫酸等。
4.可用如图所示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是_____________________________________________________________________
____________________________________________________________________________________________。
先加入2 mL乙醇和2 mL冰醋酸混合物,然后一边摇动试管一边慢慢地加入2 mL浓硫酸(或先加入2 mL乙醇,然后一边摇动试管一边慢慢加入2 mL浓硫酸,最后加入2 mL乙酸)
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是_______________________________。
(3)实验中加热试管a的目的是:
①_______________________________________________________________;
②________________________________________________________________。
a中反应的化学方程式:____________________________________________。
在试管中加入几块沸石(或碎瓷片)
加快反应速率
及时将产物乙酸乙酯蒸出,提高乙酸乙酯产率
(4)球形干燥管c的作用是_________________,b烧杯中加有饱和Na2CO3溶液,其作用是______________________________________________________________。
(5)若反应前向b中加入几滴酚酞,溶液呈红色,反应结束后b中的现象是__________________________________________________。
冷凝和防止倒吸
吸收蒸出的少量乙酸,溶解蒸出的少量乙醇,降低乙酸乙酯的溶解度
出现分层现象,下层红色变浅,上层是无色的油状液体
制取乙酸乙酯的注意事项
(1)乙酸乙酯的吸收一定注意防止倒吸,且吸收液不能用NaOH代替Na2CO3,因为NaOH溶液碱性很强,会使乙酸乙酯水解。
(2)实验中小火加热保持微沸,不能大火加热,这样有利于产物的生成和蒸发且减少反应物的蒸发。
本课小结
课时作业
一、选择题(每小题只有1个选项符合题意)
1.乙酸是生活中常见的一种有机物,下列关于乙酸的说法中正确的是( )
A.乙酸的官能团为—OH
B.乙酸的酸性比碳酸弱
C.乙酸能够与金属钠反应产生氢气
D.乙酸能使紫色的石蕊试液变蓝
解析 乙酸分子的官能团为—COOH,A错误;乙酸的酸性比碳酸强,B错误;乙酸具有酸的通性,与钠反应产生氢气,C正确;乙酸能使紫色石蕊试液变红,D错误。
2.下列关于乙酸性质的叙述错误的是( )
A.常温下,乙酸是一种有强烈刺激性气味的无色液体
B.冰醋酸是无水乙酸,不是乙酸的水溶液
C.乙酸能跟碳酸钠溶液发生反应产生CO2
D.在发生酯化反应时,乙酸分子中羧基上的氢原子跟醇分子中的羟基结合生成水
解析 酯化反应中羧基“脱羟基”,醇中羟基“脱氢”。
3.下列有关酯化反应的说法正确的是( )
A.醇与酸的反应都是酯化反应
B.酯化反应和中和反应原理一样
C.酯化反应既属于取代反应,也属于可逆反应
D.酯化反应的机理是羧酸去掉氢原子而醇去掉羟基
解析 醇与酸作用生成酯和水的反应才是酯化反应,A错误;中和反应是指酸和碱反应生成盐和水,二者反应原理不同,B错误;酯化反应的机理是羧酸去掉—OH,醇去掉羟基上的H原子,D错误。
4.如图所示是某有机物分子的空间填充模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。则该物质不具有的性质是( )
A.与氢氧化钠反应 B.与稀硫酸反应
C.发生酯化反应 D.使紫色石蕊试液变红
解析 由题给空间填充模型可知,该物质为乙酸(CH3COOH),该物质显酸性,能使紫色石蕊试液变红,能与NaOH反应,能与醇发生酯化反应。
5.实验室用乙酸、乙醇、浓硫酸制取乙酸乙酯,加热后,在饱和Na2CO3溶液的液面上得到无色油状液体,当振荡混合物时,有气泡产生,主要原因可能是( )
A.有部分H2SO4被蒸馏出来
B.有部分未反应的乙醇被蒸馏出来
C.有部分未反应的乙酸被蒸馏出来
D.有部分乙酸乙酯与碳酸钠发生了反应
解析 在酯化反应的实验中,乙酸乙酯、乙醇、乙酸均可被蒸出反应器,H2SO4具有高沸点、难挥发的特性,不易被蒸出反应器,乙醇、乙酸乙酯在常温下不与Na2CO3溶液反应;CH3COOH的酸性强于碳酸,在振荡时可与Na2CO3反应生成CO2气体。
6.莽草酸可用于合成药物达菲,莽草酸的结构简式如图所示。下列关于莽草酸的说法正确的是( )
A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成反应和取代反应
D.在水溶液中羧基和羟基均能电离出H+
解析 由结构简式可知该物质的分子式为C7H10O5,A错误;该分子中含有羧基、羟基和碳碳双键3种官能团,B错误;分子中含有碳碳双键,可发生加成反应,含有羧基、羟基,可发生酯化反应,酯化反应属于取代反应,另外分子中碳环上的氢原子也可被卤素原子取代,C正确;在水溶液中羧基能电离出H+,羟基不能电离,D错误。
7.若乙酸分子中的O都是18O,乙醇分子中的O都是16O,二者在一定条件下反应,生成物中水的相对分子质量为( )
A.22 B.20
C.18 D.19
9.如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
A.向a试管中先加入乙醇,然后边摇动试管边慢慢加入
浓硫酸,再加冰醋酸
B.试管b中导气管下端管口不能浸入液面下的原因是防
止实验过程中发生倒吸现象
C.实验时,加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率
D.可将饱和碳酸钠溶液换成氢氧化钠溶液
解析 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇,同时降低乙酸乙酯的溶解度,而氢氧化钠能与乙酸乙酯反应,故不能用氢氧化钠溶液代替饱和碳酸钠溶液,D错误。
10.分子式为C5H10O2的酸共有(不考虑立体异构)( )
A.2种 B.3种
C.4种 D.5种
解析 C5H10O2可看作C4H9—COOH,即—COOH取代丁烷中的一个H,丁烷的一元取代物有4种,则分子式为C5H10O2的酸有4种。
C4H6O5
33.6
ABCD
(3)苹果酸可能发生的反应是________(填序号)。
A.与NaOH溶液反应
B.与石蕊试液作用
C.与酸性高锰酸钾溶液反应
D.与乙醇在一定条件下发生酯化反应
12.下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采用乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,浓硫酸的作用是____________、____________。
【装置设计】甲、乙、丙三位同学分别设计了如图所示三套实验装置:
催化剂
吸水剂
请从甲、乙两位同学设计的装置中选择一套作为实验室制取乙酸乙酯的装置,应选择的装置是________(填“Ⅰ”或“Ⅱ”)。丙同学将Ⅰ装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是__________。
【实验步骤】(1)按选择的装置组装仪器,在试管①中先加入3 mL乙醇和2 mL冰醋酸,并在摇动下缓缓加入2 mL浓硫酸,再加入2~3块碎瓷片;
(2)将试管固定在铁架上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时停止实验。
Ⅱ
防止倒吸
【问题讨论】a.步骤(1)中组装好实验装置,加入样品前还应____________________。
b.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有______________________________。
c.试管②中饱和Na2CO3溶液的作用是__________、____________、_______________________。
d.从试管②中分离出乙酸乙酯的实验操作是_______。
检查装置的气密性
无色、不溶于水、密度比水小等
溶解乙醇
中和乙酸
降低乙酸乙酯的溶解度
分液
