专题4 分子空间结构与物质性质 单元检测题 (含答案) 高二下学期化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题4 分子空间结构与物质性质 单元检测题 (含答案) 高二下学期化学苏教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-21 18:48:33 | ||
图片预览



文档简介
专题4《分子空间结构与物质性质》单元检测题
一、单选题(共13题)
1.下列说法正确的是
A.N元素的电负性比P元素的大,可推断NCl3分子的极性比PCl3的大
B.卤素单质、卤素氢化物、卤素碳化物(即CX4)的熔、沸点均随着相对分子质量的增大而升高
C.食品中添加适量的SO2可以起到漂白、防腐和抗氧化等作用
D.干冰晶体中CO2的配位数为8
2.实验室用检验的离子方程式为。下列有关说法错误的是
A.中铁离子的配位数为6
B.再失去1个电子比更难
C.形成配位键时,中碳原子提供孤电子对
D.1 mol含12 mol 键
3.下列有关物质性质的说法错误的是
A.酸性:HClO4>H2SO4 B.沸点:NH3>PH3
C.范德华力:HBr>HCl D.水中的溶解性:I2>NH3
4.生活中处处有化学,下列叙述错误的是
A.荷兰物理学家范德华首先研究出了分子间作用力,因此这种力也称为范德华力
B.“蛟龙”号潜水器用到钛合金,22号钛元素属于过渡元素
C.元代青花瓷“萧何月下追韩信”梅瓶属于硅酸盐制品
D.棉花、麻和蚕丝均为碳水化合物
5.一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。
下列说法不正确的是
A.的空间结构为正四面体形
B.流程中所涉及元素的基态原子未成对电子数最多的是P
C.过程I、II、III中发生的均为氧化还原反应
D.过程I中,氧化产物与还原产物的物质的量之比为6:5
6.下列有关性质的比较,不能用元素周期律解释的是
A.酸性:
B.碱性:
C.挥发性:
D.非金属性:F>Cl
7.法匹拉韦是治疗新冠肺炎的种药物,其结构简式如图所示。下列说法错误的是
A.该分子中N、O、F的第一电离能由大到小的顺序为F>N>O
B.该有机物的分子式是C5H4O2N3F
C.该分子中所有N原子都为sp3杂化
D.该分子中σ键与Π键数目之比为15:4
8.配合物是一种具有较好疗效的抗癌药物,其中心离子为。已知X、Y、Z是分处于不同短周期的元素,原子半径依次增大,X、Z的原子核外都有一个未成对电子,Y的第一电离能比同周期相邻元素的大,A分子是由X、Y元素组成的四原子分子。下列有关叙述正确的是
A.配合物中的配位数为2
B.Y和Z的氧化物对应的水化物都是强酸
C.A分子的VSEPR模型是四面体形,A分子中的键角为
D.由X、Y、Z三种元素组成的化合物可以是离子化合物,也可以是共价化合物
9.在中,中间的碳原子和两边的碳原子分别采用的杂化方式是
A.、 B.、 C.、 D.、
10.用VSEPR模型预测下列分子或离子的立体结构,其中正确的是
A.CH4与CH2Cl2均为正四面体 B.BeCl2与SO2为直线形
C.BF3与PCl3为三角锥形 D.NO与CO为平面三角形
11.有机化合物X的结构简式如图所示,下列说法正确的是
A.X的分子式为,1个分子中采取杂化的原子数为4
B.化合物X最多能与2mol NaOH反应
C.在酸性条件下水解,水解产物含有2个手性碳原子
D.分子中所有碳原子可能共平面
12.NA为阿伏加德罗常数的值,下列说法不正确的是
A.12gNaHSO4中含有0.2NA个阳离子
B.34g呋喃( )中含有的极性键数目为3NA
C.8gCH4含有中子数为3NA
D.1mol[Cu(NH3)4]2+中共价键的个数为16NA
13.下列有关说法不正确的是
A.、、分子中的键角依次增大
B.、、分子中的键长依次增大
C.、、分子中的键能依次减小
D.、、分子的稳定性依次减弱
二、非选择题(共10题)
14.回答下列问题
(1)已知Ge、Cl两元素电负性分别为1.8和3.0,试判断的最高价氯化物中的化学键为___________(填“共价键”或“离子键”)。
(2)N≡N的键能为946kJ/mol,N-N单键的键能为193kJ/mol,计算说明N2中的σ键比π键___________(填“稳定”或“不稳定”)。
(3)氮容易形成三键,但与氮同主族的砷却难以形成三键的原因是___________。
(4)由和构成,的空间结构是___________;根据化合价判断,中心原子B的电负性___________H原子(填“>”、“<”或“=”),结合等电子体的知识判断离子的空间构型为___________。
(5)成键原子中的孤电子对对键能有影响,第2周期元素A与氢形成的化合物中键的键能(单位:)如下: 346; 247; 207,试分析上述化合物中键的键能依次下降的原因___________。
15.甲、乙、丙三种有机物的结构如下:
甲: 乙:COCl2() 丙:
(1)甲分子中有___________个键,___________个键,___________(填“有”或“没有”)非极性键。
(2)乙分子中碳原子形成___________个键,___________个键。
(3)丙分子中键与键的数目之比为___________。
三、实验题
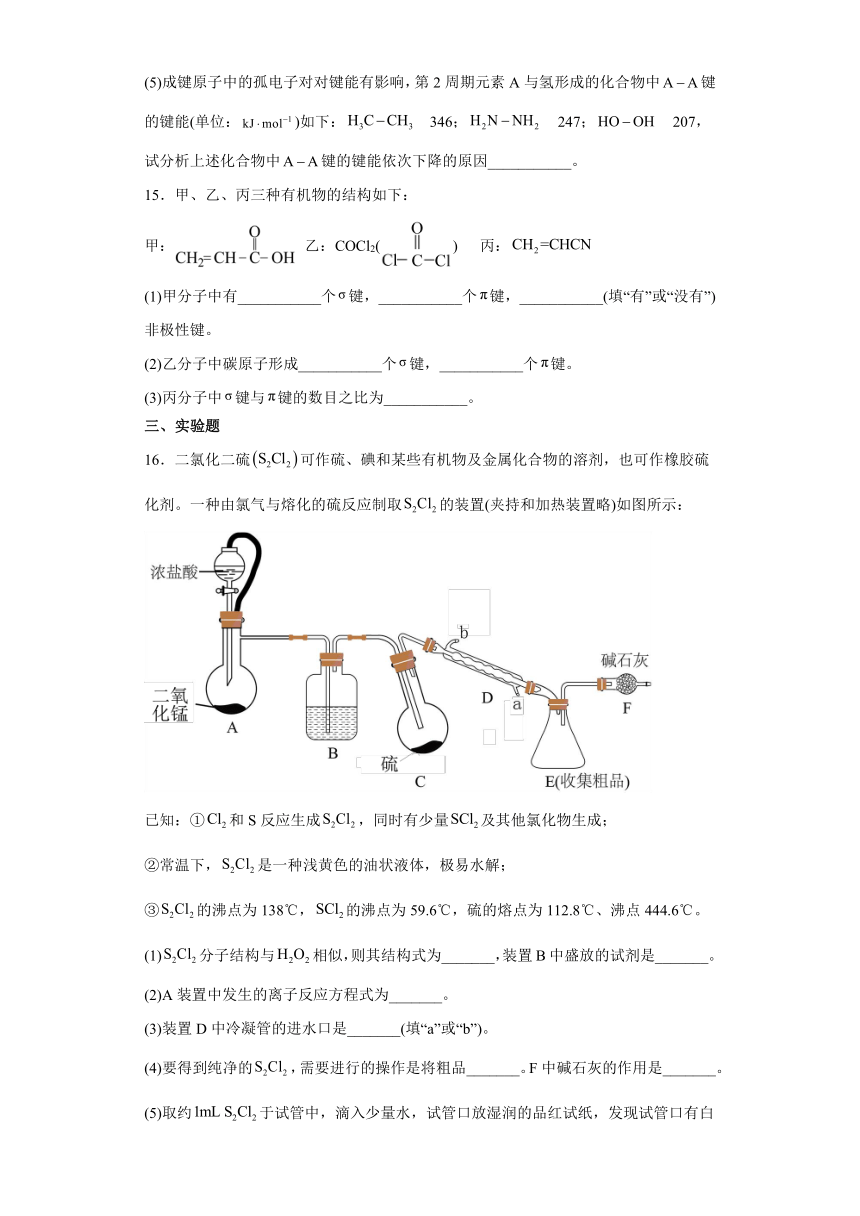
16.二氯化二硫可作硫、碘和某些有机物及金属化合物的溶剂,也可作橡胶硫化剂。一种由氯气与熔化的硫反应制取的装置(夹持和加热装置略)如图所示:
已知:①和S反应生成,同时有少量及其他氯化物生成;
②常温下,是一种浅黄色的油状液体,极易水解;
③的沸点为138℃,的沸点为59.6℃,硫的熔点为112.8℃、沸点444.6℃。
(1)分子结构与相似,则其结构式为_______,装置B中盛放的试剂是_______。
(2)A装置中发生的离子反应方程式为_______。
(3)装置D中冷凝管的进水口是_______(填“a”或“b”)。
(4)要得到纯净的,需要进行的操作是将粗品_______。F中碱石灰的作用是_______。
(5)取约于试管中,滴入少量水,试管口放湿润的品红试纸,发现试管口有白雾,品红试纸褪色,试管中有淡黄色固体生成,该反应的化学方程式为_______。
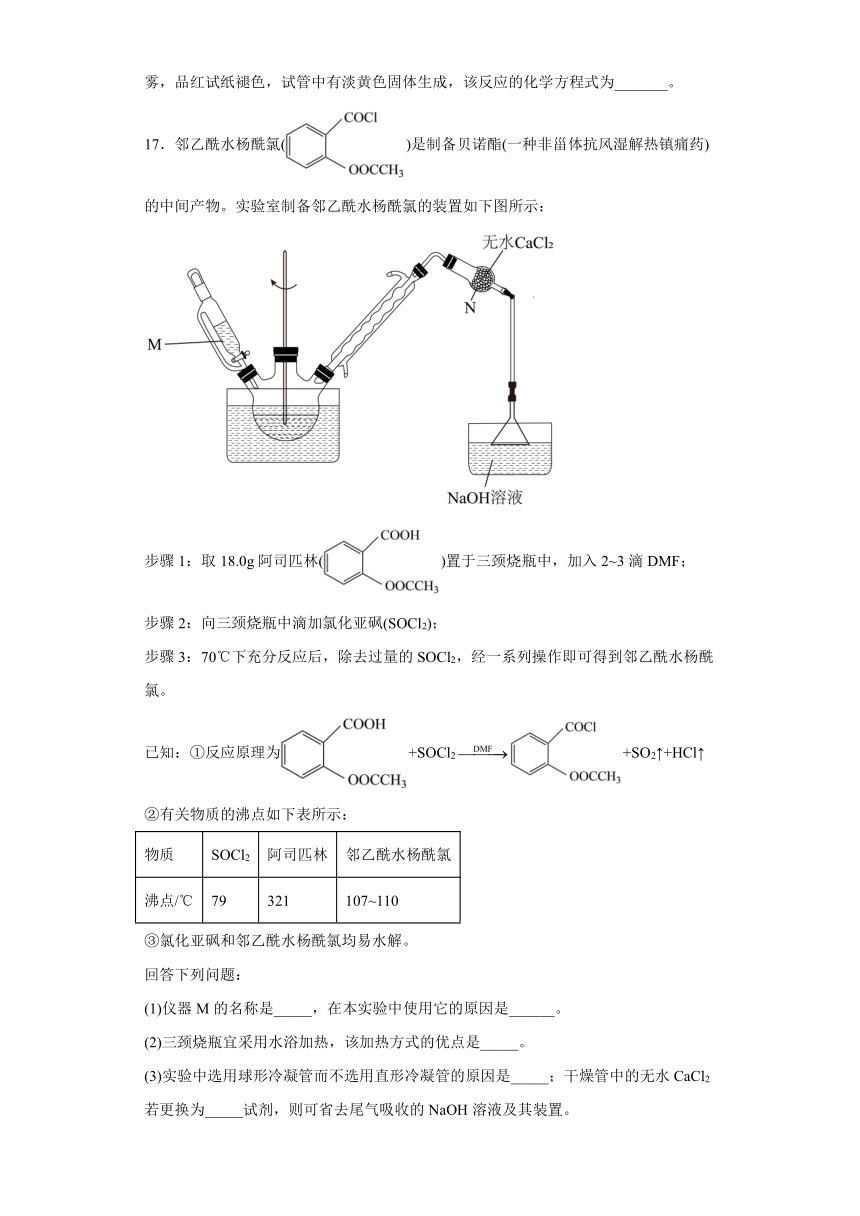
17.邻乙酰水杨酰氯()是制备贝诺酯(一种非甾体抗风湿解热镇痛药)的中间产物。实验室制备邻乙酰水杨酰氯的装置如下图所示:
步骤1:取18.0g阿司匹林()置于三颈烧瓶中,加入2~3滴DMF;
步骤2:向三颈烧瓶中滴加氯化亚砜(SOCl2);
步骤3:70℃下充分反应后,除去过量的SOCl2,经一系列操作即可得到邻乙酰水杨酰氯。
已知:①反应原理为+SOCl2+SO2↑+HCl↑
②有关物质的沸点如下表所示:
物质 SOCl2 阿司匹林 邻乙酰水杨酰氯
沸点/℃ 79 321 107~110
③氯化亚砜和邻乙酰水杨酰氯均易水解。
回答下列问题:
(1)仪器M的名称是_____,在本实验中使用它的原因是______。
(2)三颈烧瓶宜采用水浴加热,该加热方式的优点是_____。
(3)实验中选用球形冷凝管而不选用直形冷凝管的原因是_____;干燥管中的无水CaCl2若更换为_____试剂,则可省去尾气吸收的NaOH溶液及其装置。
(4)反应物SOCl2的空间结构名称是______。
(5)阿司匹林的沸点高于邻乙酰水杨酰氯的原因可能是______。
(6)反应温度适宜选取70℃的原因是___;除去过量SOCl2宜采用____方法。
四、计算题
18.铁、钴、镍的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
钴的一种化合物晶胞结构如下图所示。
①已知a点的原子坐标参数为(0,0,0),b点为(,,0),c点为(1,,),则d点的原子坐标参数为___________。
②已知该晶体的密度为ρ g·cm-3,则晶胞参数a=___________nm(用含ρ、NA的代数式表示)。
19.(1)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.4665nm,阿伏加德罗常数的值为NA,则Li2O的密度为_______g·cm-3(列出计算式)。
(2)FeS2晶体的晶胞如图所示。晶胞边长为a nm,FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_______g·cm-3;晶胞中Fe2+位于S所形成的正八面体的体心,该正八面体的边长为_______nm。
20.钒是人体不可缺少的元素,Heyliger 等首次报道了偏钒酸钠显著降低糖尿病大鼠血糖的作用后,钒化学的研究得到了很大发展。钒及其化合物也广泛应用于特种钢、催化剂、颜料、染料、电子材料及防腐剂等等领域。
(1)钒酸盐与磷酸盐结构相似。请画出VO、H2VO、VO2(H2O) 和V2O的空间构型__________。
(2)生理条件下的钒以多种氧化态存在,各种氧化态可以相互转化。通常细胞外的钒是V(V), 。而细胞内的钒是V(IV)。研究表明,钒酸二氢根离子可与亚铁血红素(Mtrc-Fe2+)反应,写出该反应的离子方程式__________。
(3)①已知配合物[VON(CH2COO)3]在水溶液中的几何构型是唯一 的,画出它的空间构型图__________。
②理论推测上述配合物分子在晶体中是有手性的,指出产生手性的原因__________。
(4)钒酸钇晶体是近年来新开发出的优良双折射光学晶体,在光电产业中得到广泛应用。可以在弱碱性溶液中用偏钒酸铵和硝酸钇合成。写出以Y2O3与V2O5为主要原料合成钒酸钇的化学方程式__________。
(5)若以市售分析纯偏钒酸铵为原料制备高纯钒酸钇单晶,需将杂质铁离子含量降至一定数量级。设每升偏钒酸铵溶液中含三价铁离子为5.0 ×10-5 mol,用0.01 mol dm-3的鏊合剂除铁。
①说明不采取使铁离子水解析出沉淀的方法除铁的理由__________。
②通过计算说明如何选择螯合剂使偏钒酸铵含铁量降至10-30moldm-3以下__________。
配离子
[Fe(edta)]2-[Fe(edta)]- [Fe(phen)3]2+ [Fe(phen)3]3+ 2.1×10141.7×1024 2.0×1021 1.3×1014
沉淀 Ksp
Fe(OH)2Fe(OH)3 8.0×10-164.0×10-38
21.已知X、Y、Z、W四种元素是元素周期表中短周期元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)Z元素位于元素周期表中的_______区,其核外电子所占据的原子轨道的形状有_______种、空间伸展方向有_______种。
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的空间构型为_______;含有离子键和共价键的化合物的电子式为_______。
(3)由X、Y、Z所形成的常见离子化合物是_______(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为_______。X与W形成的化合物与水反应时,水是_______(填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成化合物的过程:_______。
(5)Q与Z同主族,位于第4周期,其原子的价电子轨道表示式为_______。
22.A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P能级中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,AB2属于_______分子(填“极性”或“非极性”)。
(2)当n=3时,A与B形成的晶体属于_______晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是_______(用元素符号表示)。
(4)已知某红紫色络合物的组成为CoCl3·5NH3·H2O。该络合物中作为配位体之一的NH3分子的空间构型为_______。H2O分子中心原子的杂化方式为_______。
(5)金属铜晶体的堆积方式为_______。
23.A、B、C、D、E、F均为中学里常见的物质,一定条件下存在如图所示转化。已知:A是不含结晶水的酸或盐,气件D在标准状况下的密度为2.857,溶液E的焰色星黄色。
(1)第一步反应中用到的硅酸盐仪器中除酒精灯还有______。
(2)足量A溶液和澄清石灰水反应的离子方程式为______。
(3)D和足量次氯酸钠溶液反应的离子方程式为______。
(4)C的分子构型为______,A到F中属于电解质的是______(填字母)。
(5)B的化学式为______。
参考答案:
1.C 2.B 3.D 4.D 5.C 6.C 7.C 8.D 9.C 10.D 11.A 12.A 13.A
14.(1)共价键
(2)不稳定
(3)砷原子半径较大,原子间形成的σ键的键长较长,p-p轨道肩并肩重叠程度小或几乎不能重叠,难以形成π键,也就难以形成三键
(4) 正四面体形 < 直线型
(5)孤电子对的存在对成键电子的排斥作用增强,导致原子轨道重叠程度减小,成键能力下降
15.(1) 8 2 有
(2) 3 1
(3)2∶1
16.(1) 浓硫酸
(2)
(3)a
(4) 蒸馏,收集138℃的馏分 吸收剩余的,防止污染;防止空气中的水蒸气进入E中使水解
(5)
17.(1) 恒压滴液漏斗 平衡气压,使液体能够顺利流下;防止氯化亚砜接触到空气中的水蒸气发生水解
(2)受热均匀,便于控制温度
(3) 球形冷凝管与冷却水的接触面积大,冷却效率高,利于冷凝回流 碱石灰(或CaO或固体NaOH)
(4)三角锥形
(5)阿司匹林分子间存在氢键
(6) 温度较低,反应速率较慢;温度较高,SOCl2易挥发 蒸馏
18. (,1,)
19.
20. VO 、H2VO 、VO2(H2O) 和V2O Mtrc-Fe2+ + H2VO4 +4H+ = Mtrc-Fe3+ + VO2++ 3H2O 分子的手性来源于鳌环的扭曲导致镜面对称性破缺 Y2O3 + 6HNO3 = 2Y (NO3)3+ 3H2O、V2O5+ 2NH3·H2O = 2NH4VO3 + H2O、Y (NO3)3+ NH4VO3 + 2NH3·H2O = YVO4↓ + 3NH4NO3+H2O (1)如果在弱酸性条件下,采取沉淀法除铁,则有以下问题:
A.Fe3+在弱酸性条件水解难以将铁离子降低到所要求的程度。
B. Fe (OH)3具有胶体的性质,过滤困难。
(2)如果在弱碱性条件下水解,Fe (OH)3会与原料共沉淀而损失原料。
所以不能用沉淀法除去微量铁。@采用加入鳌合剂在氨水中二次重结晶的方法除去微量的铁离子。第一次重结晶时加入乙二胺四乙酸二钠盐,可以除去绝大多数Fe3+,第二次重结晶时加入邻二氨菲,进一步降低Fe3+的含量。 采用加入鳌合剂在氨水中二次重结晶的方法除去微量的铁离子。第一次重结晶时加入乙二胺四乙酸二钠盐,可以除去绝大多数Fe3+,第二次重结晶时加入邻二氨菲,进一步降低Fe3+的含量。
(1)第一步
设残余Fe3+浓度为x mol dm-3Fe3+ +edta4- = [Fe(edta)]- =1.7 ×1024 x=2.9 ×10-27
(2)第二步
设残余Fe3+浓度为y mol dm-3Fe3+ + 3 phen = Fe(phen)33+ = 1.3 ×1014 y= 2.2 ×10-35
或者
(1)第一步
设残余Fe3+浓度为x mol dm-3Fe3+ + 3 phen = Fe(phen) = 1.3 ×1014 3.8 ×10-13
(2)第二步
设残余Fe3+浓度为y mol dm-3Fe3+ +edta4- = [Fe(edta)]- =1.7 ×1024 y= 2.2 ×10-35
21.(1) p 2 4
(2) 三角锥形
(3) NH4NO3 NH+OH-NH3↑+H2O 氧化剂
(4)
(5)
22. 非极性 原子 P>S>Si 三角锥形(或四面体形) sp3 面心立方最密堆积
23.(1)玻璃棒、泥三角和坩埚
(2)Ca2++2OH-+2HSO=CaSO3↓+2H2O+SO
(3)SO2+3ClO-+H2O=SO+Cl-+2HClO
(4) V形 A、B、C、F
(5)Na2S2O5
一、单选题(共13题)
1.下列说法正确的是
A.N元素的电负性比P元素的大,可推断NCl3分子的极性比PCl3的大
B.卤素单质、卤素氢化物、卤素碳化物(即CX4)的熔、沸点均随着相对分子质量的增大而升高
C.食品中添加适量的SO2可以起到漂白、防腐和抗氧化等作用
D.干冰晶体中CO2的配位数为8
2.实验室用检验的离子方程式为。下列有关说法错误的是
A.中铁离子的配位数为6
B.再失去1个电子比更难
C.形成配位键时,中碳原子提供孤电子对
D.1 mol含12 mol 键
3.下列有关物质性质的说法错误的是
A.酸性:HClO4>H2SO4 B.沸点:NH3>PH3
C.范德华力:HBr>HCl D.水中的溶解性:I2>NH3
4.生活中处处有化学,下列叙述错误的是
A.荷兰物理学家范德华首先研究出了分子间作用力,因此这种力也称为范德华力
B.“蛟龙”号潜水器用到钛合金,22号钛元素属于过渡元素
C.元代青花瓷“萧何月下追韩信”梅瓶属于硅酸盐制品
D.棉花、麻和蚕丝均为碳水化合物
5.一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。
下列说法不正确的是
A.的空间结构为正四面体形
B.流程中所涉及元素的基态原子未成对电子数最多的是P
C.过程I、II、III中发生的均为氧化还原反应
D.过程I中,氧化产物与还原产物的物质的量之比为6:5
6.下列有关性质的比较,不能用元素周期律解释的是
A.酸性:
B.碱性:
C.挥发性:
D.非金属性:F>Cl
7.法匹拉韦是治疗新冠肺炎的种药物,其结构简式如图所示。下列说法错误的是
A.该分子中N、O、F的第一电离能由大到小的顺序为F>N>O
B.该有机物的分子式是C5H4O2N3F
C.该分子中所有N原子都为sp3杂化
D.该分子中σ键与Π键数目之比为15:4
8.配合物是一种具有较好疗效的抗癌药物,其中心离子为。已知X、Y、Z是分处于不同短周期的元素,原子半径依次增大,X、Z的原子核外都有一个未成对电子,Y的第一电离能比同周期相邻元素的大,A分子是由X、Y元素组成的四原子分子。下列有关叙述正确的是
A.配合物中的配位数为2
B.Y和Z的氧化物对应的水化物都是强酸
C.A分子的VSEPR模型是四面体形,A分子中的键角为
D.由X、Y、Z三种元素组成的化合物可以是离子化合物,也可以是共价化合物
9.在中,中间的碳原子和两边的碳原子分别采用的杂化方式是
A.、 B.、 C.、 D.、
10.用VSEPR模型预测下列分子或离子的立体结构,其中正确的是
A.CH4与CH2Cl2均为正四面体 B.BeCl2与SO2为直线形
C.BF3与PCl3为三角锥形 D.NO与CO为平面三角形
11.有机化合物X的结构简式如图所示,下列说法正确的是
A.X的分子式为,1个分子中采取杂化的原子数为4
B.化合物X最多能与2mol NaOH反应
C.在酸性条件下水解,水解产物含有2个手性碳原子
D.分子中所有碳原子可能共平面
12.NA为阿伏加德罗常数的值,下列说法不正确的是
A.12gNaHSO4中含有0.2NA个阳离子
B.34g呋喃( )中含有的极性键数目为3NA
C.8gCH4含有中子数为3NA
D.1mol[Cu(NH3)4]2+中共价键的个数为16NA
13.下列有关说法不正确的是
A.、、分子中的键角依次增大
B.、、分子中的键长依次增大
C.、、分子中的键能依次减小
D.、、分子的稳定性依次减弱
二、非选择题(共10题)
14.回答下列问题
(1)已知Ge、Cl两元素电负性分别为1.8和3.0,试判断的最高价氯化物中的化学键为___________(填“共价键”或“离子键”)。
(2)N≡N的键能为946kJ/mol,N-N单键的键能为193kJ/mol,计算说明N2中的σ键比π键___________(填“稳定”或“不稳定”)。
(3)氮容易形成三键,但与氮同主族的砷却难以形成三键的原因是___________。
(4)由和构成,的空间结构是___________;根据化合价判断,中心原子B的电负性___________H原子(填“>”、“<”或“=”),结合等电子体的知识判断离子的空间构型为___________。
(5)成键原子中的孤电子对对键能有影响,第2周期元素A与氢形成的化合物中键的键能(单位:)如下: 346; 247; 207,试分析上述化合物中键的键能依次下降的原因___________。
15.甲、乙、丙三种有机物的结构如下:
甲: 乙:COCl2() 丙:
(1)甲分子中有___________个键,___________个键,___________(填“有”或“没有”)非极性键。
(2)乙分子中碳原子形成___________个键,___________个键。
(3)丙分子中键与键的数目之比为___________。
三、实验题
16.二氯化二硫可作硫、碘和某些有机物及金属化合物的溶剂,也可作橡胶硫化剂。一种由氯气与熔化的硫反应制取的装置(夹持和加热装置略)如图所示:
已知:①和S反应生成,同时有少量及其他氯化物生成;
②常温下,是一种浅黄色的油状液体,极易水解;
③的沸点为138℃,的沸点为59.6℃,硫的熔点为112.8℃、沸点444.6℃。
(1)分子结构与相似,则其结构式为_______,装置B中盛放的试剂是_______。
(2)A装置中发生的离子反应方程式为_______。
(3)装置D中冷凝管的进水口是_______(填“a”或“b”)。
(4)要得到纯净的,需要进行的操作是将粗品_______。F中碱石灰的作用是_______。
(5)取约于试管中,滴入少量水,试管口放湿润的品红试纸,发现试管口有白雾,品红试纸褪色,试管中有淡黄色固体生成,该反应的化学方程式为_______。
17.邻乙酰水杨酰氯()是制备贝诺酯(一种非甾体抗风湿解热镇痛药)的中间产物。实验室制备邻乙酰水杨酰氯的装置如下图所示:
步骤1:取18.0g阿司匹林()置于三颈烧瓶中,加入2~3滴DMF;
步骤2:向三颈烧瓶中滴加氯化亚砜(SOCl2);
步骤3:70℃下充分反应后,除去过量的SOCl2,经一系列操作即可得到邻乙酰水杨酰氯。
已知:①反应原理为+SOCl2+SO2↑+HCl↑
②有关物质的沸点如下表所示:
物质 SOCl2 阿司匹林 邻乙酰水杨酰氯
沸点/℃ 79 321 107~110
③氯化亚砜和邻乙酰水杨酰氯均易水解。
回答下列问题:
(1)仪器M的名称是_____,在本实验中使用它的原因是______。
(2)三颈烧瓶宜采用水浴加热,该加热方式的优点是_____。
(3)实验中选用球形冷凝管而不选用直形冷凝管的原因是_____;干燥管中的无水CaCl2若更换为_____试剂,则可省去尾气吸收的NaOH溶液及其装置。
(4)反应物SOCl2的空间结构名称是______。
(5)阿司匹林的沸点高于邻乙酰水杨酰氯的原因可能是______。
(6)反应温度适宜选取70℃的原因是___;除去过量SOCl2宜采用____方法。
四、计算题
18.铁、钴、镍的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
钴的一种化合物晶胞结构如下图所示。
①已知a点的原子坐标参数为(0,0,0),b点为(,,0),c点为(1,,),则d点的原子坐标参数为___________。
②已知该晶体的密度为ρ g·cm-3,则晶胞参数a=___________nm(用含ρ、NA的代数式表示)。
19.(1)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.4665nm,阿伏加德罗常数的值为NA,则Li2O的密度为_______g·cm-3(列出计算式)。
(2)FeS2晶体的晶胞如图所示。晶胞边长为a nm,FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_______g·cm-3;晶胞中Fe2+位于S所形成的正八面体的体心,该正八面体的边长为_______nm。
20.钒是人体不可缺少的元素,Heyliger 等首次报道了偏钒酸钠显著降低糖尿病大鼠血糖的作用后,钒化学的研究得到了很大发展。钒及其化合物也广泛应用于特种钢、催化剂、颜料、染料、电子材料及防腐剂等等领域。
(1)钒酸盐与磷酸盐结构相似。请画出VO、H2VO、VO2(H2O) 和V2O的空间构型__________。
(2)生理条件下的钒以多种氧化态存在,各种氧化态可以相互转化。通常细胞外的钒是V(V), 。而细胞内的钒是V(IV)。研究表明,钒酸二氢根离子可与亚铁血红素(Mtrc-Fe2+)反应,写出该反应的离子方程式__________。
(3)①已知配合物[VON(CH2COO)3]在水溶液中的几何构型是唯一 的,画出它的空间构型图__________。
②理论推测上述配合物分子在晶体中是有手性的,指出产生手性的原因__________。
(4)钒酸钇晶体是近年来新开发出的优良双折射光学晶体,在光电产业中得到广泛应用。可以在弱碱性溶液中用偏钒酸铵和硝酸钇合成。写出以Y2O3与V2O5为主要原料合成钒酸钇的化学方程式__________。
(5)若以市售分析纯偏钒酸铵为原料制备高纯钒酸钇单晶,需将杂质铁离子含量降至一定数量级。设每升偏钒酸铵溶液中含三价铁离子为5.0 ×10-5 mol,用0.01 mol dm-3的鏊合剂除铁。
①说明不采取使铁离子水解析出沉淀的方法除铁的理由__________。
②通过计算说明如何选择螯合剂使偏钒酸铵含铁量降至10-30moldm-3以下__________。
配离子
[Fe(edta)]2-[Fe(edta)]- [Fe(phen)3]2+ [Fe(phen)3]3+ 2.1×10141.7×1024 2.0×1021 1.3×1014
沉淀 Ksp
Fe(OH)2Fe(OH)3 8.0×10-164.0×10-38
21.已知X、Y、Z、W四种元素是元素周期表中短周期元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)Z元素位于元素周期表中的_______区,其核外电子所占据的原子轨道的形状有_______种、空间伸展方向有_______种。
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的空间构型为_______;含有离子键和共价键的化合物的电子式为_______。
(3)由X、Y、Z所形成的常见离子化合物是_______(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为_______。X与W形成的化合物与水反应时,水是_______(填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成化合物的过程:_______。
(5)Q与Z同主族,位于第4周期,其原子的价电子轨道表示式为_______。
22.A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P能级中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,AB2属于_______分子(填“极性”或“非极性”)。
(2)当n=3时,A与B形成的晶体属于_______晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是_______(用元素符号表示)。
(4)已知某红紫色络合物的组成为CoCl3·5NH3·H2O。该络合物中作为配位体之一的NH3分子的空间构型为_______。H2O分子中心原子的杂化方式为_______。
(5)金属铜晶体的堆积方式为_______。
23.A、B、C、D、E、F均为中学里常见的物质,一定条件下存在如图所示转化。已知:A是不含结晶水的酸或盐,气件D在标准状况下的密度为2.857,溶液E的焰色星黄色。
(1)第一步反应中用到的硅酸盐仪器中除酒精灯还有______。
(2)足量A溶液和澄清石灰水反应的离子方程式为______。
(3)D和足量次氯酸钠溶液反应的离子方程式为______。
(4)C的分子构型为______,A到F中属于电解质的是______(填字母)。
(5)B的化学式为______。
参考答案:
1.C 2.B 3.D 4.D 5.C 6.C 7.C 8.D 9.C 10.D 11.A 12.A 13.A
14.(1)共价键
(2)不稳定
(3)砷原子半径较大,原子间形成的σ键的键长较长,p-p轨道肩并肩重叠程度小或几乎不能重叠,难以形成π键,也就难以形成三键
(4) 正四面体形 < 直线型
(5)孤电子对的存在对成键电子的排斥作用增强,导致原子轨道重叠程度减小,成键能力下降
15.(1) 8 2 有
(2) 3 1
(3)2∶1
16.(1) 浓硫酸
(2)
(3)a
(4) 蒸馏,收集138℃的馏分 吸收剩余的,防止污染;防止空气中的水蒸气进入E中使水解
(5)
17.(1) 恒压滴液漏斗 平衡气压,使液体能够顺利流下;防止氯化亚砜接触到空气中的水蒸气发生水解
(2)受热均匀,便于控制温度
(3) 球形冷凝管与冷却水的接触面积大,冷却效率高,利于冷凝回流 碱石灰(或CaO或固体NaOH)
(4)三角锥形
(5)阿司匹林分子间存在氢键
(6) 温度较低,反应速率较慢;温度较高,SOCl2易挥发 蒸馏
18. (,1,)
19.
20. VO 、H2VO 、VO2(H2O) 和V2O Mtrc-Fe2+ + H2VO4 +4H+ = Mtrc-Fe3+ + VO2++ 3H2O 分子的手性来源于鳌环的扭曲导致镜面对称性破缺 Y2O3 + 6HNO3 = 2Y (NO3)3+ 3H2O、V2O5+ 2NH3·H2O = 2NH4VO3 + H2O、Y (NO3)3+ NH4VO3 + 2NH3·H2O = YVO4↓ + 3NH4NO3+H2O (1)如果在弱酸性条件下,采取沉淀法除铁,则有以下问题:
A.Fe3+在弱酸性条件水解难以将铁离子降低到所要求的程度。
B. Fe (OH)3具有胶体的性质,过滤困难。
(2)如果在弱碱性条件下水解,Fe (OH)3会与原料共沉淀而损失原料。
所以不能用沉淀法除去微量铁。@采用加入鳌合剂在氨水中二次重结晶的方法除去微量的铁离子。第一次重结晶时加入乙二胺四乙酸二钠盐,可以除去绝大多数Fe3+,第二次重结晶时加入邻二氨菲,进一步降低Fe3+的含量。 采用加入鳌合剂在氨水中二次重结晶的方法除去微量的铁离子。第一次重结晶时加入乙二胺四乙酸二钠盐,可以除去绝大多数Fe3+,第二次重结晶时加入邻二氨菲,进一步降低Fe3+的含量。
(1)第一步
设残余Fe3+浓度为x mol dm-3Fe3+ +edta4- = [Fe(edta)]- =1.7 ×1024 x=2.9 ×10-27
(2)第二步
设残余Fe3+浓度为y mol dm-3Fe3+ + 3 phen = Fe(phen)33+ = 1.3 ×1014 y= 2.2 ×10-35
或者
(1)第一步
设残余Fe3+浓度为x mol dm-3Fe3+ + 3 phen = Fe(phen) = 1.3 ×1014 3.8 ×10-13
(2)第二步
设残余Fe3+浓度为y mol dm-3Fe3+ +edta4- = [Fe(edta)]- =1.7 ×1024 y= 2.2 ×10-35
21.(1) p 2 4
(2) 三角锥形
(3) NH4NO3 NH+OH-NH3↑+H2O 氧化剂
(4)
(5)
22. 非极性 原子 P>S>Si 三角锥形(或四面体形) sp3 面心立方最密堆积
23.(1)玻璃棒、泥三角和坩埚
(2)Ca2++2OH-+2HSO=CaSO3↓+2H2O+SO
(3)SO2+3ClO-+H2O=SO+Cl-+2HClO
(4) V形 A、B、C、F
(5)Na2S2O5
