7.1 氮的固定 课件 (共51张PPT)
文档属性
| 名称 | 7.1 氮的固定 课件 (共51张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-21 20:18:34 | ||
图片预览











文档简介
(共51张PPT)
0
专题7 氮与社会
可持续发展
第一单元 氮的固定
1.能依据氮分子的微观结构预测其性质。2.认识人工固氮的化学原理和社会价值。3.能从物质类别和氮元素的化合价角度认识氮氧化物的性质与转化,促进“证据推理与模型认知”核心素养的发展。
学习理解
01
课时分层练
04
目录
CONTENTS
探究应用
02
总结提升
03
学习理解
一、氮分子的结构
1.氮元素的存在
在自然界中,绝大部分氮元素以________________存在于空气中。
2.氮气分子的结构
电子式:_____________;结构式:________。
3.氮气的性质
(1)物理性质
无色无味难溶于水的气体,密度比空气略小。
游离态的氮气
∶N N∶
N≡N
共价键
2NO
Mg3N2
二、氮的固定
1.概念
将空气中_____________转化成____________叫作氮的固定,简称固氮。
游离态的氮
含氮化合物
生物化学
含氮化合物
含氮化合物
3NO2+H2O===2HNO3+NO
三、氮在自然界中的循环
1.自然循环
氮氧化物
判断正误,正确的打“√”,错误的打“×”。
(1)N2在放电条件下与O2反应生成NO2。( )
(2)合成氨反应属于自然固氮。( )
(3)N2与O2反应时,N2作还原剂。( )
(4)6.72 L NO2与水充分反应转移的电子数目为0.2NA。( )
(5)制二氧化氮时,用水吸收尾气。( )
×
×
√
×
×
√
探究应用
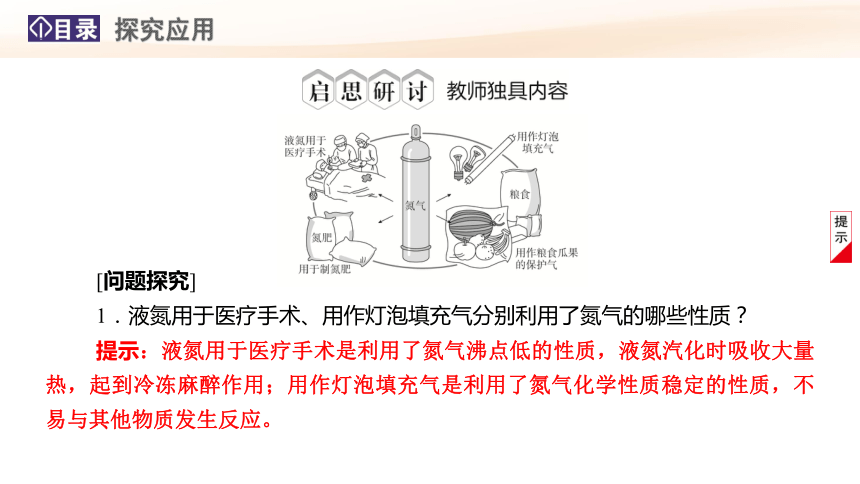
[问题探究]
1.液氮用于医疗手术、用作灯泡填充气分别利用了氮气的哪些性质?
提示:液氮用于医疗手术是利用了氮气沸点低的性质,液氮汽化时吸收大量热,起到冷冻麻醉作用;用作灯泡填充气是利用了氮气化学性质稳定的性质,不易与其他物质发生反应。
2.利用氮气制氮肥的关键是氮的固定,将氮气转化为氮氧化物或者氨气,实现氮元素化合价的升高或降低,上述变化过程中,分别体现了氮气什么性质?
提示:氮气转化为氮氧化物体现氮气的还原性,氮气合成氨体现氮气的氧化性。
知识点一 氮氧化物的产生与转化
1.生产和生活中产生的氮氧化物
汽车尾气排出的NO,就是汽缸里空气中的氮气、氧气在高温下反应而产生的;金属的冶炼可产生NO;生产氮肥的工业可产生NO;生产和使用硝酸的工业可产生NO;金属与硝酸反应可产生NO、NO2;化石燃料的燃烧也会产生氮氧化物。
2.一氧化氮和二氧化氮
物质 NO2 NO
色、味、态 红棕色、有刺激性气味的气体 无色、无味的气体
溶解性 易溶于水(不是酸酐) 微溶于水
毒性 有毒 有毒
与水反应 3NO2+H2O===NO+2HNO3 不反应
与氧气反应 不反应 2NO+O2===2NO2
其他特性 能自行化合:2NO2 N2O4(无色),NO2是形成光化学烟雾的主要物质 极少量NO有助于促进血管扩张,防止血管栓塞
[注意] NO和NO2都不是酸性氧化物,NO与碱、酸都不能反应生成盐和水,属于不成盐氧化物;NO2与碱溶液发生氧化还原反应生成两种盐,不属于酸性氧化物。
1.宇宙飞船的运载火箭的推进器引燃后发生剧烈反应,产生大量高温气体,从火箭尾部喷出。引燃后的高温气体成分有CO2、H2O、N2、NO等,这些气体均无色,但在卫星发射现场看到火箭喷射出大量的红烟,产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.NO与空气反应生成NO2
C.CO2遇NO反应生成酸性氧化物NO2
D.NO遇H2O反应生成NO2
2.把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A.氧气 B.二氧化氮
C.二氧化氮和氧气 D.二氧化氮和一氧化氮
解析:少量NO2气体通入过量小苏打溶液中,逸出的气体为NO、CO2,二者物质的量之比为1∶2,同时还有少量水蒸气逸出,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,CO2与过氧化钠反应生成的O2与NO反应生成NO2,O2有剩余,同时逸出的少量水蒸气与过氧化钠反应生成O2,所以最后收集到的气体是NO2和O2。
知识点二 氮氧化物的相关计算
常见计算的类型和方法
(1)
(2)
(3)
(4)
4.将装有50 mL NO2、NO混合气体的量筒倒立于水槽中,反应后气体体积缩小为30 mL,则原混合气体中NO2和NO的体积比是( )
A.5∶3 B.3∶5 C.3∶2 D.2∶3
总结提升
本课总结
自我反思:﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍
随堂提升
1.下列说法中错误的是( )
A.N2的化学性质不活泼,是因为氮元素不活泼
B.利用N2的不活泼性,工业上常用N2代替稀有气体来作焊接金属的保护气
C.N2可跟H2、O2在一定条件下直接化合
D.生物固氮是自然固氮的一种途径
解析:N2的活泼性与氮元素的活泼性是两个不同的概念,N2的活泼性取决于氮分子的结构,两者之间没有因果关系。
2.下列关于氮氧化物的产生,说法错误的是( )
A.空气在雷电作用下,其中少量氮气转化为氮的氧化物
B.合成氨工业属于人工固氮
C.汽车尾气主要产生氮氧化物,不会产生“温室气体”
D.豆科植物的根瘤菌能将空气中的氮气转化为含氮化合物
解析:汽车的尾气中除含氮氧化物外,还有CO2,C不正确。
3.在一大试管中装入10 mL NO,倒立于水槽中,然后慢慢地通入10 mL O2,下面有关实验最终状态的描述中,正确的是( )
A.试管内气体呈红棕色 B.试管内气体无色,是NO
C.试管内气体无色,是O2 D.试管内液面下降
4.同温同压下,在3支相同体积的试管中分别充有等体积混合的两种气体,它们是①NO和NO2,②NO2和O2,③NO和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
A.V1>V2>V3 B.V1>V3>V2
C.V2>V3>V1 D.V3>V1>V2
5.(1)豆科植物不施氮肥,仍能表现出良好的长势,其原因是_____________
_________________________________________________________________。
(2)雷雨天气常会有微量的硝酸生成,用化学方程式解释HNO3的形成过程:______________________________________________________________。
豆科植物的根瘤菌将游离态的氮转化为化合态的氨或铵盐,从而满足自身营养的需要
课时分层练
题号 1 2 3 4 5 6 7
难度 ★ ★ ★ ★ ★★ ★★ ★★
对点 氮的固定的判断 NO的性质 NO2的性质 NO2与H2O反应的实质 氮氧化物的性质及相关计算 氮氧化物的性质及相关计算 与氮氧化物有关的化学方程式书写及计算
题号 8 9 10 11 12 13
难度 ★ ★ ★★ ★★★ ★★ ★★★
对点 氮循环 人工固氮、氮氧化物的性质 氮氧化物的性质、阿伏加德罗定律及推论 氮氧化物的相关计算 镁与NO2反应的实验探究 氮氧化物的相关计算
1.下列反应属于氮的固定的是( )
A.N2和O2反应生成NO B.NH3经催化氧化生成NO
C.NO与O2反应生成NO2 D.由NH3制碳铵和硫铵
[学习·理解]
2.(2024·广东省南阳中学高一下学期月考)核酸是细胞内具有遗传功能的物质,NO属于细胞间的通信物质,两者有机结合起来共同承担人体新陈代谢的任务。下列对NO的叙述不正确的是( )
A.NO是一种无色无味的有毒气体
B.实验室收集NO可用排空气法
C.NO的生物学作用和其作用机理在医学领域中有很高的研究价值
D.NO微溶于水且不与水反应,可用排水法收集
解析:NO与空气中的O2会反应产生红棕色的NO2气体,因此不能用排空气的方法收集,B错误。
3.下列对二氧化氮的说法不正确的是( )
A.二氧化氮不是硝酸的酸酐
B.二氧化氮与水的反应是氧化还原反应
C.二氧化氮不是造成大气污染的气体之一
D.在通常状况下测得的NO2的相对分子质量是不准确的
4.将充满NO2的试管倒立于盛有水的水槽中,充分放置后的现象如图所示,其中正确的是( )
5.将盛有12 mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL无色气体,则原混合气体中O2的体积和剩余的气体分别是( )
①2.4 mL、O2 ②1.2 mL、NO ③4 mL、O2 ④3.6 mL、NO
A.②或③ B.①或②
C.③或④ D.①或④
解析:相同条件下,气体体积之比等于物质的量之比。若剩余气体为氧气,则参加反应的气体体积为12 mL-2 mL=10 mL,根据4NO2+O2+2H2O===4HNO3可知参加此反应的O2的体积为10 mL×1/5=2 mL,原混合气体中O2的体积为2 mL+2 mL=4 mL;若剩余气体为NO,根据3NO2+H2O===2HNO3+NO可知过量的NO2的体积为3×2 mL=6 mL,反应4NO2+O2+2H2O===4HNO3消耗的气体总体积为12 mL-6 mL=6 mL,则反应消耗的氧气的体积为6 mL×1/5=1.2 mL,A正确。
7.氮的氧化物是大气污染的主要污染物之一,对人类危害很大,每天行驶的汽车排放的尾气中就含有大量的氮氧化物。回答下列问题:
(1)写出汽车尾气中产生NO的化学方程式:________________。
(2)NO2易溶于水。标准状况下将体积为V mL的试管充满NO2后倒扣在水中,如图所示。
①NO2溶于水的化学方程式是____________________________。
②使试管中NO2恰好完全被水吸收需要缓慢通入氧气,标准状况
下通入氧气的体积为________。最终试管中所得硝酸的物质的量浓度
为_____________。
3NO2+H2O===2HNO3+NO
③为了消除NO2的污染,可将它与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,该反应的化学方程式是_______ ________________________。
8.氮在自然界中的转化是一个复杂的过程,如图所示的氮循环是生态系统物质循环的重要组成部分。下列有关氮循环的说法不正确的是( )
A.雷雨天气容易发生转化②的过程
B.图中转化②③④都属于氮的固定
C.动植物蛋白质中一定含有氮元素
D.转化⑥说明有机物可以转化为无机物
解析:图中④的转化不属于氮的固定,B错误。
[应用·实践]
9.下列说法错误的是( )
A.工业上利用合成氨实现人工固氮涉及氧化还原反应
B.NO2与溴蒸气的鉴别可以用水、AgNO3溶液,但不能用湿润的淀粉 KI试纸
C.除去NO中的NO2气体的方法是将气体依次通入盛有水和浓H2SO4的洗气瓶中
D.NO2为无色、有刺激性气味的气体
10.如图所示,两个连通容器用活塞分开,左、右两室体积相同,左室充入一定量NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应。下列判断正确的是(不考虑NO2转化为N2O4)( )
A.反应前左、右两室中的分子数相同
B.反应前后气体颜色相同
C.反应后容器内有O2存在
D.反应后容器内的密度与反应前的不同
解析:打开活塞前容器中左、右两室内气体的密度、体积相同,则左、右室气体的质量相同,NO、O2的摩尔质量不同,所以左、右两室中的分子数不同,A不正确;2NO(无色)+O2===2NO2(红棕色),B不正确;等质量的NO和O2反应,O2过量,C正确;连通容器的体积不变,连通容器内的气体的质量不变,所以反应后容器内的密度与反应前的密度相同,D不正确。
11.将3 mol NO2气体依次通入分别装有足量①NaHCO3饱和溶液,②浓H2SO4,③Na2O2的装置后,用排水法把残留气体收集起来,则收集到的气体是( )
A.1 mol NO B.1 mol NO2和0.05 mol O2
C.2 mol O2 D.0.25 mol O2
解析:由3NO2+H2O===2HNO3+NO可知有1 mol NO、2 mol HNO3生成,由HNO3+NaHCO3===NaNO3+H2O+CO2↑可知,2 mol HNO3与足量NaHCO3反应有2 mol CO2产生。由2CO2+2Na2O2===2Na2CO3+O2可知有1 mol O2产生。此时剩余气体为1 mol NO和1 mol O2。用排水法收集时,发生4NO+3O2+2H2O===4HNO3,最后剩余0.25 mol O2。
(2)设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)。
资料信息:2NO2+2NaOH===NaNO3+NaNO2+H2O。
①装置A中的试剂是_____________。
②干燥管和装置B的作用分别是_________________________、_________。
③实验开始时正确的操作步骤顺序是_______(填字母)。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
NaOH溶液
吸收NO2,避免污染环境
收集N2
badc
13.氮的氧化物能导致酸雨和光化学烟雾。
用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。
(1)所用烧碱溶液的物质的量浓度至少为________mol·L-1。
[创新·提高]
3∶2
(n-m)∶(3m+n)
0
专题7 氮与社会
可持续发展
第一单元 氮的固定
1.能依据氮分子的微观结构预测其性质。2.认识人工固氮的化学原理和社会价值。3.能从物质类别和氮元素的化合价角度认识氮氧化物的性质与转化,促进“证据推理与模型认知”核心素养的发展。
学习理解
01
课时分层练
04
目录
CONTENTS
探究应用
02
总结提升
03
学习理解
一、氮分子的结构
1.氮元素的存在
在自然界中,绝大部分氮元素以________________存在于空气中。
2.氮气分子的结构
电子式:_____________;结构式:________。
3.氮气的性质
(1)物理性质
无色无味难溶于水的气体,密度比空气略小。
游离态的氮气
∶N N∶
N≡N
共价键
2NO
Mg3N2
二、氮的固定
1.概念
将空气中_____________转化成____________叫作氮的固定,简称固氮。
游离态的氮
含氮化合物
生物化学
含氮化合物
含氮化合物
3NO2+H2O===2HNO3+NO
三、氮在自然界中的循环
1.自然循环
氮氧化物
判断正误,正确的打“√”,错误的打“×”。
(1)N2在放电条件下与O2反应生成NO2。( )
(2)合成氨反应属于自然固氮。( )
(3)N2与O2反应时,N2作还原剂。( )
(4)6.72 L NO2与水充分反应转移的电子数目为0.2NA。( )
(5)制二氧化氮时,用水吸收尾气。( )
×
×
√
×
×
√
探究应用
[问题探究]
1.液氮用于医疗手术、用作灯泡填充气分别利用了氮气的哪些性质?
提示:液氮用于医疗手术是利用了氮气沸点低的性质,液氮汽化时吸收大量热,起到冷冻麻醉作用;用作灯泡填充气是利用了氮气化学性质稳定的性质,不易与其他物质发生反应。
2.利用氮气制氮肥的关键是氮的固定,将氮气转化为氮氧化物或者氨气,实现氮元素化合价的升高或降低,上述变化过程中,分别体现了氮气什么性质?
提示:氮气转化为氮氧化物体现氮气的还原性,氮气合成氨体现氮气的氧化性。
知识点一 氮氧化物的产生与转化
1.生产和生活中产生的氮氧化物
汽车尾气排出的NO,就是汽缸里空气中的氮气、氧气在高温下反应而产生的;金属的冶炼可产生NO;生产氮肥的工业可产生NO;生产和使用硝酸的工业可产生NO;金属与硝酸反应可产生NO、NO2;化石燃料的燃烧也会产生氮氧化物。
2.一氧化氮和二氧化氮
物质 NO2 NO
色、味、态 红棕色、有刺激性气味的气体 无色、无味的气体
溶解性 易溶于水(不是酸酐) 微溶于水
毒性 有毒 有毒
与水反应 3NO2+H2O===NO+2HNO3 不反应
与氧气反应 不反应 2NO+O2===2NO2
其他特性 能自行化合:2NO2 N2O4(无色),NO2是形成光化学烟雾的主要物质 极少量NO有助于促进血管扩张,防止血管栓塞
[注意] NO和NO2都不是酸性氧化物,NO与碱、酸都不能反应生成盐和水,属于不成盐氧化物;NO2与碱溶液发生氧化还原反应生成两种盐,不属于酸性氧化物。
1.宇宙飞船的运载火箭的推进器引燃后发生剧烈反应,产生大量高温气体,从火箭尾部喷出。引燃后的高温气体成分有CO2、H2O、N2、NO等,这些气体均无色,但在卫星发射现场看到火箭喷射出大量的红烟,产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.NO与空气反应生成NO2
C.CO2遇NO反应生成酸性氧化物NO2
D.NO遇H2O反应生成NO2
2.把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A.氧气 B.二氧化氮
C.二氧化氮和氧气 D.二氧化氮和一氧化氮
解析:少量NO2气体通入过量小苏打溶液中,逸出的气体为NO、CO2,二者物质的量之比为1∶2,同时还有少量水蒸气逸出,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,CO2与过氧化钠反应生成的O2与NO反应生成NO2,O2有剩余,同时逸出的少量水蒸气与过氧化钠反应生成O2,所以最后收集到的气体是NO2和O2。
知识点二 氮氧化物的相关计算
常见计算的类型和方法
(1)
(2)
(3)
(4)
4.将装有50 mL NO2、NO混合气体的量筒倒立于水槽中,反应后气体体积缩小为30 mL,则原混合气体中NO2和NO的体积比是( )
A.5∶3 B.3∶5 C.3∶2 D.2∶3
总结提升
本课总结
自我反思:﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍
随堂提升
1.下列说法中错误的是( )
A.N2的化学性质不活泼,是因为氮元素不活泼
B.利用N2的不活泼性,工业上常用N2代替稀有气体来作焊接金属的保护气
C.N2可跟H2、O2在一定条件下直接化合
D.生物固氮是自然固氮的一种途径
解析:N2的活泼性与氮元素的活泼性是两个不同的概念,N2的活泼性取决于氮分子的结构,两者之间没有因果关系。
2.下列关于氮氧化物的产生,说法错误的是( )
A.空气在雷电作用下,其中少量氮气转化为氮的氧化物
B.合成氨工业属于人工固氮
C.汽车尾气主要产生氮氧化物,不会产生“温室气体”
D.豆科植物的根瘤菌能将空气中的氮气转化为含氮化合物
解析:汽车的尾气中除含氮氧化物外,还有CO2,C不正确。
3.在一大试管中装入10 mL NO,倒立于水槽中,然后慢慢地通入10 mL O2,下面有关实验最终状态的描述中,正确的是( )
A.试管内气体呈红棕色 B.试管内气体无色,是NO
C.试管内气体无色,是O2 D.试管内液面下降
4.同温同压下,在3支相同体积的试管中分别充有等体积混合的两种气体,它们是①NO和NO2,②NO2和O2,③NO和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
A.V1>V2>V3 B.V1>V3>V2
C.V2>V3>V1 D.V3>V1>V2
5.(1)豆科植物不施氮肥,仍能表现出良好的长势,其原因是_____________
_________________________________________________________________。
(2)雷雨天气常会有微量的硝酸生成,用化学方程式解释HNO3的形成过程:______________________________________________________________。
豆科植物的根瘤菌将游离态的氮转化为化合态的氨或铵盐,从而满足自身营养的需要
课时分层练
题号 1 2 3 4 5 6 7
难度 ★ ★ ★ ★ ★★ ★★ ★★
对点 氮的固定的判断 NO的性质 NO2的性质 NO2与H2O反应的实质 氮氧化物的性质及相关计算 氮氧化物的性质及相关计算 与氮氧化物有关的化学方程式书写及计算
题号 8 9 10 11 12 13
难度 ★ ★ ★★ ★★★ ★★ ★★★
对点 氮循环 人工固氮、氮氧化物的性质 氮氧化物的性质、阿伏加德罗定律及推论 氮氧化物的相关计算 镁与NO2反应的实验探究 氮氧化物的相关计算
1.下列反应属于氮的固定的是( )
A.N2和O2反应生成NO B.NH3经催化氧化生成NO
C.NO与O2反应生成NO2 D.由NH3制碳铵和硫铵
[学习·理解]
2.(2024·广东省南阳中学高一下学期月考)核酸是细胞内具有遗传功能的物质,NO属于细胞间的通信物质,两者有机结合起来共同承担人体新陈代谢的任务。下列对NO的叙述不正确的是( )
A.NO是一种无色无味的有毒气体
B.实验室收集NO可用排空气法
C.NO的生物学作用和其作用机理在医学领域中有很高的研究价值
D.NO微溶于水且不与水反应,可用排水法收集
解析:NO与空气中的O2会反应产生红棕色的NO2气体,因此不能用排空气的方法收集,B错误。
3.下列对二氧化氮的说法不正确的是( )
A.二氧化氮不是硝酸的酸酐
B.二氧化氮与水的反应是氧化还原反应
C.二氧化氮不是造成大气污染的气体之一
D.在通常状况下测得的NO2的相对分子质量是不准确的
4.将充满NO2的试管倒立于盛有水的水槽中,充分放置后的现象如图所示,其中正确的是( )
5.将盛有12 mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL无色气体,则原混合气体中O2的体积和剩余的气体分别是( )
①2.4 mL、O2 ②1.2 mL、NO ③4 mL、O2 ④3.6 mL、NO
A.②或③ B.①或②
C.③或④ D.①或④
解析:相同条件下,气体体积之比等于物质的量之比。若剩余气体为氧气,则参加反应的气体体积为12 mL-2 mL=10 mL,根据4NO2+O2+2H2O===4HNO3可知参加此反应的O2的体积为10 mL×1/5=2 mL,原混合气体中O2的体积为2 mL+2 mL=4 mL;若剩余气体为NO,根据3NO2+H2O===2HNO3+NO可知过量的NO2的体积为3×2 mL=6 mL,反应4NO2+O2+2H2O===4HNO3消耗的气体总体积为12 mL-6 mL=6 mL,则反应消耗的氧气的体积为6 mL×1/5=1.2 mL,A正确。
7.氮的氧化物是大气污染的主要污染物之一,对人类危害很大,每天行驶的汽车排放的尾气中就含有大量的氮氧化物。回答下列问题:
(1)写出汽车尾气中产生NO的化学方程式:________________。
(2)NO2易溶于水。标准状况下将体积为V mL的试管充满NO2后倒扣在水中,如图所示。
①NO2溶于水的化学方程式是____________________________。
②使试管中NO2恰好完全被水吸收需要缓慢通入氧气,标准状况
下通入氧气的体积为________。最终试管中所得硝酸的物质的量浓度
为_____________。
3NO2+H2O===2HNO3+NO
③为了消除NO2的污染,可将它与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,该反应的化学方程式是_______ ________________________。
8.氮在自然界中的转化是一个复杂的过程,如图所示的氮循环是生态系统物质循环的重要组成部分。下列有关氮循环的说法不正确的是( )
A.雷雨天气容易发生转化②的过程
B.图中转化②③④都属于氮的固定
C.动植物蛋白质中一定含有氮元素
D.转化⑥说明有机物可以转化为无机物
解析:图中④的转化不属于氮的固定,B错误。
[应用·实践]
9.下列说法错误的是( )
A.工业上利用合成氨实现人工固氮涉及氧化还原反应
B.NO2与溴蒸气的鉴别可以用水、AgNO3溶液,但不能用湿润的淀粉 KI试纸
C.除去NO中的NO2气体的方法是将气体依次通入盛有水和浓H2SO4的洗气瓶中
D.NO2为无色、有刺激性气味的气体
10.如图所示,两个连通容器用活塞分开,左、右两室体积相同,左室充入一定量NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应。下列判断正确的是(不考虑NO2转化为N2O4)( )
A.反应前左、右两室中的分子数相同
B.反应前后气体颜色相同
C.反应后容器内有O2存在
D.反应后容器内的密度与反应前的不同
解析:打开活塞前容器中左、右两室内气体的密度、体积相同,则左、右室气体的质量相同,NO、O2的摩尔质量不同,所以左、右两室中的分子数不同,A不正确;2NO(无色)+O2===2NO2(红棕色),B不正确;等质量的NO和O2反应,O2过量,C正确;连通容器的体积不变,连通容器内的气体的质量不变,所以反应后容器内的密度与反应前的密度相同,D不正确。
11.将3 mol NO2气体依次通入分别装有足量①NaHCO3饱和溶液,②浓H2SO4,③Na2O2的装置后,用排水法把残留气体收集起来,则收集到的气体是( )
A.1 mol NO B.1 mol NO2和0.05 mol O2
C.2 mol O2 D.0.25 mol O2
解析:由3NO2+H2O===2HNO3+NO可知有1 mol NO、2 mol HNO3生成,由HNO3+NaHCO3===NaNO3+H2O+CO2↑可知,2 mol HNO3与足量NaHCO3反应有2 mol CO2产生。由2CO2+2Na2O2===2Na2CO3+O2可知有1 mol O2产生。此时剩余气体为1 mol NO和1 mol O2。用排水法收集时,发生4NO+3O2+2H2O===4HNO3,最后剩余0.25 mol O2。
(2)设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)。
资料信息:2NO2+2NaOH===NaNO3+NaNO2+H2O。
①装置A中的试剂是_____________。
②干燥管和装置B的作用分别是_________________________、_________。
③实验开始时正确的操作步骤顺序是_______(填字母)。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
NaOH溶液
吸收NO2,避免污染环境
收集N2
badc
13.氮的氧化物能导致酸雨和光化学烟雾。
用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。
(1)所用烧碱溶液的物质的量浓度至少为________mol·L-1。
[创新·提高]
3∶2
(n-m)∶(3m+n)
