7.2 第二课时 硝酸 课件 (共62张PPT)
文档属性
| 名称 | 7.2 第二课时 硝酸 课件 (共62张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-21 20:20:06 | ||
图片预览











文档简介
(共62张PPT)
0
专题7 氮与社会
可持续发展
第二单元 重要的含氮
化式原料
第二课时 硝酸
1.能从物质类别、氮元素的价态的角度预测分析硝酸的性质。
2.掌握硝酸的重要性质。3.了解硝酸的用途。
学习理解
01
课时分层练
04
目录
CONTENTS
探究应用
02
总结提升
03
学习理解
颜色 状态 气味 溶解性 挥发性
_______ 液体 ________气味 与水以任意比互溶 ________
一、硝酸的性质
1.物理性质
无色
刺激性
易挥发
2.化学性质
铝、铁
二、硝酸的用途
硝酸是一种重要的化工原料,常用来制造氮肥、燃料、塑料、炸药、硝酸盐等。
判断正误,正确的打“√”,错误的打“×”。
(1)硝酸的浓度越大,其氧化性越强。( )
(2)稀硝酸可溶解Fe(OH)2生成Fe(NO3)2和水。( )
(3)碳、铜与浓硝酸反应时,浓硝酸只表现强氧化性。( )
(4)过量的铜和一定量浓硝酸反应,生成的气体只有二氧化氮。( )
(5)常温下,将铝片放入浓硝酸,无明显现象,是因为铝和浓硝酸不反应。( )
(6)实验室可以用铜和稀硝酸制备少量的NO气体。( )
√
×
×
×
×
√
探究应用
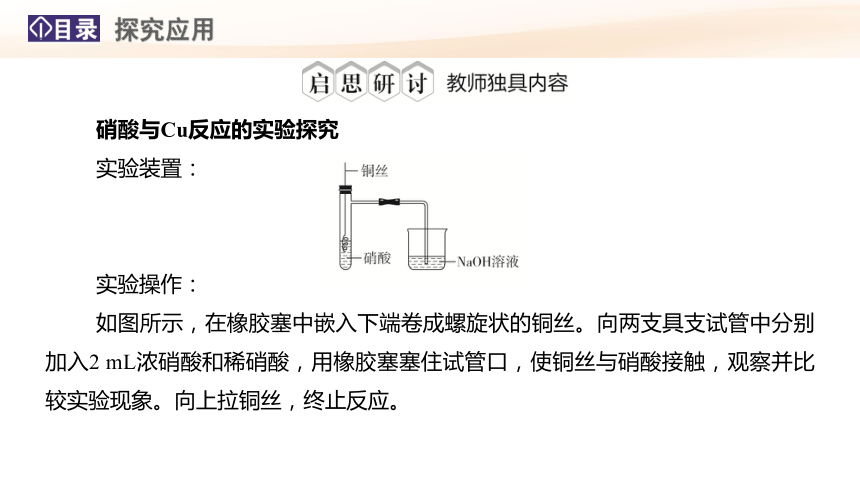
硝酸与Cu反应的实验探究
实验装置:
实验操作:
如图所示,在橡胶塞中嵌入下端卷成螺旋状的铜丝。向两支具支试管中分别加入2 mL浓硝酸和稀硝酸,用橡胶塞塞住试管口,使铜丝与硝酸接触,观察并比较实验现象。向上拉铜丝,终止反应。
[问题探究]
1.两支具支试管中观察到的实验现象是否完全相同?
反应中浓硝酸、稀硝酸起什么作用?
提示:不相同。加入浓硝酸的具支试管中出现的现象
是铜片表面产生气泡,铜片溶解,溶液变蓝,具支试管上部空间气体由无色变为红棕色。加入稀硝酸的具支试管出现的现象是铜片表面产生气泡,铜片溶解,溶液变蓝,具支试管上部空间气体由无色变红棕色,后又变成无色。两支具支试管中浓、稀硝酸既表现出氧化性,又表现出酸性。
2.分析两支具支试管中发生反应的氮元素的价态变化,
思考硝酸的浓度对还原产物有何影响。
3.足量的铜与一定量的浓硝酸反应,得到气体的成分是什么?
提示:反应中,浓硝酸的还原产物是NO2,稀硝酸的还原产物是NO,即硝酸的浓度越低,还原产物中氮元素的价态越低。
提示:NO、NO2的混合气体。铜与浓HNO3反应生成NO2,随着反应的进行,硝酸浓度变小,铜与稀硝酸反应生成NO,故得到的是NO和NO2的混合气体。
知识点一 硝酸的性质
2.硝酸氧化性的体现
(1)能将大多数金属(如铜)氧化成高价态金属的硝酸盐,浓硝酸生成NO2,稀硝酸生成NO,极稀硝酸生成N2O、N2、NH4NO3等。硝酸的浓度越大,反应温度越高,其氧化性越强。
(2)常温下,浓硝酸能使铁、铝发生钝化,这是因为浓硝酸将铁、铝表面氧化,形成致密的氧化物薄膜。若在加热条件下,可破坏氧化膜,从而使反应继续进行。
(3)王水是浓硝酸和浓盐酸体积比1∶3的混合物,能使一些不溶于硝酸的金属金、铂等溶解。
1.已知某四种单质分别与浓硝酸混合出现的情况依次是①反应生成相应的硝酸盐;②反应生成最高价含氧酸;③发生钝化;④不发生反应。则符合上述情况的单质可能是( )
A.Cu、Si、Zn、Au B.Ag、P、Al、Pt
C.Fe、C、Sb、Hg D.Cu、S、Fe、Pb
解析:浓硝酸在常温下使铁、铝钝化,故A、C不符合;浓硝酸能与绝大多数金属反应,但不能与Au、Pt反应,故D不符合。
2.硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸性质不对应的一组是( )
A.浓硝酸使紫色石蕊试液先变红后褪色——酸性和强氧化性
B.不能用稀硝酸与锌反应制氢气——强氧化性
C.要用棕色瓶盛装浓硝酸——不稳定性
D.能使滴有酚酞溶液的氢氧化钠溶液红色褪去——强氧化性
知识点二 硝酸与金属反应的相关计算
1.硝酸与金属反应的计算的思维导图
2.常用的计算方法(以Cu与硝酸反应为例)
(1)原子守恒法
反应前所有的N只存在于HNO3中,反应后含N的物质有HNO3的还原产物(假设有NO2、NO)和Cu(NO3)2,若HNO3过量,则过量HNO3中也含N,则有n(N)=n(NO2)+n(NO)+2n[Cu(NO3)2]+n剩(HNO3)(N原子守恒)。
3.0.3 mol Cu和含1.2 mol HNO3的浓硝酸充分反应后,生成NO2的量为( )
A.0.2 mol B.0.6 mol
C.小于0.6 mol D.大于0.6 mol
解析:铜与浓硝酸发生反应:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,当0.3 mol Cu与1.2 mol HNO3完全反应时,生成0.6 mol NO2,但随着反应的进行,浓硝酸变稀,铜与稀硝酸发生反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,所以生成的NO2小于0.6 mol。
4.8.4 g铁屑投入100 mL一定浓度的硝酸溶液中,二者恰好完全反应(整个反应过程中,转移电子的物质的量为0.35 mol),并收集到3.36 L(已折算为标准状况)气体。下列说法正确的是( )
A.该硝酸的浓度是5.0 mol·L-1 B.还原产物一定是NO
C.氧化产物是Fe(NO3)3 D.无法确定硝酸的浓度
解析:8.4 g即0.15 mol Fe转移0.35 mol e-,可见氧化产物是Fe(NO3)3和Fe(NO3)2的混合物,设二者物质的量分别为x、y,则x+y=0.15 mol,3x+2y=0.35 mol,解得x=0.05 mol,y=0.10 mol;同理判断3.36 L(0.15 mol)气体是NO和NO2的混合物,n(HNO3)=3x+2y+0.15 mol=0.50 mol,c(HNO3)=5.0 mol·L-1。
总结提升
本课总结
自我反思:﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍
随堂提升
1.下列关于硝酸的叙述正确的是( )
A.常温下,浓硝酸可以使金属镁钝化
B.硝酸与硫化钠反应能产生H2S气体
C.浓硝酸和稀硝酸都是强氧化剂
D.室温下,铜能与浓硝酸反应,不能与稀硝酸反应
解析:常温下,浓硝酸可以使铁、铝发生钝化,而不能使镁钝化,A错误;硝酸具有强氧化性,能将S2-氧化,得不到H2S气体,B错误;室温下,铜与浓硝酸、稀硝酸均反应,只是反应的速率及还原产物不同,D错误。
4.向200 mL稀硫酸和稀硝酸的混合溶液中缓慢加入铁粉,产生气体的体积随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列说法正确的是( )
5.实验室中常用铜和稀硝酸反应制取一氧化氮:
(1)该反应的化学方程式是___________________________________________。
(2)反应中被还原的元素是______,氧化产物是________(填名称)。
(3)氧化剂与还原剂的物质的量之比是________,硝酸所表现的性质是________________。
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
N
硝酸铜
2∶3
酸性、氧化性
课时分层练
题号 1 2 3 4 5 6 7
难度 ★ ★ ★ ★ ★ ★★ ★★
对点 浓硝酸 的性质 浓硝酸 的性质 硝酸铜制备方案的评价 铜与浓、稀硝酸反应的比较 铜与硝酸反应的相关 计算 浓硝酸性质的实验探究 锌与稀硝酸反应的相关计算
题号 8 9 10 11 12 13
难度 ★★ ★★ ★★ ★★★ ★★ ★★★
对点 铜与稀硝酸反应的实验探究 金属混合物与稀硝酸反应的相关计算 铜与混酸反应的相关 计算 铜与硝酸反应的相关计算 硝酸的性质及与金属反应的相关计算 浓、稀硝酸氧化性相对强弱的实验探究
1.常温下能盛放在铁制容器中的物质是( )
A.浓盐酸 B.浓硝酸
C.硫酸铜溶液 D.稀硫酸
[学习·理解]
2.下列关于硝酸的说法不正确的是( )
A.浓硝酸是一种易挥发的液体混合物
B.浓硝酸在空气中敞口放置,因吸收水蒸气而浓度减小
C.浓硝酸不稳定,易分解生成二氧化氮、氧气和水
D.常温下,浓硝酸常保存在棕色试剂瓶中
解析:浓硝酸易挥发,在空气中敞口放置,其浓度会不断减小。
4.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.反应剧烈程度:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
解析:同质量的铜分别和过量浓、稀硝酸反应,浓硝酸反应的更剧烈,A错误;铜和浓、稀硝酸反应的方程式分别为①4HNO3(浓)+Cu===Cu(NO3)2+2NO2↑+2H2O,②8HNO3(稀)+3Cu===3Cu(NO3)2+2NO↑+4H2O。①产生红棕色气体,②产生无色气体,C错误;由于参加反应的铜的质量相同,且两反应中还原剂都是铜,反应后铜的价态又相同,所以反应中转移的电子总数相等,D错误。
5.将2.56 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完全时,共收集到气体1.12 L(已折算为标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05 mol B.1 mol
C.1.05 mol D.0.13 mol
解析:参加反应的硝酸由两部分构成,一是被还原为氮氧化物的硝酸为0.05 mol;二是作为酸,生成Cu(NO3)2的硝酸为0.08 mol,共0.13 mol。
6.下列实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
① ② ③
解析:实验①中的碎玻璃不与浓硝酸反应,但仍有红棕色气体产生,说明浓硝酸受热分解产生了NO2和O2,A正确;对比实验②和③,红棕色气体的产生可能是由于红热的木炭与浓HNO3发生反应生成NO2,也可能是浓HNO3受热分解产生NO2,B正确;实验③中,无论NO2是浓HNO3分解产生,还是浓HNO3与红热木炭反应产生,NO2均为还原产物,C正确;CO2可能是红热的木炭与空气中的氧气反应生成,D错误。
① ② ③
7.物质的量之比为2∶5的锌与稀硝酸反应,若硝酸被还原的产物仅为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
A.1∶4 B.1∶5
C.2∶3 D.2∶5
8.一定温度下,探究铜与稀硝酸的反应过程如图所示,下列说法不正确的是( )
[应用·实践]
9.将2.64 g Mg、Cu组成的混合物投入适量稀硝酸中,固体完全溶解时收集到0.896 L(标准状况)还原产物NO气体,向反应后溶液中加入60 mL 2 mol·L-1 NaOH溶液时金属离子恰好沉淀完全。则形成沉淀质量及硝酸的物质的量分别为( )
A.4.32 g 0.02 mol B.4.68 g 0.16 mol
C.5.36 g 0.18 mol D.6.38 g 0.2 mol
10.等体积的两份稀酸溶液,一份为a mol·L-1的硝酸溶液;另一份为硝酸和硫酸的混合溶液,硝酸浓度为a mol·L-1,硫酸浓度为b mol·L-1。若分别向两份溶液中加入过量的铜粉,产生的气体体积为1∶2(都只生成NO),则a∶b的值是( )
A.1∶1 B.1∶2
C.2∶1 D.3∶2
11.38.4 g Cu与一定量浓硝酸恰好
完全反应生成氮的氧化物,这些氧化物恰
好溶解在NaOH溶液中得到NaNO3和NaNO2
的混合溶液,反应过程及有关数据如图所示。
下列有关该过程的判断不正确的是( )
A.氮的氧化物和NaOH溶液反应时,NO作还原剂
B.0.9 mol混合气体中N2O4的物质的量是0.2 mol
C.若浓硝酸体积为200 mL,则其物质的量浓度为11 mol/L
D.欲使上述0.9 mol氮的氧化物完全被水吸收,理论上至少需要通入标准状况下的O2体积为6.72 L
12.铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将反应方程式表示为:Cu+HNO3―→Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平)。
(1)硝酸在该反应中表现出的性质是_________________。
(2)0.3 mol Cu被一定浓度的硝酸完全溶解后,如果此时产生的NO和NO2气体总体积为8.96 L(已折算为标准状况下),则被还原的硝酸的物质的量是________mol,参加反应的硝酸的物质的量是____mol,产生的混合气体中NO和NO2的体积比为________。
酸性和氧化性
0.4
1
1∶3
解析:(2)气体的总物质的量为0.4 mol,由N原子守恒可知被还原的硝酸的物质的量为0.4 mol。由Cu(NO3)2可知,起酸的作用的硝酸为0.6 mol,则参加反应的硝酸的总物质的量是0.4 mol+0.6 mol=1 mol。设NO的物质的量为n,则NO2的物质的量为0.4 mol-n,根据得失电子守恒得:0.3 mol×2=n×(5-2)+(0.4 mol-n)×(5-4),解得n=0.1 mol,则混合气体中NO和NO2的体积比为0.1 mol∶0.3 mol=1∶3。
13.某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3 mol·L-1稀硝酸、
蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与
NO2反应:2NO2+2NaOH===NaNO3+NaNO2
+H2O。
[创新·提高]
(1)实验应避免有害气体排放到空气中,装
置③、④、⑥中盛放的药品依次是___________
______________________________。
(2)装置①中发生反应的化学方程式是____
_________________________________________。
(3)装置②的作用是_______________________发生反应的化学方程式是____________________________。
(4)该小组得出的结论所依据的实验现象是______________________________ _____________________________。
3 mol·L-1稀硝酸、浓硝酸、氢氧化钠溶液
4HNO3(浓)+Cu===Cu(NO3)2+2NO2↑+2H2O
将NO2转化为NO
3NO2+H2O===2HNO3+NO
装置③液面上方气体仍为无色,装置④液面上方气体为红棕色
(5)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是________(填字母)。
A.加热该绿色溶液,观察颜色变化
B.加水稀释该绿色溶液,观察颜色变化
C.向该绿色溶液中通入氮气,观察颜色
变化
D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
ACD
解析:(1)装置⑥的作用是吸收尾气,则装
置④内溶液可氧化NO为NO2,装置④中为浓硝
酸,NO2尾气用装置⑥中的NaOH溶液吸收;装
置③中装有3 mol·L-1稀硝酸,不能氧化NO,在
装置⑤中用排水法收集NO。
(4)NO通过稀硝酸,若无红棕色气体产生,装置③液面上方气体仍为无色,则说明稀硝酸不能氧化NO;NO通过浓硝酸,若浓硝酸能氧化NO,则装置④中液面上方会产生红棕色气体。
(5)要证明是Cu(NO3)2浓度过高或是溶解了NO2导致装置①中溶液呈绿色,一是可设计将溶解的NO2赶走(A、C方案)再观察颜色变化,二是增大溶液中NO2浓度(D方案),通过观察颜色变化可以判断。B方案不可行,加水稀释,Cu(NO3)2浓度与NO2浓度均降低,无法判断是由哪个量的变化所引起的。
0
专题7 氮与社会
可持续发展
第二单元 重要的含氮
化式原料
第二课时 硝酸
1.能从物质类别、氮元素的价态的角度预测分析硝酸的性质。
2.掌握硝酸的重要性质。3.了解硝酸的用途。
学习理解
01
课时分层练
04
目录
CONTENTS
探究应用
02
总结提升
03
学习理解
颜色 状态 气味 溶解性 挥发性
_______ 液体 ________气味 与水以任意比互溶 ________
一、硝酸的性质
1.物理性质
无色
刺激性
易挥发
2.化学性质
铝、铁
二、硝酸的用途
硝酸是一种重要的化工原料,常用来制造氮肥、燃料、塑料、炸药、硝酸盐等。
判断正误,正确的打“√”,错误的打“×”。
(1)硝酸的浓度越大,其氧化性越强。( )
(2)稀硝酸可溶解Fe(OH)2生成Fe(NO3)2和水。( )
(3)碳、铜与浓硝酸反应时,浓硝酸只表现强氧化性。( )
(4)过量的铜和一定量浓硝酸反应,生成的气体只有二氧化氮。( )
(5)常温下,将铝片放入浓硝酸,无明显现象,是因为铝和浓硝酸不反应。( )
(6)实验室可以用铜和稀硝酸制备少量的NO气体。( )
√
×
×
×
×
√
探究应用
硝酸与Cu反应的实验探究
实验装置:
实验操作:
如图所示,在橡胶塞中嵌入下端卷成螺旋状的铜丝。向两支具支试管中分别加入2 mL浓硝酸和稀硝酸,用橡胶塞塞住试管口,使铜丝与硝酸接触,观察并比较实验现象。向上拉铜丝,终止反应。
[问题探究]
1.两支具支试管中观察到的实验现象是否完全相同?
反应中浓硝酸、稀硝酸起什么作用?
提示:不相同。加入浓硝酸的具支试管中出现的现象
是铜片表面产生气泡,铜片溶解,溶液变蓝,具支试管上部空间气体由无色变为红棕色。加入稀硝酸的具支试管出现的现象是铜片表面产生气泡,铜片溶解,溶液变蓝,具支试管上部空间气体由无色变红棕色,后又变成无色。两支具支试管中浓、稀硝酸既表现出氧化性,又表现出酸性。
2.分析两支具支试管中发生反应的氮元素的价态变化,
思考硝酸的浓度对还原产物有何影响。
3.足量的铜与一定量的浓硝酸反应,得到气体的成分是什么?
提示:反应中,浓硝酸的还原产物是NO2,稀硝酸的还原产物是NO,即硝酸的浓度越低,还原产物中氮元素的价态越低。
提示:NO、NO2的混合气体。铜与浓HNO3反应生成NO2,随着反应的进行,硝酸浓度变小,铜与稀硝酸反应生成NO,故得到的是NO和NO2的混合气体。
知识点一 硝酸的性质
2.硝酸氧化性的体现
(1)能将大多数金属(如铜)氧化成高价态金属的硝酸盐,浓硝酸生成NO2,稀硝酸生成NO,极稀硝酸生成N2O、N2、NH4NO3等。硝酸的浓度越大,反应温度越高,其氧化性越强。
(2)常温下,浓硝酸能使铁、铝发生钝化,这是因为浓硝酸将铁、铝表面氧化,形成致密的氧化物薄膜。若在加热条件下,可破坏氧化膜,从而使反应继续进行。
(3)王水是浓硝酸和浓盐酸体积比1∶3的混合物,能使一些不溶于硝酸的金属金、铂等溶解。
1.已知某四种单质分别与浓硝酸混合出现的情况依次是①反应生成相应的硝酸盐;②反应生成最高价含氧酸;③发生钝化;④不发生反应。则符合上述情况的单质可能是( )
A.Cu、Si、Zn、Au B.Ag、P、Al、Pt
C.Fe、C、Sb、Hg D.Cu、S、Fe、Pb
解析:浓硝酸在常温下使铁、铝钝化,故A、C不符合;浓硝酸能与绝大多数金属反应,但不能与Au、Pt反应,故D不符合。
2.硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸性质不对应的一组是( )
A.浓硝酸使紫色石蕊试液先变红后褪色——酸性和强氧化性
B.不能用稀硝酸与锌反应制氢气——强氧化性
C.要用棕色瓶盛装浓硝酸——不稳定性
D.能使滴有酚酞溶液的氢氧化钠溶液红色褪去——强氧化性
知识点二 硝酸与金属反应的相关计算
1.硝酸与金属反应的计算的思维导图
2.常用的计算方法(以Cu与硝酸反应为例)
(1)原子守恒法
反应前所有的N只存在于HNO3中,反应后含N的物质有HNO3的还原产物(假设有NO2、NO)和Cu(NO3)2,若HNO3过量,则过量HNO3中也含N,则有n(N)=n(NO2)+n(NO)+2n[Cu(NO3)2]+n剩(HNO3)(N原子守恒)。
3.0.3 mol Cu和含1.2 mol HNO3的浓硝酸充分反应后,生成NO2的量为( )
A.0.2 mol B.0.6 mol
C.小于0.6 mol D.大于0.6 mol
解析:铜与浓硝酸发生反应:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,当0.3 mol Cu与1.2 mol HNO3完全反应时,生成0.6 mol NO2,但随着反应的进行,浓硝酸变稀,铜与稀硝酸发生反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,所以生成的NO2小于0.6 mol。
4.8.4 g铁屑投入100 mL一定浓度的硝酸溶液中,二者恰好完全反应(整个反应过程中,转移电子的物质的量为0.35 mol),并收集到3.36 L(已折算为标准状况)气体。下列说法正确的是( )
A.该硝酸的浓度是5.0 mol·L-1 B.还原产物一定是NO
C.氧化产物是Fe(NO3)3 D.无法确定硝酸的浓度
解析:8.4 g即0.15 mol Fe转移0.35 mol e-,可见氧化产物是Fe(NO3)3和Fe(NO3)2的混合物,设二者物质的量分别为x、y,则x+y=0.15 mol,3x+2y=0.35 mol,解得x=0.05 mol,y=0.10 mol;同理判断3.36 L(0.15 mol)气体是NO和NO2的混合物,n(HNO3)=3x+2y+0.15 mol=0.50 mol,c(HNO3)=5.0 mol·L-1。
总结提升
本课总结
自我反思:﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍
随堂提升
1.下列关于硝酸的叙述正确的是( )
A.常温下,浓硝酸可以使金属镁钝化
B.硝酸与硫化钠反应能产生H2S气体
C.浓硝酸和稀硝酸都是强氧化剂
D.室温下,铜能与浓硝酸反应,不能与稀硝酸反应
解析:常温下,浓硝酸可以使铁、铝发生钝化,而不能使镁钝化,A错误;硝酸具有强氧化性,能将S2-氧化,得不到H2S气体,B错误;室温下,铜与浓硝酸、稀硝酸均反应,只是反应的速率及还原产物不同,D错误。
4.向200 mL稀硫酸和稀硝酸的混合溶液中缓慢加入铁粉,产生气体的体积随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列说法正确的是( )
5.实验室中常用铜和稀硝酸反应制取一氧化氮:
(1)该反应的化学方程式是___________________________________________。
(2)反应中被还原的元素是______,氧化产物是________(填名称)。
(3)氧化剂与还原剂的物质的量之比是________,硝酸所表现的性质是________________。
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
N
硝酸铜
2∶3
酸性、氧化性
课时分层练
题号 1 2 3 4 5 6 7
难度 ★ ★ ★ ★ ★ ★★ ★★
对点 浓硝酸 的性质 浓硝酸 的性质 硝酸铜制备方案的评价 铜与浓、稀硝酸反应的比较 铜与硝酸反应的相关 计算 浓硝酸性质的实验探究 锌与稀硝酸反应的相关计算
题号 8 9 10 11 12 13
难度 ★★ ★★ ★★ ★★★ ★★ ★★★
对点 铜与稀硝酸反应的实验探究 金属混合物与稀硝酸反应的相关计算 铜与混酸反应的相关 计算 铜与硝酸反应的相关计算 硝酸的性质及与金属反应的相关计算 浓、稀硝酸氧化性相对强弱的实验探究
1.常温下能盛放在铁制容器中的物质是( )
A.浓盐酸 B.浓硝酸
C.硫酸铜溶液 D.稀硫酸
[学习·理解]
2.下列关于硝酸的说法不正确的是( )
A.浓硝酸是一种易挥发的液体混合物
B.浓硝酸在空气中敞口放置,因吸收水蒸气而浓度减小
C.浓硝酸不稳定,易分解生成二氧化氮、氧气和水
D.常温下,浓硝酸常保存在棕色试剂瓶中
解析:浓硝酸易挥发,在空气中敞口放置,其浓度会不断减小。
4.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.反应剧烈程度:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
解析:同质量的铜分别和过量浓、稀硝酸反应,浓硝酸反应的更剧烈,A错误;铜和浓、稀硝酸反应的方程式分别为①4HNO3(浓)+Cu===Cu(NO3)2+2NO2↑+2H2O,②8HNO3(稀)+3Cu===3Cu(NO3)2+2NO↑+4H2O。①产生红棕色气体,②产生无色气体,C错误;由于参加反应的铜的质量相同,且两反应中还原剂都是铜,反应后铜的价态又相同,所以反应中转移的电子总数相等,D错误。
5.将2.56 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完全时,共收集到气体1.12 L(已折算为标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05 mol B.1 mol
C.1.05 mol D.0.13 mol
解析:参加反应的硝酸由两部分构成,一是被还原为氮氧化物的硝酸为0.05 mol;二是作为酸,生成Cu(NO3)2的硝酸为0.08 mol,共0.13 mol。
6.下列实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
① ② ③
解析:实验①中的碎玻璃不与浓硝酸反应,但仍有红棕色气体产生,说明浓硝酸受热分解产生了NO2和O2,A正确;对比实验②和③,红棕色气体的产生可能是由于红热的木炭与浓HNO3发生反应生成NO2,也可能是浓HNO3受热分解产生NO2,B正确;实验③中,无论NO2是浓HNO3分解产生,还是浓HNO3与红热木炭反应产生,NO2均为还原产物,C正确;CO2可能是红热的木炭与空气中的氧气反应生成,D错误。
① ② ③
7.物质的量之比为2∶5的锌与稀硝酸反应,若硝酸被还原的产物仅为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
A.1∶4 B.1∶5
C.2∶3 D.2∶5
8.一定温度下,探究铜与稀硝酸的反应过程如图所示,下列说法不正确的是( )
[应用·实践]
9.将2.64 g Mg、Cu组成的混合物投入适量稀硝酸中,固体完全溶解时收集到0.896 L(标准状况)还原产物NO气体,向反应后溶液中加入60 mL 2 mol·L-1 NaOH溶液时金属离子恰好沉淀完全。则形成沉淀质量及硝酸的物质的量分别为( )
A.4.32 g 0.02 mol B.4.68 g 0.16 mol
C.5.36 g 0.18 mol D.6.38 g 0.2 mol
10.等体积的两份稀酸溶液,一份为a mol·L-1的硝酸溶液;另一份为硝酸和硫酸的混合溶液,硝酸浓度为a mol·L-1,硫酸浓度为b mol·L-1。若分别向两份溶液中加入过量的铜粉,产生的气体体积为1∶2(都只生成NO),则a∶b的值是( )
A.1∶1 B.1∶2
C.2∶1 D.3∶2
11.38.4 g Cu与一定量浓硝酸恰好
完全反应生成氮的氧化物,这些氧化物恰
好溶解在NaOH溶液中得到NaNO3和NaNO2
的混合溶液,反应过程及有关数据如图所示。
下列有关该过程的判断不正确的是( )
A.氮的氧化物和NaOH溶液反应时,NO作还原剂
B.0.9 mol混合气体中N2O4的物质的量是0.2 mol
C.若浓硝酸体积为200 mL,则其物质的量浓度为11 mol/L
D.欲使上述0.9 mol氮的氧化物完全被水吸收,理论上至少需要通入标准状况下的O2体积为6.72 L
12.铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将反应方程式表示为:Cu+HNO3―→Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平)。
(1)硝酸在该反应中表现出的性质是_________________。
(2)0.3 mol Cu被一定浓度的硝酸完全溶解后,如果此时产生的NO和NO2气体总体积为8.96 L(已折算为标准状况下),则被还原的硝酸的物质的量是________mol,参加反应的硝酸的物质的量是____mol,产生的混合气体中NO和NO2的体积比为________。
酸性和氧化性
0.4
1
1∶3
解析:(2)气体的总物质的量为0.4 mol,由N原子守恒可知被还原的硝酸的物质的量为0.4 mol。由Cu(NO3)2可知,起酸的作用的硝酸为0.6 mol,则参加反应的硝酸的总物质的量是0.4 mol+0.6 mol=1 mol。设NO的物质的量为n,则NO2的物质的量为0.4 mol-n,根据得失电子守恒得:0.3 mol×2=n×(5-2)+(0.4 mol-n)×(5-4),解得n=0.1 mol,则混合气体中NO和NO2的体积比为0.1 mol∶0.3 mol=1∶3。
13.某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3 mol·L-1稀硝酸、
蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与
NO2反应:2NO2+2NaOH===NaNO3+NaNO2
+H2O。
[创新·提高]
(1)实验应避免有害气体排放到空气中,装
置③、④、⑥中盛放的药品依次是___________
______________________________。
(2)装置①中发生反应的化学方程式是____
_________________________________________。
(3)装置②的作用是_______________________发生反应的化学方程式是____________________________。
(4)该小组得出的结论所依据的实验现象是______________________________ _____________________________。
3 mol·L-1稀硝酸、浓硝酸、氢氧化钠溶液
4HNO3(浓)+Cu===Cu(NO3)2+2NO2↑+2H2O
将NO2转化为NO
3NO2+H2O===2HNO3+NO
装置③液面上方气体仍为无色,装置④液面上方气体为红棕色
(5)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是________(填字母)。
A.加热该绿色溶液,观察颜色变化
B.加水稀释该绿色溶液,观察颜色变化
C.向该绿色溶液中通入氮气,观察颜色
变化
D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
ACD
解析:(1)装置⑥的作用是吸收尾气,则装
置④内溶液可氧化NO为NO2,装置④中为浓硝
酸,NO2尾气用装置⑥中的NaOH溶液吸收;装
置③中装有3 mol·L-1稀硝酸,不能氧化NO,在
装置⑤中用排水法收集NO。
(4)NO通过稀硝酸,若无红棕色气体产生,装置③液面上方气体仍为无色,则说明稀硝酸不能氧化NO;NO通过浓硝酸,若浓硝酸能氧化NO,则装置④中液面上方会产生红棕色气体。
(5)要证明是Cu(NO3)2浓度过高或是溶解了NO2导致装置①中溶液呈绿色,一是可设计将溶解的NO2赶走(A、C方案)再观察颜色变化,二是增大溶液中NO2浓度(D方案),通过观察颜色变化可以判断。B方案不可行,加水稀释,Cu(NO3)2浓度与NO2浓度均降低,无法判断是由哪个量的变化所引起的。
