8.2 第一课时 乙醇 课件 (共56张PPT)
文档属性
| 名称 | 8.2 第一课时 乙醇 课件 (共56张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-21 20:30:18 | ||
图片预览










文档简介
(共56张PPT)
0
专题8 有机化合物的获得与应用
第二单元 食品中的有机化合物
第一课时 乙醇
1.知道乙醇的组成、结构、物理性质及用途。2.了解官能团与性质的关系。3.掌握乙醇的化学性质。
学习理解
01
课时分层练
04
目录
CONTENTS
探究应用
02
总结提升
03
学习理解
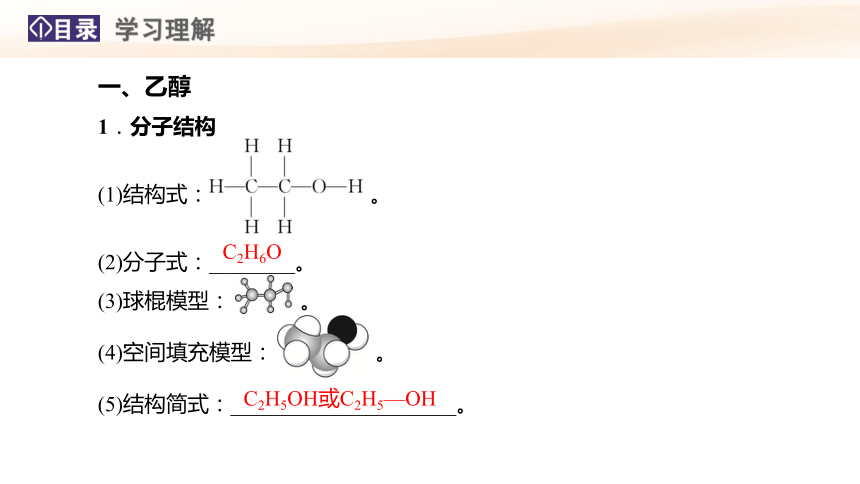
一、乙醇
1.分子结构
(1)结构式: 。
(2)分子式:________。
(3)球棍模型: 。
(4)空间填充模型: 。
(5)结构简式:_____________________。
C2H6O
C2H5OH或C2H5—OH
2.物理性质
乙醇是无色、有特殊香味的液体,密度比水小,可与水以___________互溶,易挥发。
3.化学性质
(1)乙醇分子中_____________上的氢原子能被金属钠置换生成氢气,但反应比钠与水要___________。
乙醇与金属钠反应的化学方程式为_____________________________________。
任意比例
羟基(—OH)
缓慢得多
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
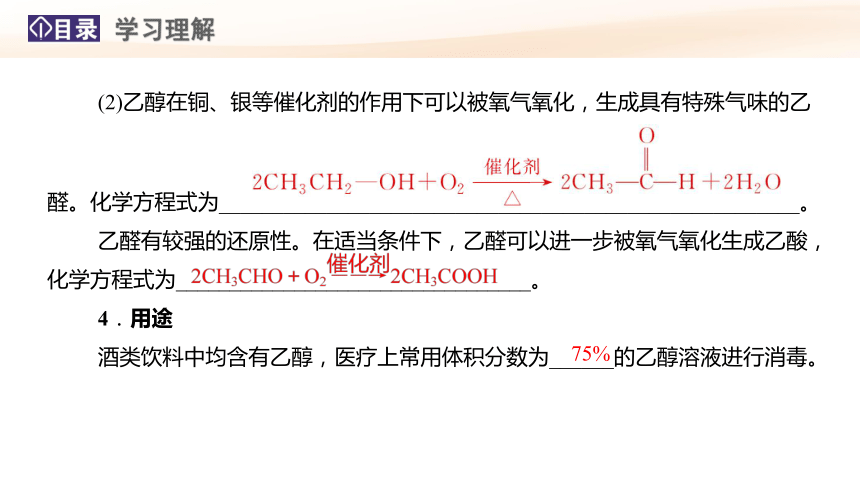
(2)乙醇在铜、银等催化剂的作用下可以被氧气氧化,生成具有特殊气味的乙
醛。化学方程式为______________________________________________________。
乙醛有较强的还原性。在适当条件下,乙醛可以进一步被氧气氧化生成乙酸,化学方程式为_________________________________。
4.用途
酒类饮料中均含有乙醇,医疗上常用体积分数为______的乙醇溶液进行消毒。
75%
二、官能团
1.概念:对物质_______起决定性作用的基团叫作官能团。
2.举例:乙醇分子的官能团是_______________,乙醛分子的官能团是_______________。
性质
羟基(—OH)
醛基(—CHO)
判断正误,正确的打“√”,错误的打“×”。
(1)乙醇的结构简式为C2H6O。( )
(2)医疗上用质量分数为75%的乙醇溶液消毒。( )
(3)向碘水中加入少量乙醇,振荡静置,上层液体呈紫色,下层液体无色。( )
(4)乙醇结构中有—OH,所以乙醇在水溶液中可以电离出OH-而显碱性。( )
(5)乙醇中的羟基氢比水中的羟基氢活泼。( )
(6)铜可以作乙醇催化氧化反应的催化剂。( )
(7)乙醇与钠反应可以产生氢气,所以乙醇显酸性。( )
×
×
×
×
×
√
×
探究应用
材料一 中国“酒文化”源远流长,早在几千年前,人们就掌握了发酵法酿酒的技术,各种酒类都含有浓度不等的乙醇,故乙醇俗称酒精。乙醇的分子式为C2H6O,结构简式为CH3CH2OH。
材料二 银饰作为我国传统的一种首饰,一直以来都广受人们的喜爱。焊接银器、铜器时,表面会生成黑色的氧化膜,银匠说可以先把铜、银放在火上烧热,马上蘸一下酒精,铜、银会光亮如初。
[问题探究]
1.查阅资料知,溴更易溶于有机溶剂,所以可以用有机溶剂四氯化碳把溴从溴水中提取出来,乙醇也是一种有机溶剂,能否用乙醇把溴从溴水中提取出来,为什么?
提示:不能。四氯化碳和水不互溶,二者分层,溴在四氯化碳层;乙醇与水以任意比例互溶,二者不分层,故无法从溴水中提取溴。
2.符合分子式C2H6O的还有一种结构: (甲醚)。根据该结构
式分析,甲醚能否与钠反应生成H2,说明理由。
提示:不能。乙醇能和钠反应生成H2是因为其分子结构中含有羟基,羟基中的H较活泼,钠与羟基氢发生置换反应,但甲醚分子中无羟基,C—H键中的H不活泼,不能与钠发生反应。
3.材料二中发生了哪些反应?铜、银在反应中起到什么作用?
知识点一 乙醇与钠的反应
1.乙醇与钠的反应
(1)实验操作
(2)实验现象:钠粒位于试管的底部,有无色气体产生;验纯后点燃气体,火焰呈淡蓝色,干燥的烧杯内壁上有液滴生成;澄清石灰水不变浑浊。
(3)实验结论:钠的密度比乙醇的大,乙醇与钠反应产生氢气。
(4)化学方程式:2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑。
(5)反应实质:乙醇分子中羟基(—OH)上的氢原子被金属钠置换生成氢气,乙醇分子中的O—H键断裂。
2.乙醇与钠反应的相关结论
(1)密度关系:金属钠与乙醇反应时沉在乙醇的底部,而与水反应时浮在水面上,说明三者的密度关系为ρ水>ρ钠>ρ乙醇。
(2)氢原子的活泼性:钠与乙醇反应,是乙醇羟基上的氢原子被置换,而不是乙基上的氢原子被置换,即氢原子的活泼性顺序为羟基氢原子>烃基氢原子。乙醇与钠反应时没有熔化成小球,也没有发出声响,这说明乙醇分子中羟基氢原子不如水分子中的羟基氢原子活泼。
(3)数量关系:1 mol乙醇跟足量钠反应,产生0.5 mol H2,故羟基(—OH)与生成的氢气之间存在的数量关系为2—OH~H2。
1.某同学在试管中进行乙醇与钠反应的实验,下列关于其操作及实验现象的描述中正确的是( )
A.乙醇与钠反应时,钠熔化成闪亮的小球
B.做钠与乙醇反应的实验时,取出一小块钠,直接放入乙醇中
C.钠块开始沉于试管底部,最后慢慢消失
D.乙醇与钠的反应要比水与钠的反应剧烈
解析:由于乙醇与钠反应较慢,不会出现钠熔化成闪亮的小球这一现象,A错误;钠常保存在煤油中,在做钠与乙醇反应的实验时,必须用滤纸吸干钠表面的煤油,防止对实验造成干扰,B错误;乙醇分子中羟基氢原子没有水分子中的氢原子活泼,所以乙醇与钠的反应也没有钠与水的反应剧烈,D错误。
2.已知分子中含有羟基的物质都能与钠反应产生氢气。乙醇、乙二醇
( )、丙三醇( )分别与足量金属钠作用,产生等量的氢气。则
这三种醇的物质的量之比为( )
A.6∶3∶2 B.1∶2∶3
C.3∶2∶1 D.4∶3∶2
知识点二 乙醇的氧化反应
2.乙醇的催化氧化
(1)实验
①实验步骤:将弯成螺旋状的铜丝在酒精灯上烧至红热,迅速插入乙醇中,反复多次。
②实验现象:红色光亮的铜丝灼烧后变为黑色,趁热插入乙醇中,铜丝又变为红色。经过几次实验后,闻到试管中的液体有刺激性气味。
[注意] 与羟基相连的碳原子上有2个氢原子的醇(即含有—CH2OH结构),可被氧化为醛;与羟基相连的碳原子上有1个氢原子的醇(即含有 结构),可
被氧化为酮( ,R、R′代表烃基);与羟基相连的碳原子上无氢原子的醇不能被催化氧化。
3.乙醇可以被酸性KMnO4溶液或酸性K2Cr2O7溶液直接氧化为乙酸(CH3COOH)。
由以上反应不能得出的结论是( )
A.由反应①②可知,条件不同,乙醇与O2反应的产物不同
B.由反应②可知,Cu是乙醇氧化生成乙醛反应的催化剂
C.由反应①可知,乙醇燃烧时,碳碳键、碳氢键、氢氧键均断裂
D.由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
解析:由反应②可知,乙醇氧化为乙醛时,断开了氢氧键、碳氢键,不能得出D项的结论。
(1)实验过程中铜网出现红色和黑
色交替的现象,请写出对应的化学方程
式:______________________________
_________________________________________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇的催化氧化反应是________反应(填“吸热”或“放热”)。
放热
(2)甲和乙两个水浴的作用不相同。甲的作用是__________________________;乙的作用是_________________________。
(3)反应进行一段时间后,试管a中收
集到的物质是________________;集气瓶
中收集到的气体的主要成分是_______。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_______,要除去该物质,可先在混合液中加入____(填字母),然后再进行________即可(填操作名称)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
加热乙醇,便于乙醇的挥发
冷却乙醛,便于乙醛的收集
乙醛、乙醇、水
氮气
乙酸
c
蒸馏
解析:(4)乙醛可被氧化为乙酸,若试管a中收集到的液体可使紫色石蕊试纸变红,则试管a中应有乙酸。由于乙酸和乙醛互溶,所以可先将乙酸转化为乙酸盐,再进行蒸馏。
总结提升
本课总结
自我反思:﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍
随堂提升
2.比较乙烷和乙醇的分子结构,下列说法中错误的是( )
A.两个碳原子均以单键相连
B.分子里都含6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
3.下列物质中,分别加入金属钠,不能产生氢气的是( )
A.苯 B.蒸馏水
C.无水酒精 D.75%的酒精
4.下列说法正确的是( )
A.检测乙醇中是否含有水可加入少量的无水硫酸铜,如果变蓝则含水
B.除去乙醇中的微量水可加入金属钠,使其完全反应
C.获得无水乙醇的方法通常采用先用浓H2SO4吸水,然后再加热蒸馏的方法
D.获得无水乙醇的方法通常采用直接加热蒸馏的方法
解析:乙醇、水均能与金属钠反应,B错误;浓硫酸和乙醇混合加热,会发生化学反应,C错误;直接蒸馏时乙醇和水一起变为蒸气,难以得到无水乙醇,应先用新制生石灰吸水,再蒸馏,D错误。
5.已知乙醇在催化氧化反应中断裂的为如图所示的化学键:
试完成下列问题:
(1)如将乙醇改为 ,试写出在该条件下反应的化学方程式:
______________________________________________。
(2)如醇为 ,在该条件下,醇还能被催化氧化吗?为什么?_______ __________________________________________________________________。
不能,因为该分子中和羟基相连的碳原子上没有氢原子,不能被催化氧化
课时分层练
题号 1 2 3 4 5 6 7
难度 ★ ★ ★ ★ ★ ★ ★★
对点 乙醇的结构与性质 乙醇的物理性质 乙醇的结构与性质 乙醇的结构与性质 乙醇的催化氧化反应 醇的结构、性质等的比较 醇的催化氧化反应
题号 8 9 10 11 12 13
难度 ★ ★★ ★★ ★★★ ★★ ★★★
对点 乙醇性质的应用 钠与水和乙醇反应的比较 乙醇催化氧化反应的实验探究 乙醇燃烧反应的相关计算 乙醇分子结构的验证实验 乙醇催化氧化反应的探究
1.下列有关乙醇的说法正确的是( )
A.能与H2O发生加成反应 B.能使紫色石蕊试液变红
C.是食醋的主要成分 D.能使酸性高锰酸钾溶液褪色
解析:乙醇为饱和一元醇,不能发生加成反应,A错误;乙醇显中性,不能使紫色石蕊试液变红,B错误;食醋的主要成分是乙酸,C错误。
[学习·理解]
2.下列有关乙醇的物理性质的叙述不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑不同浓度的酒
D.由于乙醇容易挥发,所以才有俗语“酒好不怕巷子深”的说法
解析:乙醇的密度比水小,但可与水以任意比互溶,故除去乙醇中的水不能用分液的方法,应加入生石灰,然后蒸馏。
3.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说明不正确的是( )
A.和金属钠反应时键①断裂
B.在铜催化共热下与O2反应时断裂①和③
C.乙醇是电解质,在水中键①断裂电离出氢离子
D.在空气中完全燃烧时断裂①②③④⑤
4.下列说法能证明乙醇的结构是(Ⅱ)而不是(Ⅰ)的是( )
A.1 mol乙醇完全燃烧生成3 mol水
B.1 mol乙醇与足量钠反应生成
0.5 mol H2
C.乙醇易挥发
D.乙醇能与水以任意比互溶
5.某化学反应过程如图所示。下列判断错误的是( )
A.生成物M的分子式为C2H4O
B.乙醇发生了还原反应
C.铜是此反应过程中的催化剂
D.反应中有红黑交替变化的现象
6.如图所示的两种有机物都由碳、氢、氧三种元素组成,下列叙述不正确的是( )
A.①和②都含有官能团羟基
B.①和②具有相似的化学性质
C.①和②互为同系物
D.①和②所含氧元素的质量分数相同
解析:由球棍模型可知,①的结构简式为CH3CH2OH,②的结构简式为CH3CH2CH2OH,CH3CH2OH和CH3CH2CH2OH都含有1个氧原子,相对分子质量不同,则①和②所含氧元素的质量分数不同,D错误。
7.下列四种有机物的分子式都是C4H10O,其中不能被氧化为同碳原子数醛的是( )
A.①④ B.①②
C.②④ D.②③
解析:醇分子结构中含有—CH2OH结构的醇才能被催化氧化为醛,故选A。
8.酒后驾车是引发交通事故的重要原因之一。交警对驾驶员进行呼气酒精检测的原理是橙色的酸性K2Cr2O7溶液遇乙醇迅速生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇的沸点低 ②乙醇的密度比水小 ③乙醇有还原性 ④乙醇的组成中含有氧元素
A.②④ B.②③
C.①③ D.①④
[应用·实践]
9.下列有关金属钠在水中和乙醇中的反应情况对比,正确的是( )
A.钠能置换出水中所有的H,却只能置换出乙醇里羟基中的H
B.钠都要浮在水面上或乙醇液体表面
C.钠无论与水反应还是与乙醇反应都要放出热量
D.钠在乙醇中反应更剧烈,是因为乙醇分子中含有的氢原子比水分子中的多
解析:钠和水反应生成氢氧化钠和氢气,即不能置换出水中所有的H,A错误;钠的密度比水小,比乙醇大,钠沉在乙醇的底部,B错误;钠与水、乙醇的反应中钠都可逐渐熔化,都为放热反应,C正确;钠与水反应较为剧烈,D错误。
10.某同学设计如图装置进行乙醇氧化反应的探究
实验。下列有关说法不正确的是( )
A.热水的作用是促使乙醇挥发,为硬质玻璃管内
提供乙醇蒸气
B.通入乙醇蒸气反应的过程中,撤离酒精灯后反应能继续进行
D.实验结束时,先停止加热,再关闭活塞a、b,最后将导管移出水面
解析:实验结束时,要先将导管移出水面,后停止加热,否则易引起倒吸,D错误。
11.一定量的乙醇在不足量氧气中燃烧,得到CO2、CO和H2O(g)的混合气体,其质量为27.6 g,将所得混合气体通过盛有浓硫酸的洗气瓶,洗气瓶质量增加10.8 g,则CO的质量为( )
A.4.4 g B.2.2 g
C.1.4 g D.3.6 g
12.某校化学兴趣小组的学生为了验证乙醇的分子结构,设计如下实验程序:乙醇的组成元素的测定、分子式的测定、分子结构的测定。
(1)确定乙醇中含有C、H两种元素。简要说明其具体操作:
①证明含有氢元素的操作是__________________________________________
_____________________。
②证明含有碳元素的操作是__________________________________________
___________________________。
(2)要用燃烧分析产物证实乙醇中还含有氧元素时,需要取得一些实验数据,这些数据应该是____________________________________。
用一干燥的冷烧杯倒置在乙醇燃烧的火焰上方,烧杯内壁有水珠生成
将内壁涂有澄清石灰水的小烧杯倒置在乙醇燃烧的火焰上方,石灰水变浑浊
乙醇、二氧化碳及水三种物质的质量
(3)为测定乙醇的分子式,除(2)中数据外,还需不需要测定乙醇的相对分子质量?________。
(4)为测定乙醇分子结构,用无水
乙醇和金属钠反应收集氢气的方法,
选用了如图所示的仪器(有的仪器有双
孔橡皮塞)。
①装置的连接顺序是_____接_____接_____接_____接_____接_____。
②由实验证明乙醇的分子结构是CH3CH2OH而不是CH3OCH3的理由是__________________________________________________。
不需要
D
B
E
A
F
C
乙醇分子有一个H原子与其他H原子处于不同的位置
13.下图所示为某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中A试管盛有无水乙醇(沸点为78 ℃),B处为螺旋状的细铜丝,C处为无水硫酸铜粉末,干燥管D中盛有碱石灰,E为新制氢氧化铜碱性悬浊液,F为氧气的发生装
置。(已知:—CHO在加热条件下与新
制Cu(OH)2碱性悬浊液反应产生砖红色
沉淀)
(1)在实验过程中,需要加热的仪器(或区域)有_____________。(填仪器或区域的代号A~F)
[创新·提高]
A、B、E、F
(2)B处发生的反应的化学方程式为____________________________________
_______________________________________________________________________。
(3)C处应出现的现象是________________________,D处使用碱石灰的作用是____________________________________________,E处应出现的实验现象是__________________,F处可以添加的固体药品是________________________。
固体由白色变为蓝色
吸收水蒸气,以避免E中水进入C产生干扰
产生砖红色沉淀
高锰酸钾(合理即可)
(4)若本实验中去掉F装置(包括其带有的单孔塞和导管),同时将A试管处原来的双孔塞换成单孔塞用以保证装置的气密性,其他操作不变,则发现C处无明显变化,而E处除了依然有上述(3)中所出现的现象之外,还有气体不断地逸出。由
此推断此时B处发生反应的化学方程式为_________________________________。
0
专题8 有机化合物的获得与应用
第二单元 食品中的有机化合物
第一课时 乙醇
1.知道乙醇的组成、结构、物理性质及用途。2.了解官能团与性质的关系。3.掌握乙醇的化学性质。
学习理解
01
课时分层练
04
目录
CONTENTS
探究应用
02
总结提升
03
学习理解
一、乙醇
1.分子结构
(1)结构式: 。
(2)分子式:________。
(3)球棍模型: 。
(4)空间填充模型: 。
(5)结构简式:_____________________。
C2H6O
C2H5OH或C2H5—OH
2.物理性质
乙醇是无色、有特殊香味的液体,密度比水小,可与水以___________互溶,易挥发。
3.化学性质
(1)乙醇分子中_____________上的氢原子能被金属钠置换生成氢气,但反应比钠与水要___________。
乙醇与金属钠反应的化学方程式为_____________________________________。
任意比例
羟基(—OH)
缓慢得多
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
(2)乙醇在铜、银等催化剂的作用下可以被氧气氧化,生成具有特殊气味的乙
醛。化学方程式为______________________________________________________。
乙醛有较强的还原性。在适当条件下,乙醛可以进一步被氧气氧化生成乙酸,化学方程式为_________________________________。
4.用途
酒类饮料中均含有乙醇,医疗上常用体积分数为______的乙醇溶液进行消毒。
75%
二、官能团
1.概念:对物质_______起决定性作用的基团叫作官能团。
2.举例:乙醇分子的官能团是_______________,乙醛分子的官能团是_______________。
性质
羟基(—OH)
醛基(—CHO)
判断正误,正确的打“√”,错误的打“×”。
(1)乙醇的结构简式为C2H6O。( )
(2)医疗上用质量分数为75%的乙醇溶液消毒。( )
(3)向碘水中加入少量乙醇,振荡静置,上层液体呈紫色,下层液体无色。( )
(4)乙醇结构中有—OH,所以乙醇在水溶液中可以电离出OH-而显碱性。( )
(5)乙醇中的羟基氢比水中的羟基氢活泼。( )
(6)铜可以作乙醇催化氧化反应的催化剂。( )
(7)乙醇与钠反应可以产生氢气,所以乙醇显酸性。( )
×
×
×
×
×
√
×
探究应用
材料一 中国“酒文化”源远流长,早在几千年前,人们就掌握了发酵法酿酒的技术,各种酒类都含有浓度不等的乙醇,故乙醇俗称酒精。乙醇的分子式为C2H6O,结构简式为CH3CH2OH。
材料二 银饰作为我国传统的一种首饰,一直以来都广受人们的喜爱。焊接银器、铜器时,表面会生成黑色的氧化膜,银匠说可以先把铜、银放在火上烧热,马上蘸一下酒精,铜、银会光亮如初。
[问题探究]
1.查阅资料知,溴更易溶于有机溶剂,所以可以用有机溶剂四氯化碳把溴从溴水中提取出来,乙醇也是一种有机溶剂,能否用乙醇把溴从溴水中提取出来,为什么?
提示:不能。四氯化碳和水不互溶,二者分层,溴在四氯化碳层;乙醇与水以任意比例互溶,二者不分层,故无法从溴水中提取溴。
2.符合分子式C2H6O的还有一种结构: (甲醚)。根据该结构
式分析,甲醚能否与钠反应生成H2,说明理由。
提示:不能。乙醇能和钠反应生成H2是因为其分子结构中含有羟基,羟基中的H较活泼,钠与羟基氢发生置换反应,但甲醚分子中无羟基,C—H键中的H不活泼,不能与钠发生反应。
3.材料二中发生了哪些反应?铜、银在反应中起到什么作用?
知识点一 乙醇与钠的反应
1.乙醇与钠的反应
(1)实验操作
(2)实验现象:钠粒位于试管的底部,有无色气体产生;验纯后点燃气体,火焰呈淡蓝色,干燥的烧杯内壁上有液滴生成;澄清石灰水不变浑浊。
(3)实验结论:钠的密度比乙醇的大,乙醇与钠反应产生氢气。
(4)化学方程式:2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑。
(5)反应实质:乙醇分子中羟基(—OH)上的氢原子被金属钠置换生成氢气,乙醇分子中的O—H键断裂。
2.乙醇与钠反应的相关结论
(1)密度关系:金属钠与乙醇反应时沉在乙醇的底部,而与水反应时浮在水面上,说明三者的密度关系为ρ水>ρ钠>ρ乙醇。
(2)氢原子的活泼性:钠与乙醇反应,是乙醇羟基上的氢原子被置换,而不是乙基上的氢原子被置换,即氢原子的活泼性顺序为羟基氢原子>烃基氢原子。乙醇与钠反应时没有熔化成小球,也没有发出声响,这说明乙醇分子中羟基氢原子不如水分子中的羟基氢原子活泼。
(3)数量关系:1 mol乙醇跟足量钠反应,产生0.5 mol H2,故羟基(—OH)与生成的氢气之间存在的数量关系为2—OH~H2。
1.某同学在试管中进行乙醇与钠反应的实验,下列关于其操作及实验现象的描述中正确的是( )
A.乙醇与钠反应时,钠熔化成闪亮的小球
B.做钠与乙醇反应的实验时,取出一小块钠,直接放入乙醇中
C.钠块开始沉于试管底部,最后慢慢消失
D.乙醇与钠的反应要比水与钠的反应剧烈
解析:由于乙醇与钠反应较慢,不会出现钠熔化成闪亮的小球这一现象,A错误;钠常保存在煤油中,在做钠与乙醇反应的实验时,必须用滤纸吸干钠表面的煤油,防止对实验造成干扰,B错误;乙醇分子中羟基氢原子没有水分子中的氢原子活泼,所以乙醇与钠的反应也没有钠与水的反应剧烈,D错误。
2.已知分子中含有羟基的物质都能与钠反应产生氢气。乙醇、乙二醇
( )、丙三醇( )分别与足量金属钠作用,产生等量的氢气。则
这三种醇的物质的量之比为( )
A.6∶3∶2 B.1∶2∶3
C.3∶2∶1 D.4∶3∶2
知识点二 乙醇的氧化反应
2.乙醇的催化氧化
(1)实验
①实验步骤:将弯成螺旋状的铜丝在酒精灯上烧至红热,迅速插入乙醇中,反复多次。
②实验现象:红色光亮的铜丝灼烧后变为黑色,趁热插入乙醇中,铜丝又变为红色。经过几次实验后,闻到试管中的液体有刺激性气味。
[注意] 与羟基相连的碳原子上有2个氢原子的醇(即含有—CH2OH结构),可被氧化为醛;与羟基相连的碳原子上有1个氢原子的醇(即含有 结构),可
被氧化为酮( ,R、R′代表烃基);与羟基相连的碳原子上无氢原子的醇不能被催化氧化。
3.乙醇可以被酸性KMnO4溶液或酸性K2Cr2O7溶液直接氧化为乙酸(CH3COOH)。
由以上反应不能得出的结论是( )
A.由反应①②可知,条件不同,乙醇与O2反应的产物不同
B.由反应②可知,Cu是乙醇氧化生成乙醛反应的催化剂
C.由反应①可知,乙醇燃烧时,碳碳键、碳氢键、氢氧键均断裂
D.由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
解析:由反应②可知,乙醇氧化为乙醛时,断开了氢氧键、碳氢键,不能得出D项的结论。
(1)实验过程中铜网出现红色和黑
色交替的现象,请写出对应的化学方程
式:______________________________
_________________________________________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇的催化氧化反应是________反应(填“吸热”或“放热”)。
放热
(2)甲和乙两个水浴的作用不相同。甲的作用是__________________________;乙的作用是_________________________。
(3)反应进行一段时间后,试管a中收
集到的物质是________________;集气瓶
中收集到的气体的主要成分是_______。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_______,要除去该物质,可先在混合液中加入____(填字母),然后再进行________即可(填操作名称)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
加热乙醇,便于乙醇的挥发
冷却乙醛,便于乙醛的收集
乙醛、乙醇、水
氮气
乙酸
c
蒸馏
解析:(4)乙醛可被氧化为乙酸,若试管a中收集到的液体可使紫色石蕊试纸变红,则试管a中应有乙酸。由于乙酸和乙醛互溶,所以可先将乙酸转化为乙酸盐,再进行蒸馏。
总结提升
本课总结
自我反思:﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍
随堂提升
2.比较乙烷和乙醇的分子结构,下列说法中错误的是( )
A.两个碳原子均以单键相连
B.分子里都含6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
3.下列物质中,分别加入金属钠,不能产生氢气的是( )
A.苯 B.蒸馏水
C.无水酒精 D.75%的酒精
4.下列说法正确的是( )
A.检测乙醇中是否含有水可加入少量的无水硫酸铜,如果变蓝则含水
B.除去乙醇中的微量水可加入金属钠,使其完全反应
C.获得无水乙醇的方法通常采用先用浓H2SO4吸水,然后再加热蒸馏的方法
D.获得无水乙醇的方法通常采用直接加热蒸馏的方法
解析:乙醇、水均能与金属钠反应,B错误;浓硫酸和乙醇混合加热,会发生化学反应,C错误;直接蒸馏时乙醇和水一起变为蒸气,难以得到无水乙醇,应先用新制生石灰吸水,再蒸馏,D错误。
5.已知乙醇在催化氧化反应中断裂的为如图所示的化学键:
试完成下列问题:
(1)如将乙醇改为 ,试写出在该条件下反应的化学方程式:
______________________________________________。
(2)如醇为 ,在该条件下,醇还能被催化氧化吗?为什么?_______ __________________________________________________________________。
不能,因为该分子中和羟基相连的碳原子上没有氢原子,不能被催化氧化
课时分层练
题号 1 2 3 4 5 6 7
难度 ★ ★ ★ ★ ★ ★ ★★
对点 乙醇的结构与性质 乙醇的物理性质 乙醇的结构与性质 乙醇的结构与性质 乙醇的催化氧化反应 醇的结构、性质等的比较 醇的催化氧化反应
题号 8 9 10 11 12 13
难度 ★ ★★ ★★ ★★★ ★★ ★★★
对点 乙醇性质的应用 钠与水和乙醇反应的比较 乙醇催化氧化反应的实验探究 乙醇燃烧反应的相关计算 乙醇分子结构的验证实验 乙醇催化氧化反应的探究
1.下列有关乙醇的说法正确的是( )
A.能与H2O发生加成反应 B.能使紫色石蕊试液变红
C.是食醋的主要成分 D.能使酸性高锰酸钾溶液褪色
解析:乙醇为饱和一元醇,不能发生加成反应,A错误;乙醇显中性,不能使紫色石蕊试液变红,B错误;食醋的主要成分是乙酸,C错误。
[学习·理解]
2.下列有关乙醇的物理性质的叙述不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑不同浓度的酒
D.由于乙醇容易挥发,所以才有俗语“酒好不怕巷子深”的说法
解析:乙醇的密度比水小,但可与水以任意比互溶,故除去乙醇中的水不能用分液的方法,应加入生石灰,然后蒸馏。
3.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说明不正确的是( )
A.和金属钠反应时键①断裂
B.在铜催化共热下与O2反应时断裂①和③
C.乙醇是电解质,在水中键①断裂电离出氢离子
D.在空气中完全燃烧时断裂①②③④⑤
4.下列说法能证明乙醇的结构是(Ⅱ)而不是(Ⅰ)的是( )
A.1 mol乙醇完全燃烧生成3 mol水
B.1 mol乙醇与足量钠反应生成
0.5 mol H2
C.乙醇易挥发
D.乙醇能与水以任意比互溶
5.某化学反应过程如图所示。下列判断错误的是( )
A.生成物M的分子式为C2H4O
B.乙醇发生了还原反应
C.铜是此反应过程中的催化剂
D.反应中有红黑交替变化的现象
6.如图所示的两种有机物都由碳、氢、氧三种元素组成,下列叙述不正确的是( )
A.①和②都含有官能团羟基
B.①和②具有相似的化学性质
C.①和②互为同系物
D.①和②所含氧元素的质量分数相同
解析:由球棍模型可知,①的结构简式为CH3CH2OH,②的结构简式为CH3CH2CH2OH,CH3CH2OH和CH3CH2CH2OH都含有1个氧原子,相对分子质量不同,则①和②所含氧元素的质量分数不同,D错误。
7.下列四种有机物的分子式都是C4H10O,其中不能被氧化为同碳原子数醛的是( )
A.①④ B.①②
C.②④ D.②③
解析:醇分子结构中含有—CH2OH结构的醇才能被催化氧化为醛,故选A。
8.酒后驾车是引发交通事故的重要原因之一。交警对驾驶员进行呼气酒精检测的原理是橙色的酸性K2Cr2O7溶液遇乙醇迅速生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇的沸点低 ②乙醇的密度比水小 ③乙醇有还原性 ④乙醇的组成中含有氧元素
A.②④ B.②③
C.①③ D.①④
[应用·实践]
9.下列有关金属钠在水中和乙醇中的反应情况对比,正确的是( )
A.钠能置换出水中所有的H,却只能置换出乙醇里羟基中的H
B.钠都要浮在水面上或乙醇液体表面
C.钠无论与水反应还是与乙醇反应都要放出热量
D.钠在乙醇中反应更剧烈,是因为乙醇分子中含有的氢原子比水分子中的多
解析:钠和水反应生成氢氧化钠和氢气,即不能置换出水中所有的H,A错误;钠的密度比水小,比乙醇大,钠沉在乙醇的底部,B错误;钠与水、乙醇的反应中钠都可逐渐熔化,都为放热反应,C正确;钠与水反应较为剧烈,D错误。
10.某同学设计如图装置进行乙醇氧化反应的探究
实验。下列有关说法不正确的是( )
A.热水的作用是促使乙醇挥发,为硬质玻璃管内
提供乙醇蒸气
B.通入乙醇蒸气反应的过程中,撤离酒精灯后反应能继续进行
D.实验结束时,先停止加热,再关闭活塞a、b,最后将导管移出水面
解析:实验结束时,要先将导管移出水面,后停止加热,否则易引起倒吸,D错误。
11.一定量的乙醇在不足量氧气中燃烧,得到CO2、CO和H2O(g)的混合气体,其质量为27.6 g,将所得混合气体通过盛有浓硫酸的洗气瓶,洗气瓶质量增加10.8 g,则CO的质量为( )
A.4.4 g B.2.2 g
C.1.4 g D.3.6 g
12.某校化学兴趣小组的学生为了验证乙醇的分子结构,设计如下实验程序:乙醇的组成元素的测定、分子式的测定、分子结构的测定。
(1)确定乙醇中含有C、H两种元素。简要说明其具体操作:
①证明含有氢元素的操作是__________________________________________
_____________________。
②证明含有碳元素的操作是__________________________________________
___________________________。
(2)要用燃烧分析产物证实乙醇中还含有氧元素时,需要取得一些实验数据,这些数据应该是____________________________________。
用一干燥的冷烧杯倒置在乙醇燃烧的火焰上方,烧杯内壁有水珠生成
将内壁涂有澄清石灰水的小烧杯倒置在乙醇燃烧的火焰上方,石灰水变浑浊
乙醇、二氧化碳及水三种物质的质量
(3)为测定乙醇的分子式,除(2)中数据外,还需不需要测定乙醇的相对分子质量?________。
(4)为测定乙醇分子结构,用无水
乙醇和金属钠反应收集氢气的方法,
选用了如图所示的仪器(有的仪器有双
孔橡皮塞)。
①装置的连接顺序是_____接_____接_____接_____接_____接_____。
②由实验证明乙醇的分子结构是CH3CH2OH而不是CH3OCH3的理由是__________________________________________________。
不需要
D
B
E
A
F
C
乙醇分子有一个H原子与其他H原子处于不同的位置
13.下图所示为某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中A试管盛有无水乙醇(沸点为78 ℃),B处为螺旋状的细铜丝,C处为无水硫酸铜粉末,干燥管D中盛有碱石灰,E为新制氢氧化铜碱性悬浊液,F为氧气的发生装
置。(已知:—CHO在加热条件下与新
制Cu(OH)2碱性悬浊液反应产生砖红色
沉淀)
(1)在实验过程中,需要加热的仪器(或区域)有_____________。(填仪器或区域的代号A~F)
[创新·提高]
A、B、E、F
(2)B处发生的反应的化学方程式为____________________________________
_______________________________________________________________________。
(3)C处应出现的现象是________________________,D处使用碱石灰的作用是____________________________________________,E处应出现的实验现象是__________________,F处可以添加的固体药品是________________________。
固体由白色变为蓝色
吸收水蒸气,以避免E中水进入C产生干扰
产生砖红色沉淀
高锰酸钾(合理即可)
(4)若本实验中去掉F装置(包括其带有的单孔塞和导管),同时将A试管处原来的双孔塞换成单孔塞用以保证装置的气密性,其他操作不变,则发现C处无明显变化,而E处除了依然有上述(3)中所出现的现象之外,还有气体不断地逸出。由
此推断此时B处发生反应的化学方程式为_________________________________。
