9.1 金属的冶炼方法 课件 (共61张PPT)
文档属性
| 名称 | 9.1 金属的冶炼方法 课件 (共61张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-21 20:32:02 | ||
图片预览











文档简介
(共61张PPT)
0
专题9 金属与人类文明
第一单元 金属的冶炼方法
1.能从物质性质与反应条件角度解释不同金属冶炼方法的差异,会写相关的化学方程式。2.认识我国古代文明与金属冶炼的关系。3.感受物质制备中的化学思想。
学习理解
01
课时分层练
04
目录
CONTENTS
探究应用
02
总结提升
03
学习理解
一、金属的存在形式
1.一般而言,活动性较强的金属,在自然界中以________存在;活动性较弱的金属,有可能以________形式存在,如:金。有的金属元素能以游离态和化合态存在,如:_____、_____元素等。
2.金属越_______,人类开发、利用的越晚。
二、金属的冶炼
1.定义:利用化学反应使金属元素从______态变为______态的过程称为金属冶炼。
化合态
游离态
铁
银
活泼
化合
游离
2.金属冶炼方法
(1)热分解法
适合冶炼_________金属,如通过加热氧化银(Ag2O)来制备金属银,化学方程式为_______________________。
(2)高温还原法
适合冶炼金属活动性顺序表中锌到铜之间的大多数金属,常用的还原剂有_________________________等。
不活泼
C、CO、H2和活泼金属
较活泼
铁矿石、焦炭、石灰石
CO
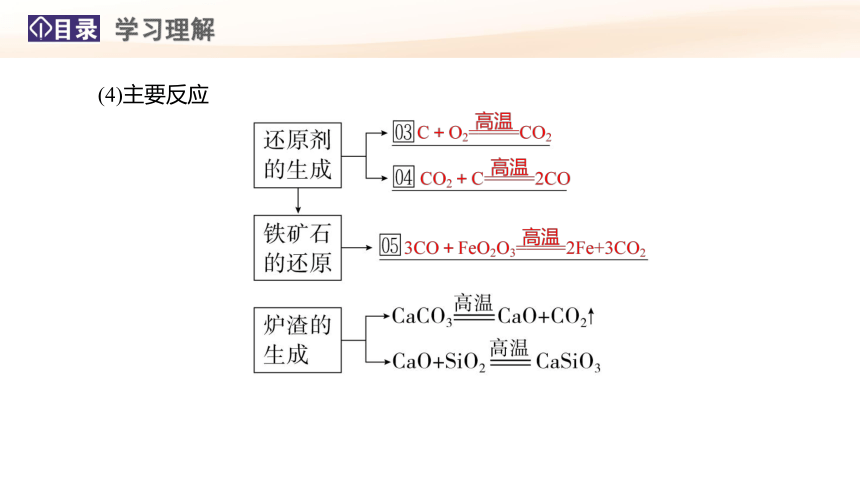
(4)主要反应
4.铝热反应
(1)概念:铝粉与某些______________在高温条件下的反应。
(2)铝热剂:铝粉与某些难熔的______________以__________形成的混合物。
(3)反应方程式(如与Fe2O3):_____________________________。
(4)反应特点:反应_______大量的热,生成氧化铝和相应的金属。
(5)应用:焊接钢轨、冶炼熔点_______的金属(如钒、铬、锰等)。
金属氧化物
金属氧化物
一定比例
放出
较高
5.铝的冶炼
(1)工艺流程
Al2O3+2NaOH===2NaAlO2+H2O
NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
判断正误,正确的打“√”,错误的打“×”。
(1)化合态的金属元素被还原时,一定得到相应的金属单质。( )
(2)铜是人类使用和开发比较早的金属之一。( )
(3)Na、K等活泼金属可用CO还原法冶炼。( )
(4)Al与MgO也能发生铝热反应。( )
(5)铁元素只以化合态形式存在于矿石中。( )
(6)铝热剂是指铝和氧化铁的混合物。( )
×
√
×
×
×
×
探究应用
素材1 古代炼丹术士葛洪所著《抱朴子》中记载:“丹砂烧之成水银。”
素材2 唐代诗人刘禹锡在《浪淘沙九首》中有云:“美人首饰侯王印,尽是沙中浪底来。”
素材3 北宋科学家沈括在《梦溪笔谈》中写道:“信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。烹胆矾则成铜;熬胆矾铁釜,久之亦化为铜。”
素材4 当铁轨有缝隙时,维修工人常将铝粉与氧化铁的混合物点燃,让熔融的铁水流入铁轨的缝隙,冷却后就将铁轨牢牢地黏在一起。
[问题探究]
1.以上素材中涉及了哪些金属的冶炼?写出相关的化学方程式。
2.人类使用金属的年代先后顺序与金属的活动性有什么关系?
提示:金属冶炼方法的选择取决于金属在自然界中的存在状态和金属的活动性。金属越活泼,冶炼时所需条件要求越高,在人类历史上出现相对晚一些。金属越不活泼,冶炼的方法越简单,人们使用的时间越早,所以有青铜、铁器等时代的发展历程。
3.为什么冶炼镁时不能使用MgO,冶炼铝时不能使用AlCl3
提示:因为氧化镁熔点太高,不易熔化,而氯化镁熔点低,易熔化且熔化后易电离出自由移动的阴、阳离子,所以用氯化镁;氯化铝是共价化合物,熔化时不能电离出自由移动的阴、阳离子,所以不能使用,只能用熔点较高的氧化铝。
知识点一 金属的冶炼
1.金属的冶炼原理
金属冶炼的实质是使金属化合物中的金属阳离子得到电子被还原为金属单质的过程,即:Mn++ne-===M。
2.金属活动性顺序与金属冶炼方法的关系
金属的活动性顺序 K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属原子失电子能力 强→弱
金属阳离子得电子能力 弱→强
主要冶炼方法 电解法 热还原法 热分解法 物理方法(富集法)
(4)湿法冶金
湿法冶金就是利用溶液中发生的化学反应(如置换、氧化还原、中和、水解反应等)对原料中的金属进行提取和分离的冶炼过程,可用于提取锌、铀及稀土金属等。例如:西汉时期,刘安在《淮南万毕术》中记载“曾青得铁则化为铜”:Fe+CuSO4===Cu+FeSO4,宋朝时,湿法冶金已被广泛使用。
(5)富集法
由于Pt、Au在自然界中多以游离态的形式存在,经多次淘洗去掉矿粒、泥沙等杂质,便可得到Pt、Au。
1.金属锂是密度最小的金属,等质量的不同金属,锂可以释放出更多的电子,故常用来制造高性能电池。已知锂的金属性介于钠和镁之间,则冶炼金属锂应采用的方法是( )
A.电解法 B.高温还原法
C.热分解法 D.铝热法
2.下表中金属的冶炼原理与方法不完全正确的是( )
知识点二 铝热反应
1.实验探究
实验装置
2.注意事项
(1)镁条要打磨净表面的氧化膜,否则难以点燃;氧化铁粉末与铝粉要选择干燥的;铝粉要用没有被氧化的,否则反应难以进行。
(2)氧化铁粉末与铝粉两者要混合均匀,以保证氧化铁与铝都完全反应。
(3)内层滤纸要用水润湿,以防纸漏斗燃烧。
(4)蒸发皿中的细沙要适量,既要防止蒸发皿炸裂,又要防止熔融的液体溅出伤人。
(5)铝热反应中镁条作引燃剂,KClO3作助燃剂。
3.等物质的量的铝与足量的下列物质进行铝热反应,制得金属的物质的量最少的是( )
A.MnO2 B.Fe3O4
C.Cr2O3 D.V2O5
解析:根据得失电子守恒,转移等量电子时,金属氧化物中金属元素价态越高,其发生铝热反应时得到的金属越少。
4.用如图所示装置进行铝热反应:
观察发生的现象,回答下列问题:
(1)写出该反应的化学方程式:____________________________,在该反应中________是氧化剂,_____是还原剂。
(2)某同学为研究该实验,查阅有关资料得到如表数据:
Fe2O3
Al
①该同学推测,铝热反应所得到的熔融物是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?_______(填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用的试剂是________________,反应的离子方程式为________________ ____________________________________。
合理
氢氧化钠溶液
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2054 1535 1462
沸点/℃ 2467 2980 2750 —
总结提升
本课总结
自我反思:﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍
随堂提升
1.下列叙述正确的是( )
A.所有金属元素都只存在于地壳中
B.铁元素主要以化合态存在于自然界
C.常温下所有的金属都是固态
D.金属元素大多数以游离态存在于自然界
2.下列关于工业上冶炼铝的叙述中正确的是( )
A.既可以电解熔融的氯化铝,也可以电解熔融的氧化铝来冶炼铝
B.既可以电解熔融的氧化铝,也可以用氢气或一氧化碳还原氧化铝来冶炼铝
C.美国化学家霍尔在氧化铝中添加冰晶石,冰晶石的作用是催化剂,加快电解反应速率
D.熔融的氧化铝电离出Al3+和O2-,通电后,Al3+得电子被还原,O2-失电子被氧化
解析:AlCl3是共价化合物,其熔融状态不导电(氯化铝还易升华);Al的还原性强,Al2O3不能被H2或CO还原;冰晶石(Na3AlF6)作助熔剂,使氧化铝熔融温度降低,从而减少冶炼过程中的能量消耗,故A、B、C均错误。
3.下列关于金属冶炼的说法正确的是( )
A.金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活动性决定
B.铜的湿法冶炼是将金属钠投入CuSO4溶液中,从而置换出铜
C.铁通常采用高温还原法冶炼,加入石灰石的目的是除去过量的碳
D.用海水为原料制得精盐,再电解纯净的NaCl溶液可制得金属钠
解析:B项,湿法炼铜是用铁置换出铜;C项,炼铁中加入石灰石是为了除去二氧化硅杂质,且能防止生成SO2污染空气;D项,工业上电解熔融的NaCl来制取Na。
4.铝热反应有广泛的用途,实验装置如
图甲所示。下列说法正确的是( )
A.铝热反应的能量变化可用图乙表示
B.工业上可用铝热反应的方法提取镁
C.在铝热反应过程中没有涉及的化学反
应类型是化合反应
解析:铝热反应是放热反应,则反应物
的总能量高于生成物的总能量,符合图乙中
能量变化,A正确;镁的活泼性大于铝,不能
用铝热反应的方法提取镁,B错误;铝热反应
过程中,Mg与O2发生化合反应生成MgO,C错误;氧化铁是Fe2O3而不是Fe3O4,D错误。
5.请写出冶炼下列金属的化学方程式。
(1)加热氧化汞制单质汞:_______________________。
(2)在高温下,一氧化碳与氧化铁反应可以制得金属铁:_______________ ____________________________。
(3)湿法炼铜(将铁加入硫酸铜溶液中):__________________________。
(4)电解熔融氯化钠制得金属钠:____________________________。
Fe+CuSO4===FeSO4+Cu
课时分层练
题号 1 2 3 4 5 6 7
难度 ★ ★ ★ ★ ★ ★ ★
对点 金属的冶炼方法 金属的存在形式 金属的冶炼原理 金属的冶炼原理 铝热 反应 金属的冶炼方法 金属的性质、铁的冶炼
题号 8 9 10 11 12 13 14
难度 ★ ★ ★★ ★★ ★★ ★★ ★★★
对点 铝的冶炼 钛的 冶炼 铜的冶炼 金属的冶炼 铝热反应及铝热剂成分的判断 铜矿石中提取铜的实验探究 铝土矿冶炼铝的工艺流程及相关知识
1.《天工开物》中描述“共煅五个时辰,其中砂末尽化为汞,布于满釜”。下列金属的冶炼方法与此相同的是( )
A.钠 B.铝
C.银 D.铁
[学习·理解]
2.下列关于金属在自然界中存在形态的说法不正确的是( )
A.地壳中含量最高的金属是铁,其次是铝
B.铝在自然界中主要存在于铝土矿(主要成分是氧化铝)中
C.铁主要存在于铁矿石(磁铁矿、赤铁矿、菱铁矿等)中
D.金、铂等不活泼的金属以游离态形式存在
3.下列说法不正确的是( )
A.有些活泼金属如铝可作高温还原法的还原剂
B.可以通过加热Ag2O的方法制取金属银
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收废旧金属可以重新制成金属或它们的化合物
4.下列化工生产原理错误的是( )
①可以用电解熔融氯化钠的方法来制取金属钠 ②可以将钠加入氯化镁饱和溶液中制取镁 ③用电解法冶炼铝时,原料是氯化铝 ④炼铁高炉中所发生的反应都是放热的,故无需加热
A.②③ B.①④ C.①②③ D.②③④
5.利用如图装置做铝热反应实验,下列说法不正确的是( )
B.该反应会产生高温、发出强光
C.根据铝热反应的原理,可以冶炼某些高熔点的金属
D.若反应中转移3 mol电子,则消耗氧化剂的物质的
量是1 mol
6.下列关于金属冶炼的叙述正确的是( )
A.工业上可利用铝热反应大量冶炼金属铁
B.钠、铝和铜都可用高温还原法制备
C.用铝粉还原磁铁矿得到9 mol铁时转移24 mol e-
D.电解饱和氯化镁溶液可得金属镁
解析:用铝热反应大量冶炼金属铁的经济效益差,A错误;钠、铝用电解法制备,B错误;电解熔融MgCl2可制得金属镁,D错误。
7.金属与人类生活和社会发展的关系非常密切。
(1)如图表示金属活动性顺序表中铜、铁和铝元素被人类大规模开发、利用的大致年限。
图中信息可以说明:铜、铁和铝的金属活动性强弱与人类开发、利用它们的时间先后的关系是____________________________________________。金属铬(Cr)能溶解在热的盐酸中,放出H2,同时生成CrCl2,预测:铬____(填“能”或“不能”)与硫酸铜溶液反应,理由是____________________________________________。
金属的活动性越弱,人类开发利用它的时间越早
能
铬排在氢前,而铜排在氢后,铬的活动性大于铜
CO2
8.下列有关铝土矿中提炼铝的说法不正确的是( )
A.铝土矿中的铝元素是以化合态形式存在的,需用化学方法把铝元素变成游离态
B.提炼过程中,先将铝土矿净化提取氧化铝,再进行冶炼
C.在NaAlO2溶液中通入过量CO2可得到Al(OH)3沉淀和Na2CO3溶液
D.冶炼铝的方法同工业冶炼钠、镁相似,可用电解法
解析:在NaAlO2溶液中通入过量CO2可得到Al(OH)3沉淀和NaHCO3溶液。
[应用·实践]
针对以上五个反应,下列叙述错误的是( )
A.反应①是非氧化还原反应
B.反应②生成了两种酸
C.反应④中的TiO2是氧化剂
D.反应⑤表现了金属镁比金属钛的还原性强
解析:反应④中钛元素和氧元素化合价未发生改变,Cl2是氧化剂,C错误。
11.不同的金属在冶炼方法上也有所不同,下列说法正确的是( )
A.钒、铬、锰、铁等难熔金属通常采用铝热法炼制
B.炼铁是采用氧化剂将铁从其化合物中氧化出来的方法
C.由于钠、镁、铝等金属化学性质太活泼,人们通常采用电解熔融状态下的氯化物的方式来获取其金属单质
D.炼铁时加入的焦炭除了提供热量外,还用来制造还原剂一氧化碳
解析:铁用CO还原法炼制,用铝热法炼制成本太高,A错误;炼铁是采用还原剂将铁从其化合物中还原出来的方法,B错误;AlCl3是共价化合物,其熔融态不导电,工业上用电解熔融Al2O3的方法制取铝,C错误。
12.实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质18 g,则该氧化物粉末可能是( )
A.Fe2O3和MnO2 B.MnO2和V2O5
C.Cr2O3和V2O5 D.MnO2和Cr2O3
13.孔雀石的主要成分为CuCO3·Cu(OH)2,某同学设计从孔雀石中冶炼金属铜的方案如下:
①将孔雀石粉碎后加过量的稀硫酸;②将反应后的混合物过滤;
③向滤液中加入一种金属粉末。
根据上述实验方案,试回答:
(1)第①步反应中的现象为_________________________________________。
(2)第③步加入的金属粉末是____,理由是______________________________
______________________。
(3)若向滤液中加入过量生石灰后,过滤,将沉淀加热灼烧后再通入________ ____________气体,可制得较纯净的铜。
固体溶解,有无色气体生成,溶液变成蓝色
Fe
铁的活泼性比铜强,可从溶液中置换出铜(合理即可)
氢气(答案合理即可)
14.铝土矿(主要成分Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料,工业上提取铝的工艺流程如下:
(1)试剂a的化学式为________。
(2)步骤③中通入过量CO2,产生沉淀C的离子方程式为___________________
______________________________________。
[创新·提高]
NaOH
(3)步骤③中通入过量CO2气体而不加入过量盐酸的理由是________________ ______。
(4)Al2O3中所含化学键的类型为________。
(5)工业上用电解熔融Al2O3的方法制备金属铝,化学方程式为_____________
_____________________________。
Al(OH)3溶于过量盐酸
离子键
解析:铝土矿的主要成分为Al2O3,还含有SiO2、Fe2O3等,步骤①中加入过量稀盐酸溶解,SiO2不反应,过滤后得到的沉淀A为SiO2。滤液甲中含有AlCl3、FeCl3、HCl等,步骤②中加入的过量试剂a为NaOH溶液,AlCl3转化为NaAlO2,FeCl3则生成Fe(OH)3沉淀,故过滤后的沉淀B为Fe(OH)3。滤液乙中含有NaAlO2、NaOH等,步骤③中通入过量CO2,NaAlO2转化为Al(OH)3沉淀。
0
专题9 金属与人类文明
第一单元 金属的冶炼方法
1.能从物质性质与反应条件角度解释不同金属冶炼方法的差异,会写相关的化学方程式。2.认识我国古代文明与金属冶炼的关系。3.感受物质制备中的化学思想。
学习理解
01
课时分层练
04
目录
CONTENTS
探究应用
02
总结提升
03
学习理解
一、金属的存在形式
1.一般而言,活动性较强的金属,在自然界中以________存在;活动性较弱的金属,有可能以________形式存在,如:金。有的金属元素能以游离态和化合态存在,如:_____、_____元素等。
2.金属越_______,人类开发、利用的越晚。
二、金属的冶炼
1.定义:利用化学反应使金属元素从______态变为______态的过程称为金属冶炼。
化合态
游离态
铁
银
活泼
化合
游离
2.金属冶炼方法
(1)热分解法
适合冶炼_________金属,如通过加热氧化银(Ag2O)来制备金属银,化学方程式为_______________________。
(2)高温还原法
适合冶炼金属活动性顺序表中锌到铜之间的大多数金属,常用的还原剂有_________________________等。
不活泼
C、CO、H2和活泼金属
较活泼
铁矿石、焦炭、石灰石
CO
(4)主要反应
4.铝热反应
(1)概念:铝粉与某些______________在高温条件下的反应。
(2)铝热剂:铝粉与某些难熔的______________以__________形成的混合物。
(3)反应方程式(如与Fe2O3):_____________________________。
(4)反应特点:反应_______大量的热,生成氧化铝和相应的金属。
(5)应用:焊接钢轨、冶炼熔点_______的金属(如钒、铬、锰等)。
金属氧化物
金属氧化物
一定比例
放出
较高
5.铝的冶炼
(1)工艺流程
Al2O3+2NaOH===2NaAlO2+H2O
NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
判断正误,正确的打“√”,错误的打“×”。
(1)化合态的金属元素被还原时,一定得到相应的金属单质。( )
(2)铜是人类使用和开发比较早的金属之一。( )
(3)Na、K等活泼金属可用CO还原法冶炼。( )
(4)Al与MgO也能发生铝热反应。( )
(5)铁元素只以化合态形式存在于矿石中。( )
(6)铝热剂是指铝和氧化铁的混合物。( )
×
√
×
×
×
×
探究应用
素材1 古代炼丹术士葛洪所著《抱朴子》中记载:“丹砂烧之成水银。”
素材2 唐代诗人刘禹锡在《浪淘沙九首》中有云:“美人首饰侯王印,尽是沙中浪底来。”
素材3 北宋科学家沈括在《梦溪笔谈》中写道:“信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。烹胆矾则成铜;熬胆矾铁釜,久之亦化为铜。”
素材4 当铁轨有缝隙时,维修工人常将铝粉与氧化铁的混合物点燃,让熔融的铁水流入铁轨的缝隙,冷却后就将铁轨牢牢地黏在一起。
[问题探究]
1.以上素材中涉及了哪些金属的冶炼?写出相关的化学方程式。
2.人类使用金属的年代先后顺序与金属的活动性有什么关系?
提示:金属冶炼方法的选择取决于金属在自然界中的存在状态和金属的活动性。金属越活泼,冶炼时所需条件要求越高,在人类历史上出现相对晚一些。金属越不活泼,冶炼的方法越简单,人们使用的时间越早,所以有青铜、铁器等时代的发展历程。
3.为什么冶炼镁时不能使用MgO,冶炼铝时不能使用AlCl3
提示:因为氧化镁熔点太高,不易熔化,而氯化镁熔点低,易熔化且熔化后易电离出自由移动的阴、阳离子,所以用氯化镁;氯化铝是共价化合物,熔化时不能电离出自由移动的阴、阳离子,所以不能使用,只能用熔点较高的氧化铝。
知识点一 金属的冶炼
1.金属的冶炼原理
金属冶炼的实质是使金属化合物中的金属阳离子得到电子被还原为金属单质的过程,即:Mn++ne-===M。
2.金属活动性顺序与金属冶炼方法的关系
金属的活动性顺序 K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属原子失电子能力 强→弱
金属阳离子得电子能力 弱→强
主要冶炼方法 电解法 热还原法 热分解法 物理方法(富集法)
(4)湿法冶金
湿法冶金就是利用溶液中发生的化学反应(如置换、氧化还原、中和、水解反应等)对原料中的金属进行提取和分离的冶炼过程,可用于提取锌、铀及稀土金属等。例如:西汉时期,刘安在《淮南万毕术》中记载“曾青得铁则化为铜”:Fe+CuSO4===Cu+FeSO4,宋朝时,湿法冶金已被广泛使用。
(5)富集法
由于Pt、Au在自然界中多以游离态的形式存在,经多次淘洗去掉矿粒、泥沙等杂质,便可得到Pt、Au。
1.金属锂是密度最小的金属,等质量的不同金属,锂可以释放出更多的电子,故常用来制造高性能电池。已知锂的金属性介于钠和镁之间,则冶炼金属锂应采用的方法是( )
A.电解法 B.高温还原法
C.热分解法 D.铝热法
2.下表中金属的冶炼原理与方法不完全正确的是( )
知识点二 铝热反应
1.实验探究
实验装置
2.注意事项
(1)镁条要打磨净表面的氧化膜,否则难以点燃;氧化铁粉末与铝粉要选择干燥的;铝粉要用没有被氧化的,否则反应难以进行。
(2)氧化铁粉末与铝粉两者要混合均匀,以保证氧化铁与铝都完全反应。
(3)内层滤纸要用水润湿,以防纸漏斗燃烧。
(4)蒸发皿中的细沙要适量,既要防止蒸发皿炸裂,又要防止熔融的液体溅出伤人。
(5)铝热反应中镁条作引燃剂,KClO3作助燃剂。
3.等物质的量的铝与足量的下列物质进行铝热反应,制得金属的物质的量最少的是( )
A.MnO2 B.Fe3O4
C.Cr2O3 D.V2O5
解析:根据得失电子守恒,转移等量电子时,金属氧化物中金属元素价态越高,其发生铝热反应时得到的金属越少。
4.用如图所示装置进行铝热反应:
观察发生的现象,回答下列问题:
(1)写出该反应的化学方程式:____________________________,在该反应中________是氧化剂,_____是还原剂。
(2)某同学为研究该实验,查阅有关资料得到如表数据:
Fe2O3
Al
①该同学推测,铝热反应所得到的熔融物是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?_______(填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用的试剂是________________,反应的离子方程式为________________ ____________________________________。
合理
氢氧化钠溶液
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2054 1535 1462
沸点/℃ 2467 2980 2750 —
总结提升
本课总结
自我反思:﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍﹍
随堂提升
1.下列叙述正确的是( )
A.所有金属元素都只存在于地壳中
B.铁元素主要以化合态存在于自然界
C.常温下所有的金属都是固态
D.金属元素大多数以游离态存在于自然界
2.下列关于工业上冶炼铝的叙述中正确的是( )
A.既可以电解熔融的氯化铝,也可以电解熔融的氧化铝来冶炼铝
B.既可以电解熔融的氧化铝,也可以用氢气或一氧化碳还原氧化铝来冶炼铝
C.美国化学家霍尔在氧化铝中添加冰晶石,冰晶石的作用是催化剂,加快电解反应速率
D.熔融的氧化铝电离出Al3+和O2-,通电后,Al3+得电子被还原,O2-失电子被氧化
解析:AlCl3是共价化合物,其熔融状态不导电(氯化铝还易升华);Al的还原性强,Al2O3不能被H2或CO还原;冰晶石(Na3AlF6)作助熔剂,使氧化铝熔融温度降低,从而减少冶炼过程中的能量消耗,故A、B、C均错误。
3.下列关于金属冶炼的说法正确的是( )
A.金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活动性决定
B.铜的湿法冶炼是将金属钠投入CuSO4溶液中,从而置换出铜
C.铁通常采用高温还原法冶炼,加入石灰石的目的是除去过量的碳
D.用海水为原料制得精盐,再电解纯净的NaCl溶液可制得金属钠
解析:B项,湿法炼铜是用铁置换出铜;C项,炼铁中加入石灰石是为了除去二氧化硅杂质,且能防止生成SO2污染空气;D项,工业上电解熔融的NaCl来制取Na。
4.铝热反应有广泛的用途,实验装置如
图甲所示。下列说法正确的是( )
A.铝热反应的能量变化可用图乙表示
B.工业上可用铝热反应的方法提取镁
C.在铝热反应过程中没有涉及的化学反
应类型是化合反应
解析:铝热反应是放热反应,则反应物
的总能量高于生成物的总能量,符合图乙中
能量变化,A正确;镁的活泼性大于铝,不能
用铝热反应的方法提取镁,B错误;铝热反应
过程中,Mg与O2发生化合反应生成MgO,C错误;氧化铁是Fe2O3而不是Fe3O4,D错误。
5.请写出冶炼下列金属的化学方程式。
(1)加热氧化汞制单质汞:_______________________。
(2)在高温下,一氧化碳与氧化铁反应可以制得金属铁:_______________ ____________________________。
(3)湿法炼铜(将铁加入硫酸铜溶液中):__________________________。
(4)电解熔融氯化钠制得金属钠:____________________________。
Fe+CuSO4===FeSO4+Cu
课时分层练
题号 1 2 3 4 5 6 7
难度 ★ ★ ★ ★ ★ ★ ★
对点 金属的冶炼方法 金属的存在形式 金属的冶炼原理 金属的冶炼原理 铝热 反应 金属的冶炼方法 金属的性质、铁的冶炼
题号 8 9 10 11 12 13 14
难度 ★ ★ ★★ ★★ ★★ ★★ ★★★
对点 铝的冶炼 钛的 冶炼 铜的冶炼 金属的冶炼 铝热反应及铝热剂成分的判断 铜矿石中提取铜的实验探究 铝土矿冶炼铝的工艺流程及相关知识
1.《天工开物》中描述“共煅五个时辰,其中砂末尽化为汞,布于满釜”。下列金属的冶炼方法与此相同的是( )
A.钠 B.铝
C.银 D.铁
[学习·理解]
2.下列关于金属在自然界中存在形态的说法不正确的是( )
A.地壳中含量最高的金属是铁,其次是铝
B.铝在自然界中主要存在于铝土矿(主要成分是氧化铝)中
C.铁主要存在于铁矿石(磁铁矿、赤铁矿、菱铁矿等)中
D.金、铂等不活泼的金属以游离态形式存在
3.下列说法不正确的是( )
A.有些活泼金属如铝可作高温还原法的还原剂
B.可以通过加热Ag2O的方法制取金属银
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收废旧金属可以重新制成金属或它们的化合物
4.下列化工生产原理错误的是( )
①可以用电解熔融氯化钠的方法来制取金属钠 ②可以将钠加入氯化镁饱和溶液中制取镁 ③用电解法冶炼铝时,原料是氯化铝 ④炼铁高炉中所发生的反应都是放热的,故无需加热
A.②③ B.①④ C.①②③ D.②③④
5.利用如图装置做铝热反应实验,下列说法不正确的是( )
B.该反应会产生高温、发出强光
C.根据铝热反应的原理,可以冶炼某些高熔点的金属
D.若反应中转移3 mol电子,则消耗氧化剂的物质的
量是1 mol
6.下列关于金属冶炼的叙述正确的是( )
A.工业上可利用铝热反应大量冶炼金属铁
B.钠、铝和铜都可用高温还原法制备
C.用铝粉还原磁铁矿得到9 mol铁时转移24 mol e-
D.电解饱和氯化镁溶液可得金属镁
解析:用铝热反应大量冶炼金属铁的经济效益差,A错误;钠、铝用电解法制备,B错误;电解熔融MgCl2可制得金属镁,D错误。
7.金属与人类生活和社会发展的关系非常密切。
(1)如图表示金属活动性顺序表中铜、铁和铝元素被人类大规模开发、利用的大致年限。
图中信息可以说明:铜、铁和铝的金属活动性强弱与人类开发、利用它们的时间先后的关系是____________________________________________。金属铬(Cr)能溶解在热的盐酸中,放出H2,同时生成CrCl2,预测:铬____(填“能”或“不能”)与硫酸铜溶液反应,理由是____________________________________________。
金属的活动性越弱,人类开发利用它的时间越早
能
铬排在氢前,而铜排在氢后,铬的活动性大于铜
CO2
8.下列有关铝土矿中提炼铝的说法不正确的是( )
A.铝土矿中的铝元素是以化合态形式存在的,需用化学方法把铝元素变成游离态
B.提炼过程中,先将铝土矿净化提取氧化铝,再进行冶炼
C.在NaAlO2溶液中通入过量CO2可得到Al(OH)3沉淀和Na2CO3溶液
D.冶炼铝的方法同工业冶炼钠、镁相似,可用电解法
解析:在NaAlO2溶液中通入过量CO2可得到Al(OH)3沉淀和NaHCO3溶液。
[应用·实践]
针对以上五个反应,下列叙述错误的是( )
A.反应①是非氧化还原反应
B.反应②生成了两种酸
C.反应④中的TiO2是氧化剂
D.反应⑤表现了金属镁比金属钛的还原性强
解析:反应④中钛元素和氧元素化合价未发生改变,Cl2是氧化剂,C错误。
11.不同的金属在冶炼方法上也有所不同,下列说法正确的是( )
A.钒、铬、锰、铁等难熔金属通常采用铝热法炼制
B.炼铁是采用氧化剂将铁从其化合物中氧化出来的方法
C.由于钠、镁、铝等金属化学性质太活泼,人们通常采用电解熔融状态下的氯化物的方式来获取其金属单质
D.炼铁时加入的焦炭除了提供热量外,还用来制造还原剂一氧化碳
解析:铁用CO还原法炼制,用铝热法炼制成本太高,A错误;炼铁是采用还原剂将铁从其化合物中还原出来的方法,B错误;AlCl3是共价化合物,其熔融态不导电,工业上用电解熔融Al2O3的方法制取铝,C错误。
12.实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质18 g,则该氧化物粉末可能是( )
A.Fe2O3和MnO2 B.MnO2和V2O5
C.Cr2O3和V2O5 D.MnO2和Cr2O3
13.孔雀石的主要成分为CuCO3·Cu(OH)2,某同学设计从孔雀石中冶炼金属铜的方案如下:
①将孔雀石粉碎后加过量的稀硫酸;②将反应后的混合物过滤;
③向滤液中加入一种金属粉末。
根据上述实验方案,试回答:
(1)第①步反应中的现象为_________________________________________。
(2)第③步加入的金属粉末是____,理由是______________________________
______________________。
(3)若向滤液中加入过量生石灰后,过滤,将沉淀加热灼烧后再通入________ ____________气体,可制得较纯净的铜。
固体溶解,有无色气体生成,溶液变成蓝色
Fe
铁的活泼性比铜强,可从溶液中置换出铜(合理即可)
氢气(答案合理即可)
14.铝土矿(主要成分Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料,工业上提取铝的工艺流程如下:
(1)试剂a的化学式为________。
(2)步骤③中通入过量CO2,产生沉淀C的离子方程式为___________________
______________________________________。
[创新·提高]
NaOH
(3)步骤③中通入过量CO2气体而不加入过量盐酸的理由是________________ ______。
(4)Al2O3中所含化学键的类型为________。
(5)工业上用电解熔融Al2O3的方法制备金属铝,化学方程式为_____________
_____________________________。
Al(OH)3溶于过量盐酸
离子键
解析:铝土矿的主要成分为Al2O3,还含有SiO2、Fe2O3等,步骤①中加入过量稀盐酸溶解,SiO2不反应,过滤后得到的沉淀A为SiO2。滤液甲中含有AlCl3、FeCl3、HCl等,步骤②中加入的过量试剂a为NaOH溶液,AlCl3转化为NaAlO2,FeCl3则生成Fe(OH)3沉淀,故过滤后的沉淀B为Fe(OH)3。滤液乙中含有NaAlO2、NaOH等,步骤③中通入过量CO2,NaAlO2转化为Al(OH)3沉淀。
