5.1硫及其化合物同步练习题高一下学期化学人教版(2019)必修第二册(含解析)
文档属性
| 名称 | 5.1硫及其化合物同步练习题高一下学期化学人教版(2019)必修第二册(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 680.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-22 00:00:00 | ||
图片预览



文档简介
5.1 硫及其化合物 同步练习题
一、单选题
1.下列实验中,所得现象和结论均对应且正确的是
选项 实验 现象 结论
A 向溴水中通入足量SO2气体 溴水褪色 SO2具有还原性
B 将少量氯气通入KI-淀粉溶液中 溶液变蓝 还原性:I-<Cl-
C 向pH试纸上滴加一滴浓硫酸 pH试纸先变红后变黑 浓硫酸具有强氧化性
D 向某溶液中滴加硝酸酸化的BaCl2溶液 有白色沉淀产生 该溶液中一定含SO
A.A B.B C.C D.D
2.针对下列实验现象表述不正确的是
A.用pH试纸测量浓硫酸的pH
B.在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C.向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D.浓硫酸与蔗糖反应体现浓硫酸的脱水性和强氧化性
3.下列指定反应的离子方程式正确的是
A.氯气溶于水:
B.将过量的通入NaOH溶液中:
C.与反应:
D.向溶液中加入过量氨水:
4.用制,既利用资源又环保。1体积含体积分数为0.84混合气体(、、)在过量的空气中(过量77%)完全燃烧,下列分析正确的是(已知空气组成:体积分数0.79、体积分数0.21)
A.消耗氧气0.42体积
B.通入空气6体积
C.产物中体积分数是0.85(是气体)
D.若完全转化,每摩尔混合气体制得98%的硫酸
5.用下面的方案进行某些离子的检验,其中方案设计严密的是( )
A.检验试液中的SO42-:试液无沉淀白色沉淀
B.检验试液中的Fe2+:试液无明显现象红色溶液
C.检验试液中的CO32-:试液白色沉淀沉淀溶解
D.检验试液中的I-:试液无明显现象蓝色溶液
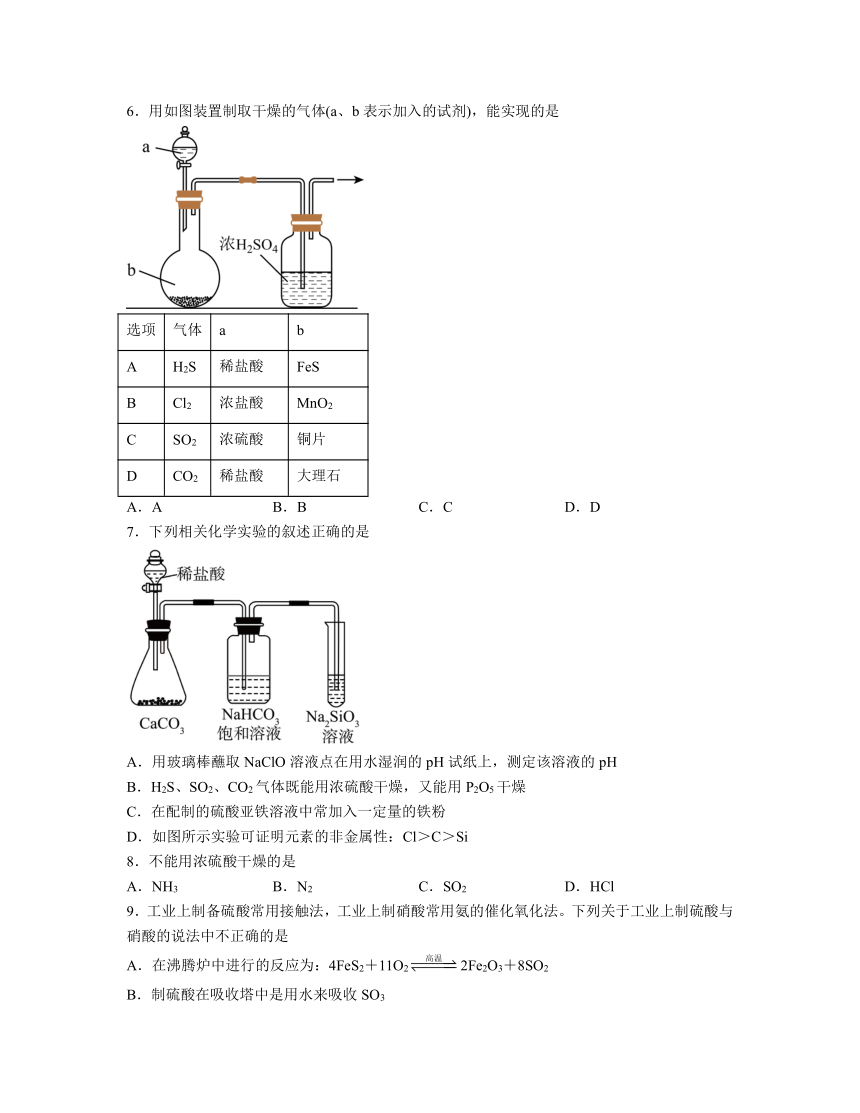
6.用如图装置制取干燥的气体(a、b表示加入的试剂),能实现的是
选项 气体 a b
A H2S 稀盐酸 FeS
B Cl2 浓盐酸 MnO2
C SO2 浓硫酸 铜片
D CO2 稀盐酸 大理石
A.A B.B C.C D.D
7.下列相关化学实验的叙述正确的是
A.用玻璃棒蘸取NaClO溶液点在用水湿润的pH试纸上,测定该溶液的pH
B.H2S、SO2、CO2气体既能用浓硫酸干燥,又能用P2O5干燥
C.在配制的硫酸亚铁溶液中常加入一定量的铁粉
D.如图所示实验可证明元素的非金属性:Cl>C>Si
8.不能用浓硫酸干燥的是
A.NH3 B.N2 C.SO2 D.HCl
9.工业上制备硫酸常用接触法,工业上制硝酸常用氨的催化氧化法。下列关于工业上制硫酸与硝酸的说法中不正确的是
A.在沸腾炉中进行的反应为:4FeS2+11O22Fe2O3+8SO2
B.制硫酸在吸收塔中是用水来吸收SO3
C.氨催化氧化制硝酸过程中的三个主要反应都属于氧化还原反应
D.硫酸工业、硝酸工业都需要对工业尾气进行处理
10.有关于对硫单质的说法中不正确的是( )
A.俗称硫磺 B.难溶于水
C.易溶于二硫化碳 D.空气中燃烧生成三氧化硫
二、填空题
11.分别向盛有①紫色石蕊试液②澄清石灰水③品红溶液④酸性高锰酸钾溶液的试管中通入气体。
(1)试管①中的实验现象为_______ 。
(2)试管②中发生反应的离子方程式为_______(通入少量的)。
(3)上述实验中,出现溶液褪色现象的是_______(填试管标号)。
(4)上述实验中,表现出酸性氧化物性质的是 _______(填试管标号,下同)。表现出漂白性的是_______ ,表现出还原性的是_______。
(5)从海水中提取溴常用空气吹出法,即用氯气()将海水里的溴化钠()中的溴置换出来,再用空气吹出溴(),流程示意图如下:
①请写出在吸收塔中发生的反应的离子方程式并用单线桥标出电子转移的方向和数目____ 。
②假设最后在蒸馏塔中获得理论上从酸化的海水开始,至少消耗_(标准状况下)。
12.向一个铝制易拉罐充满后,再往罐内注入足量的溶液,立即用胶布严封罐口,不多会儿就会听到罐内“咔、咔”作响,发现易拉罐变瘪,再过一会儿易拉罐又鼓涨起来,解释上述变化的实验现象.
(1)易拉罐开始变瘪的原因是___________,其离子方程式(或化学方程式)为___________.
(2)易拉罐后来又鼓涨起来的原因是_____________,其离子方程式(或化学方程式)为_______.
三、计算题
13.将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O22SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
(1)求该反应达到平衡时SO2的转化率(用百分数表示)。_____________
(2)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?(要有解题过程)____
14.接触法制硫酸是先把SO2催化氧化成SO3,然后用浓硫酸吸收得到的SO3制取产品。某工厂生产硫酸时,进入接触室的原料气成分为SO27%、O211%、N2 82%(体积分数)。
(1)计算标准状况下10 m3原料气中的SO2物质的量______________mol。
(2)计算标准状况下1 0m3原料气的质量______千克。
(3)若SO2的转化率为99.2%,计算接触室导出的气体中SO3的体积分数_____。
(4)若接触室导出的气体中含6.72%(体积分数)的SO3。把出口气体送进吸收塔,
用3%的硫酸吸收,可得到“发烟H2SO4”(H2SO4和SO3的混合物,其中含质量分数为20%的SO3)。计算吸收1000 m3出口气体(已折算为标准状况)所需要的98.3%的硫酸的质量_____千克。
四、实验题
15.硫酰氯(SO2Cl2)是生产医药、农药、染料的重要原料。硫酰氯与硫酸的部分性质如下表:
物质 熔点/℃ 沸点/℃ 其他性质
SO2Cl2 -54.1 69.1 ①易水解,产生大量白雾,生成两种强酸②易分解:SO2Cl2SO2↑+Cl2↑
H2SO4 10.4 338 强吸水性、稳定不易分解
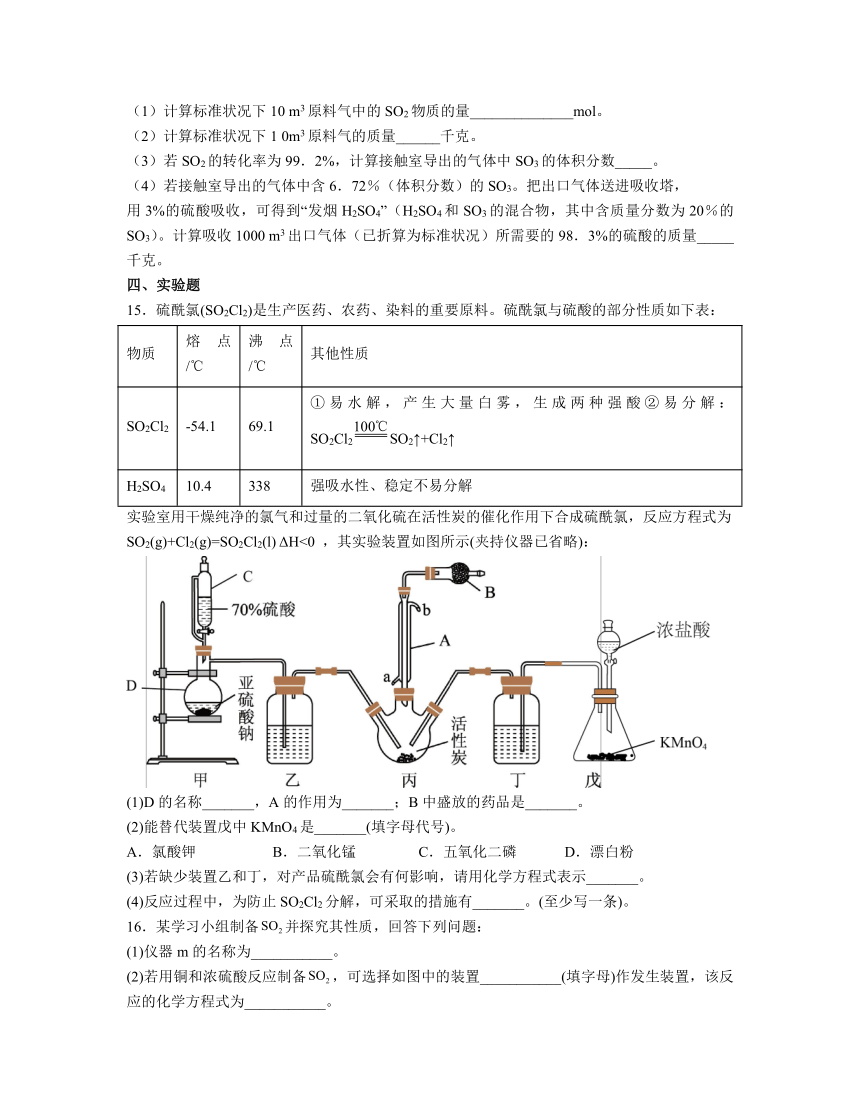
实验室用干燥纯净的氯气和过量的二氧化硫在活性炭的催化作用下合成硫酰氯,反应方程式为SO2(g)+Cl2(g)=SO2Cl2(l) ΔH<0 ,其实验装置如图所示(夹持仪器已省略):
(1)D的名称_______,A的作用为_______;B中盛放的药品是_______。
(2)能替代装置戊中KMnO4是_______(填字母代号)。
A.氯酸钾 B.二氧化锰 C.五氧化二磷 D.漂白粉
(3)若缺少装置乙和丁,对产品硫酰氯会有何影响,请用化学方程式表示_______。
(4)反应过程中,为防止SO2Cl2分解,可采取的措施有_______。(至少写一条)。
16.某学习小组制备并探究其性质,回答下列问题:
(1)仪器m的名称为___________。
(2)若用铜和浓硫酸反应制备,可选择如图中的装置___________(填字母)作发生装置,该反应的化学方程式为___________。
(3)与装置E中的溶液充分接触后,溶液变浑浊,则该溶液可能是___________。
A.溶液 B.溶液
C.氯水 D.溶液
(4)若与装置E中的100 mL 0.2 酸性溶液恰好完全反应,则被氧化的的质量为___________g。(已知:)
(5)若选用装置F进行尾气吸收,则该反应的离子方程式为___________。
五、元素或物质推断题
17.某钠盐溶液可能含有阴离子 NO、CO、SO、SO、Cl-、Br-、I-。为鉴定这些离子,分别取少量溶液进行以下实验:
①测得溶液呈碱性;
②加HCl后,生成无色、无味气体。该气体能使饱和石灰水溶液变浑浊;
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3溶液,溶液中析出白色沉淀。
分析上述5个实验,写出每一实验鉴定离子的结论(用“一定有”或“可能有”或“一定没有”来描述,说明理由。)。
(1)实验①_____________________________;
(2)实验②______________________________;
(3)实验③____________________________;
(4)实验④____________________________;
(5)实验⑤____________________________。
【参考答案】
一、单选题
1.A
解析:A.溴水与二氧化硫发生氧化还原反应生成硫酸、HBr,则二氧化硫具有还原性,故A正确;
B.将少量氯气通入到KI溶液中,淀粉溶液变蓝,离子方程式为:Cl2+2I-=2Cl-+I2,I-是还原剂,则还原性:I->Cl-,故B错误;
C.浓硫酸具有脱水性,则把浓硫酸滴到pH试纸上,试纸变黑,故C错误;
D.亚硫酸根离子可以被硝酸氧化为硫酸根离子,该离子可以和BaCl2溶液反应,有白色沉淀生成,溶液中可能会含有亚硫酸根离子、或是银离子等,故D错误;
故选:A。
2.A
解析:A.浓硫酸具有脱水性,会使pH脱水碳化,因此不能用pH试纸测量浓硫酸的pH,A错误;
B.浓硫酸具有吸水性,会使CuSO5·5H2O失水变为白色CuSO4粉末,故在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色,B正确;
C.SO2具有还原性,H2O2具有氧化性,在酸性条件下H2O2会将SO2氧化为硫酸,硫酸再与溶液中的BaCl2反应产生BaSO4白色沉淀,C正确;
D.浓硫酸具有脱水性,能够将有机物蔗糖中的H、O两种元素以2:1的组成脱去,反应会放出大量热,反应产生的C会进一步被浓硫酸氧化产生CO2,浓硫酸被还原产生SO2气体,故将浓硫酸与蔗糖混合,体现了浓硫酸的脱水性和强氧化性,D正确;
故合理选项是A。
3.D
解析:A.次氯酸是弱酸不能拆,A错误;
B.过量的二氧化硫会与碱反应生成酸式盐亚硫酸氢钠,B错误;
C.氧元素不守恒,,C错误;
D.过量氨水不能溶解氢氧化铝,离子方程式为,D正确;
故选D。
4.D
解析:A.由分析可知,消耗氧气1.26体积,A错误;
B.由分析可知,通入空气10.62体积,B错误;
C.由分析可知,产物中体积分数是0.075(是气体),C错误;
D.若完全转化,则可找到关系式:H2S~SO2~SO3~H2SO4,气体的体积之比等于物质的量之比,每摩尔混合气体含有0.84mol的H2S,根据上述关系式可知,制得98%的硫酸=,D正确;
故答案为:D。
5.D
解析:A.硝酸可氧化亚硫酸根离子,则原溶液中可能含SO32-,故A错误;
B.氯化钡溶液没有氧化性,加入氯化钡溶液后不能将亚铁离子氧化,故溶液不可能变红,故B错误
C.白色沉淀为碳酸钡或亚硫酸钡,则原溶液中可能含SO32-,故C错误;
D.淀粉遇碘变蓝,可知加入双氧水将碘离子氧化为碘,则可知试液中含I-,方案严密,故D正确;故选D。
6.D
解析:A.H2S具有还原性,浓硫酸具有强氧化性,两者会发生氧化还原反应,故不能用浓硫酸干燥H2S, A不符合题意;
B.MnO2与浓盐酸反应制备氯气需要加热,B不符合题意;
C.铜和浓硫酸需要加热才能生成二氧化硫气体,C不符合题意;
D.大理石与稀盐酸反应生成CO2,且CO2能用浓硫酸干燥,D符合题意;
故选D。
7.C
解析:A.NaClO溶液具有漂白性,不能用pH试纸测定其pH,A错误;
B.H2S具有还原性,会被浓硫酸氧化,不能用浓硫酸干燥,B错误;
C.亚铁离子易被氧化为铁离子,铁离子可以被铁粉还原为亚铁离子,所以在配制的硫酸亚铁溶液中常加入一定量的铁粉,可以防止亚铁离子被氧化,C正确;
D.盐酸不是Cl元素的最高价含氧酸,不能通过比较盐酸和碳酸、硅酸的强弱来确定非金属性的强弱关系,D错误;综上所述故选C。
8.A
解析:浓硫酸可与氨气反应生成硫酸铵,则不能干燥氨气,浓硫酸与氮气、二氧化硫、氯化氢不反应,可干燥这些气体,综上所述,答案为A。
9.B
解析:A.在沸腾炉中进行的反应为4FeS2+11O22Fe2O3+8SO2,在接触室中进行的反应为2SO2+O2 2SO3,故A正确;
B.在吸收塔中,直接用水吸收SO3,易形成酸雾,降低SO3吸收效率,应用98.3%硫酸吸收SO3,故B错误;
C.工业上制硝酸是用氨的催化氧化法,过程中有三个主要反应:4NH3+5O24NO+6H2O,2NO+O2 ═2NO2 ,3NO2+H2O═2HNO3+NO,NH3→NO→NO2→HNO3 ,氮元素的化合价改变,所以三个反应都是氧化还原反应,故C正确;
D.工业制硫酸、硝酸,会生成二氧化硫、三氧化硫、一氧化氮、二氧化氮等酸性气体,而且这些气体都有毒,需对其进行尾气处理,故D正确;
故选B。
10.D
解析:A. 硫单质为黄色晶体,俗称硫磺,A正确;
B. 硫难溶于水,微溶于酒精,B正确;
C. 硫易溶于二硫化碳,C正确;
D. 硫无论在空气中还是在纯氧中燃烧的产物都是二氧化硫,而不是三氧化硫,如果要使硫转化为三氧化硫,需在催化剂并加热的条件下与氧气发生化合反应,D错误;
故选D。
二、填空题
11. 溶液由紫色变为红色 ③④ ①② ③ ④ 44.8
解析:(1)为酸性氧化物,向试管①紫色石蕊溶液中通入气体的实验现象为溶液由紫色变为红色。
(2)向试管②澄清石灰水中通入少量的气体,发生反应的离子方程式为。
(3)因为具有还原性,能使酸性高锰酸钾溶液褪色;具有漂白性,能使品红溶液褪色,所以上述实验中,出现溶液褪色现象的是③④。
(4)表现出酸性氧化物性质的是能使紫色石蕊溶液褪色;能与澄清石灰水反应,所以符合题意的是①②;表现出漂白性的是使品红溶液褪色,表现出还原性的是使酸性高锰酸钾溶液褪色。
(5)①在吸收塔中发生的反应的离子方程式为:,Br原子由Br2中0价降低到Br-中-1价,得到2个电子,S元素由SO2中+4价升高到 中+6价,失去2个电子,所以S元素转移2个电子给Br元素,故有②由发生的三个反应可知,最后在蒸馏塔中获得,理论上从酸化的海水开始,至少消耗为。
12. 与反应,罐内压强随气体的减少而减小 易拉罐中的铝与反应产生氢气
解析:(1)CO2能和氢氧化钠发生反应,CO2被吸收,与反应,罐内压强随气体的减少而减小,反应的离子方程式为:(或2NaOH+CO2═Na2CO3+H2O),
故答案为与反应,罐内压强随气体的减少而减小;(或2NaOH+CO2═Na2CO3+H2O);
(2)金属铝能和强碱反应生成氢气,导致罐内气体压强又增大而重新鼓起,金属铝能和强碱反应的实质是:,
故答案为易拉罐中的铝与反应产生氢气;。
三、计算题
13.7% 10.5g
解析:(1)消耗的O2物质的量:0.7mol =0.45mol,
生成的SO3物质的量:0.45mol×2=0.9mol,
SO2和SO3的物质的量和:=0.95mol,
依据硫元素守恒,反应前的SO2物质的量0.95mol,
SO2的转化率:=94.7%;
(2)依据(1)的计算可知混合气体中生成三氧化硫气体物质的量为0.9mol,在给定的条件下,溶液呈强酸性,BaSO3不会沉淀,因此BaSO4的质量=0.9mol×5%×233g/mol=10.5g。
14.25 13.82Kg 7.19% 665Kg
解析:(1)原料气中SO2的体积分数为7%,故10m3原料气中的SO2的体积为10m3×7%=0.7m3=700L,故标准状况下二氧化硫的物质的量为故答案为31.25;
(2)原料气中O2的体积分数为11%,故10m3原料气中的O2的体积为10m3×11%=1.1m3=1100L,故标准状况下氧气的物质的量为原料气中N2的体积分数为82%,故10m3原料气中的N2的体积为10m3×82%=8.2m3=8200L,故标准状况下氮气的物质的量为故标准状况下10m3原料气的质量为:31.25mol×64g/mol+49.11mol×32g/mol+366.07mol×28g/mol=13821.48≈13.82kg,答:标准状况下10m3原料气的质量为13.82kg;
(3)SO2的转化率为99.2%,则参加反应的二氧化硫的体积为10m3×7%×99.2%=0.6944m3,则:2SO2+O2=2SO3体积减少△V
2 2 1
6944m3 0.6944m3 0.3472m3
故反应后气体的体积为10m3-0.3472m3=9.6528m3,
故接触室导出的气体中SO3的体积为0.6944m3,体积分数为
答:接触室导出的气体中SO3的体积分数为7.19%;
(4)假设需要浓硫酸的质量为mg,则浓硫酸中硫酸的质量为mg×98g%=0.98mg,物质的量为浓硫酸中水的质量为mg-0.98mg=0.02mg,物质的量为故吸收三氧化硫后生成的硫酸的物质的量为发烟硫酸中硫酸的物质的量为0.01m mol+1000m3出口气体中三氧化硫的体积为1000m3×6.72%=67.2m3=67200L,SO3的物质的量为被水吸收后剩余的三氧化硫的物质的量为3000mol-
故,解得m=664615g=664.6kg,
答:吸收1000m3出口气体所需要的98%的硫酸的质量为664.6kg.
四、实验题
15.(1) 蒸馏烧瓶 冷凝回流硫酰氯(SO2Cl2) 碱石灰
(2)AD
(3)SO2Cl2+2H2O=H2SO4+2HCl
(4)调节装置甲、戊中液体滴入的速度,减慢气体通入丙(三口烧瓶)的速率;给丙(三口烧瓶)冷水浴,降温等
【分析】装置甲中利用70%硫酸与亚硫酸钠反应制取SO2,利用装置乙中浓硫酸干燥后进入装置丙中进行反应,戊装置中利用浓盐酸和高锰酸钾反应制取氯气,经装置丁中浓硫酸干燥后进入装置丙进行反应,在活性炭的催化作用下合成硫酰氯。
解析:(1)根据D仪器的结构特点可知其为蒸馏烧瓶;SO2Cl2熔沸点较低,容易挥发,所以利用装置A冷凝回流;为防止空气中的水蒸气进入,同时吸收未反应的SO2和Cl2,所以装置B中应盛放碱石灰;
(2)装置戊中KMnO4是作为氧化剂来氧化Cl-,五氧化二磷无法氧化Cl-,虽然二氧化锰可以氧化Cl-,但需要加热,图示没有加热装置,氯酸钾、漂白粉都可以和浓盐酸发生归中反应制取氯气,且不需要加热,故选AD;
(3)SO2Cl2易水解,若缺少装置乙和丁,水蒸气进入装置丙,发生反应:SO2Cl2+2H2O=H2SO4+2HCl;
(4)温度过高SO2Cl2会分解,而制取反应为放热反应,所以为了防止装置丙内温度过高,需控制反应速率,或者物理降温,具体方法有:调节装置甲、戊中液体滴入的速度,减慢气体通入丙(三口烧瓶)的速率;给丙(三口烧瓶)冷水浴,降温等。
16.(1)长颈漏斗
(2) C
(3)AD
(4)3.2
(5)
解析:(1)根据装置信息得到仪器m的名称为长颈漏斗;故答案为:长颈漏斗。
(2)若用铜和浓硫酸反应制备,需要加热才能生成二氧化硫气体,因此可选择如图中的装置C作发生装置,该反应的化学方程式为;故答案为:C;。
(3)A. 溶液和二氧化硫反应生成硫沉淀和水,故A符合题意;B. 溶液和二氧化硫不反应,故B不符合题意;C. 氯水与二氧化硫反应生成盐酸和硫酸,溶液不变浑浊,故C不符合题意;D. 溶液通入二氧化硫,生成亚硫酸,亚硫酸提供了氢离子,氢离子硝酸根、亚硫酸反应生成硫酸根,因此最终生成硫酸钡沉淀,故D符合题意;综上所述,答案为AD。
(4)若与装置E中的100 mL 0.2 酸性(物质的量为0.02mol)溶液恰好完全反应,根据方程式得到被氧化的二氧化硫物质的量为0.05mol,则被氧化的的质量为0.05mol×64g mol 1=3.2g;故答案为:3.2。
(5)若选用装置F进行尾气吸收,二氧化硫和氢氧化钠溶液反应生成亚硫酸钠和水,其反应的离子方程式为;故答案为:。
五、元素或物质推断题
17. 说明可能有CO32-,或可能有SO32-,或二者都可能有,因为二者水解均显碱性 一定有CO32-,一定没有SO32-,因SO2有刺激性气味 一定没有Br-、I-,因二者均能与氯水反应生成溴单质和碘单质,溴和碘单质溶于CCl4显色 一定有SO42-,因BaSO4不溶于盐酸 可能有Cl-,因为加入硝酸银溶液,可能会产生硫酸银白色沉淀
解析:分析:(1)实验①:CO和SO均水解显碱性,在碱性环境下可能存在。
(2)实验②:CO和SO均能和强酸反应生成气体二氧化碳和二氧化硫,二氧化硫气体有刺激性气味。
(3)实验③:氯气能将溴离子和碘离子氧化为碘单质和溴单质,二者在四氯化碳中溶解度很大,并且均是有颜色的。
(4)实验④:向溶液中加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解,则一定含有硫酸钡。
(5)实验⑤:溶液中加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀,可能为硫酸银沉淀,不一定为氯化银沉淀。
详解:(1)实验①:测得混合液呈碱性,而CO和SO水解显碱性,所以在碱性环境下可能含有CO32-或者含有SO32-或二者都存在;正确为 说明可能有CO32-,或可能有SO32-,或二者都可能有,因为二者水解均显碱性。
(2)实验②:CO和SO均能和强酸反应生成气体二氧化碳和二氧化硫,但是二氧化硫是有刺激性气味的气体,所以生成无色无味气体是二氧化碳,一定不存在SO离子,一定有CO离子;正确为 一定有CO32-,一定没有SO32-,因SO2有刺激性气味。
(3)实验③:氯气能将溴离子和碘离子氧化为碘单质和溴单质,二者在四氯化碳中溶解度很大,并且均是有颜色的;正确为一定没有Br-、I-,因二者均能与氯水反应生成溴单质和碘单质,溴和碘单质溶于CCl4显色。
(4)实验④:根据硫酸根离子的检验试剂是氯化钡,可以向溶液中加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解,则一定含有硫酸钡;正确为 一定有SO42-,因BaSO4不溶于盐酸。
(5)实验⑤:溶液中加HNO3酸化后, 再加过量AgNO3,如果溶液中含有SO42-,Ag+与SO42-也可生成硫酸银白色沉淀,不一定会产生氯化银沉淀,所以不能确定溶液中含有氯离子;正确为 可能有Cl-,因为加入硝酸银溶液,可能会产生硫酸银白色沉淀。
点睛:本题考查学生有关离子检验的知识,注意离子之间的反应以及离子共存知识是解题的关键,该题注重学生能力的考查。
一、单选题
1.下列实验中,所得现象和结论均对应且正确的是
选项 实验 现象 结论
A 向溴水中通入足量SO2气体 溴水褪色 SO2具有还原性
B 将少量氯气通入KI-淀粉溶液中 溶液变蓝 还原性:I-<Cl-
C 向pH试纸上滴加一滴浓硫酸 pH试纸先变红后变黑 浓硫酸具有强氧化性
D 向某溶液中滴加硝酸酸化的BaCl2溶液 有白色沉淀产生 该溶液中一定含SO
A.A B.B C.C D.D
2.针对下列实验现象表述不正确的是
A.用pH试纸测量浓硫酸的pH
B.在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C.向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D.浓硫酸与蔗糖反应体现浓硫酸的脱水性和强氧化性
3.下列指定反应的离子方程式正确的是
A.氯气溶于水:
B.将过量的通入NaOH溶液中:
C.与反应:
D.向溶液中加入过量氨水:
4.用制,既利用资源又环保。1体积含体积分数为0.84混合气体(、、)在过量的空气中(过量77%)完全燃烧,下列分析正确的是(已知空气组成:体积分数0.79、体积分数0.21)
A.消耗氧气0.42体积
B.通入空气6体积
C.产物中体积分数是0.85(是气体)
D.若完全转化,每摩尔混合气体制得98%的硫酸
5.用下面的方案进行某些离子的检验,其中方案设计严密的是( )
A.检验试液中的SO42-:试液无沉淀白色沉淀
B.检验试液中的Fe2+:试液无明显现象红色溶液
C.检验试液中的CO32-:试液白色沉淀沉淀溶解
D.检验试液中的I-:试液无明显现象蓝色溶液
6.用如图装置制取干燥的气体(a、b表示加入的试剂),能实现的是
选项 气体 a b
A H2S 稀盐酸 FeS
B Cl2 浓盐酸 MnO2
C SO2 浓硫酸 铜片
D CO2 稀盐酸 大理石
A.A B.B C.C D.D
7.下列相关化学实验的叙述正确的是
A.用玻璃棒蘸取NaClO溶液点在用水湿润的pH试纸上,测定该溶液的pH
B.H2S、SO2、CO2气体既能用浓硫酸干燥,又能用P2O5干燥
C.在配制的硫酸亚铁溶液中常加入一定量的铁粉
D.如图所示实验可证明元素的非金属性:Cl>C>Si
8.不能用浓硫酸干燥的是
A.NH3 B.N2 C.SO2 D.HCl
9.工业上制备硫酸常用接触法,工业上制硝酸常用氨的催化氧化法。下列关于工业上制硫酸与硝酸的说法中不正确的是
A.在沸腾炉中进行的反应为:4FeS2+11O22Fe2O3+8SO2
B.制硫酸在吸收塔中是用水来吸收SO3
C.氨催化氧化制硝酸过程中的三个主要反应都属于氧化还原反应
D.硫酸工业、硝酸工业都需要对工业尾气进行处理
10.有关于对硫单质的说法中不正确的是( )
A.俗称硫磺 B.难溶于水
C.易溶于二硫化碳 D.空气中燃烧生成三氧化硫
二、填空题
11.分别向盛有①紫色石蕊试液②澄清石灰水③品红溶液④酸性高锰酸钾溶液的试管中通入气体。
(1)试管①中的实验现象为_______ 。
(2)试管②中发生反应的离子方程式为_______(通入少量的)。
(3)上述实验中,出现溶液褪色现象的是_______(填试管标号)。
(4)上述实验中,表现出酸性氧化物性质的是 _______(填试管标号,下同)。表现出漂白性的是_______ ,表现出还原性的是_______。
(5)从海水中提取溴常用空气吹出法,即用氯气()将海水里的溴化钠()中的溴置换出来,再用空气吹出溴(),流程示意图如下:
①请写出在吸收塔中发生的反应的离子方程式并用单线桥标出电子转移的方向和数目____ 。
②假设最后在蒸馏塔中获得理论上从酸化的海水开始,至少消耗_(标准状况下)。
12.向一个铝制易拉罐充满后,再往罐内注入足量的溶液,立即用胶布严封罐口,不多会儿就会听到罐内“咔、咔”作响,发现易拉罐变瘪,再过一会儿易拉罐又鼓涨起来,解释上述变化的实验现象.
(1)易拉罐开始变瘪的原因是___________,其离子方程式(或化学方程式)为___________.
(2)易拉罐后来又鼓涨起来的原因是_____________,其离子方程式(或化学方程式)为_______.
三、计算题
13.将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O22SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
(1)求该反应达到平衡时SO2的转化率(用百分数表示)。_____________
(2)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?(要有解题过程)____
14.接触法制硫酸是先把SO2催化氧化成SO3,然后用浓硫酸吸收得到的SO3制取产品。某工厂生产硫酸时,进入接触室的原料气成分为SO27%、O211%、N2 82%(体积分数)。
(1)计算标准状况下10 m3原料气中的SO2物质的量______________mol。
(2)计算标准状况下1 0m3原料气的质量______千克。
(3)若SO2的转化率为99.2%,计算接触室导出的气体中SO3的体积分数_____。
(4)若接触室导出的气体中含6.72%(体积分数)的SO3。把出口气体送进吸收塔,
用3%的硫酸吸收,可得到“发烟H2SO4”(H2SO4和SO3的混合物,其中含质量分数为20%的SO3)。计算吸收1000 m3出口气体(已折算为标准状况)所需要的98.3%的硫酸的质量_____千克。
四、实验题
15.硫酰氯(SO2Cl2)是生产医药、农药、染料的重要原料。硫酰氯与硫酸的部分性质如下表:
物质 熔点/℃ 沸点/℃ 其他性质
SO2Cl2 -54.1 69.1 ①易水解,产生大量白雾,生成两种强酸②易分解:SO2Cl2SO2↑+Cl2↑
H2SO4 10.4 338 强吸水性、稳定不易分解
实验室用干燥纯净的氯气和过量的二氧化硫在活性炭的催化作用下合成硫酰氯,反应方程式为SO2(g)+Cl2(g)=SO2Cl2(l) ΔH<0 ,其实验装置如图所示(夹持仪器已省略):
(1)D的名称_______,A的作用为_______;B中盛放的药品是_______。
(2)能替代装置戊中KMnO4是_______(填字母代号)。
A.氯酸钾 B.二氧化锰 C.五氧化二磷 D.漂白粉
(3)若缺少装置乙和丁,对产品硫酰氯会有何影响,请用化学方程式表示_______。
(4)反应过程中,为防止SO2Cl2分解,可采取的措施有_______。(至少写一条)。
16.某学习小组制备并探究其性质,回答下列问题:
(1)仪器m的名称为___________。
(2)若用铜和浓硫酸反应制备,可选择如图中的装置___________(填字母)作发生装置,该反应的化学方程式为___________。
(3)与装置E中的溶液充分接触后,溶液变浑浊,则该溶液可能是___________。
A.溶液 B.溶液
C.氯水 D.溶液
(4)若与装置E中的100 mL 0.2 酸性溶液恰好完全反应,则被氧化的的质量为___________g。(已知:)
(5)若选用装置F进行尾气吸收,则该反应的离子方程式为___________。
五、元素或物质推断题
17.某钠盐溶液可能含有阴离子 NO、CO、SO、SO、Cl-、Br-、I-。为鉴定这些离子,分别取少量溶液进行以下实验:
①测得溶液呈碱性;
②加HCl后,生成无色、无味气体。该气体能使饱和石灰水溶液变浑浊;
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3溶液,溶液中析出白色沉淀。
分析上述5个实验,写出每一实验鉴定离子的结论(用“一定有”或“可能有”或“一定没有”来描述,说明理由。)。
(1)实验①_____________________________;
(2)实验②______________________________;
(3)实验③____________________________;
(4)实验④____________________________;
(5)实验⑤____________________________。
【参考答案】
一、单选题
1.A
解析:A.溴水与二氧化硫发生氧化还原反应生成硫酸、HBr,则二氧化硫具有还原性,故A正确;
B.将少量氯气通入到KI溶液中,淀粉溶液变蓝,离子方程式为:Cl2+2I-=2Cl-+I2,I-是还原剂,则还原性:I->Cl-,故B错误;
C.浓硫酸具有脱水性,则把浓硫酸滴到pH试纸上,试纸变黑,故C错误;
D.亚硫酸根离子可以被硝酸氧化为硫酸根离子,该离子可以和BaCl2溶液反应,有白色沉淀生成,溶液中可能会含有亚硫酸根离子、或是银离子等,故D错误;
故选:A。
2.A
解析:A.浓硫酸具有脱水性,会使pH脱水碳化,因此不能用pH试纸测量浓硫酸的pH,A错误;
B.浓硫酸具有吸水性,会使CuSO5·5H2O失水变为白色CuSO4粉末,故在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色,B正确;
C.SO2具有还原性,H2O2具有氧化性,在酸性条件下H2O2会将SO2氧化为硫酸,硫酸再与溶液中的BaCl2反应产生BaSO4白色沉淀,C正确;
D.浓硫酸具有脱水性,能够将有机物蔗糖中的H、O两种元素以2:1的组成脱去,反应会放出大量热,反应产生的C会进一步被浓硫酸氧化产生CO2,浓硫酸被还原产生SO2气体,故将浓硫酸与蔗糖混合,体现了浓硫酸的脱水性和强氧化性,D正确;
故合理选项是A。
3.D
解析:A.次氯酸是弱酸不能拆,A错误;
B.过量的二氧化硫会与碱反应生成酸式盐亚硫酸氢钠,B错误;
C.氧元素不守恒,,C错误;
D.过量氨水不能溶解氢氧化铝,离子方程式为,D正确;
故选D。
4.D
解析:A.由分析可知,消耗氧气1.26体积,A错误;
B.由分析可知,通入空气10.62体积,B错误;
C.由分析可知,产物中体积分数是0.075(是气体),C错误;
D.若完全转化,则可找到关系式:H2S~SO2~SO3~H2SO4,气体的体积之比等于物质的量之比,每摩尔混合气体含有0.84mol的H2S,根据上述关系式可知,制得98%的硫酸=,D正确;
故答案为:D。
5.D
解析:A.硝酸可氧化亚硫酸根离子,则原溶液中可能含SO32-,故A错误;
B.氯化钡溶液没有氧化性,加入氯化钡溶液后不能将亚铁离子氧化,故溶液不可能变红,故B错误
C.白色沉淀为碳酸钡或亚硫酸钡,则原溶液中可能含SO32-,故C错误;
D.淀粉遇碘变蓝,可知加入双氧水将碘离子氧化为碘,则可知试液中含I-,方案严密,故D正确;故选D。
6.D
解析:A.H2S具有还原性,浓硫酸具有强氧化性,两者会发生氧化还原反应,故不能用浓硫酸干燥H2S, A不符合题意;
B.MnO2与浓盐酸反应制备氯气需要加热,B不符合题意;
C.铜和浓硫酸需要加热才能生成二氧化硫气体,C不符合题意;
D.大理石与稀盐酸反应生成CO2,且CO2能用浓硫酸干燥,D符合题意;
故选D。
7.C
解析:A.NaClO溶液具有漂白性,不能用pH试纸测定其pH,A错误;
B.H2S具有还原性,会被浓硫酸氧化,不能用浓硫酸干燥,B错误;
C.亚铁离子易被氧化为铁离子,铁离子可以被铁粉还原为亚铁离子,所以在配制的硫酸亚铁溶液中常加入一定量的铁粉,可以防止亚铁离子被氧化,C正确;
D.盐酸不是Cl元素的最高价含氧酸,不能通过比较盐酸和碳酸、硅酸的强弱来确定非金属性的强弱关系,D错误;综上所述故选C。
8.A
解析:浓硫酸可与氨气反应生成硫酸铵,则不能干燥氨气,浓硫酸与氮气、二氧化硫、氯化氢不反应,可干燥这些气体,综上所述,答案为A。
9.B
解析:A.在沸腾炉中进行的反应为4FeS2+11O22Fe2O3+8SO2,在接触室中进行的反应为2SO2+O2 2SO3,故A正确;
B.在吸收塔中,直接用水吸收SO3,易形成酸雾,降低SO3吸收效率,应用98.3%硫酸吸收SO3,故B错误;
C.工业上制硝酸是用氨的催化氧化法,过程中有三个主要反应:4NH3+5O24NO+6H2O,2NO+O2 ═2NO2 ,3NO2+H2O═2HNO3+NO,NH3→NO→NO2→HNO3 ,氮元素的化合价改变,所以三个反应都是氧化还原反应,故C正确;
D.工业制硫酸、硝酸,会生成二氧化硫、三氧化硫、一氧化氮、二氧化氮等酸性气体,而且这些气体都有毒,需对其进行尾气处理,故D正确;
故选B。
10.D
解析:A. 硫单质为黄色晶体,俗称硫磺,A正确;
B. 硫难溶于水,微溶于酒精,B正确;
C. 硫易溶于二硫化碳,C正确;
D. 硫无论在空气中还是在纯氧中燃烧的产物都是二氧化硫,而不是三氧化硫,如果要使硫转化为三氧化硫,需在催化剂并加热的条件下与氧气发生化合反应,D错误;
故选D。
二、填空题
11. 溶液由紫色变为红色 ③④ ①② ③ ④ 44.8
解析:(1)为酸性氧化物,向试管①紫色石蕊溶液中通入气体的实验现象为溶液由紫色变为红色。
(2)向试管②澄清石灰水中通入少量的气体,发生反应的离子方程式为。
(3)因为具有还原性,能使酸性高锰酸钾溶液褪色;具有漂白性,能使品红溶液褪色,所以上述实验中,出现溶液褪色现象的是③④。
(4)表现出酸性氧化物性质的是能使紫色石蕊溶液褪色;能与澄清石灰水反应,所以符合题意的是①②;表现出漂白性的是使品红溶液褪色,表现出还原性的是使酸性高锰酸钾溶液褪色。
(5)①在吸收塔中发生的反应的离子方程式为:,Br原子由Br2中0价降低到Br-中-1价,得到2个电子,S元素由SO2中+4价升高到 中+6价,失去2个电子,所以S元素转移2个电子给Br元素,故有②由发生的三个反应可知,最后在蒸馏塔中获得,理论上从酸化的海水开始,至少消耗为。
12. 与反应,罐内压强随气体的减少而减小 易拉罐中的铝与反应产生氢气
解析:(1)CO2能和氢氧化钠发生反应,CO2被吸收,与反应,罐内压强随气体的减少而减小,反应的离子方程式为:(或2NaOH+CO2═Na2CO3+H2O),
故答案为与反应,罐内压强随气体的减少而减小;(或2NaOH+CO2═Na2CO3+H2O);
(2)金属铝能和强碱反应生成氢气,导致罐内气体压强又增大而重新鼓起,金属铝能和强碱反应的实质是:,
故答案为易拉罐中的铝与反应产生氢气;。
三、计算题
13.7% 10.5g
解析:(1)消耗的O2物质的量:0.7mol =0.45mol,
生成的SO3物质的量:0.45mol×2=0.9mol,
SO2和SO3的物质的量和:=0.95mol,
依据硫元素守恒,反应前的SO2物质的量0.95mol,
SO2的转化率:=94.7%;
(2)依据(1)的计算可知混合气体中生成三氧化硫气体物质的量为0.9mol,在给定的条件下,溶液呈强酸性,BaSO3不会沉淀,因此BaSO4的质量=0.9mol×5%×233g/mol=10.5g。
14.25 13.82Kg 7.19% 665Kg
解析:(1)原料气中SO2的体积分数为7%,故10m3原料气中的SO2的体积为10m3×7%=0.7m3=700L,故标准状况下二氧化硫的物质的量为故答案为31.25;
(2)原料气中O2的体积分数为11%,故10m3原料气中的O2的体积为10m3×11%=1.1m3=1100L,故标准状况下氧气的物质的量为原料气中N2的体积分数为82%,故10m3原料气中的N2的体积为10m3×82%=8.2m3=8200L,故标准状况下氮气的物质的量为故标准状况下10m3原料气的质量为:31.25mol×64g/mol+49.11mol×32g/mol+366.07mol×28g/mol=13821.48≈13.82kg,答:标准状况下10m3原料气的质量为13.82kg;
(3)SO2的转化率为99.2%,则参加反应的二氧化硫的体积为10m3×7%×99.2%=0.6944m3,则:2SO2+O2=2SO3体积减少△V
2 2 1
6944m3 0.6944m3 0.3472m3
故反应后气体的体积为10m3-0.3472m3=9.6528m3,
故接触室导出的气体中SO3的体积为0.6944m3,体积分数为
答:接触室导出的气体中SO3的体积分数为7.19%;
(4)假设需要浓硫酸的质量为mg,则浓硫酸中硫酸的质量为mg×98g%=0.98mg,物质的量为浓硫酸中水的质量为mg-0.98mg=0.02mg,物质的量为故吸收三氧化硫后生成的硫酸的物质的量为发烟硫酸中硫酸的物质的量为0.01m mol+1000m3出口气体中三氧化硫的体积为1000m3×6.72%=67.2m3=67200L,SO3的物质的量为被水吸收后剩余的三氧化硫的物质的量为3000mol-
故,解得m=664615g=664.6kg,
答:吸收1000m3出口气体所需要的98%的硫酸的质量为664.6kg.
四、实验题
15.(1) 蒸馏烧瓶 冷凝回流硫酰氯(SO2Cl2) 碱石灰
(2)AD
(3)SO2Cl2+2H2O=H2SO4+2HCl
(4)调节装置甲、戊中液体滴入的速度,减慢气体通入丙(三口烧瓶)的速率;给丙(三口烧瓶)冷水浴,降温等
【分析】装置甲中利用70%硫酸与亚硫酸钠反应制取SO2,利用装置乙中浓硫酸干燥后进入装置丙中进行反应,戊装置中利用浓盐酸和高锰酸钾反应制取氯气,经装置丁中浓硫酸干燥后进入装置丙进行反应,在活性炭的催化作用下合成硫酰氯。
解析:(1)根据D仪器的结构特点可知其为蒸馏烧瓶;SO2Cl2熔沸点较低,容易挥发,所以利用装置A冷凝回流;为防止空气中的水蒸气进入,同时吸收未反应的SO2和Cl2,所以装置B中应盛放碱石灰;
(2)装置戊中KMnO4是作为氧化剂来氧化Cl-,五氧化二磷无法氧化Cl-,虽然二氧化锰可以氧化Cl-,但需要加热,图示没有加热装置,氯酸钾、漂白粉都可以和浓盐酸发生归中反应制取氯气,且不需要加热,故选AD;
(3)SO2Cl2易水解,若缺少装置乙和丁,水蒸气进入装置丙,发生反应:SO2Cl2+2H2O=H2SO4+2HCl;
(4)温度过高SO2Cl2会分解,而制取反应为放热反应,所以为了防止装置丙内温度过高,需控制反应速率,或者物理降温,具体方法有:调节装置甲、戊中液体滴入的速度,减慢气体通入丙(三口烧瓶)的速率;给丙(三口烧瓶)冷水浴,降温等。
16.(1)长颈漏斗
(2) C
(3)AD
(4)3.2
(5)
解析:(1)根据装置信息得到仪器m的名称为长颈漏斗;故答案为:长颈漏斗。
(2)若用铜和浓硫酸反应制备,需要加热才能生成二氧化硫气体,因此可选择如图中的装置C作发生装置,该反应的化学方程式为;故答案为:C;。
(3)A. 溶液和二氧化硫反应生成硫沉淀和水,故A符合题意;B. 溶液和二氧化硫不反应,故B不符合题意;C. 氯水与二氧化硫反应生成盐酸和硫酸,溶液不变浑浊,故C不符合题意;D. 溶液通入二氧化硫,生成亚硫酸,亚硫酸提供了氢离子,氢离子硝酸根、亚硫酸反应生成硫酸根,因此最终生成硫酸钡沉淀,故D符合题意;综上所述,答案为AD。
(4)若与装置E中的100 mL 0.2 酸性(物质的量为0.02mol)溶液恰好完全反应,根据方程式得到被氧化的二氧化硫物质的量为0.05mol,则被氧化的的质量为0.05mol×64g mol 1=3.2g;故答案为:3.2。
(5)若选用装置F进行尾气吸收,二氧化硫和氢氧化钠溶液反应生成亚硫酸钠和水,其反应的离子方程式为;故答案为:。
五、元素或物质推断题
17. 说明可能有CO32-,或可能有SO32-,或二者都可能有,因为二者水解均显碱性 一定有CO32-,一定没有SO32-,因SO2有刺激性气味 一定没有Br-、I-,因二者均能与氯水反应生成溴单质和碘单质,溴和碘单质溶于CCl4显色 一定有SO42-,因BaSO4不溶于盐酸 可能有Cl-,因为加入硝酸银溶液,可能会产生硫酸银白色沉淀
解析:分析:(1)实验①:CO和SO均水解显碱性,在碱性环境下可能存在。
(2)实验②:CO和SO均能和强酸反应生成气体二氧化碳和二氧化硫,二氧化硫气体有刺激性气味。
(3)实验③:氯气能将溴离子和碘离子氧化为碘单质和溴单质,二者在四氯化碳中溶解度很大,并且均是有颜色的。
(4)实验④:向溶液中加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解,则一定含有硫酸钡。
(5)实验⑤:溶液中加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀,可能为硫酸银沉淀,不一定为氯化银沉淀。
详解:(1)实验①:测得混合液呈碱性,而CO和SO水解显碱性,所以在碱性环境下可能含有CO32-或者含有SO32-或二者都存在;正确为 说明可能有CO32-,或可能有SO32-,或二者都可能有,因为二者水解均显碱性。
(2)实验②:CO和SO均能和强酸反应生成气体二氧化碳和二氧化硫,但是二氧化硫是有刺激性气味的气体,所以生成无色无味气体是二氧化碳,一定不存在SO离子,一定有CO离子;正确为 一定有CO32-,一定没有SO32-,因SO2有刺激性气味。
(3)实验③:氯气能将溴离子和碘离子氧化为碘单质和溴单质,二者在四氯化碳中溶解度很大,并且均是有颜色的;正确为一定没有Br-、I-,因二者均能与氯水反应生成溴单质和碘单质,溴和碘单质溶于CCl4显色。
(4)实验④:根据硫酸根离子的检验试剂是氯化钡,可以向溶液中加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解,则一定含有硫酸钡;正确为 一定有SO42-,因BaSO4不溶于盐酸。
(5)实验⑤:溶液中加HNO3酸化后, 再加过量AgNO3,如果溶液中含有SO42-,Ag+与SO42-也可生成硫酸银白色沉淀,不一定会产生氯化银沉淀,所以不能确定溶液中含有氯离子;正确为 可能有Cl-,因为加入硝酸银溶液,可能会产生硫酸银白色沉淀。
点睛:本题考查学生有关离子检验的知识,注意离子之间的反应以及离子共存知识是解题的关键,该题注重学生能力的考查。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
