四川省眉山市仁寿县第一中学2024-2025学年高一上学期1月期末化学试题(含答案)
文档属性
| 名称 | 四川省眉山市仁寿县第一中学2024-2025学年高一上学期1月期末化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-22 22:16:05 | ||
图片预览




文档简介
1
2024-2025学年高一上半期期末考试
化学试题
一、单选题
1. 化学与生活紧密相关,下列说法错误的是
A. BaSO4可用于胃部X射线造影检查
B. Na2CO3可用作食用碱,也可用于治疗胃酸过多
C. 氮氧化物的大量排放可引起光化学烟雾
D. SO2可用作纸张、草席编织品的漂白剂
2. 下列化学用语正确的是
A. NH3的结构模型: B. 氯原子的结构示意图:
C. HCl的电子式: D. 次氯酸的结构式:H—O—Cl
3. 用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 1.8gD2O含有中子数NA
B. 3.2gO2和O3的混合气体中含有的氧原子数为0.2NA
C. 7.8gNa2O2与足量水反应,转移的电子数为0.2NA
D. 标况下,22.4LCCl4所含分子数为NA
4. 短周期元素W、X、Y、Z的原子序数依次增大,X与W、Z相邻,且X、Z同主族,W、X、Y、Z的最外层电子数之和为18,Y的金属性是短周期元素中最强的。下列说法正确的是
A. 简单离子半径:X>Y>Z B. 简单氢化物的稳定性:W>X
C. Y、Z形成的化合物中含有离子键 D. W的氧化物的水化物均为强酸
5. 工业干法制备高铁酸钠的反应为:,设为阿伏加德罗常数的值。下列说法正确的是
A. 1L溶液中含氧原子的总数为
B. 当产生2.24L(标准状况下)时,转移电子数为
C. 0.1mol含有的质子总数为
D. 0.1mol中含O—O键的数目为
6. 为除去括号内的杂质,所选用的试剂或方法正确的是
A. CO2(HCl):将混合气体通过足量的饱和碳酸钠溶液
B. Na2CO3固体粉末(NaHCO3):加热到固体质量不再减轻为止
C. NaHCO3溶液(Na2CO3):向溶液中加入过量Ca(OH)2溶液,过滤
D. Cl2(HCl):将混合气体通过浓硫酸
7. 某化学小组用“84消毒液”(主要成分是NaClO)制备氯气并探究其性质,进行如图所示的实验(a~d中均为浸有相应试液的棉花,夹持装置省略)。下列说法正确的是
A. a处变为蓝色,b处变为橙色,说明Cl2具有氧化性
B. c处褪色,说明Cl2具有还原性
C. d处褪色,一定是因酚酞被氧化而引起
D. 为防止尾气污染空气,应使用饱和食盐水吸收尾气
8. 室温下,下列各组离子在指定溶液中能大量共存的是
A. 澄清透明的溶液中:Cu2+、Fe3+、Cl-、SO
B. pH=2的溶液中:Ca2+、Fe2+、ClO-、Br-
C. 0.1mol L-1的HI溶液中:Na+、K+、MnO、CO
D. 含有大量CO的溶液中:NH、H+、NO、ClO
9. 将SO2分别通入下列四种溶液,根据实验现象所得结论正确的是
选项 溶液 现象 结论
A 溴水溶液 溴水褪色 SO2具有漂白性
B H2S溶液 出现淡黄色浑浊 SO2具有氧化性
C BaCl2溶液 无明显变化 BaSO4能溶于水
D H2O2溶液 无明显变化 SO2和H2O2溶液不反应
A. A B. B C. C D. D
10. 下列物质性质实验对应的离子方程式书写正确的是
A. 铁溶解在稀硝酸中:
B. 铝溶解在NaOH溶液中:
C. SO2通入酸性KMnO4溶液中:
D. Na2S2O3溶液中加入稀硫酸:
11. 氨催化氧化法制硝酸的过程为,下列叙述正确的是
A. 制备的化学方程式为
B. 标准状况下,含氢原子数目约为
C. 与足量混合生成的分子数与参加反应的分子数相等
D. 在吸收塔中充入空气的目的是提高的原子利用率
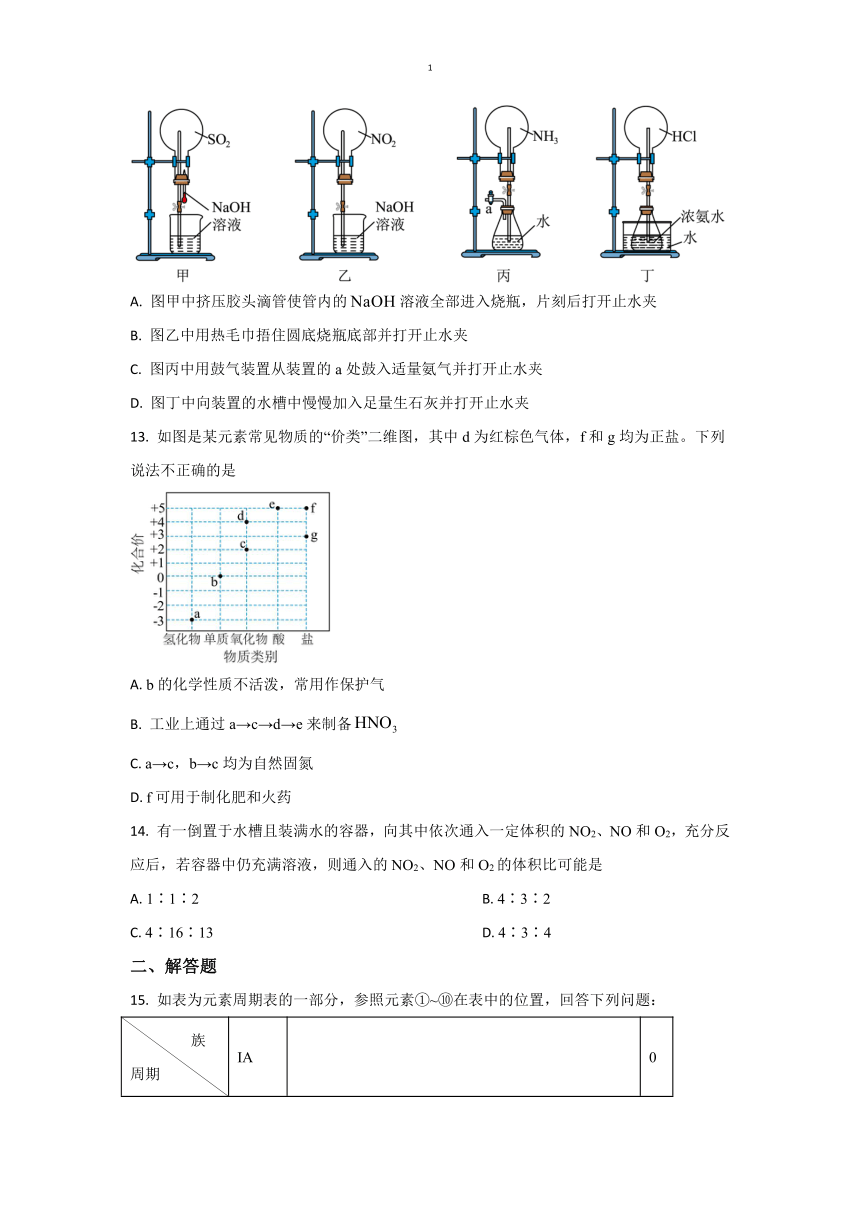
12. 如图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉现象的是
A. 图甲中挤压胶头滴管使管内的溶液全部进入烧瓶,片刻后打开止水夹
B. 图乙中用热毛巾捂住圆底烧瓶底部并打开止水夹
C. 图丙中用鼓气装置从装置的a处鼓入适量氨气并打开止水夹
D. 图丁中向装置的水槽中慢慢加入足量生石灰并打开止水夹
13. 如图是某元素常见物质的“价类”二维图,其中d为红棕色气体,f和g均为正盐。下列说法不正确的是
A. b的化学性质不活泼,常用作保护气
B. 工业上通过a→c→d→e来制备
C. a→c,b→c均为自然固氮
D. f可用于制化肥和火药
14. 有一倒置于水槽且装满水的容器,向其中依次通入一定体积的NO2、NO和O2,充分反应后,若容器中仍充满溶液,则通入的NO2、NO和O2的体积比可能是
A. 1∶1∶2 B. 4∶3∶2
C. 4∶16∶13 D. 4∶3∶4
二、解答题
15. 如表为元素周期表的一部分,参照元素①~⑩在表中的位置,回答下列问题:
族周期 IA
0
1 ① IIA IIIA IVA VA VIA VIIA
2
② ③ ④
3 ⑤
⑥ ⑦ ⑧ ⑨ ⑩
(1)写出元素锗(Ge,原子序数32)在元素周期表中的位置_______。
(2)第三周期中非金属性最强的元素的原子形成简单离子的结构示意图为_______。
(3)③⑦⑧最高价氧化物对应水化物酸性由强到弱的顺序为(填化学式)_______。
(4)写出②的单质在足量④的单质中燃烧产物的电子式_______。用电子式表示⑤和⑩组成简单化合物的形成过程______。
(5)④和⑨的单质均能与H2反应生成的H2R型化合物,请判断这两种H2R型化合物的热稳定性_______>______(填化学式)_______,从原子结构角度解释原因_______。
(6)由表中①、③、④、⑥、⑩元素形成的常见物质Z、M、N可发生以下反应:
i.M中所含的化学键种类为_______(填字母)。
a.离子键 b.极性共价键 c.非极性共价键
ii.生成Z和M的离子方程式_______。
iii.Z→N的化学方程式______。
16. 氮及其化合物在农业、医药、国防等领域应用广泛。请回答下列问题
(1)实验室加热和固体混合物制取,反应的化学方程式是___________。
(2)工业合成氨及氨氧化制取硝酸的流程示意图如下。
①合成塔中生成,说明具有___________(填“氧化性”或“还原性”)。
②氧化炉中转化为,发生反应的化学方程式是___________。
③吸收塔中最终可转化为。通入空气是为了提供___________(填字母)。
a. b. c.
④尾气处理装置中,可用将尾气中还原为。反应的化学方程式是___________。
(3)氮元素含量过高会造成水体污染,添加铁粉能够提高氮的脱除率,工艺如下图所示。试从价态角度分析原因___________。
17. 以黄铁矿(主要成分)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
回答问题:
(1)写出黄铁矿煅烧的化学方程式_______。
(2)由炉渣制备还原铁粉的化学方程式为_______。
(3)欲得到更纯的,反应①应通入_______(填“过量”或“不足量”)的气体。
(4)因为具有_______性,导致商品中不可避免地存在检验其中含有的方法是_______。
18. 铝的单质和化合物广泛应用于日常生活中。工业上用铝土矿(主要成分是、含有和)和萤石(主要成分为)联合制取铝的工艺流程如图所示:
已知:不溶于酸
(1)提高“酸浸”时溶出率的方法有_______(任写2种)。
(2)“滤渣2”的化学式是_______。
(3)“酸化2”产生和HF气体的化学方程式为_______。
(4)写出“酸化1”过程制备的离子方程式:_______。
(5)生产过程中,可以循环使用的物质除外还有_______(填两种物质化学式)。
(6)“碱浸”时选用不用氨水的原因是_______。
(7)写出“混合”过程制取冰晶石,并放出气体的化学方程式_______。
2024-2025学年高一上半期期末考试
化学试题
一、单选题
1.
【答案】B
2.
【答案】D
3.
【答案】B
4.
【答案】C
5.
【答案】C
6.
【答案】B
7.
【答案】A
8.
【答案】A
9.
【答案】B
10.
【答案】D
11.
【答案】D
12.
【答案】C
13.
【答案】C
14.
【答案】C
二、解答题
15.
【答案】(1)第四周期第IVA族
(2)(3)HNO3>H3PO4>H2SiO3
(4) ①. ②.
(5) ①. H2O>H2S ②. O与S为同主族元素,最外层电子数相同,电子层数O小于S,原子半径O小于S,得电子能力O大于S,非金属性O强于S,故H2O的稳定性大于H2S
(6) ①a、b ②. Al3++3NH3+3H2O=Al(OH)3↓+3NH或Al3++3NH3 H2O=Al(OH)3↓+3NH ③. 2Al(OH)3Al2O3+3H2O
16.
【答案】(1)
(2) ①. 氧化性 ②. ③. a ④.
(3)铁粉能够失去电子,具有还原性,可促进还原为,进而转化为
17.
【答案】(1)4FeS2+11O22Fe2O3+8SO2
(2)Fe2O3+3CO2Fe+3CO2
(3)过量(4) ①. 还原 ②. 首先用盐酸酸化,除去S2,再加入氯化钡溶液,看有无白色沉淀生成,若生成白色沉淀,证明含有,否则没有
18.
【答案】(1)加热、搅拌、粉碎、适当增大盐酸浓度等合理即可
(2)
(3)
(4)
(5)、CaO
(6)不溶于氨水,而溶于NaOH溶液
(7)
2024-2025学年高一上半期期末考试
化学试题
一、单选题
1. 化学与生活紧密相关,下列说法错误的是
A. BaSO4可用于胃部X射线造影检查
B. Na2CO3可用作食用碱,也可用于治疗胃酸过多
C. 氮氧化物的大量排放可引起光化学烟雾
D. SO2可用作纸张、草席编织品的漂白剂
2. 下列化学用语正确的是
A. NH3的结构模型: B. 氯原子的结构示意图:
C. HCl的电子式: D. 次氯酸的结构式:H—O—Cl
3. 用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 1.8gD2O含有中子数NA
B. 3.2gO2和O3的混合气体中含有的氧原子数为0.2NA
C. 7.8gNa2O2与足量水反应,转移的电子数为0.2NA
D. 标况下,22.4LCCl4所含分子数为NA
4. 短周期元素W、X、Y、Z的原子序数依次增大,X与W、Z相邻,且X、Z同主族,W、X、Y、Z的最外层电子数之和为18,Y的金属性是短周期元素中最强的。下列说法正确的是
A. 简单离子半径:X>Y>Z B. 简单氢化物的稳定性:W>X
C. Y、Z形成的化合物中含有离子键 D. W的氧化物的水化物均为强酸
5. 工业干法制备高铁酸钠的反应为:,设为阿伏加德罗常数的值。下列说法正确的是
A. 1L溶液中含氧原子的总数为
B. 当产生2.24L(标准状况下)时,转移电子数为
C. 0.1mol含有的质子总数为
D. 0.1mol中含O—O键的数目为
6. 为除去括号内的杂质,所选用的试剂或方法正确的是
A. CO2(HCl):将混合气体通过足量的饱和碳酸钠溶液
B. Na2CO3固体粉末(NaHCO3):加热到固体质量不再减轻为止
C. NaHCO3溶液(Na2CO3):向溶液中加入过量Ca(OH)2溶液,过滤
D. Cl2(HCl):将混合气体通过浓硫酸
7. 某化学小组用“84消毒液”(主要成分是NaClO)制备氯气并探究其性质,进行如图所示的实验(a~d中均为浸有相应试液的棉花,夹持装置省略)。下列说法正确的是
A. a处变为蓝色,b处变为橙色,说明Cl2具有氧化性
B. c处褪色,说明Cl2具有还原性
C. d处褪色,一定是因酚酞被氧化而引起
D. 为防止尾气污染空气,应使用饱和食盐水吸收尾气
8. 室温下,下列各组离子在指定溶液中能大量共存的是
A. 澄清透明的溶液中:Cu2+、Fe3+、Cl-、SO
B. pH=2的溶液中:Ca2+、Fe2+、ClO-、Br-
C. 0.1mol L-1的HI溶液中:Na+、K+、MnO、CO
D. 含有大量CO的溶液中:NH、H+、NO、ClO
9. 将SO2分别通入下列四种溶液,根据实验现象所得结论正确的是
选项 溶液 现象 结论
A 溴水溶液 溴水褪色 SO2具有漂白性
B H2S溶液 出现淡黄色浑浊 SO2具有氧化性
C BaCl2溶液 无明显变化 BaSO4能溶于水
D H2O2溶液 无明显变化 SO2和H2O2溶液不反应
A. A B. B C. C D. D
10. 下列物质性质实验对应的离子方程式书写正确的是
A. 铁溶解在稀硝酸中:
B. 铝溶解在NaOH溶液中:
C. SO2通入酸性KMnO4溶液中:
D. Na2S2O3溶液中加入稀硫酸:
11. 氨催化氧化法制硝酸的过程为,下列叙述正确的是
A. 制备的化学方程式为
B. 标准状况下,含氢原子数目约为
C. 与足量混合生成的分子数与参加反应的分子数相等
D. 在吸收塔中充入空气的目的是提高的原子利用率
12. 如图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉现象的是
A. 图甲中挤压胶头滴管使管内的溶液全部进入烧瓶,片刻后打开止水夹
B. 图乙中用热毛巾捂住圆底烧瓶底部并打开止水夹
C. 图丙中用鼓气装置从装置的a处鼓入适量氨气并打开止水夹
D. 图丁中向装置的水槽中慢慢加入足量生石灰并打开止水夹
13. 如图是某元素常见物质的“价类”二维图,其中d为红棕色气体,f和g均为正盐。下列说法不正确的是
A. b的化学性质不活泼,常用作保护气
B. 工业上通过a→c→d→e来制备
C. a→c,b→c均为自然固氮
D. f可用于制化肥和火药
14. 有一倒置于水槽且装满水的容器,向其中依次通入一定体积的NO2、NO和O2,充分反应后,若容器中仍充满溶液,则通入的NO2、NO和O2的体积比可能是
A. 1∶1∶2 B. 4∶3∶2
C. 4∶16∶13 D. 4∶3∶4
二、解答题
15. 如表为元素周期表的一部分,参照元素①~⑩在表中的位置,回答下列问题:
族周期 IA
0
1 ① IIA IIIA IVA VA VIA VIIA
2
② ③ ④
3 ⑤
⑥ ⑦ ⑧ ⑨ ⑩
(1)写出元素锗(Ge,原子序数32)在元素周期表中的位置_______。
(2)第三周期中非金属性最强的元素的原子形成简单离子的结构示意图为_______。
(3)③⑦⑧最高价氧化物对应水化物酸性由强到弱的顺序为(填化学式)_______。
(4)写出②的单质在足量④的单质中燃烧产物的电子式_______。用电子式表示⑤和⑩组成简单化合物的形成过程______。
(5)④和⑨的单质均能与H2反应生成的H2R型化合物,请判断这两种H2R型化合物的热稳定性_______>______(填化学式)_______,从原子结构角度解释原因_______。
(6)由表中①、③、④、⑥、⑩元素形成的常见物质Z、M、N可发生以下反应:
i.M中所含的化学键种类为_______(填字母)。
a.离子键 b.极性共价键 c.非极性共价键
ii.生成Z和M的离子方程式_______。
iii.Z→N的化学方程式______。
16. 氮及其化合物在农业、医药、国防等领域应用广泛。请回答下列问题
(1)实验室加热和固体混合物制取,反应的化学方程式是___________。
(2)工业合成氨及氨氧化制取硝酸的流程示意图如下。
①合成塔中生成,说明具有___________(填“氧化性”或“还原性”)。
②氧化炉中转化为,发生反应的化学方程式是___________。
③吸收塔中最终可转化为。通入空气是为了提供___________(填字母)。
a. b. c.
④尾气处理装置中,可用将尾气中还原为。反应的化学方程式是___________。
(3)氮元素含量过高会造成水体污染,添加铁粉能够提高氮的脱除率,工艺如下图所示。试从价态角度分析原因___________。
17. 以黄铁矿(主要成分)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
回答问题:
(1)写出黄铁矿煅烧的化学方程式_______。
(2)由炉渣制备还原铁粉的化学方程式为_______。
(3)欲得到更纯的,反应①应通入_______(填“过量”或“不足量”)的气体。
(4)因为具有_______性,导致商品中不可避免地存在检验其中含有的方法是_______。
18. 铝的单质和化合物广泛应用于日常生活中。工业上用铝土矿(主要成分是、含有和)和萤石(主要成分为)联合制取铝的工艺流程如图所示:
已知:不溶于酸
(1)提高“酸浸”时溶出率的方法有_______(任写2种)。
(2)“滤渣2”的化学式是_______。
(3)“酸化2”产生和HF气体的化学方程式为_______。
(4)写出“酸化1”过程制备的离子方程式:_______。
(5)生产过程中,可以循环使用的物质除外还有_______(填两种物质化学式)。
(6)“碱浸”时选用不用氨水的原因是_______。
(7)写出“混合”过程制取冰晶石,并放出气体的化学方程式_______。
2024-2025学年高一上半期期末考试
化学试题
一、单选题
1.
【答案】B
2.
【答案】D
3.
【答案】B
4.
【答案】C
5.
【答案】C
6.
【答案】B
7.
【答案】A
8.
【答案】A
9.
【答案】B
10.
【答案】D
11.
【答案】D
12.
【答案】C
13.
【答案】C
14.
【答案】C
二、解答题
15.
【答案】(1)第四周期第IVA族
(2)(3)HNO3>H3PO4>H2SiO3
(4) ①. ②.
(5) ①. H2O>H2S ②. O与S为同主族元素,最外层电子数相同,电子层数O小于S,原子半径O小于S,得电子能力O大于S,非金属性O强于S,故H2O的稳定性大于H2S
(6) ①a、b ②. Al3++3NH3+3H2O=Al(OH)3↓+3NH或Al3++3NH3 H2O=Al(OH)3↓+3NH ③. 2Al(OH)3Al2O3+3H2O
16.
【答案】(1)
(2) ①. 氧化性 ②. ③. a ④.
(3)铁粉能够失去电子,具有还原性,可促进还原为,进而转化为
17.
【答案】(1)4FeS2+11O22Fe2O3+8SO2
(2)Fe2O3+3CO2Fe+3CO2
(3)过量(4) ①. 还原 ②. 首先用盐酸酸化,除去S2,再加入氯化钡溶液,看有无白色沉淀生成,若生成白色沉淀,证明含有,否则没有
18.
【答案】(1)加热、搅拌、粉碎、适当增大盐酸浓度等合理即可
(2)
(3)
(4)
(5)、CaO
(6)不溶于氨水,而溶于NaOH溶液
(7)
同课章节目录
