2024-2025学年高三化学二轮复习 电解质溶液图像题分析 讲义(含解析)
文档属性
| 名称 | 2024-2025学年高三化学二轮复习 电解质溶液图像题分析 讲义(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 696.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-25 21:52:45 | ||
图片预览


文档简介
电解质溶液图像题分析
课前学习任务
核心归纳
1.酸碱中和滴定曲线
氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线 盐酸滴定等浓度等体积的氢氧化钠溶液、氨水的滴定曲线
曲线起点不同。强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高
突跃点变化范围不同。强碱与强酸反应的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)
室温下pH=7不一定是终点。强碱与强酸反应时,终点pH=7;强碱与弱酸反应终点pH>7,强酸与弱碱反应终点pH<7
2.滴定图像的五点突破方法
(1)“起始”点:判断酸、碱的相对强弱;
(2)“半”点:判断是哪些溶质的等量混合;
(3)“恰好”点:判断生成的溶质成分及溶液的酸碱性;
(4)“中性”点:判断溶液中溶质的成分及哪些物质过量或不足;
(5)“过量”点:判断溶液中的溶质组成,并判断哪些物质过量。
3.透析分布曲线,确定思维方向
分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。
一元弱酸(以 CH3COOH为例) 二元弱酸(以 H2C2O4为例)
注:pKa为电离常数的 负对数
δ0为CH3COOH的分布系数,δ1为CH3COO-的分布系数 δ0为H2C2O4的分布系数,δ1为的分布系数,δ2为的分布系数
4.明确解题要领,快速准确作答
(1)“读曲线”——每条曲线所代表的粒子及变化趋势;
(2)“读浓度”——通过横坐标轴的垂线,可读出某pH时的粒子浓度相对大小;
(3)“用交点”——交点是某两种粒子浓度相等的点,可计算电离常数K;
(4)“可替换”——根据溶液中的元素质量守恒进行替换,分析得出结论。
5.常考的对数图像类型
类型 含义 变化规律 解题策略
pH= -lg c(H+) 氢离子浓度的常用对数负值 pH越大,c(H+)越小,溶液的碱性越强 ①先弄清是对数还是负对数 ②弄清楚是什么的对数,如浓度对数、浓度比对数、体积比对数等 ③弄清楚对数变化所表示的意义
pC= -lg c(C) C离子浓度的常用对数负值 pC越大,c(C)越小
lg 生成物与反应物离子浓度比的常用对数 lg越大,反应向正反应方向进行的程度越大
lg 稀释后与稀释前体积比的常用对数 lg越大,稀释程度越大
AG= lg 氢离子与氢氧根离子浓度比的常用对数 AG越大,酸性越强,中性时,=1,AG=0
6.破解对数图像的数据
(1)运算法则:lg ab=lg a+lg b、lg =lg a-lg b、lg 1=0。
(2)运算突破点:如lg =0的点有c(A)=c(B);lg c(D)=0的点有c(D)=。
课堂学习任务
命题点1 滴定曲线分析
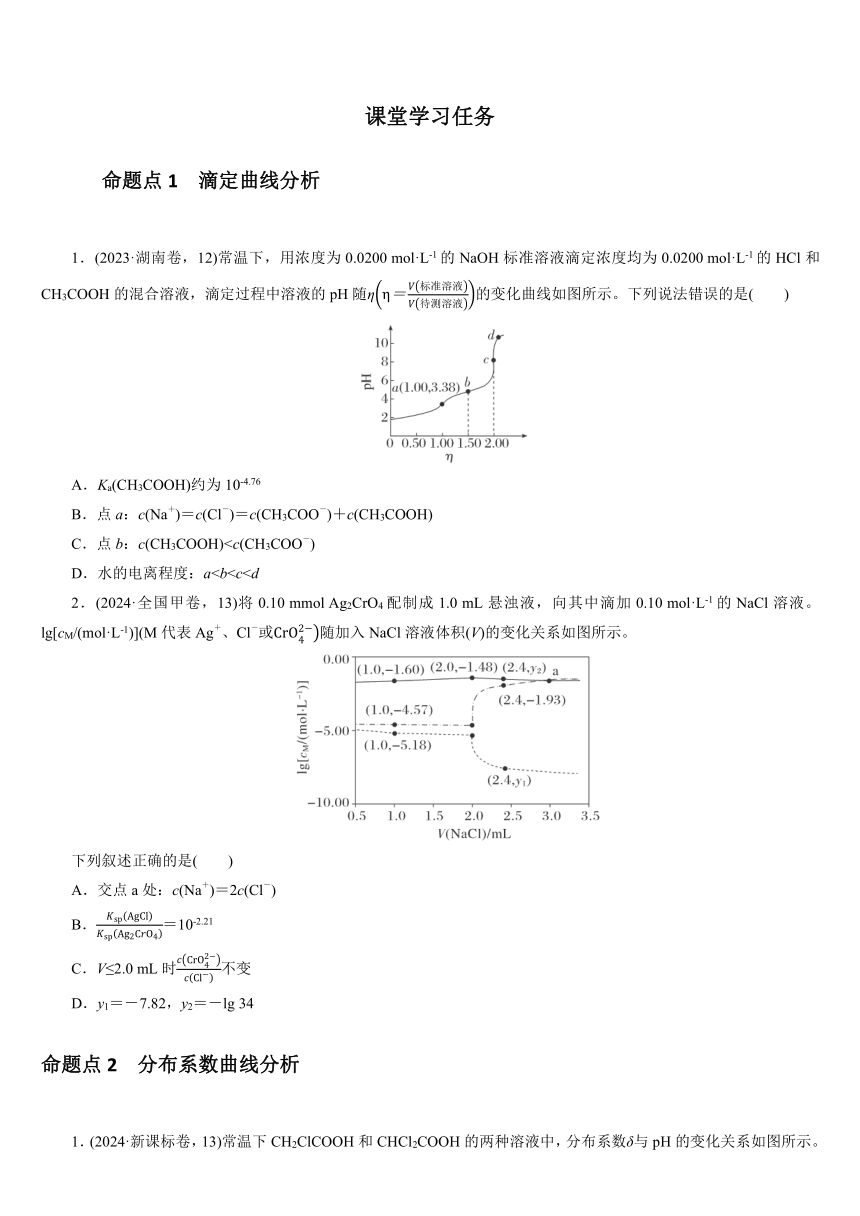
1.(2023·湖南卷,12)常温下,用浓度为0.0200 mol·L-1的NaOH标准溶液滴定浓度均为0.0200 mol·L-1的HCl和CH3COOH的混合溶液,滴定过程中溶液的pH随η的变化曲线如图所示。下列说法错误的是( )
A.Ka(CH3COOH)约为10-4.76
B.点a:c(Na+)=c(Cl-)=c(CH3COO-)+c(CH3COOH)
C.点b:c(CH3COOH)D.水的电离程度:a2.(2024·全国甲卷,13)将0.10 mmol Ag2CrO4配制成1.0 mL悬浊液,向其中滴加0.10 mol·L-1的NaCl溶液。lg[cM/(mol·L-1)](M代表Ag+、Cl-或随加入NaCl溶液体积(V)的变化关系如图所示。
下列叙述正确的是( )
A.交点a处:c(Na+)=2c(Cl-)
B.=10-2.21
C.V≤2.0 mL时不变
D.y1=-7.82,y2=-lg 34
命题点2 分布系数曲线分析
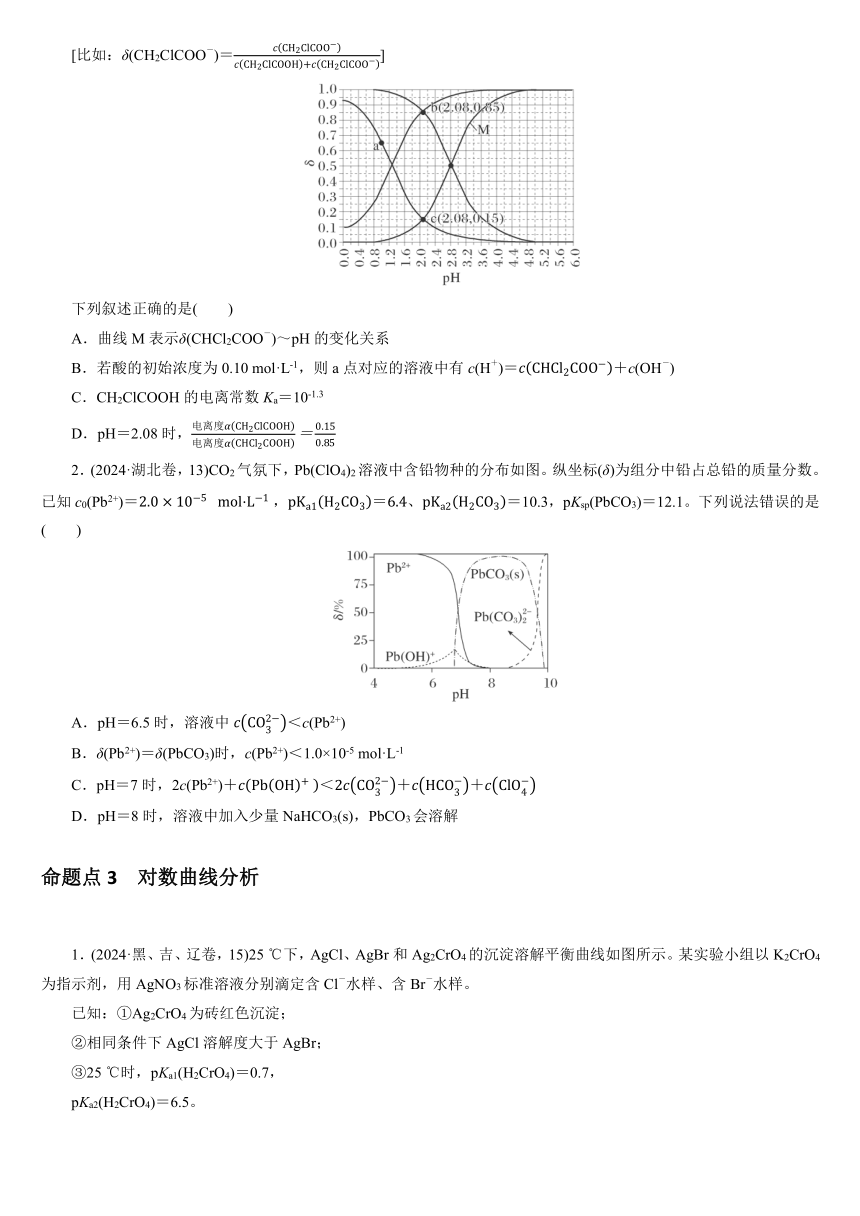
1.(2024·新课标卷,13)常温下CH2ClCOOH和CHCl2COOH的两种溶液中,分布系数δ与pH的变化关系如图所示。
[比如:δ(CH2ClCOO-)=]
下列叙述正确的是( )
A.曲线M表示δ(CHCl2COO-)~pH的变化关系
B.若酸的初始浓度为0.10 mol·L-1,则a点对应的溶液中有c(H+)=+c(OH-)
C.CH2ClCOOH的电离常数Ka=10-1.3
D.pH=2.08时,
2.(2024·湖北卷,13)CO2气氛下,Pb(ClO4)2溶液中含铅物种的分布如图。纵坐标(δ)为组分中铅占总铅的质量分数。已知c0(Pb2+)==10.3,pKsp(PbCO3)=12.1。下列说法错误的是( )
A.pH=6.5时,溶液中<c(Pb2+)
B.δ(Pb2+)=δ(PbCO3)时,c(Pb2+)<1.0×10-5 mol·L-1
C.pH=7时,2c(Pb2+)+++
D.pH=8时,溶液中加入少量NaHCO3(s),PbCO3会溶解
命题点3 对数曲线分析
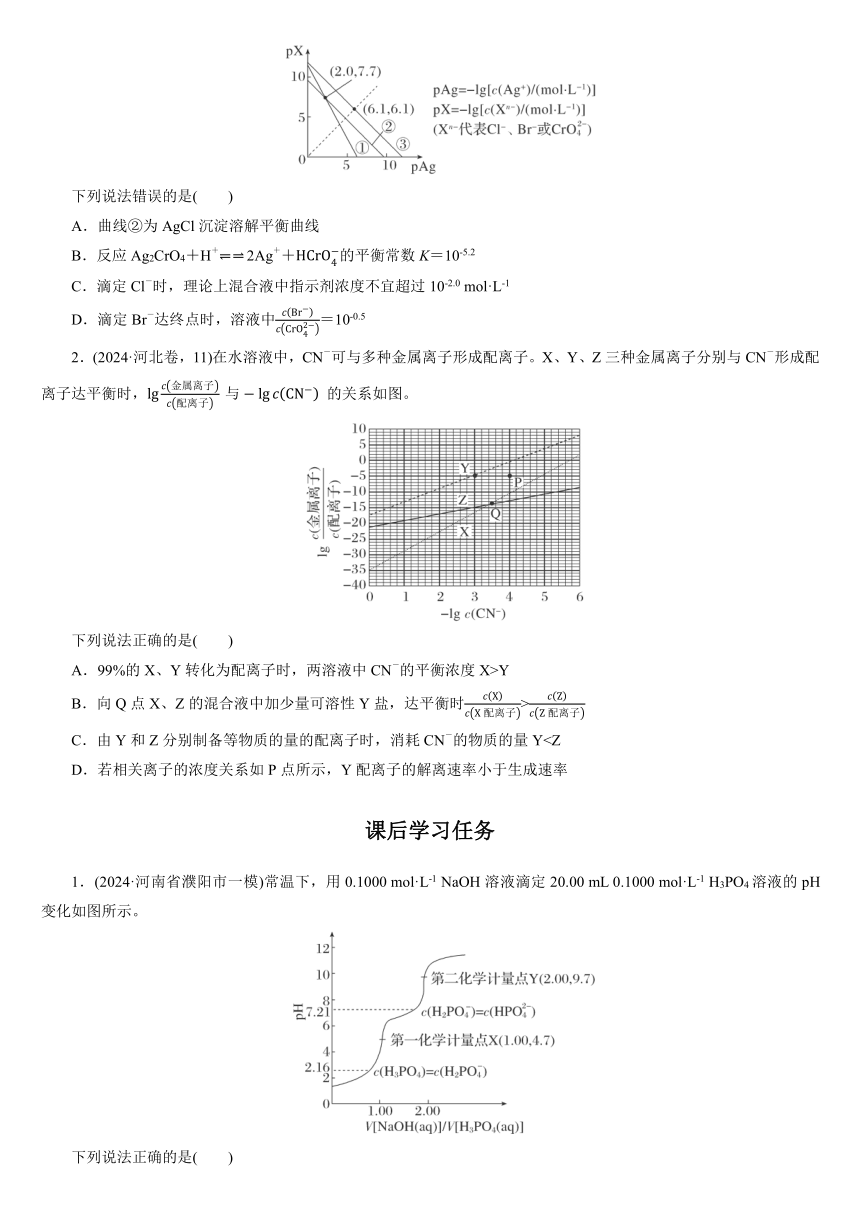
1.(2024·黑、吉、辽卷,15)25 ℃下,AgCl、AgBr和Ag2CrO4的沉淀溶解平衡曲线如图所示。某实验小组以K2CrO4为指示剂,用AgNO3标准溶液分别滴定含Cl-水样、含Br-水样。
已知:①Ag2CrO4为砖红色沉淀;
②相同条件下AgCl溶解度大于AgBr;
③25 ℃时,pKa1(H2CrO4)=0.7,
pKa2(H2CrO4)=6.5。
下列说法错误的是( )
A.曲线②为AgCl沉淀溶解平衡曲线
B.反应Ag2CrO4+H+ 2Ag++的平衡常数K=10-5.2
C.滴定Cl-时,理论上混合液中指示剂浓度不宜超过10-2.0 mol·L-1
D.滴定Br-达终点时,溶液中=10-0.5
2.(2024·河北卷,11)在水溶液中,CN-可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与CN-形成配离子达平衡时, 的关系如图。
下列说法正确的是( )
A.99%的X、Y转化为配离子时,两溶液中CN-的平衡浓度X>Y
B.向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时>
C.由Y和Z分别制备等物质的量的配离子时,消耗CN-的物质的量YD.若相关离子的浓度关系如P点所示,Y配离子的解离速率小于生成速率
课后学习任务
1.(2024·河南省濮阳市一模)常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 H3PO4溶液的pH变化如图所示。
下列说法正确的是( )
A.先用甲基橙作指示剂,滴定终点时溶液由红色变为橙色
B.X点到Y点发生的反应为H3PO4++2H2O
C.常温下的水解常数小于其电离常数
D.常温下,H3PO4+的平衡常数K=105.05
2.(2024·广东省江门市一模)常温下,向10.00 mL 0.1 mol·L-1 MOH碱溶液中滴加0.1 mol·L-1盐酸,溶液的pH及导电能力随滴加盐酸体积的变化曲线如图所示。下列说法正确的是( )
A.MOH的电离方程式为MOH=M++OH-
B.水的电离程度:c>a>b
C.b点溶液中c(Cl-)=c(M+)+c(MOH)
D.c点溶液中c(Cl-)>c(M+)>c(H+)>c(OH-)
3.(2024·河南省信阳市一模)配离子的稳定性可用K不稳衡量,如[Ag(NH3)2]+的K不稳=。一定温度下,向0.1 mol·L-1硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3 [Ag(NH3)2]+,溶液中pNH3与δ(X)的关系如图所示,其中pNH3=-lg c(NH3)、δ(X)=(X代表Ag+或[Ag(NH3)2]+)。已知该温度下Ksp(AgCl)=1.6×10-10。下列说法正确的是( )
Ag+和[Ag(NH3)2]+的分布系数图
A.图中δ2代表的是δ(Ag+)
B.该溶液中c(Ag+)+c([Ag(NH3)2]+)+=
C.向该溶液中滴入稀硝酸,δ([Ag(NH3)2]+)增大
D.AgCl溶于氨水时+Cl-平衡常数为K=1.6×10-2.7
4.(2024·九省联考江西卷)一定温度下,H2SO3水溶液中H2SO3、、的分布分数δ与pH的关系如下图。例如=。向0.5 L浓度为0.10 mol·L-1的氨水中通入SO2气体。已知该温度下Kb(NH3·H2O)=2×10-5,lg 2≈0.3,Kw≈1×10-14,下列说法正确的是( )
A.通入0.05 mol SO2时,c(NH3·H2O)+c(OH-)=+c(H2SO3)+c(H+)
B.当=1时,=2×104
C.当pH=7.0时+
D.P点时溶液的pH值为8.3
5.(2024·河南省五市3月联考)25 ℃时,用 NaOH 溶液滴定H2A 溶液,溶液中和-lg c(HA-)或-lg和-lg c(A2-)关系如图所示,下列说法正确的是( )
A.H2A 为弱酸,其Ka1约为10-4
B.滴定过程中,当pH=5时,c(Na+)>3c(A2-)
C.水的电离程度:M点<N点
D.向 H2A 溶液中加入等体积等浓度的NaOH溶液完全反应后的溶液中:c(OH-)+c(A2-)=c(H+)+2c(H2A)
6.(2024·湖北省十一校3月联考)已知MgF2难溶于水、可溶于酸。常温下,用HCl调节MgF2浊液的pH,测得在不同pH条件下,体系中-lg c(X)(X为Mg2+或F-)与lg的关系如图所示。下列说法错误的是( )
A.L2代表-lg c(Mg2+)与lg的变化曲线
B.c点的纵坐标值为2.8
C.MgF2(s)+2H+(aq) Mg2+(aq)+2HF(aq),该反应的平衡常数K=100
D.c点的溶液中存在c(Cl-)>c(Mg2+)=c(HF)>c(H+)
答案与解析
课堂学习任务
命题点1 滴定曲线分析
1.D 图像分析
根据CH3COOH CH3COO-+H+,可近似认为a点c(H+)=c(CH3 COO-),又a点pH=3.38,c(H+)=10-3.38 mol·L-1,故Ka(CH3COOH)≈2.D Ag2CrO4完全转化为AgCl需消耗2.0 mL NaCl溶液,结合题图知,V(NaCl)=2.0 mL以后,曲线从上到下分别代表Cl-、Ag+,由图可知,a点处c(Ag+)<10-5 mol·L-1(忽略),根据电荷守恒c(Na+)+c(H+)+c(Ag+)=c(Cl-)+c(OH-)+,由于a点处c(Cl-)=≠2c(Cl-),A错误;V(NaCl)=1.0 mL时,溶液中存在Ag2CrO4和部分AgCl沉淀,因此溶液中满足Ksp(Ag2CrO4)=,即lg[Ksp(Ag2CrO4)]==2×(-5.18)+(-1.60)=-11.96,Ksp(Ag2CrO4)=10-11.96,同理,Ksp(AgCl)=10-9.75,则=102.21,B错误;在滴加NaCl溶液的最初阶段,滴入的Cl-的量极少,尚不足以生成AgCl沉淀,滴入的Cl-全部以离子形式存在,其浓度随着NaCl溶液的滴入而增大,由于Cl-未与Ag+发生作用,此时溶液仍为Ag2CrO4的饱和溶液,其中=,为定值,因此在此阶段,随着NaCl溶液的滴入而减小,当部分Ag2CrO4转化为AgCl后,结合沉淀转化反应为可逆反应知,当V(NaCl)≤2.0 mL时,体系中仍存在Ag2CrO4沉淀,溶液中满足Ksp(Ag2CrO4)=、Ksp(AgCl)=c(Ag+)·c(Cl-),两式相除得,其中会随着NaCl溶液的滴加而增大,C错误;V(NaCl)=2.4 mL时,体系中有AgCl沉淀,溶液中满足lg[Ksp(AgCl)]=lg[c(Ag+)]+lg[c(Cl-)],代入数据-9.75=y1+(-1.93),得y1=-7.82,假设此时溶液中仍存在Ag2CrO4,则lg[Ksp(Ag2CrO4)]=2lg[c(Ag+)]+,代入数据-11.96=2×(-7.82)+,得=3.68,即=103.68 mol·L-1,远超过Ag2CrO4全部溶解所得的浓度,因此此时溶液中不存在Ag2CrO4沉淀,Ag2CrO4已全部溶解,故= mol·=lg=-lg 34,D正确。
命题点2 分布系数曲线分析
1.D
Cl的电负性大于H的电负性,则—CHCl2的极性大于—CH2Cl的极性,导致CHCl2COOH的酸性大于CH2ClCOOH的酸性,则CHCl2COOH溶液中的大于CH2ClCOOH溶液中的δ(CH2ClCOO-),则曲线M表示~pH的变化关系,A项错误;由于CH2ClCOOH与CHCl2COOH均为弱酸,当初始浓度为0.10 mol·L-1时,pH>1,而a点溶液的pH=1,故需外加酸使pH减小,题给关系式中缺少外加酸中阴离子的浓度,B项错误;Ka(CH2ClCOOH)=根据上图d点可知,pH=2.8时,c(CH2ClCOOH)=c(CH2ClCOO-),则Ka(CH2ClCOOH)=c(H+)=10-2.8,C项错误;pH=2.08时,δ(CHCl2COO-)=0.85,δ(CH2ClCOO-)=0.15,则CH2ClCOOH与CHCl2COOH的电离度之比为0.15∶0.85,D项正确。
2.D 由图可知,pH=6.5时δ(Pb2+)>75%,c(Pb2+)=c0(Pb2+)·δ(Pb2+)>1.5×10-5 mol·L-1,此时体系中还没有PbCO3(s),则Ksp(PbCO3)≥c< mol·L-1=×10-7.1 mol·L-1<1.5×10-5 mol·L-1命题点3 对数曲线分析
1.D AgCl、AgBr的阴、阳离子个数比相同,则曲线的斜率相同,结合已知②溶解度:AgCl>AgBr,可确定③表示AgBr,②表示AgCl,则①表示Ag2CrO4。
结合(6.1,6.1)可计算出Ksp(AgBr)=10-6.1×10-6.1=10-12.2,由(2.0,7.7)可计算出Ksp(Ag2CrO4)=(10-2.0)2×10-7.7=10-11.7,Ksp(AgCl)=10-2.0×10-7.7=10-9.7。
由以上分析可知,曲线②为AgCl沉淀溶解平衡曲线,A正确;该反应的平衡常数K====10-5.2,B正确;Cl-与Ag+恰好反应生成AgCl沉淀时,c(Ag+)=c(Cl-)=,在此之前不能沉淀,故=10-2.0 mol·L-1,则滴定Cl-时,理论上混合液中指示剂浓度不宜超过10-2.0 mol·L-1,C正确;滴定Br-达终点时,溶液中同时存在AgBr、Ag2CrO4沉淀,则溶液中,D错误。
2.B 设X、Y、Z与CN-形成的配离子化学式分别为X(CN)x、Y(CN)y、Z(CN)z,以X为例,存在解离平衡X(CN)x X+xCN-,其平衡常数KX=,两边同时取对数并整理得lg,则X对应的图像为斜率为x的直线,同理,Y对应的图像为斜率为y的直线,Z对应的图像为斜率为z的直线。
设X的初始浓度为a,99%的X转化成配离子时,c(X)=0.01a,c[X(CN)x]=0.99a,≈-2,同理,≈-2,在图像中找到X、Y两直线纵坐标值为-2对应的横坐标的值,X的横坐标数值更大,由于横坐标是,则X对应的c(CN-)更小,A错误;向Q点X、Z的混合液中加少量可溶性Y盐,Y会消耗溶液中的CN-,新平衡下会变小,-lg c(CN-)就会变大,则此时X、Z对应的点会沿着相应直线向右移动,结合图像可知,移动后lg>,则>,B正确;根据上述分析知,x>y>z,因此由Y和Z分别制备等物质的量的配离子时,消耗CN-的物质的量Y>Z,C错误;直线上的点代表平衡状态,P点在Y对应直线的下方,在-lg c(CN-)不变,即c(CN-)不变的情况下,P点的lg 相比平衡时偏小,即偏小,则此时QY=课后学习任务
1.D 第一个化学计量点的pH=4.7,甲基橙的变色范围为3.1~4.4,终点时溶液由橙色变为黄色,故A错误;X点到Y点是磷酸二氢钠逐渐转化为磷酸氢二钠,发生的反应为+H2O,故B错误;第二个化学计量点的含磷物种主要是,此时溶液的pH=9.7>7,显碱性,说明的水解常数大于其电离常数,故C错误;由图中c(H3PO4)=时溶液的pH=2.16可知+H+的Ka1(H3PO4)=10-2.16,图中=时溶液的pH=7.21可知=10-7.21,两式相减得到H3PO4+的平衡常数K==105.05,故D正确。
2.D 0.1 mol·L-1 MOH溶液的pH小于13,则其为弱碱,其电离方程式为:MOH M++OH-,A错误;MOH电离出的氢氧根离子会抑制水的电离,随着盐酸的加入消耗MOH,水的电离程度增大,c点时HCl与MOH恰好完全反应,水的电离程度最大,则水的电离程度:c>b>a,B错误;根据电荷守恒可知,b点有c(Cl-)+c(OH-)=c(M+)+c(H+),此时溶液显中性,则c(Cl-)=c(M+),C错误;c为滴定终点,则c点溶质为MCl,此时由于M+的水解,导致溶液显酸性,则c(Cl-)>c(M+)>c(H+)>c(OH-),D正确。
3.D c(NH3)越大,pNH3越小,=c(OH-)+,故B错误;向体系中滴入稀硝酸,NH3与H+反应生成减小,Ag++2NH3 [Ag(NH3)2]+的平衡逆向移动,δ([Ag(NH3)2]+)减小,故C错误;a点,δ(Ag+)=δ([Ag(NH3)2]+),则K不稳==1.0×10-7.3,则对于反应AgCl+2NH3 [Ag(NH3)2]++Cl-,K==1.6×10-2.7,故D正确。
4.B 0.5 L浓度为0.10 mol·L-1的氨水,通入0.05 mol SO2时,此时溶质为NH4HSO3,根据物料守恒有c(NH3·H2O)+=+c(H2SO3)+,根据电荷守恒有c(OH-)++=c(H+)+,二者联立可得:c(NH3·H2O)+c(OH-)=,故A错误;由图中曲线相交时的pH可知,H2SO3的电离平衡常数Ka1==10-2.2,Ka2==10-7.8,Ka1·Ka2==10-2.2×10-7.8=10-10,当=10-5,c(OH-)=10-9,Kb==2×10-5,得=2×104,故B正确;当pH=7.0时,c(OH-)=c(H+),根据电荷守恒有=+,则+,故C错误;Ka2==10-7.8=,c(H+)==7.8+2lg 2=8.4,故D错误。
5.C 当-lg 时,Ka1==-lg Ka1,同理当=0,即c(H+)=c(HA-)时,Ka2==c(A2-),则-lg c(A2-)=<-lg Ka2=-lg c(A2-),故曲线Ⅱ代表-lg c(A2-)与-lg关系,曲线Ⅰ代表-lg c(HA-)与-lg关系。当-lg=0时,Ka1==2,即c(HA-)=10-2,故Ka1=10-2,A错误;由图中N点知,=3时,-lg c(A2-)=2,即=10-2,则Ka2==10-1 mol·L-1,说明此时溶液中生成大量的HA-,由于Kh(HA-)=,D错误。
6.C 根据lg越小,则氢离子浓度越大,氟离子浓度越小,MgF2(s) 的变化曲线,L2代表-lg c(Mg2+)与的变化曲线,A正确;lg==[Ksp(MgF2)]1/3=10-2.8,则c点的纵坐标值为2.8,B正确;MgF2(s)+2H+(aq) Mg2+(aq)+2HF(aq),该反应的平衡常数K==c(HF),c点时c(H+)=+2c(Mg2+)=大于0,则>c(Mg2+)=c(HF)>c(H+),D正确。
课前学习任务
核心归纳
1.酸碱中和滴定曲线
氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线 盐酸滴定等浓度等体积的氢氧化钠溶液、氨水的滴定曲线
曲线起点不同。强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高
突跃点变化范围不同。强碱与强酸反应的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)
室温下pH=7不一定是终点。强碱与强酸反应时,终点pH=7;强碱与弱酸反应终点pH>7,强酸与弱碱反应终点pH<7
2.滴定图像的五点突破方法
(1)“起始”点:判断酸、碱的相对强弱;
(2)“半”点:判断是哪些溶质的等量混合;
(3)“恰好”点:判断生成的溶质成分及溶液的酸碱性;
(4)“中性”点:判断溶液中溶质的成分及哪些物质过量或不足;
(5)“过量”点:判断溶液中的溶质组成,并判断哪些物质过量。
3.透析分布曲线,确定思维方向
分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。
一元弱酸(以 CH3COOH为例) 二元弱酸(以 H2C2O4为例)
注:pKa为电离常数的 负对数
δ0为CH3COOH的分布系数,δ1为CH3COO-的分布系数 δ0为H2C2O4的分布系数,δ1为的分布系数,δ2为的分布系数
4.明确解题要领,快速准确作答
(1)“读曲线”——每条曲线所代表的粒子及变化趋势;
(2)“读浓度”——通过横坐标轴的垂线,可读出某pH时的粒子浓度相对大小;
(3)“用交点”——交点是某两种粒子浓度相等的点,可计算电离常数K;
(4)“可替换”——根据溶液中的元素质量守恒进行替换,分析得出结论。
5.常考的对数图像类型
类型 含义 变化规律 解题策略
pH= -lg c(H+) 氢离子浓度的常用对数负值 pH越大,c(H+)越小,溶液的碱性越强 ①先弄清是对数还是负对数 ②弄清楚是什么的对数,如浓度对数、浓度比对数、体积比对数等 ③弄清楚对数变化所表示的意义
pC= -lg c(C) C离子浓度的常用对数负值 pC越大,c(C)越小
lg 生成物与反应物离子浓度比的常用对数 lg越大,反应向正反应方向进行的程度越大
lg 稀释后与稀释前体积比的常用对数 lg越大,稀释程度越大
AG= lg 氢离子与氢氧根离子浓度比的常用对数 AG越大,酸性越强,中性时,=1,AG=0
6.破解对数图像的数据
(1)运算法则:lg ab=lg a+lg b、lg =lg a-lg b、lg 1=0。
(2)运算突破点:如lg =0的点有c(A)=c(B);lg c(D)=0的点有c(D)=。
课堂学习任务
命题点1 滴定曲线分析
1.(2023·湖南卷,12)常温下,用浓度为0.0200 mol·L-1的NaOH标准溶液滴定浓度均为0.0200 mol·L-1的HCl和CH3COOH的混合溶液,滴定过程中溶液的pH随η的变化曲线如图所示。下列说法错误的是( )
A.Ka(CH3COOH)约为10-4.76
B.点a:c(Na+)=c(Cl-)=c(CH3COO-)+c(CH3COOH)
C.点b:c(CH3COOH)
下列叙述正确的是( )
A.交点a处:c(Na+)=2c(Cl-)
B.=10-2.21
C.V≤2.0 mL时不变
D.y1=-7.82,y2=-lg 34
命题点2 分布系数曲线分析
1.(2024·新课标卷,13)常温下CH2ClCOOH和CHCl2COOH的两种溶液中,分布系数δ与pH的变化关系如图所示。
[比如:δ(CH2ClCOO-)=]
下列叙述正确的是( )
A.曲线M表示δ(CHCl2COO-)~pH的变化关系
B.若酸的初始浓度为0.10 mol·L-1,则a点对应的溶液中有c(H+)=+c(OH-)
C.CH2ClCOOH的电离常数Ka=10-1.3
D.pH=2.08时,
2.(2024·湖北卷,13)CO2气氛下,Pb(ClO4)2溶液中含铅物种的分布如图。纵坐标(δ)为组分中铅占总铅的质量分数。已知c0(Pb2+)==10.3,pKsp(PbCO3)=12.1。下列说法错误的是( )
A.pH=6.5时,溶液中<c(Pb2+)
B.δ(Pb2+)=δ(PbCO3)时,c(Pb2+)<1.0×10-5 mol·L-1
C.pH=7时,2c(Pb2+)+++
D.pH=8时,溶液中加入少量NaHCO3(s),PbCO3会溶解
命题点3 对数曲线分析
1.(2024·黑、吉、辽卷,15)25 ℃下,AgCl、AgBr和Ag2CrO4的沉淀溶解平衡曲线如图所示。某实验小组以K2CrO4为指示剂,用AgNO3标准溶液分别滴定含Cl-水样、含Br-水样。
已知:①Ag2CrO4为砖红色沉淀;
②相同条件下AgCl溶解度大于AgBr;
③25 ℃时,pKa1(H2CrO4)=0.7,
pKa2(H2CrO4)=6.5。
下列说法错误的是( )
A.曲线②为AgCl沉淀溶解平衡曲线
B.反应Ag2CrO4+H+ 2Ag++的平衡常数K=10-5.2
C.滴定Cl-时,理论上混合液中指示剂浓度不宜超过10-2.0 mol·L-1
D.滴定Br-达终点时,溶液中=10-0.5
2.(2024·河北卷,11)在水溶液中,CN-可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与CN-形成配离子达平衡时, 的关系如图。
下列说法正确的是( )
A.99%的X、Y转化为配离子时,两溶液中CN-的平衡浓度X>Y
B.向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时>
C.由Y和Z分别制备等物质的量的配离子时,消耗CN-的物质的量Y
课后学习任务
1.(2024·河南省濮阳市一模)常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 H3PO4溶液的pH变化如图所示。
下列说法正确的是( )
A.先用甲基橙作指示剂,滴定终点时溶液由红色变为橙色
B.X点到Y点发生的反应为H3PO4++2H2O
C.常温下的水解常数小于其电离常数
D.常温下,H3PO4+的平衡常数K=105.05
2.(2024·广东省江门市一模)常温下,向10.00 mL 0.1 mol·L-1 MOH碱溶液中滴加0.1 mol·L-1盐酸,溶液的pH及导电能力随滴加盐酸体积的变化曲线如图所示。下列说法正确的是( )
A.MOH的电离方程式为MOH=M++OH-
B.水的电离程度:c>a>b
C.b点溶液中c(Cl-)=c(M+)+c(MOH)
D.c点溶液中c(Cl-)>c(M+)>c(H+)>c(OH-)
3.(2024·河南省信阳市一模)配离子的稳定性可用K不稳衡量,如[Ag(NH3)2]+的K不稳=。一定温度下,向0.1 mol·L-1硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3 [Ag(NH3)2]+,溶液中pNH3与δ(X)的关系如图所示,其中pNH3=-lg c(NH3)、δ(X)=(X代表Ag+或[Ag(NH3)2]+)。已知该温度下Ksp(AgCl)=1.6×10-10。下列说法正确的是( )
Ag+和[Ag(NH3)2]+的分布系数图
A.图中δ2代表的是δ(Ag+)
B.该溶液中c(Ag+)+c([Ag(NH3)2]+)+=
C.向该溶液中滴入稀硝酸,δ([Ag(NH3)2]+)增大
D.AgCl溶于氨水时+Cl-平衡常数为K=1.6×10-2.7
4.(2024·九省联考江西卷)一定温度下,H2SO3水溶液中H2SO3、、的分布分数δ与pH的关系如下图。例如=。向0.5 L浓度为0.10 mol·L-1的氨水中通入SO2气体。已知该温度下Kb(NH3·H2O)=2×10-5,lg 2≈0.3,Kw≈1×10-14,下列说法正确的是( )
A.通入0.05 mol SO2时,c(NH3·H2O)+c(OH-)=+c(H2SO3)+c(H+)
B.当=1时,=2×104
C.当pH=7.0时+
D.P点时溶液的pH值为8.3
5.(2024·河南省五市3月联考)25 ℃时,用 NaOH 溶液滴定H2A 溶液,溶液中和-lg c(HA-)或-lg和-lg c(A2-)关系如图所示,下列说法正确的是( )
A.H2A 为弱酸,其Ka1约为10-4
B.滴定过程中,当pH=5时,c(Na+)>3c(A2-)
C.水的电离程度:M点<N点
D.向 H2A 溶液中加入等体积等浓度的NaOH溶液完全反应后的溶液中:c(OH-)+c(A2-)=c(H+)+2c(H2A)
6.(2024·湖北省十一校3月联考)已知MgF2难溶于水、可溶于酸。常温下,用HCl调节MgF2浊液的pH,测得在不同pH条件下,体系中-lg c(X)(X为Mg2+或F-)与lg的关系如图所示。下列说法错误的是( )
A.L2代表-lg c(Mg2+)与lg的变化曲线
B.c点的纵坐标值为2.8
C.MgF2(s)+2H+(aq) Mg2+(aq)+2HF(aq),该反应的平衡常数K=100
D.c点的溶液中存在c(Cl-)>c(Mg2+)=c(HF)>c(H+)
答案与解析
课堂学习任务
命题点1 滴定曲线分析
1.D 图像分析
根据CH3COOH CH3COO-+H+,可近似认为a点c(H+)=c(CH3 COO-),又a点pH=3.38,c(H+)=10-3.38 mol·L-1,故Ka(CH3COOH)≈
命题点2 分布系数曲线分析
1.D
Cl的电负性大于H的电负性,则—CHCl2的极性大于—CH2Cl的极性,导致CHCl2COOH的酸性大于CH2ClCOOH的酸性,则CHCl2COOH溶液中的大于CH2ClCOOH溶液中的δ(CH2ClCOO-),则曲线M表示~pH的变化关系,A项错误;由于CH2ClCOOH与CHCl2COOH均为弱酸,当初始浓度为0.10 mol·L-1时,pH>1,而a点溶液的pH=1,故需外加酸使pH减小,题给关系式中缺少外加酸中阴离子的浓度,B项错误;Ka(CH2ClCOOH)=根据上图d点可知,pH=2.8时,c(CH2ClCOOH)=c(CH2ClCOO-),则Ka(CH2ClCOOH)=c(H+)=10-2.8,C项错误;pH=2.08时,δ(CHCl2COO-)=0.85,δ(CH2ClCOO-)=0.15,则CH2ClCOOH与CHCl2COOH的电离度之比为0.15∶0.85,D项正确。
2.D 由图可知,pH=6.5时δ(Pb2+)>75%,c(Pb2+)=c0(Pb2+)·δ(Pb2+)>1.5×10-5 mol·L-1,此时体系中还没有PbCO3(s),则Ksp(PbCO3)≥c< mol·L-1=×10-7.1 mol·L-1<1.5×10-5 mol·L-1
1.D AgCl、AgBr的阴、阳离子个数比相同,则曲线的斜率相同,结合已知②溶解度:AgCl>AgBr,可确定③表示AgBr,②表示AgCl,则①表示Ag2CrO4。
结合(6.1,6.1)可计算出Ksp(AgBr)=10-6.1×10-6.1=10-12.2,由(2.0,7.7)可计算出Ksp(Ag2CrO4)=(10-2.0)2×10-7.7=10-11.7,Ksp(AgCl)=10-2.0×10-7.7=10-9.7。
由以上分析可知,曲线②为AgCl沉淀溶解平衡曲线,A正确;该反应的平衡常数K====10-5.2,B正确;Cl-与Ag+恰好反应生成AgCl沉淀时,c(Ag+)=c(Cl-)=,在此之前不能沉淀,故=10-2.0 mol·L-1,则滴定Cl-时,理论上混合液中指示剂浓度不宜超过10-2.0 mol·L-1,C正确;滴定Br-达终点时,溶液中同时存在AgBr、Ag2CrO4沉淀,则溶液中,D错误。
2.B 设X、Y、Z与CN-形成的配离子化学式分别为X(CN)x、Y(CN)y、Z(CN)z,以X为例,存在解离平衡X(CN)x X+xCN-,其平衡常数KX=,两边同时取对数并整理得lg,则X对应的图像为斜率为x的直线,同理,Y对应的图像为斜率为y的直线,Z对应的图像为斜率为z的直线。
设X的初始浓度为a,99%的X转化成配离子时,c(X)=0.01a,c[X(CN)x]=0.99a,≈-2,同理,≈-2,在图像中找到X、Y两直线纵坐标值为-2对应的横坐标的值,X的横坐标数值更大,由于横坐标是,则X对应的c(CN-)更小,A错误;向Q点X、Z的混合液中加少量可溶性Y盐,Y会消耗溶液中的CN-,新平衡下会变小,-lg c(CN-)就会变大,则此时X、Z对应的点会沿着相应直线向右移动,结合图像可知,移动后lg>,则>,B正确;根据上述分析知,x>y>z,因此由Y和Z分别制备等物质的量的配离子时,消耗CN-的物质的量Y>Z,C错误;直线上的点代表平衡状态,P点在Y对应直线的下方,在-lg c(CN-)不变,即c(CN-)不变的情况下,P点的lg 相比平衡时偏小,即偏小,则此时QY=
1.D 第一个化学计量点的pH=4.7,甲基橙的变色范围为3.1~4.4,终点时溶液由橙色变为黄色,故A错误;X点到Y点是磷酸二氢钠逐渐转化为磷酸氢二钠,发生的反应为+H2O,故B错误;第二个化学计量点的含磷物种主要是,此时溶液的pH=9.7>7,显碱性,说明的水解常数大于其电离常数,故C错误;由图中c(H3PO4)=时溶液的pH=2.16可知+H+的Ka1(H3PO4)=10-2.16,图中=时溶液的pH=7.21可知=10-7.21,两式相减得到H3PO4+的平衡常数K==105.05,故D正确。
2.D 0.1 mol·L-1 MOH溶液的pH小于13,则其为弱碱,其电离方程式为:MOH M++OH-,A错误;MOH电离出的氢氧根离子会抑制水的电离,随着盐酸的加入消耗MOH,水的电离程度增大,c点时HCl与MOH恰好完全反应,水的电离程度最大,则水的电离程度:c>b>a,B错误;根据电荷守恒可知,b点有c(Cl-)+c(OH-)=c(M+)+c(H+),此时溶液显中性,则c(Cl-)=c(M+),C错误;c为滴定终点,则c点溶质为MCl,此时由于M+的水解,导致溶液显酸性,则c(Cl-)>c(M+)>c(H+)>c(OH-),D正确。
3.D c(NH3)越大,pNH3越小,=c(OH-)+,故B错误;向体系中滴入稀硝酸,NH3与H+反应生成减小,Ag++2NH3 [Ag(NH3)2]+的平衡逆向移动,δ([Ag(NH3)2]+)减小,故C错误;a点,δ(Ag+)=δ([Ag(NH3)2]+),则K不稳==1.0×10-7.3,则对于反应AgCl+2NH3 [Ag(NH3)2]++Cl-,K==1.6×10-2.7,故D正确。
4.B 0.5 L浓度为0.10 mol·L-1的氨水,通入0.05 mol SO2时,此时溶质为NH4HSO3,根据物料守恒有c(NH3·H2O)+=+c(H2SO3)+,根据电荷守恒有c(OH-)++=c(H+)+,二者联立可得:c(NH3·H2O)+c(OH-)=,故A错误;由图中曲线相交时的pH可知,H2SO3的电离平衡常数Ka1==10-2.2,Ka2==10-7.8,Ka1·Ka2==10-2.2×10-7.8=10-10,当=10-5,c(OH-)=10-9,Kb==2×10-5,得=2×104,故B正确;当pH=7.0时,c(OH-)=c(H+),根据电荷守恒有=+,则+,故C错误;Ka2==10-7.8=,c(H+)==7.8+2lg 2=8.4,故D错误。
5.C 当-lg 时,Ka1==-lg Ka1,同理当=0,即c(H+)=c(HA-)时,Ka2==c(A2-),则-lg c(A2-)=<-lg Ka2=-lg c(A2-),故曲线Ⅱ代表-lg c(A2-)与-lg关系,曲线Ⅰ代表-lg c(HA-)与-lg关系。当-lg=0时,Ka1==2,即c(HA-)=10-2,故Ka1=10-2,A错误;由图中N点知,=3时,-lg c(A2-)=2,即=10-2,则Ka2==10-1 mol·L-1,说明此时溶液中生成大量的HA-,由于Kh(HA-)=,D错误。
6.C 根据lg越小,则氢离子浓度越大,氟离子浓度越小,MgF2(s) 的变化曲线,L2代表-lg c(Mg2+)与的变化曲线,A正确;lg==[Ksp(MgF2)]1/3=10-2.8,则c点的纵坐标值为2.8,B正确;MgF2(s)+2H+(aq) Mg2+(aq)+2HF(aq),该反应的平衡常数K==c(HF),c点时c(H+)=+2c(Mg2+)=大于0,则>c(Mg2+)=c(HF)>c(H+),D正确。
同课章节目录
