陕西省西安市2024-2025学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 陕西省西安市2024-2025学年高二上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-26 16:54:28 | ||
图片预览


文档简介
2024~2025学年第一学期
高二年级期末考试化学(高考类)试题
可能用到的相对原子质量:O-16 S-32 Ti-48 Cu-64
一、选择题(本大题共14小题,每小题3分,共42分。在每小题给出的四个选项中, 只有一项是符合题目要求的)
1.人类对核外电子运动的认知不断进步。下列是小猪佩奇在学校课堂上羚羊夫人让他们讨论核外电子运动的说法,其中说法正确的是( )
A.小羊苏西 B.小狗丹尼 C.小猪佩奇 D.小猪乔冶
2.HCl与NH3相遇,可产生白烟,反应化学方程式为HCl+NH3=NH4Cl。下列有关化学用语或图示表达正确的是( )
A.基态N原子价层电子排布式:
B.NH4C1的电子式:]+Cl-
C.NH3的VSEPR模型
D.HCl分子中σ键的形成:
3.物质结构决定物质性质。下列性质差异与结构因素匹配错误的是( )
4.中国“人造太阳”首先实现100万安培等离子体电流下的高约束模式运行,还实现了第一个采用氦-3等离子体作为燃料的“人造太阳”,不断刷新世界纪录。下列相关说法不正确的是( )
A.氦-3原子中有3个电子
B.等离子体中有电子、阳离子和电中性粒子,整体呈电中性
C.“人造太阳”中的常用原料和互为同位素
D.已知氚可以在反应堆中通过锂再生,基态锂原子最高能级的电子云轮廓图为球形
5.下列类比或推论正确的是( )
A.HF分子间氢键强度大于水的分子间氢键,因此HF的沸点更高
B.P与Cl可以形成PCl3和PCl5,N与Cl也可以形成NCl3和NCl5
C.CH4和CCl4的键角相同,NH3和NCl3的键角也相同
D.NH4+、SO42-为正四面体,PH4+、PO43-也为正四面体
6.赤血盐(K3[Fe(CN)6])可用于检验Fe2+,也可用于蓝图印刷术等。下列说法正确的是( )
A.基态K+核外有18种不同运动状态的电子
B.电负性:C>N>K>Fe
C.Fe2+的价电子排布式为3d54s1
D.4种元素分布在元素周期表的s、p、ds区
研究物质结构及性质是学习化学的有效方法。下列事实解释错误的是( )
8.软包电池的关键组件是一种离子化合物,其结构如图。X、Y、Z、W、M、Q为原子序数依次增大的短周期元素,X元素基态原子最外层电子是次外层电子数的一半, W和Q同主族。下列说法错误的是( )
A.简单离子半径:Q>W>M>X
B.简单氢化物的稳定性:M>W>Q
C.第一电离能:W>Z>Y
D.W3是含有极性键的极性分子
9.科学家研究发现石墨烯在室温下具有前所未有的磁阻(一种物理参量)。已知:石墨烯比金刚石更坚硬,比铜更能导电。下列叙述错误的是( )
A.石墨烯中碳原子都采用sp2杂化
B.石墨烯中碳碳键平均键能大于金刚石中碳碳键平均键能,石墨烯的熔点比金刚石的高
C.石墨烯可以看成由正六边形构成,碳原子、碳碳键数目之比为3∶2
D.石墨烯是二维结构,每个碳原子有1个电子能自由移动,具有良好的导电性
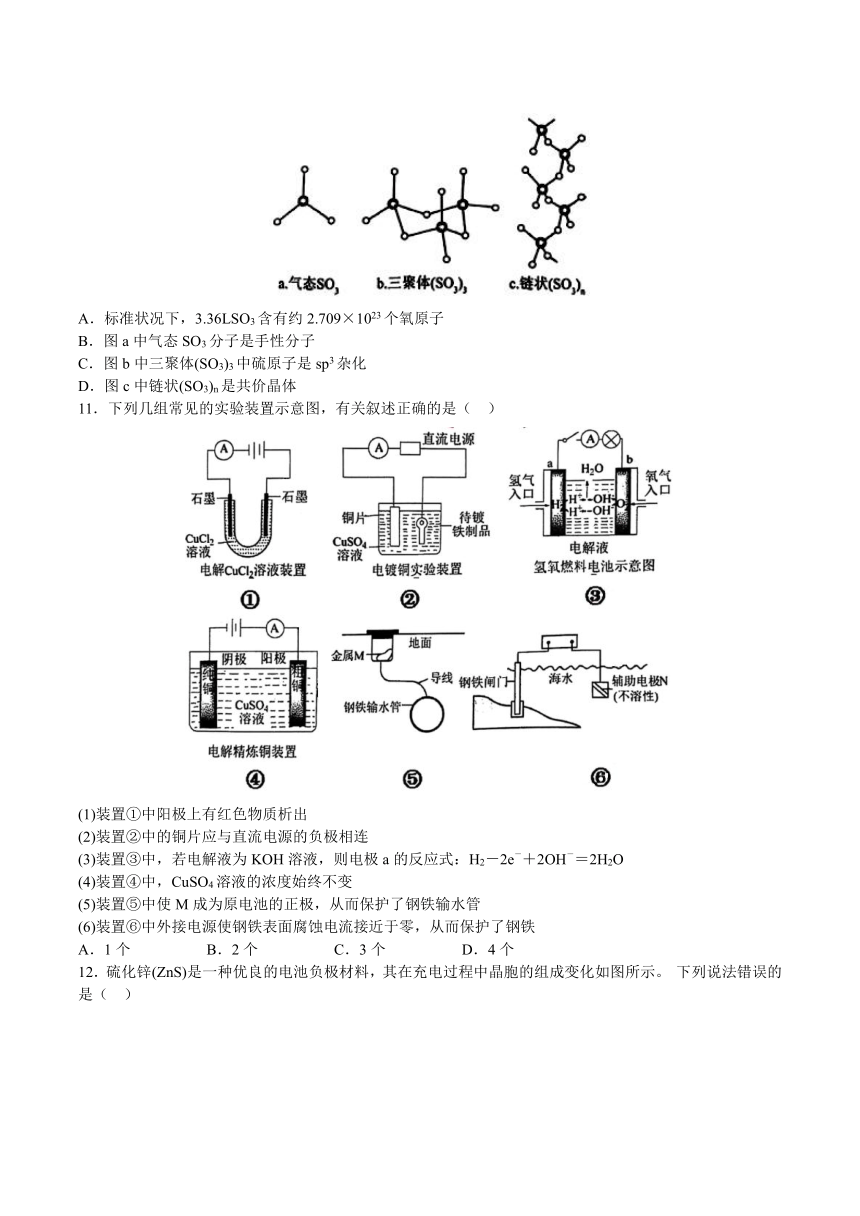
10.物质结构具有多样性。三氧化硫在标准状况下为固态,主要以两种形式存在:一种是三聚体环状结构(如图b),另外一种是螺旋链状结构(如图c)。下列说法正确的是( )
A.标准状况下,3.36LSO3含有约2.709×1023个氧原子
B.图a中气态SO3分子是手性分子
C.图b中三聚体(SO3)3中硫原子是sp3杂化
D.图c中链状(SO3)n是共价晶体
11.下列几组常见的实验装置示意图,有关叙述正确的是( )
(1)装置①中阳极上有红色物质析出
(2)装置②中的铜片应与直流电源的负极相连
(3)装置③中,若电解液为KOH溶液,则电极a的反应式:H2-2e-+2OH-=2H2O
(4)装置④中,CuSO4溶液的浓度始终不变
(5)装置⑤中使M成为原电池的正极,从而保护了钢铁输水管
(6)装置⑥中外接电源使钢铁表面腐蚀电流接近于零,从而保护了钢铁
A.1个 B.2个 C.3个 D.4个
12.硫化锌(ZnS)是一种优良的电池负极材料,其在充电过程中晶胞的组成变化如图所示。 下列说法错误的是( )
A.基态Zn原子核外电子的空间运动状态有15种
B.S2-在ZnS晶胞和Li2S晶胞中的配位数相同
C.在ZnS晶胞中体对角线的一维空间上会出现的排布规律
D.充电I过程中该电极反应式为4ZnS+6Li++6e-=3Zn+4Li1.5Zn0.25S
13.硫锌二次电池工作原理如图所示,下列叙述错误的是( )
A.放电时,电极a为负极
B.充电时,电极b与电源正极连接
C.放电时,电极a上的电极反应式为Zn-2e-+4OH-=[Zn(OH)4]2-
D.充电时,16.0g Cu2S完全反应时,有0.2mol Na+向电极a迁移
14.二氧化铈(CeO2)是一种重要的催化剂,在其立方晶胞中掺杂Y2O3,Y3+占据原来Ce4+的位置,可以得到更稳定的结构(过程如下图),这种稳定的结构使得二氧化铈具有许多独特的性能。下列说法正确的是( )
[已知:O2-的空缺率= 00%]
A.CeO2晶胞中,距离Ce4+最近且等距的Ce4+数目为8
B.若CeO2晶胞中两个Ce4+间的最小距离为a pm,则Ce4+与O2-的最小核间距为
C.已知M点原子的分数坐标为(0,0,0),则N点原子的分数坐标为(0.75,0.25,0.25)
D.若掺杂Y2O3后得到n(CeO2)∶n(Y2O3)=3∶1的晶体,则此晶体中O2-的空缺率为10%
二、非选择题(4个大题,共58分)
15.(14分)镧系元素包括锎、钕、钐、钆等元素,是高科技发展的重要支撑。结合所学知识,回答下列问题。
已知:基态钕(Nd)原子、钆(Gd)原子的电子排布式分别为[xe]4f46s2、[Xe]4f75d16s2。
(1)钕(Nd)属 区元素,基态钕原子中未成对电子数为 ,基态Nd3+离子的价电子排布图为 (已知f能级共包含7个轨道)。
(2)根据构造原理,5d轨道的能量高于4f轨道的能量,钆(Gd)的价电子排布式不为4f86s2的原因是 。
(3)钐等稀土元素的发现和鉴别利用了哪一现代分析手段 (填标号)。
A.质谱 B.红外线光谱 C.X射线衍射 D.原子光谱
(4)稀土矿藏中也含有大量非金属元素。第一电离能介于Be和N之间的第二周期的元素有 种,它们的基态原子电子占据的最高能级的电子云轮廓图均为 形。
16.(14分)酸碱是化学中的重要概念,其概念也在不断扩展。结合所学知识,回答下列问题。
(1)HF、HCl、HBr、HI是常见的酸,按照沸点由高到低的顺序为 。
(2)已知Sn与C同族,按照酸碱电子理论,SnCl2也属于酸,其空间构型为 ,中心原子的杂化方式为 ,可采用 实验获得SnCl2的键长和键角数据。
(3)富马酸、马来酸(结构分别如图A、B所示)和乙酸是有机化学中常用的合成原料。
①极性:富马酸 马来酸(填“>”、“<”或“=”);
②1个富马酸分子中含有 个σ键
③乙酸易溶于水,难溶于二硫化碳,原因为 。
17.(15分)电化学在生活中的应用无处不在。结合所学知识,回答下列问题。
I.在新能源汽车中的应用。HCOOH燃料电池是一种可应用于汽车动力的燃料电池。研究HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的半透膜隔开。
(1)该电池电势较高的是图中 电极(填“左侧”或“右侧”)。
(2)放电过程中需补充的物质A为 (填化学式)。
(3)Fe3+在该电池中作用是 。
II.在工业生产中的应用。次磷酸(H3PO2)可以通过电解的方法制备。电解制备次磷酸工作原理如图所示(相邻各室之间由阴或阳离子交换膜隔开):
(1)写出阴极的电极反应式 。
(2)图中电解装置的三个离子交换膜从左到右依次为哪种类型交换膜: 、 、 (填“阳”或“阴”)。
(3)随着电解的进行,阳极区稀硫酸浓度逐渐 _(填“升高”、“降低”或“不变”)。
Ⅲ.在金属精炼中的应用。如图为电解精炼银的示意图。若b极有少量红棕色气体产生,则生成该气体的电极反应式为 。
18.(15分)天然矿物有着丰富多彩的晶体结构。结合所学知识,回答下列问题。
(1)SiO2在自然界中以玛瑙、水晶等形式存在,玛瑙是熔融态的SiO2 冷却形成的(填“缓慢”或“快速”)。
(2)已知一束入射光在方解石中分解成两束偏振方向互相垂直、折射角不同的光,这种现象称为双折射。而普通玻璃却不能产生双折射现象,是因为方解石晶体具有 性。
(3)KCl和NaCl都是盐湖中常见的矿物盐。KCl、NaCl、AlCl3的熔点从高到低顺序依次为 ,原因是 。
(4)红镍矿的主要成分为砷化镍,其晶胞结构如下左图所示,则砷化镍化学式为: ,As的配位数是 。
(5)TiO2在自然界中存在三种矿石,其中金红石的晶胞结构如图A。TaO2的晶胞结构与其相似,也可用图A表示。TaO2与金红石的晶胞体积比约为1.065,TaO2与金红石的密度比约为2.5,则Ta的相对原子质量为 。
2024-2025学年第一学期
高二年级期末考试化学(高考类)参考答案
一、选择题
1-5.DDBAD 6-10.ABCCC 11-14.BBDD
↑ ↑ ↑
二、非选择题
15.(1)f 4
4f
(2)4f7轨道半充满,能量较低。 (3) D (4)2 哑铃
16.(1) HF>HI>HBr>HCl (2) V形 sp2 X射线衍射
(3)①< ②11 ③乙酸和水都为极性分子,二硫化碳为非极性分子,相似相溶;且乙酸和水分子间可以形成氢键,故乙酸易溶于水。
17.Ⅰ.(1) 右侧 (2) H2SO4 (3)催化剂
Ⅱ.(1) 2H2O+2e-=H2↑+2OH- (2)阳、阴、阳 (3)升高
Ⅲ.2H++NO3-+e-=NO2↑+H2O
18.(1)快速 (2)各向异
(3)NaCl>KCl>AlCl3
NaCl和KCl为离子晶体,AlCl3为分子晶体,离子晶体熔点>分子晶体,故AlCl3熔点最低;K+半径大于Na+,故KCl离子键弱于NaCl,因此熔点NaCl>KCl。
(4) NiAs 6 (5) 181
高二年级期末考试化学(高考类)试题
可能用到的相对原子质量:O-16 S-32 Ti-48 Cu-64
一、选择题(本大题共14小题,每小题3分,共42分。在每小题给出的四个选项中, 只有一项是符合题目要求的)
1.人类对核外电子运动的认知不断进步。下列是小猪佩奇在学校课堂上羚羊夫人让他们讨论核外电子运动的说法,其中说法正确的是( )
A.小羊苏西 B.小狗丹尼 C.小猪佩奇 D.小猪乔冶
2.HCl与NH3相遇,可产生白烟,反应化学方程式为HCl+NH3=NH4Cl。下列有关化学用语或图示表达正确的是( )
A.基态N原子价层电子排布式:
B.NH4C1的电子式:]+Cl-
C.NH3的VSEPR模型
D.HCl分子中σ键的形成:
3.物质结构决定物质性质。下列性质差异与结构因素匹配错误的是( )
4.中国“人造太阳”首先实现100万安培等离子体电流下的高约束模式运行,还实现了第一个采用氦-3等离子体作为燃料的“人造太阳”,不断刷新世界纪录。下列相关说法不正确的是( )
A.氦-3原子中有3个电子
B.等离子体中有电子、阳离子和电中性粒子,整体呈电中性
C.“人造太阳”中的常用原料和互为同位素
D.已知氚可以在反应堆中通过锂再生,基态锂原子最高能级的电子云轮廓图为球形
5.下列类比或推论正确的是( )
A.HF分子间氢键强度大于水的分子间氢键,因此HF的沸点更高
B.P与Cl可以形成PCl3和PCl5,N与Cl也可以形成NCl3和NCl5
C.CH4和CCl4的键角相同,NH3和NCl3的键角也相同
D.NH4+、SO42-为正四面体,PH4+、PO43-也为正四面体
6.赤血盐(K3[Fe(CN)6])可用于检验Fe2+,也可用于蓝图印刷术等。下列说法正确的是( )
A.基态K+核外有18种不同运动状态的电子
B.电负性:C>N>K>Fe
C.Fe2+的价电子排布式为3d54s1
D.4种元素分布在元素周期表的s、p、ds区
研究物质结构及性质是学习化学的有效方法。下列事实解释错误的是( )
8.软包电池的关键组件是一种离子化合物,其结构如图。X、Y、Z、W、M、Q为原子序数依次增大的短周期元素,X元素基态原子最外层电子是次外层电子数的一半, W和Q同主族。下列说法错误的是( )
A.简单离子半径:Q>W>M>X
B.简单氢化物的稳定性:M>W>Q
C.第一电离能:W>Z>Y
D.W3是含有极性键的极性分子
9.科学家研究发现石墨烯在室温下具有前所未有的磁阻(一种物理参量)。已知:石墨烯比金刚石更坚硬,比铜更能导电。下列叙述错误的是( )
A.石墨烯中碳原子都采用sp2杂化
B.石墨烯中碳碳键平均键能大于金刚石中碳碳键平均键能,石墨烯的熔点比金刚石的高
C.石墨烯可以看成由正六边形构成,碳原子、碳碳键数目之比为3∶2
D.石墨烯是二维结构,每个碳原子有1个电子能自由移动,具有良好的导电性
10.物质结构具有多样性。三氧化硫在标准状况下为固态,主要以两种形式存在:一种是三聚体环状结构(如图b),另外一种是螺旋链状结构(如图c)。下列说法正确的是( )
A.标准状况下,3.36LSO3含有约2.709×1023个氧原子
B.图a中气态SO3分子是手性分子
C.图b中三聚体(SO3)3中硫原子是sp3杂化
D.图c中链状(SO3)n是共价晶体
11.下列几组常见的实验装置示意图,有关叙述正确的是( )
(1)装置①中阳极上有红色物质析出
(2)装置②中的铜片应与直流电源的负极相连
(3)装置③中,若电解液为KOH溶液,则电极a的反应式:H2-2e-+2OH-=2H2O
(4)装置④中,CuSO4溶液的浓度始终不变
(5)装置⑤中使M成为原电池的正极,从而保护了钢铁输水管
(6)装置⑥中外接电源使钢铁表面腐蚀电流接近于零,从而保护了钢铁
A.1个 B.2个 C.3个 D.4个
12.硫化锌(ZnS)是一种优良的电池负极材料,其在充电过程中晶胞的组成变化如图所示。 下列说法错误的是( )
A.基态Zn原子核外电子的空间运动状态有15种
B.S2-在ZnS晶胞和Li2S晶胞中的配位数相同
C.在ZnS晶胞中体对角线的一维空间上会出现的排布规律
D.充电I过程中该电极反应式为4ZnS+6Li++6e-=3Zn+4Li1.5Zn0.25S
13.硫锌二次电池工作原理如图所示,下列叙述错误的是( )
A.放电时,电极a为负极
B.充电时,电极b与电源正极连接
C.放电时,电极a上的电极反应式为Zn-2e-+4OH-=[Zn(OH)4]2-
D.充电时,16.0g Cu2S完全反应时,有0.2mol Na+向电极a迁移
14.二氧化铈(CeO2)是一种重要的催化剂,在其立方晶胞中掺杂Y2O3,Y3+占据原来Ce4+的位置,可以得到更稳定的结构(过程如下图),这种稳定的结构使得二氧化铈具有许多独特的性能。下列说法正确的是( )
[已知:O2-的空缺率= 00%]
A.CeO2晶胞中,距离Ce4+最近且等距的Ce4+数目为8
B.若CeO2晶胞中两个Ce4+间的最小距离为a pm,则Ce4+与O2-的最小核间距为
C.已知M点原子的分数坐标为(0,0,0),则N点原子的分数坐标为(0.75,0.25,0.25)
D.若掺杂Y2O3后得到n(CeO2)∶n(Y2O3)=3∶1的晶体,则此晶体中O2-的空缺率为10%
二、非选择题(4个大题,共58分)
15.(14分)镧系元素包括锎、钕、钐、钆等元素,是高科技发展的重要支撑。结合所学知识,回答下列问题。
已知:基态钕(Nd)原子、钆(Gd)原子的电子排布式分别为[xe]4f46s2、[Xe]4f75d16s2。
(1)钕(Nd)属 区元素,基态钕原子中未成对电子数为 ,基态Nd3+离子的价电子排布图为 (已知f能级共包含7个轨道)。
(2)根据构造原理,5d轨道的能量高于4f轨道的能量,钆(Gd)的价电子排布式不为4f86s2的原因是 。
(3)钐等稀土元素的发现和鉴别利用了哪一现代分析手段 (填标号)。
A.质谱 B.红外线光谱 C.X射线衍射 D.原子光谱
(4)稀土矿藏中也含有大量非金属元素。第一电离能介于Be和N之间的第二周期的元素有 种,它们的基态原子电子占据的最高能级的电子云轮廓图均为 形。
16.(14分)酸碱是化学中的重要概念,其概念也在不断扩展。结合所学知识,回答下列问题。
(1)HF、HCl、HBr、HI是常见的酸,按照沸点由高到低的顺序为 。
(2)已知Sn与C同族,按照酸碱电子理论,SnCl2也属于酸,其空间构型为 ,中心原子的杂化方式为 ,可采用 实验获得SnCl2的键长和键角数据。
(3)富马酸、马来酸(结构分别如图A、B所示)和乙酸是有机化学中常用的合成原料。
①极性:富马酸 马来酸(填“>”、“<”或“=”);
②1个富马酸分子中含有 个σ键
③乙酸易溶于水,难溶于二硫化碳,原因为 。
17.(15分)电化学在生活中的应用无处不在。结合所学知识,回答下列问题。
I.在新能源汽车中的应用。HCOOH燃料电池是一种可应用于汽车动力的燃料电池。研究HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的半透膜隔开。
(1)该电池电势较高的是图中 电极(填“左侧”或“右侧”)。
(2)放电过程中需补充的物质A为 (填化学式)。
(3)Fe3+在该电池中作用是 。
II.在工业生产中的应用。次磷酸(H3PO2)可以通过电解的方法制备。电解制备次磷酸工作原理如图所示(相邻各室之间由阴或阳离子交换膜隔开):
(1)写出阴极的电极反应式 。
(2)图中电解装置的三个离子交换膜从左到右依次为哪种类型交换膜: 、 、 (填“阳”或“阴”)。
(3)随着电解的进行,阳极区稀硫酸浓度逐渐 _(填“升高”、“降低”或“不变”)。
Ⅲ.在金属精炼中的应用。如图为电解精炼银的示意图。若b极有少量红棕色气体产生,则生成该气体的电极反应式为 。
18.(15分)天然矿物有着丰富多彩的晶体结构。结合所学知识,回答下列问题。
(1)SiO2在自然界中以玛瑙、水晶等形式存在,玛瑙是熔融态的SiO2 冷却形成的(填“缓慢”或“快速”)。
(2)已知一束入射光在方解石中分解成两束偏振方向互相垂直、折射角不同的光,这种现象称为双折射。而普通玻璃却不能产生双折射现象,是因为方解石晶体具有 性。
(3)KCl和NaCl都是盐湖中常见的矿物盐。KCl、NaCl、AlCl3的熔点从高到低顺序依次为 ,原因是 。
(4)红镍矿的主要成分为砷化镍,其晶胞结构如下左图所示,则砷化镍化学式为: ,As的配位数是 。
(5)TiO2在自然界中存在三种矿石,其中金红石的晶胞结构如图A。TaO2的晶胞结构与其相似,也可用图A表示。TaO2与金红石的晶胞体积比约为1.065,TaO2与金红石的密度比约为2.5,则Ta的相对原子质量为 。
2024-2025学年第一学期
高二年级期末考试化学(高考类)参考答案
一、选择题
1-5.DDBAD 6-10.ABCCC 11-14.BBDD
↑ ↑ ↑
二、非选择题
15.(1)f 4
4f
(2)4f7轨道半充满,能量较低。 (3) D (4)2 哑铃
16.(1) HF>HI>HBr>HCl (2) V形 sp2 X射线衍射
(3)①< ②11 ③乙酸和水都为极性分子,二硫化碳为非极性分子,相似相溶;且乙酸和水分子间可以形成氢键,故乙酸易溶于水。
17.Ⅰ.(1) 右侧 (2) H2SO4 (3)催化剂
Ⅱ.(1) 2H2O+2e-=H2↑+2OH- (2)阳、阴、阳 (3)升高
Ⅲ.2H++NO3-+e-=NO2↑+H2O
18.(1)快速 (2)各向异
(3)NaCl>KCl>AlCl3
NaCl和KCl为离子晶体,AlCl3为分子晶体,离子晶体熔点>分子晶体,故AlCl3熔点最低;K+半径大于Na+,故KCl离子键弱于NaCl,因此熔点NaCl>KCl。
(4) NiAs 6 (5) 181
同课章节目录
