人教版(2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构 课件(共38张PPT)
文档属性
| 名称 | 人教版(2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构 课件(共38张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 11.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-29 15:05:17 | ||
图片预览







文档简介
(共38张PPT)
第一课时 原子结构
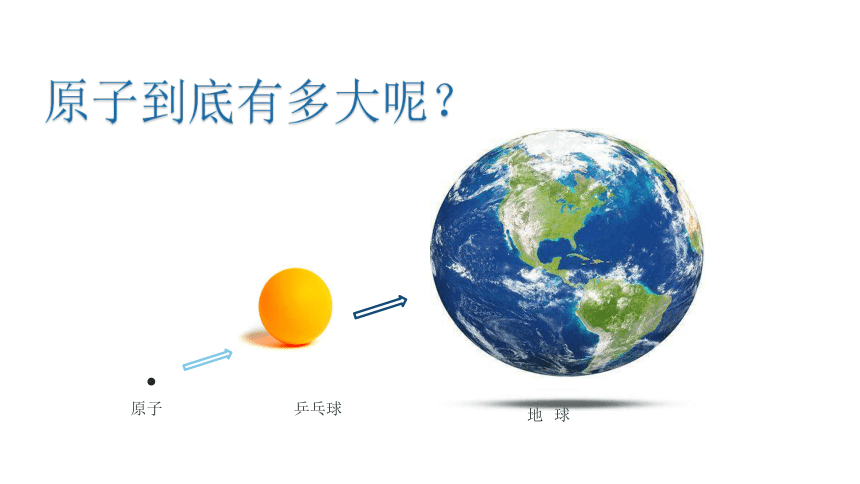
原子到底有多大呢?
乒乓球
原子
地 球
任务1 :回顾原子结构发展史
“原子”这一概念,最早是古希腊哲学家德谟克利特提出来的。他认为:宇宙万物由极微小的不可穿透、不可分割的粒子组成,这些粒子被称为原子
原子的起源
笼统模糊的哲学思辨
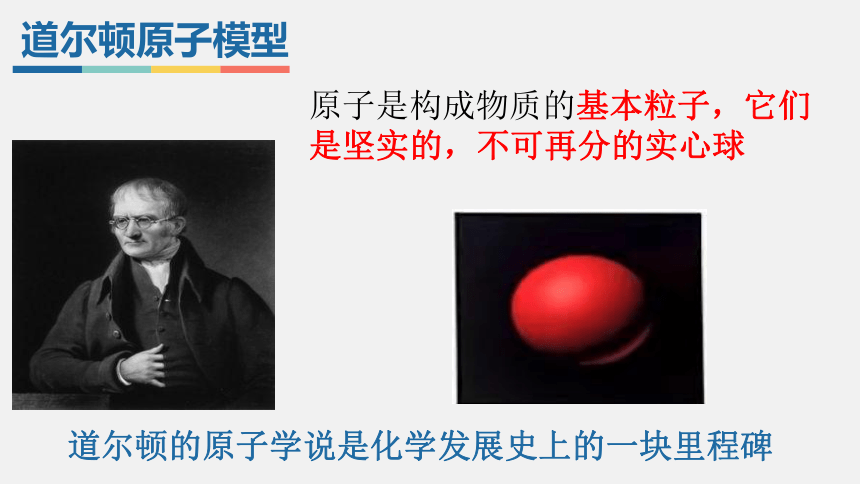
道尔顿原子模型
原子是构成物质的基本粒子,它们是坚实的,不可再分的实心球
道尔顿的原子学说是化学发展史上的一块里程碑
当客观对象不能直接研究时可以采取模型方法揭示原型客体的形态、本质和特征
如何理解模型
活动1:观察实验现象
阴极射线实验
带电的粒子被命名为电子
发现电子后,从此原子的大门被打开
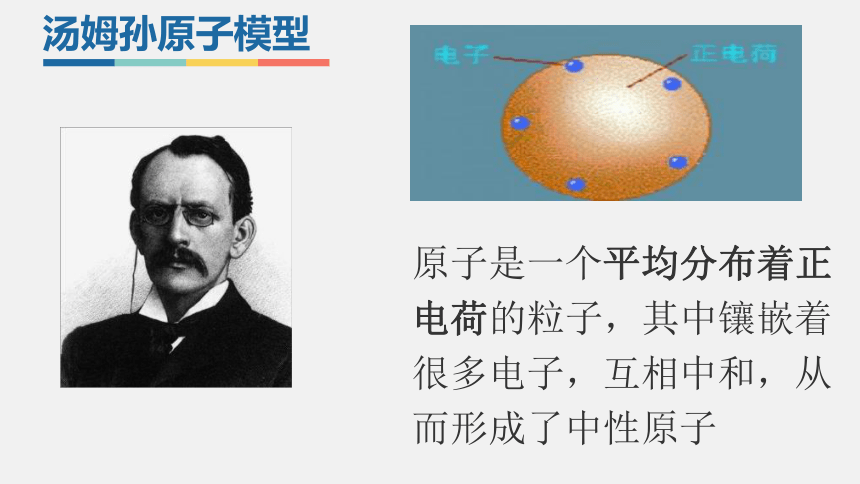
汤姆孙阴极射线实验
原子是一个平均分布着正电荷的粒子,其中镶嵌着很多电子,互相中和,从而形成了中性原子
汤姆孙原子模型
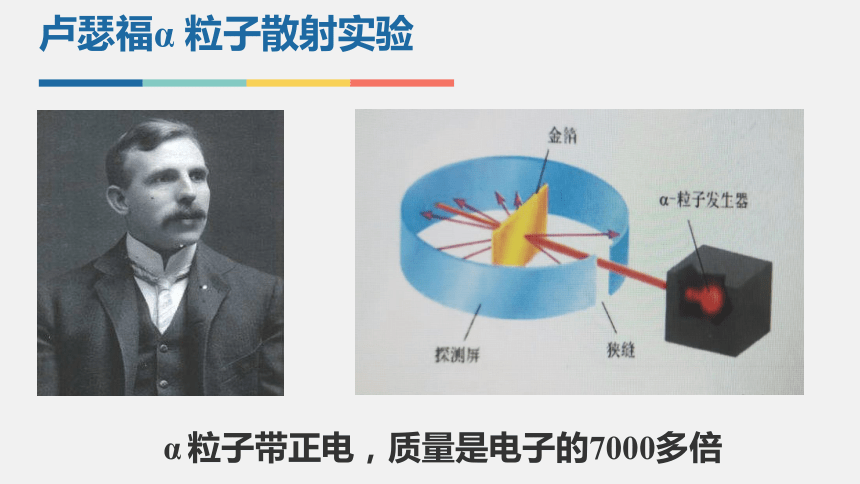
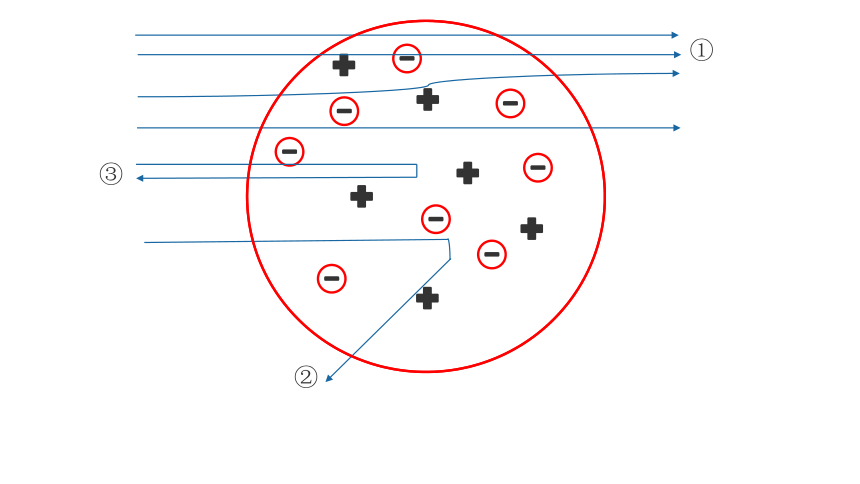
卢瑟福α 粒子散射实验
α 粒子带正电,质量是电子的7000多倍
活动2:观察实验现象
①
③
②
现象
(1)绝大多数α粒子穿过金箔后仍沿原来方向前进;
(2)少数α粒子发生了较大的偏转;
(3)有的甚至反弹,概率为1/8000
卢瑟福原子模型的建立
原子中心有一个很小的正电荷,并命名为“原子核”、原子质量几乎集中在原子核上,电子在核外空间进行绕核运动,卢瑟福把这个模型称作是“行星模型”
质子和中子的发现
1919年,卢瑟福又用α粒子轰击氮核发现了质子,进而猜想原子核里还有一种不带电的中子,10年后被他的学生查德威克用实验证实,并得到公认
基于核外电子运动建构原子模型
电子在原子核外空间的一定轨道上绕核做高速圆周运动
在微观世界,微观粒子的运动状态具有不确定性,只能用统计的方法来描述某一电子在核外某-空间位置出现的概率
电子云模型
玻尔模型
局限
基于经典力学解释微观粒子运动
原子结构模型的演变史
建立模型、运用模型和修正模型
科学理论的暂定性
科学中的观察、推理
科学知识的创造性和想象性
没有普适的科学方法
科学知识的尝试性本质
原子
原子核
核外电子
质子
中子
任务2. 原子质量的计算
质量数(A)=质子数(Z)+中子数(N)
C原子质量的1/12为标准,微粒质量的值与标准值相比得到相对质量
X
A
Z
原子符号
质子数相同,中子数不同的一种原子叫做核素
质子数相同、中子数不同的同一元素的不同原子互称为同位素
连续光谱有连续的能量,而原子光谱是线状光谱,核外电子的能量是不连续的
任务3. 掌握核外电子的排布规律
多电子原子,电子分别在能量不同的区域内运动,我们把这种不同的区域简化为不连续的壳层,也称作电子层
电子层表示方法:n=1、2、3、4、5、6、7或K、L、M、N、O、P、Q来表示从内到外的电子层
电子层表示方法 1 2 3 4 5 6 7
K L M N O P Q
排布顺序 能量高低 低 高
内 外
先排内层,能量低,较稳定
核外电子的排布规律
每个电子层最多可以排布多少个电子呢?
为什么内层能量低,外层能量高?
思考
核外电子排布规律
(1)电子总是先从内层排起,然后再排下一层
(2)最外层中的电子数最多只有8个(K层只有2个)
(3)次外层最多排布18个
(4)原子核外第n层最多能容纳的电子数为2n2
(5)倒数第三层最多排布32个(补充)
根据核外电子排布规律
书写 19号K、20号Ca、35号Br、53号I元素原子的核外电子排布示意图
Br
I
Ca
K
核外电子、元素性质的关系
Na易失去一个电子,表现出Na的还原性
CI易得到一个电子,表现出CI2的氧化性
Na
CI
CI-
最外层电子决定元素性质
基于核外电子排布预测未知元素性质
易失去一个电子,表现出强还原性
小结
1.原子
核外电子
质子
中子
原子核
2.质量数(A)=质子数(Z)+中子数(N)
3. 核外电子排布规律
核素、同位素
随堂练习
1.下列关于原子模型说法正确的是( )
A .道尔顿的原子模型是基于哲学思辨提出来的,没有经过实验的验证
B.玻尔模型的局限性在于用经典力学来解释微观世界
C.电子云模型中原子核外的小黑点代表电子
D.卢瑟福认为核外电子是在确定的轨道上运动的
B
随堂练习
2. O ,质量数、质子数、中子数各为多少
3. 关于 U 、U,下列说法不正确的是( )
1 8
8
235
238
A. 它们的化学性质基本相同 B. 它们互称同位素
C. 它们的质子数相同 D. 它们的中子数相同
D
随堂练习
4.下面关于多电子原子的核外电子的运动规律叙述正确的是( )
①核外电子是分层排布的 ②所有电子在同一区域里运动
③能量高的电子在离核近的区域内运动 ④能量低的电子在离核近的区域内运动
A.①④ B.②③
C.①③ D.②④
A
随堂练习
5.下列元素原子核外电子排布说法正确的是( )
A. 钠元素原子结构示意图中最外层只有1个电子
B. 所有元素最外层最多只能排布8个电子
C.所有元素次外层最多只能容纳18个电子
D. 稀有气体元素都是8电子稳定结构
E.第n层最多能容纳的电子数为n2个
A
已知 X 、 Y 、 Z 三种元素,X元素第L层为第K层的3倍,Y元素失去1个电子形成8电子稳定结构,且Y+与X电子层数相等,Z元素最外层为7个电子,和Y电子层数相同,试推断X、Y、Z三种元素
X: O Y: Na Z: CI
推断题
下课,同学们再见
第一课时 原子结构
原子到底有多大呢?
乒乓球
原子
地 球
任务1 :回顾原子结构发展史
“原子”这一概念,最早是古希腊哲学家德谟克利特提出来的。他认为:宇宙万物由极微小的不可穿透、不可分割的粒子组成,这些粒子被称为原子
原子的起源
笼统模糊的哲学思辨
道尔顿原子模型
原子是构成物质的基本粒子,它们是坚实的,不可再分的实心球
道尔顿的原子学说是化学发展史上的一块里程碑
当客观对象不能直接研究时可以采取模型方法揭示原型客体的形态、本质和特征
如何理解模型
活动1:观察实验现象
阴极射线实验
带电的粒子被命名为电子
发现电子后,从此原子的大门被打开
汤姆孙阴极射线实验
原子是一个平均分布着正电荷的粒子,其中镶嵌着很多电子,互相中和,从而形成了中性原子
汤姆孙原子模型
卢瑟福α 粒子散射实验
α 粒子带正电,质量是电子的7000多倍
活动2:观察实验现象
①
③
②
现象
(1)绝大多数α粒子穿过金箔后仍沿原来方向前进;
(2)少数α粒子发生了较大的偏转;
(3)有的甚至反弹,概率为1/8000
卢瑟福原子模型的建立
原子中心有一个很小的正电荷,并命名为“原子核”、原子质量几乎集中在原子核上,电子在核外空间进行绕核运动,卢瑟福把这个模型称作是“行星模型”
质子和中子的发现
1919年,卢瑟福又用α粒子轰击氮核发现了质子,进而猜想原子核里还有一种不带电的中子,10年后被他的学生查德威克用实验证实,并得到公认
基于核外电子运动建构原子模型
电子在原子核外空间的一定轨道上绕核做高速圆周运动
在微观世界,微观粒子的运动状态具有不确定性,只能用统计的方法来描述某一电子在核外某-空间位置出现的概率
电子云模型
玻尔模型
局限
基于经典力学解释微观粒子运动
原子结构模型的演变史
建立模型、运用模型和修正模型
科学理论的暂定性
科学中的观察、推理
科学知识的创造性和想象性
没有普适的科学方法
科学知识的尝试性本质
原子
原子核
核外电子
质子
中子
任务2. 原子质量的计算
质量数(A)=质子数(Z)+中子数(N)
C原子质量的1/12为标准,微粒质量的值与标准值相比得到相对质量
X
A
Z
原子符号
质子数相同,中子数不同的一种原子叫做核素
质子数相同、中子数不同的同一元素的不同原子互称为同位素
连续光谱有连续的能量,而原子光谱是线状光谱,核外电子的能量是不连续的
任务3. 掌握核外电子的排布规律
多电子原子,电子分别在能量不同的区域内运动,我们把这种不同的区域简化为不连续的壳层,也称作电子层
电子层表示方法:n=1、2、3、4、5、6、7或K、L、M、N、O、P、Q来表示从内到外的电子层
电子层表示方法 1 2 3 4 5 6 7
K L M N O P Q
排布顺序 能量高低 低 高
内 外
先排内层,能量低,较稳定
核外电子的排布规律
每个电子层最多可以排布多少个电子呢?
为什么内层能量低,外层能量高?
思考
核外电子排布规律
(1)电子总是先从内层排起,然后再排下一层
(2)最外层中的电子数最多只有8个(K层只有2个)
(3)次外层最多排布18个
(4)原子核外第n层最多能容纳的电子数为2n2
(5)倒数第三层最多排布32个(补充)
根据核外电子排布规律
书写 19号K、20号Ca、35号Br、53号I元素原子的核外电子排布示意图
Br
I
Ca
K
核外电子、元素性质的关系
Na易失去一个电子,表现出Na的还原性
CI易得到一个电子,表现出CI2的氧化性
Na
CI
CI-
最外层电子决定元素性质
基于核外电子排布预测未知元素性质
易失去一个电子,表现出强还原性
小结
1.原子
核外电子
质子
中子
原子核
2.质量数(A)=质子数(Z)+中子数(N)
3. 核外电子排布规律
核素、同位素
随堂练习
1.下列关于原子模型说法正确的是( )
A .道尔顿的原子模型是基于哲学思辨提出来的,没有经过实验的验证
B.玻尔模型的局限性在于用经典力学来解释微观世界
C.电子云模型中原子核外的小黑点代表电子
D.卢瑟福认为核外电子是在确定的轨道上运动的
B
随堂练习
2. O ,质量数、质子数、中子数各为多少
3. 关于 U 、U,下列说法不正确的是( )
1 8
8
235
238
A. 它们的化学性质基本相同 B. 它们互称同位素
C. 它们的质子数相同 D. 它们的中子数相同
D
随堂练习
4.下面关于多电子原子的核外电子的运动规律叙述正确的是( )
①核外电子是分层排布的 ②所有电子在同一区域里运动
③能量高的电子在离核近的区域内运动 ④能量低的电子在离核近的区域内运动
A.①④ B.②③
C.①③ D.②④
A
随堂练习
5.下列元素原子核外电子排布说法正确的是( )
A. 钠元素原子结构示意图中最外层只有1个电子
B. 所有元素最外层最多只能排布8个电子
C.所有元素次外层最多只能容纳18个电子
D. 稀有气体元素都是8电子稳定结构
E.第n层最多能容纳的电子数为n2个
A
已知 X 、 Y 、 Z 三种元素,X元素第L层为第K层的3倍,Y元素失去1个电子形成8电子稳定结构,且Y+与X电子层数相等,Z元素最外层为7个电子,和Y电子层数相同,试推断X、Y、Z三种元素
X: O Y: Na Z: CI
推断题
下课,同学们再见
