上海市2024-2025学年高二上学期1月期末考试 化学试题(无答案)
文档属性
| 名称 | 上海市2024-2025学年高二上学期1月期末考试 化学试题(无答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-31 09:44:34 | ||
图片预览

文档简介
2024学年第一学期期末教学质量检测
高二化学 (B) 试卷
说明:(1) 本场考试时间为60分钟,总分100分;
(2) 请认真答卷,并用规范汉字书写。
可能用到的相对原子质量:
H-1 O-16 Cl-35.5 As-75
一、甲苯和甲烷在有机合成中的应用
甲苯和甲烷是有机合成中的重要原料,以二者为原料合成某有机物的历程如下:
已知:a. 两个羟基同时连在同一个碳原子上的结构是不稳定的,会发生脱水反应:
c. E能发生银镜反应,且只有一种化学环境的氢原子
完成下列填空:
1. G中所含官能团名称为 , 。
2. G中氧原子的杂化方式为 。
3. A→B的化学方程式为 。
4. H的结构简式为 。
5. 下列说法正确的是 ( )(不定项选择)
A. F可以使希夫试剂变为紫红色
B. 甲苯是石油裂解的主要产物之一
C. 1molE 最多与4mol银氨溶液充分反应生成碳酸铵
D . G分子中最多有4个原子共平面
6. 以乙苯为原料(其他原料任选)制备目标产物聚苯乙烯
二、SnCl 的制备
SnCl 主要用于有机锡化合物的制造,也可用作分析试剂、有机合成脱水剂,还可用于电镀工业。
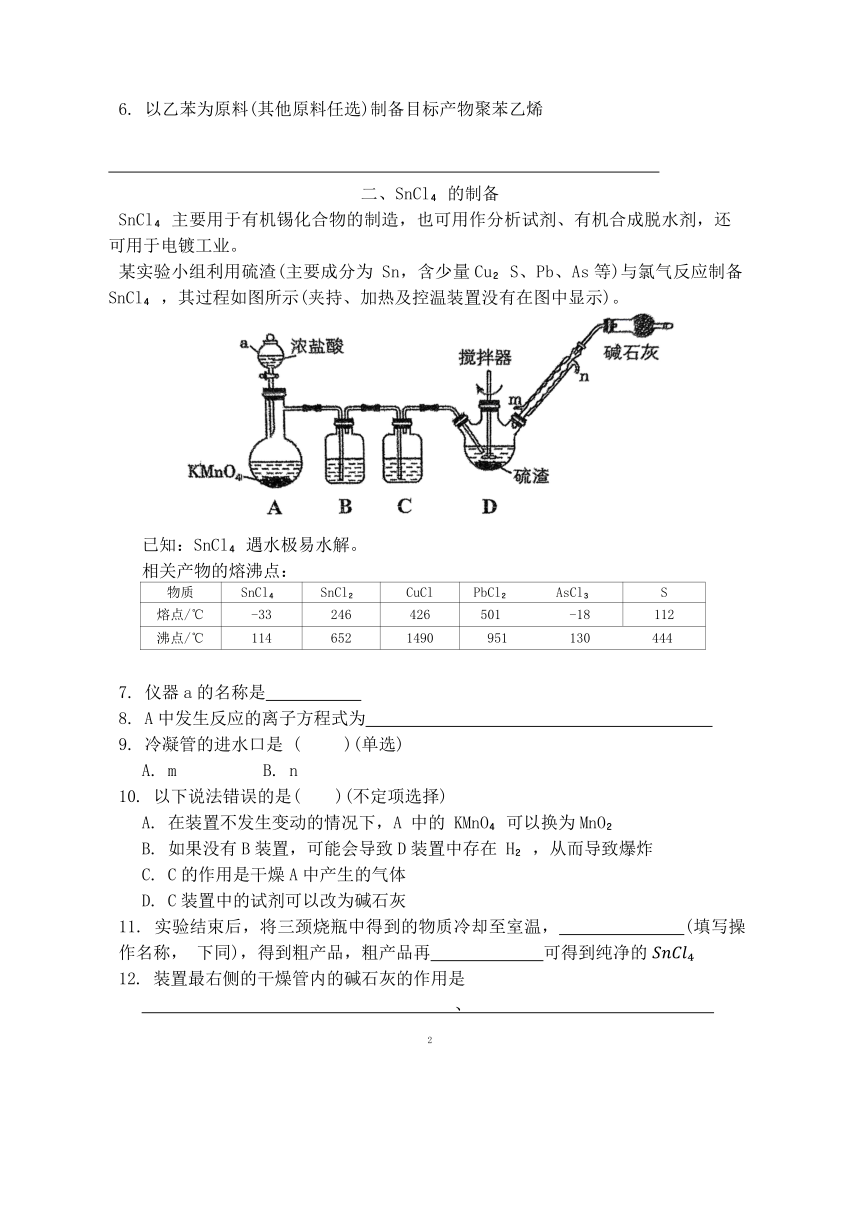
某实验小组利用硫渣(主要成分为 Sn,含少量Cu S、Pb、As等)与氯气反应制备SnCl ,其过程如图所示(夹持、加热及控温装置没有在图中显示)。
已知:SnCl 遇水极易水解。
相关产物的熔沸点:
物质 SnCl SnCl CuCl PbCl AsCl S
熔点/℃ -33 246 426 501 -18 112
沸点/℃ 114 652 1490 951 130 444
7. 仪器a的名称是
8. A中发生反应的离子方程式为
9. 冷凝管的进水口是 ( )(单选)
A. m B. n
10. 以下说法错误的是( )(不定项选择)
A. 在装置不发生变动的情况下,A 中的 KMnO 可以换为MnO
B. 如果没有B装置,可能会导致D装置中存在 H ,从而导致爆炸
C. C的作用是干燥A中产生的气体
D. C装置中的试剂可以改为碱石灰
11. 实验结束后,将三颈烧瓶中得到的物质冷却至室温, (填写操作名称, 下同),得到粗产品,粗产品再 可得到纯净的
12. 装置最右侧的干燥管内的碱石灰的作用是
、
2
13. 用碘量法可测得粗产品(主要杂质为AsCl )的纯度:取8.00g粗产品溶于水,加入 的标准I 溶液20.00mL, 并加入少量的淀粉溶液; 用1.000× 的硫代硫酸钠溶液滴定过量的碘。滴定终点时,消耗18.00mL硫代硫酸钠标准溶液。测定过程中发生的相关反应:
则粗产品中 SnCl 的质量分数为 (保留三位有效数字)
三、软锰矿工业合成电极材料
工业可用软锰矿制备锰酸锂(LiMn O ),锰酸锂作为电极材料具有价格低、电位高、环境友好、安全性能高等优点,是最有希望取代钴酸锂LiCoO 成为新一代锂离子电池的正极材料。
工业上常用软锰矿(主要成分 MnO ,含少量 和 合成电极材料LiMn O 并回收净水剂明矾,其工业如下图所示:
已知:
②SiO 不溶于硫酸
③Mn 在酸性条件下比较稳定,当pH 高于 5.5 时易被O 氧化
④当溶液中某离子 时,可认为该离子沉淀完全; 常温下,集中沉淀的 Ksp如下表所示:
Fe(OH) Al(OH) Mn(OH) Fe(OH)
Ksp 1.0×10 1.0×10 5.0×10 5.0×10
14. Mn的价电子排布式为
15. 以下关于第一步“酸浸”的说法正确的是( )(单选)
A. 稀硫酸可以改为浓硫酸
B. 滤渣Ⅰ的主要成分是 SiO
C. 加入 SO 的目的只是为了还原 MnO
D. “酸浸”后溶液中主要存在的离子有
16. 一定温度下,软锰矿与不同浓度的硫酸反应60min时结果如表所示:
c(H SO )/(mol·L ) 1.0 5.0 10.0 16.0
Mn浸出率/% 25 78 95 85
Al浸出率/% 35 90 83 5
3
则“酸浸”时,选择(a(H SO )为( ) mol-L-1 (单选)
A. 1.0 B. 5.0 C. 10.0 D.16.0
17. 滤渣Ⅱ的主要成分是
18. 加入O 氧化的目的是
19. 获取明矾的一系列操作为 、冷却结晶、过滤、洗涤、干燥
20. 如入 MaCO 调pH时,为了使得沉淀Ⅱ沉淀完全,又可以使溶液中Mn 的浓度大于等于1mol-L ,其他离子含量较低,不考虑调整pH过程中产生的沉淀。则pH的调整范围是 (保留1位小数)
四、氨水的滴定
常温下, 往20.00mL1.000mol-L-1 氨水中滴入等浓度盐酸, 溶液pH和温度随加入盐酸体积的变化曲线如图:
21. c、d两点水的离子积 Kw(c) Kw(d)。 (单选)
A > B.< C.=
22. 写出氯化铵水解的离子方程式: 。
23. 图上各点中,水的电离程度最大的是 ( )(单选)
A. a B. b C. c D. d E. e
24. 若e点的 该温度下 则该温度下溶液pH= 。(保留2位有效数字)
25. 当盐酸滴入10mL时得到b点溶液,已知该温度下 此时[NH ·H O] [NH ] (单选)
A.> B.< C.=
通过计算解释原因:
26、针对上图各点,说法正确的是 ( )(单选)
A. a点对应的溶液存在
B. b点对应的溶液存在
C. b点氮化铵浓度低于e点,b点铵根离子的水解程度一定大于e点
D. c点对应的溶液存在
五、氯吡格雷的合成
氯吡格雷是一种血小板“拮抗剂”,主要用于预防或治疗血液循环障碍疾病。某实验小组设计了一种合成氯吡格雷(G) 的路线如下:
回答下列问题:
27. A的化学式为 ,E中含氧官能团名称为 。
28. C的结构简式为 , 1m ol C最多与 mol NaOH 反应。
29. G分子中含有 个手性碳原子。
30. A→B 的反应类型为 。
31. 写出D→E的化学方程式 ;反应类型为 。
32. A与银氨溶液的反应方程式 。
33. A中卤原子种类的检测方法 。
34. 符合下列条件的的D同分异构体有 。
①属于芳香族化合物;
②含有氯原子且所有的氯原子与苯环直接相连;
③能够在新制氢氧化铜加热的条件下产生砖红色沉淀;
④分子中含有3种不同化学环境的氢原子
。 H
5
高二化学 (B) 试卷
说明:(1) 本场考试时间为60分钟,总分100分;
(2) 请认真答卷,并用规范汉字书写。
可能用到的相对原子质量:
H-1 O-16 Cl-35.5 As-75
一、甲苯和甲烷在有机合成中的应用
甲苯和甲烷是有机合成中的重要原料,以二者为原料合成某有机物的历程如下:
已知:a. 两个羟基同时连在同一个碳原子上的结构是不稳定的,会发生脱水反应:
c. E能发生银镜反应,且只有一种化学环境的氢原子
完成下列填空:
1. G中所含官能团名称为 , 。
2. G中氧原子的杂化方式为 。
3. A→B的化学方程式为 。
4. H的结构简式为 。
5. 下列说法正确的是 ( )(不定项选择)
A. F可以使希夫试剂变为紫红色
B. 甲苯是石油裂解的主要产物之一
C. 1molE 最多与4mol银氨溶液充分反应生成碳酸铵
D . G分子中最多有4个原子共平面
6. 以乙苯为原料(其他原料任选)制备目标产物聚苯乙烯
二、SnCl 的制备
SnCl 主要用于有机锡化合物的制造,也可用作分析试剂、有机合成脱水剂,还可用于电镀工业。
某实验小组利用硫渣(主要成分为 Sn,含少量Cu S、Pb、As等)与氯气反应制备SnCl ,其过程如图所示(夹持、加热及控温装置没有在图中显示)。
已知:SnCl 遇水极易水解。
相关产物的熔沸点:
物质 SnCl SnCl CuCl PbCl AsCl S
熔点/℃ -33 246 426 501 -18 112
沸点/℃ 114 652 1490 951 130 444
7. 仪器a的名称是
8. A中发生反应的离子方程式为
9. 冷凝管的进水口是 ( )(单选)
A. m B. n
10. 以下说法错误的是( )(不定项选择)
A. 在装置不发生变动的情况下,A 中的 KMnO 可以换为MnO
B. 如果没有B装置,可能会导致D装置中存在 H ,从而导致爆炸
C. C的作用是干燥A中产生的气体
D. C装置中的试剂可以改为碱石灰
11. 实验结束后,将三颈烧瓶中得到的物质冷却至室温, (填写操作名称, 下同),得到粗产品,粗产品再 可得到纯净的
12. 装置最右侧的干燥管内的碱石灰的作用是
、
2
13. 用碘量法可测得粗产品(主要杂质为AsCl )的纯度:取8.00g粗产品溶于水,加入 的标准I 溶液20.00mL, 并加入少量的淀粉溶液; 用1.000× 的硫代硫酸钠溶液滴定过量的碘。滴定终点时,消耗18.00mL硫代硫酸钠标准溶液。测定过程中发生的相关反应:
则粗产品中 SnCl 的质量分数为 (保留三位有效数字)
三、软锰矿工业合成电极材料
工业可用软锰矿制备锰酸锂(LiMn O ),锰酸锂作为电极材料具有价格低、电位高、环境友好、安全性能高等优点,是最有希望取代钴酸锂LiCoO 成为新一代锂离子电池的正极材料。
工业上常用软锰矿(主要成分 MnO ,含少量 和 合成电极材料LiMn O 并回收净水剂明矾,其工业如下图所示:
已知:
②SiO 不溶于硫酸
③Mn 在酸性条件下比较稳定,当pH 高于 5.5 时易被O 氧化
④当溶液中某离子 时,可认为该离子沉淀完全; 常温下,集中沉淀的 Ksp如下表所示:
Fe(OH) Al(OH) Mn(OH) Fe(OH)
Ksp 1.0×10 1.0×10 5.0×10 5.0×10
14. Mn的价电子排布式为
15. 以下关于第一步“酸浸”的说法正确的是( )(单选)
A. 稀硫酸可以改为浓硫酸
B. 滤渣Ⅰ的主要成分是 SiO
C. 加入 SO 的目的只是为了还原 MnO
D. “酸浸”后溶液中主要存在的离子有
16. 一定温度下,软锰矿与不同浓度的硫酸反应60min时结果如表所示:
c(H SO )/(mol·L ) 1.0 5.0 10.0 16.0
Mn浸出率/% 25 78 95 85
Al浸出率/% 35 90 83 5
3
则“酸浸”时,选择(a(H SO )为( ) mol-L-1 (单选)
A. 1.0 B. 5.0 C. 10.0 D.16.0
17. 滤渣Ⅱ的主要成分是
18. 加入O 氧化的目的是
19. 获取明矾的一系列操作为 、冷却结晶、过滤、洗涤、干燥
20. 如入 MaCO 调pH时,为了使得沉淀Ⅱ沉淀完全,又可以使溶液中Mn 的浓度大于等于1mol-L ,其他离子含量较低,不考虑调整pH过程中产生的沉淀。则pH的调整范围是 (保留1位小数)
四、氨水的滴定
常温下, 往20.00mL1.000mol-L-1 氨水中滴入等浓度盐酸, 溶液pH和温度随加入盐酸体积的变化曲线如图:
21. c、d两点水的离子积 Kw(c) Kw(d)。 (单选)
A > B.< C.=
22. 写出氯化铵水解的离子方程式: 。
23. 图上各点中,水的电离程度最大的是 ( )(单选)
A. a B. b C. c D. d E. e
24. 若e点的 该温度下 则该温度下溶液pH= 。(保留2位有效数字)
25. 当盐酸滴入10mL时得到b点溶液,已知该温度下 此时[NH ·H O] [NH ] (单选)
A.> B.< C.=
通过计算解释原因:
26、针对上图各点,说法正确的是 ( )(单选)
A. a点对应的溶液存在
B. b点对应的溶液存在
C. b点氮化铵浓度低于e点,b点铵根离子的水解程度一定大于e点
D. c点对应的溶液存在
五、氯吡格雷的合成
氯吡格雷是一种血小板“拮抗剂”,主要用于预防或治疗血液循环障碍疾病。某实验小组设计了一种合成氯吡格雷(G) 的路线如下:
回答下列问题:
27. A的化学式为 ,E中含氧官能团名称为 。
28. C的结构简式为 , 1m ol C最多与 mol NaOH 反应。
29. G分子中含有 个手性碳原子。
30. A→B 的反应类型为 。
31. 写出D→E的化学方程式 ;反应类型为 。
32. A与银氨溶液的反应方程式 。
33. A中卤原子种类的检测方法 。
34. 符合下列条件的的D同分异构体有 。
①属于芳香族化合物;
②含有氯原子且所有的氯原子与苯环直接相连;
③能够在新制氢氧化铜加热的条件下产生砖红色沉淀;
④分子中含有3种不同化学环境的氢原子
。 H
5
同课章节目录
