1.3常见的酸
图片预览








文档简介
课件31张PPT。常见的酸酸、碱、盐盐酸:
硝酸:
硫酸:HCI === H + + CI-电离方程式:H NO3 === H + + NO3-H2SO4 == 2H + + SO 42-
酸电离通式:酸= H+ + 酸根阴离子什么是酸?强酸:盐酸(HCl)、硫酸(H2SO4)、
硝酸(HNO3)
弱酸:醋酸(CH3COOH)
H2CO3 H2S HF 等一、酸有哪些性质1、酸能使指示剂变色,其中能使紫色石蕊试液变红色,使无色酚酞试液不变色。2、酸 + 碱 = 盐 + 水 2HCl + CaCO3 = CaCl2 + H2O + CO2↑HCl+AgNO3= AgCl↓+HNO33、酸 + 盐 = 新盐 + 新酸 4、酸 +金属氧化物= 盐 + 水2HCl + CuO = CuCl2 + H2O5、酸 + 某些金属 === 盐 + 氢气Fe + 2HCl === FeCl2 + H2 ↑
Zn + 2HCl === ZnCl2 + H2↑*? CO32-的检验:加盐酸,能产生使澄清石灰水变浑浊的气体(二氧化碳) Ca(OH)2 + CO2 = CaCO3 ↓ + H2ONa2C03+2AgNO3===Ag2C03↓+2NaN03
Ag2C03+2HN03===AgN03+H20+C02↑CI-的检验:滴加几滴AgNO3溶液,如果能产
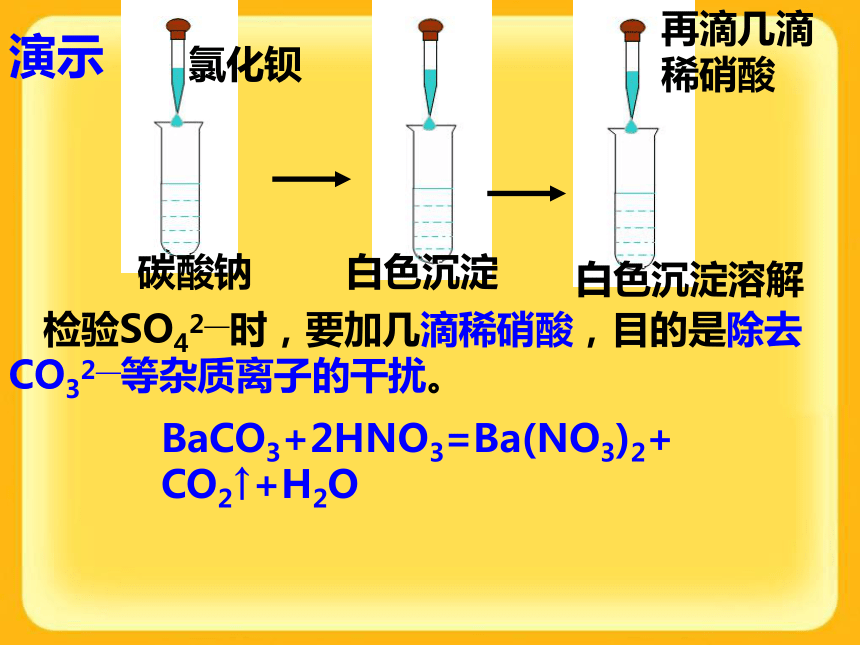
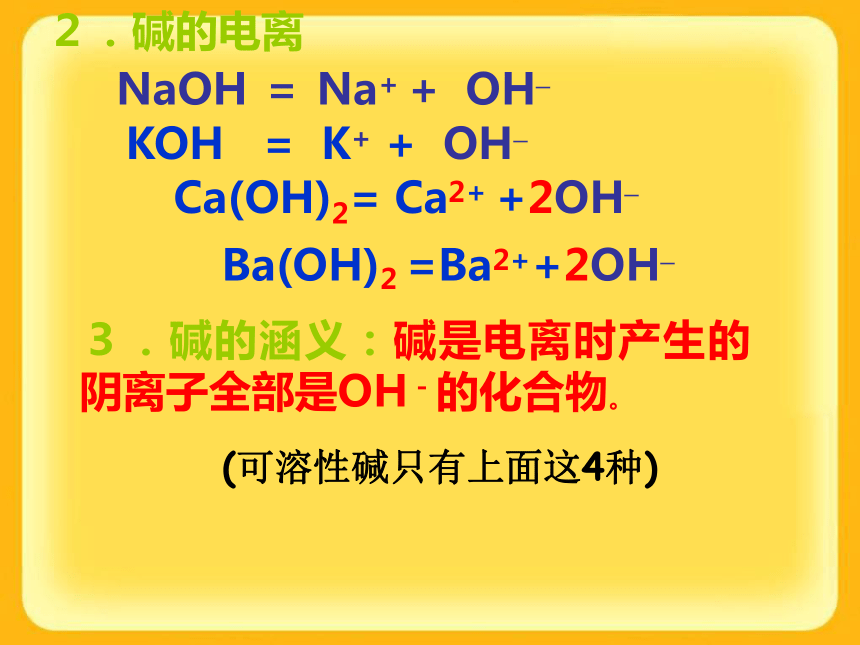
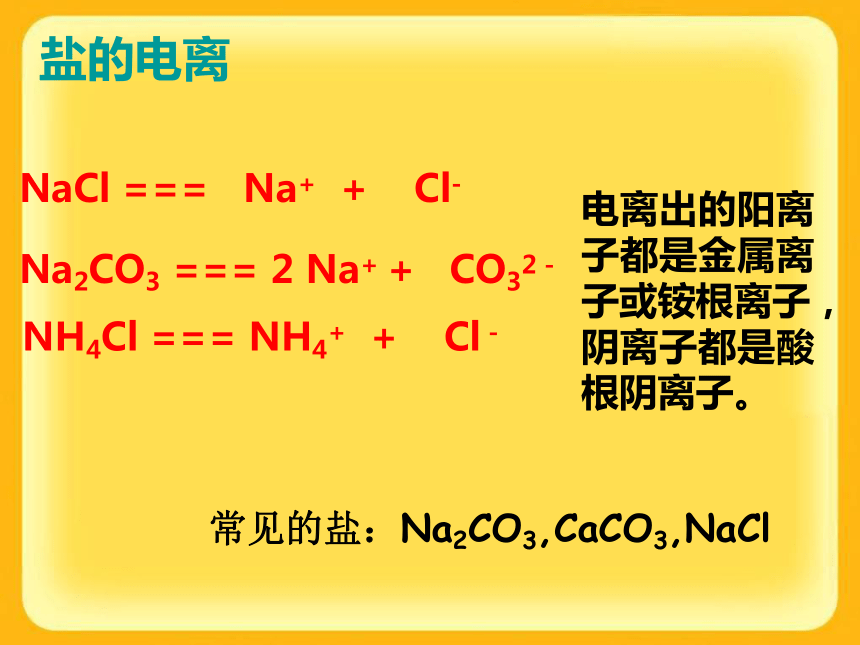
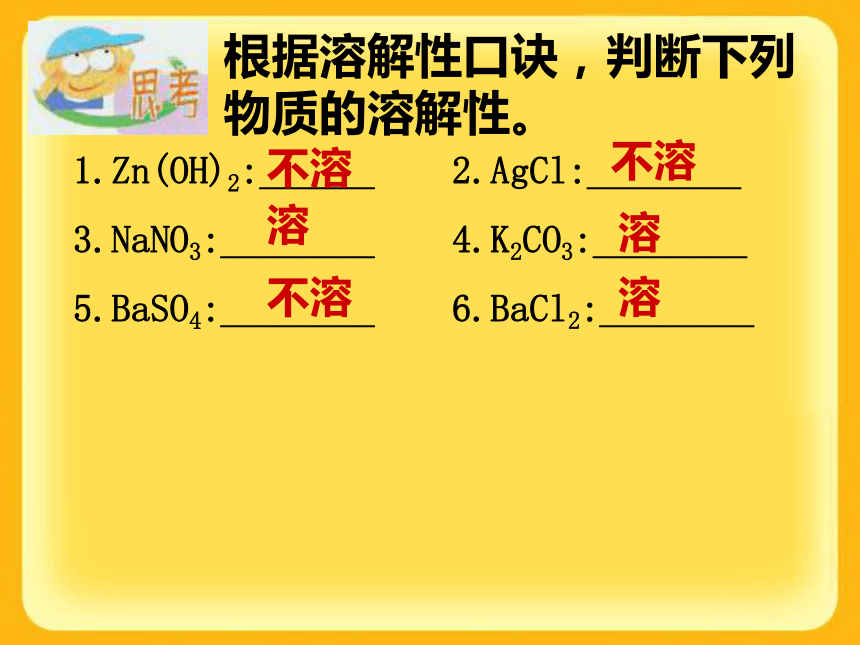
生一种不溶于稀硝酸的白色沉 淀,则该物质中就含有Cl-思考:检验Cl-时,为什么要加稀HNO3? Na2C03溶液滴几滴AgNO3溶液,再滴稀硝酸,观察现象演示:检验Cl-时,要加几滴稀硝酸,目的是除去CO32—等杂质离子的干扰。SO42—的检验方法:滴加氯化钡溶液出现白色沉淀,再滴入稀硝酸沉淀不溶解。思考:检验Cl-或SO42-时,为什么要加稀HNO3? 演示碳酸钠氯化钡白色沉淀再滴几滴稀硝酸白色沉淀溶解 检验SO42—时,要加几滴稀硝酸,目的是除去CO32—等杂质离子的干扰。BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2ONaOH = Na+ + OH– Ca(OH)2= Ca2+ +2OH– Ba(OH)2 =Ba2++2OH– KOH = K+ + OH–3.碱的涵义:碱是电离时产生的阴离子全部是OH-的化合物。2.碱的电离(可溶性碱只有上面这4种)2、碱+ 酸 = 盐 + 水实质:H++OH-=H2O3、碱+某些盐?另碱+另盐CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl4、碱+非金属氧化物?盐+水盐的电离NaCl === Na+ + Cl-Na2CO3 === 2 Na+ + CO32-电离出的阳离子都是金属离子或铵根离子,阴离子都是酸根阴离子。NH4Cl === NH4+ + Cl-常见的盐:Na2CO3,CaCO3,NaCl根据溶解性口诀,判断下列物质的溶解性。1.Zn(OH)2:______ 2.AgCl:________
3.NaNO3:________ 4.K2CO3:________
5.BaSO4:________ 6.BaCl2:________不溶不溶不溶溶溶溶复分解反应的条件:生成物中有沉淀或气体或水。2NaOH + H2SO4 = Na2SO4 + 2H2O Na2CO3+Ca(OH)2 = CaCO3↓ +2NaOH2HCl + CaCO3 = CaCl2 + H2O + CO2↑下列反应能进行吗?NaOH+BaCl2= Ba(OH)2+NaCl这个反应是不能进行。金属变化的规律金属和氧气的反应金属和酸的反应2Al + 6HCl = 2AlCl3 + 3H2↑Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑金属跟盐反应Fe + CuSO4 = FeSO4 + Cu
Cu+ FeSO4 ≠常见题型一、溶液中的共存题 例1下列各组物质中,能够共存于同一溶液中的是( )
(A)HNO3、Cu(NO3)2、NaOH
(B)KOH、KNO3、MgSO4
(C)MgCl2、Na2CO3、HCl
(D)NaNO3、NaOH、KClD例2 向下列分别装有三种物质的4支试管中,加入足量的水,可得到无色透明溶液的一组物质是( )
(A)AgNO3、Zn(NO3)2、MgCl2
(B)NaCl、FeCl3、H2SO4
(C)KCl、Na2CO3、KNO3
(D)CaCl2、NaNO3、K2CO3C例3 下列各组离子中,不能大量共存于同一溶液中的一组是( )。
(A)Ag+、Ba2+、NO3-、H+
(B)Fe3+、Cl-、K+、OH-
(C)Cu2+、SO42-、K+、NO3-
(D)Zn2+、Cl-、K+、NO3-B例4 某溶液的pH=10,在该溶液中能够大量共存的一组物质是( )。
(A)KOH、BaCl2、NaNO3
(B)Ca(NO3)2、NaCl、K2CO3
(C)FeCl3、KNO3、NaNO3:
(D)KCl、Na2SO4、MgSO4 A巩固练习
1.下列各组物质在溶液中可大量共存的一组是( )
(A)NaOH、NaNO3、CuCl2
(B)Ba(OH)2、KCl、NaNO3
(C)BaCl2、HCl、Na2SO4
(D) K2SO4、Na2CO3、Ba(NO3)2
2.将下列各组物质在水中混合,可配制成澄清的混合溶液的是( )。
(A)Ba(OH)2、NaNO3、K2SO4
(B)NH4Cl、H2SO4、AgNO3
(C)K2CO3、Na2SO4、HNO3
(D)NaOH、BaCl2、KNO3BD3.在pH=0的溶液中,能够大量共存的一组物质是( )
(A)NaNO3、K2CO3、CuCl2
(B)FeCl3、NaCl、Ca(NO3)2
(C)KNO3、NaOH、CaCl2
(D)Ca(NO3)2、CuSO4、Na2CO3
4.在检验某蓝色未知溶液的组成时,不同的实验者分别得到下列几种结论,其中可能正确的是( )
(A)Cu(NO3)2、NaNO3、BaCl2
(B)Na2SO4、CuCl2、AgNO3
(C)Cu(NO3)2、BaCl2、NaOH
(D)Na2SO4、MgCl2、HNO3
BA●指示剂法●酸液法●碱液法●盐溶液法二、鉴别物质 用化学方法鉴别Na2SO4、KOH和稀H2SO4溶液,指出反应现象及结论。方法一、指示剂法。选用紫色石蕊试液方法二、碱液法 先加入氢氧化钡溶液再加入碳酸钠溶液 用化学方法鉴别Na2SO4、KOH和稀H2SO4溶液,指出
反应现象及结论。方法三、盐溶液法 先加碳酸钠溶液再滴加硫酸铜溶液 在试剂鉴别中要遵循方法简单、
操作方便、现象明显、设计合理
的原则二、鉴别物质A 组 NaOH HCl NaCl
B 组 NaOH NaCl CuSO4 例3在一条鱼虾绝迹的小河边,有四座工厂:甲、乙、丙、丁。他们排放的废液里,每厂只有碳酸钠、氯化铁、氢氧化钙、盐酸的一种。某中学环保小组对实现调查的情况如图。甲处的河水是乳白色的,乙处的河水是红褐色的,丙处的河水变清了,丁处的河水是清的,但有气泡产生。
请推测这四座工厂废液里的污染物Ca(OH)2是微溶的,所以甲厂排放的是Ca(OH)2乙处的河水呈红褐色,说明生成了氢氧
化铁沉淀。 乙工厂排放的废液含有FeCl3从上流下的不溶物是Ca(OH)2和Fe(OH)3,
丙处变清了,说明生发反应,能与之反应
的是HClHCl丁处产生气泡,说明碳酸钠与盐酸反应Na2CO34.不用其他试剂,鉴别①Na2CO3,②KCl,③Mg(NO3)2,④CuSO4四种溶液,正确的鉴别顺序是( )
A、①④③② B.④①③②
C.④②①③ D.①③④②B
硝酸:
硫酸:HCI === H + + CI-电离方程式:H NO3 === H + + NO3-H2SO4 == 2H + + SO 42-
酸电离通式:酸= H+ + 酸根阴离子什么是酸?强酸:盐酸(HCl)、硫酸(H2SO4)、
硝酸(HNO3)
弱酸:醋酸(CH3COOH)
H2CO3 H2S HF 等一、酸有哪些性质1、酸能使指示剂变色,其中能使紫色石蕊试液变红色,使无色酚酞试液不变色。2、酸 + 碱 = 盐 + 水 2HCl + CaCO3 = CaCl2 + H2O + CO2↑HCl+AgNO3= AgCl↓+HNO33、酸 + 盐 = 新盐 + 新酸 4、酸 +金属氧化物= 盐 + 水2HCl + CuO = CuCl2 + H2O5、酸 + 某些金属 === 盐 + 氢气Fe + 2HCl === FeCl2 + H2 ↑
Zn + 2HCl === ZnCl2 + H2↑*? CO32-的检验:加盐酸,能产生使澄清石灰水变浑浊的气体(二氧化碳) Ca(OH)2 + CO2 = CaCO3 ↓ + H2ONa2C03+2AgNO3===Ag2C03↓+2NaN03
Ag2C03+2HN03===AgN03+H20+C02↑CI-的检验:滴加几滴AgNO3溶液,如果能产
生一种不溶于稀硝酸的白色沉 淀,则该物质中就含有Cl-思考:检验Cl-时,为什么要加稀HNO3? Na2C03溶液滴几滴AgNO3溶液,再滴稀硝酸,观察现象演示:检验Cl-时,要加几滴稀硝酸,目的是除去CO32—等杂质离子的干扰。SO42—的检验方法:滴加氯化钡溶液出现白色沉淀,再滴入稀硝酸沉淀不溶解。思考:检验Cl-或SO42-时,为什么要加稀HNO3? 演示碳酸钠氯化钡白色沉淀再滴几滴稀硝酸白色沉淀溶解 检验SO42—时,要加几滴稀硝酸,目的是除去CO32—等杂质离子的干扰。BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2ONaOH = Na+ + OH– Ca(OH)2= Ca2+ +2OH– Ba(OH)2 =Ba2++2OH– KOH = K+ + OH–3.碱的涵义:碱是电离时产生的阴离子全部是OH-的化合物。2.碱的电离(可溶性碱只有上面这4种)2、碱+ 酸 = 盐 + 水实质:H++OH-=H2O3、碱+某些盐?另碱+另盐CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl4、碱+非金属氧化物?盐+水盐的电离NaCl === Na+ + Cl-Na2CO3 === 2 Na+ + CO32-电离出的阳离子都是金属离子或铵根离子,阴离子都是酸根阴离子。NH4Cl === NH4+ + Cl-常见的盐:Na2CO3,CaCO3,NaCl根据溶解性口诀,判断下列物质的溶解性。1.Zn(OH)2:______ 2.AgCl:________
3.NaNO3:________ 4.K2CO3:________
5.BaSO4:________ 6.BaCl2:________不溶不溶不溶溶溶溶复分解反应的条件:生成物中有沉淀或气体或水。2NaOH + H2SO4 = Na2SO4 + 2H2O Na2CO3+Ca(OH)2 = CaCO3↓ +2NaOH2HCl + CaCO3 = CaCl2 + H2O + CO2↑下列反应能进行吗?NaOH+BaCl2= Ba(OH)2+NaCl这个反应是不能进行。金属变化的规律金属和氧气的反应金属和酸的反应2Al + 6HCl = 2AlCl3 + 3H2↑Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑金属跟盐反应Fe + CuSO4 = FeSO4 + Cu
Cu+ FeSO4 ≠常见题型一、溶液中的共存题 例1下列各组物质中,能够共存于同一溶液中的是( )
(A)HNO3、Cu(NO3)2、NaOH
(B)KOH、KNO3、MgSO4
(C)MgCl2、Na2CO3、HCl
(D)NaNO3、NaOH、KClD例2 向下列分别装有三种物质的4支试管中,加入足量的水,可得到无色透明溶液的一组物质是( )
(A)AgNO3、Zn(NO3)2、MgCl2
(B)NaCl、FeCl3、H2SO4
(C)KCl、Na2CO3、KNO3
(D)CaCl2、NaNO3、K2CO3C例3 下列各组离子中,不能大量共存于同一溶液中的一组是( )。
(A)Ag+、Ba2+、NO3-、H+
(B)Fe3+、Cl-、K+、OH-
(C)Cu2+、SO42-、K+、NO3-
(D)Zn2+、Cl-、K+、NO3-B例4 某溶液的pH=10,在该溶液中能够大量共存的一组物质是( )。
(A)KOH、BaCl2、NaNO3
(B)Ca(NO3)2、NaCl、K2CO3
(C)FeCl3、KNO3、NaNO3:
(D)KCl、Na2SO4、MgSO4 A巩固练习
1.下列各组物质在溶液中可大量共存的一组是( )
(A)NaOH、NaNO3、CuCl2
(B)Ba(OH)2、KCl、NaNO3
(C)BaCl2、HCl、Na2SO4
(D) K2SO4、Na2CO3、Ba(NO3)2
2.将下列各组物质在水中混合,可配制成澄清的混合溶液的是( )。
(A)Ba(OH)2、NaNO3、K2SO4
(B)NH4Cl、H2SO4、AgNO3
(C)K2CO3、Na2SO4、HNO3
(D)NaOH、BaCl2、KNO3BD3.在pH=0的溶液中,能够大量共存的一组物质是( )
(A)NaNO3、K2CO3、CuCl2
(B)FeCl3、NaCl、Ca(NO3)2
(C)KNO3、NaOH、CaCl2
(D)Ca(NO3)2、CuSO4、Na2CO3
4.在检验某蓝色未知溶液的组成时,不同的实验者分别得到下列几种结论,其中可能正确的是( )
(A)Cu(NO3)2、NaNO3、BaCl2
(B)Na2SO4、CuCl2、AgNO3
(C)Cu(NO3)2、BaCl2、NaOH
(D)Na2SO4、MgCl2、HNO3
BA●指示剂法●酸液法●碱液法●盐溶液法二、鉴别物质 用化学方法鉴别Na2SO4、KOH和稀H2SO4溶液,指出反应现象及结论。方法一、指示剂法。选用紫色石蕊试液方法二、碱液法 先加入氢氧化钡溶液再加入碳酸钠溶液 用化学方法鉴别Na2SO4、KOH和稀H2SO4溶液,指出
反应现象及结论。方法三、盐溶液法 先加碳酸钠溶液再滴加硫酸铜溶液 在试剂鉴别中要遵循方法简单、
操作方便、现象明显、设计合理
的原则二、鉴别物质A 组 NaOH HCl NaCl
B 组 NaOH NaCl CuSO4 例3在一条鱼虾绝迹的小河边,有四座工厂:甲、乙、丙、丁。他们排放的废液里,每厂只有碳酸钠、氯化铁、氢氧化钙、盐酸的一种。某中学环保小组对实现调查的情况如图。甲处的河水是乳白色的,乙处的河水是红褐色的,丙处的河水变清了,丁处的河水是清的,但有气泡产生。
请推测这四座工厂废液里的污染物Ca(OH)2是微溶的,所以甲厂排放的是Ca(OH)2乙处的河水呈红褐色,说明生成了氢氧
化铁沉淀。 乙工厂排放的废液含有FeCl3从上流下的不溶物是Ca(OH)2和Fe(OH)3,
丙处变清了,说明生发反应,能与之反应
的是HClHCl丁处产生气泡,说明碳酸钠与盐酸反应Na2CO34.不用其他试剂,鉴别①Na2CO3,②KCl,③Mg(NO3)2,④CuSO4四种溶液,正确的鉴别顺序是( )
A、①④③② B.④①③②
C.④②①③ D.①③④②B
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
