2025届高三化学二轮复习 提分点十三 电化学原理及应用(含解析)
文档属性
| 名称 | 2025届高三化学二轮复习 提分点十三 电化学原理及应用(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-05 11:59:44 | ||
图片预览


文档简介
2025届高三高考化学二轮复习
提分点十三 电化学原理及应用
【真题再现】
考向1 原电池原理与应用
1.(2024·江苏卷)碱性锌锰电池的总反应为Zn+2MnO2+H2O===ZnO+2MnOOH,电池构造示意图如图所示。下列有关说法正确的是 ( )
A.电池工作时,MnO2发生氧化反应
B.电池工作时,OH-通过隔膜向正极移动
C.环境温度过低,不利于电池放电
D.反应中每生成1 mol MnOOH,转移电子数为2×6.02×1023
2.(2024·新课标卷)一种可植入体内的微型电池工作原理如图所示,通过CuO催化消耗血糖发电,从而控制血糖浓度。当传感器检测到血糖浓度高于标准,电池启动。血糖浓度下降至标准,电池停止工作。(血糖浓度以葡萄糖浓度计)
电池工作时,下列叙述错误的是 ( )
A.电池总反应为:2C6H12O6+O2===2C6H12O7
B.b电极上CuO通过Cu(Ⅱ)和Cu(Ⅰ)相互转变起催化作用
C.消耗18 mg葡萄糖,理论上a电极有0.4 mmol 电子流入
D.两电极间血液中的Na+在电场驱动下的迁移方向为b→a
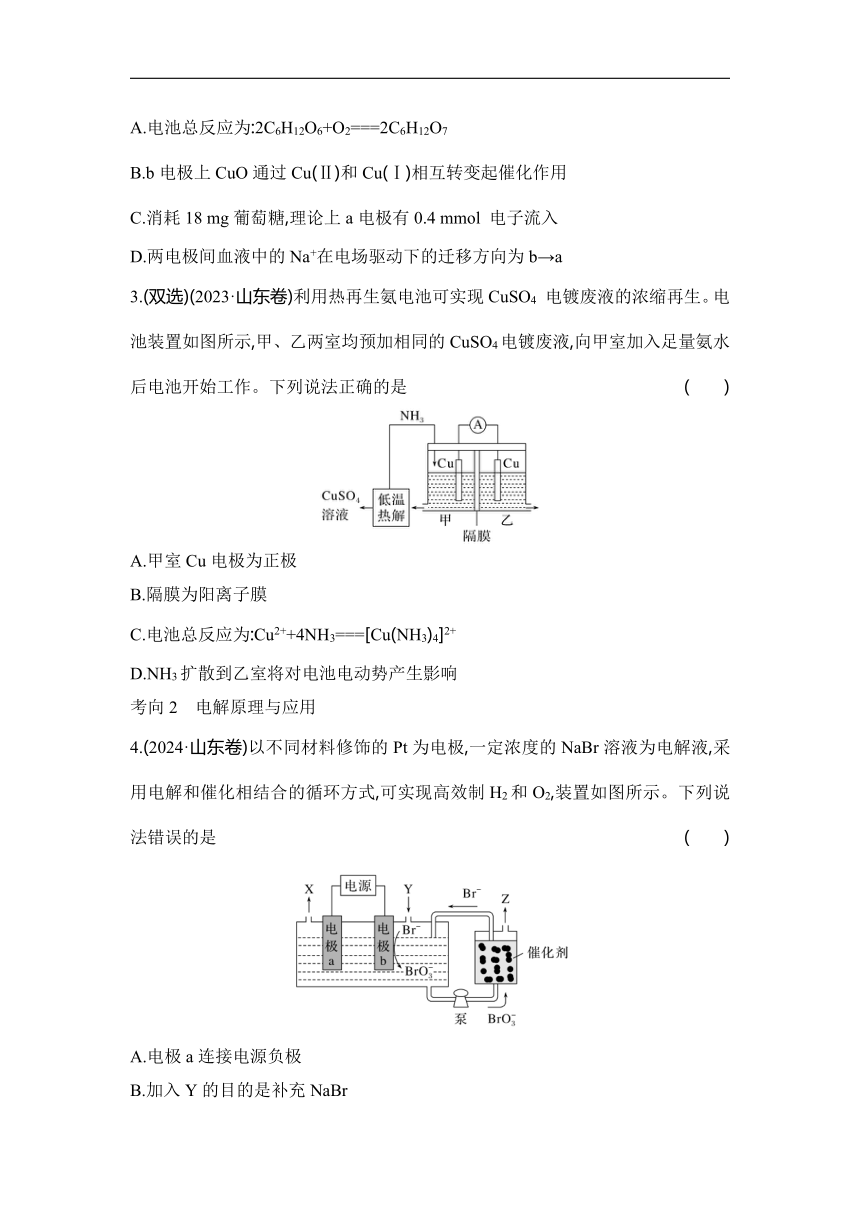
3.(双选)(2023·山东卷)利用热再生氨电池可实现CuSO4 电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的CuSO4电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是 ( )
A.甲室Cu电极为正极
B.隔膜为阳离子膜
C.电池总反应为:Cu2++4NH3===[Cu(NH3)4]2+
D.NH3扩散到乙室将对电池电动势产生影响
考向2 电解原理与应用
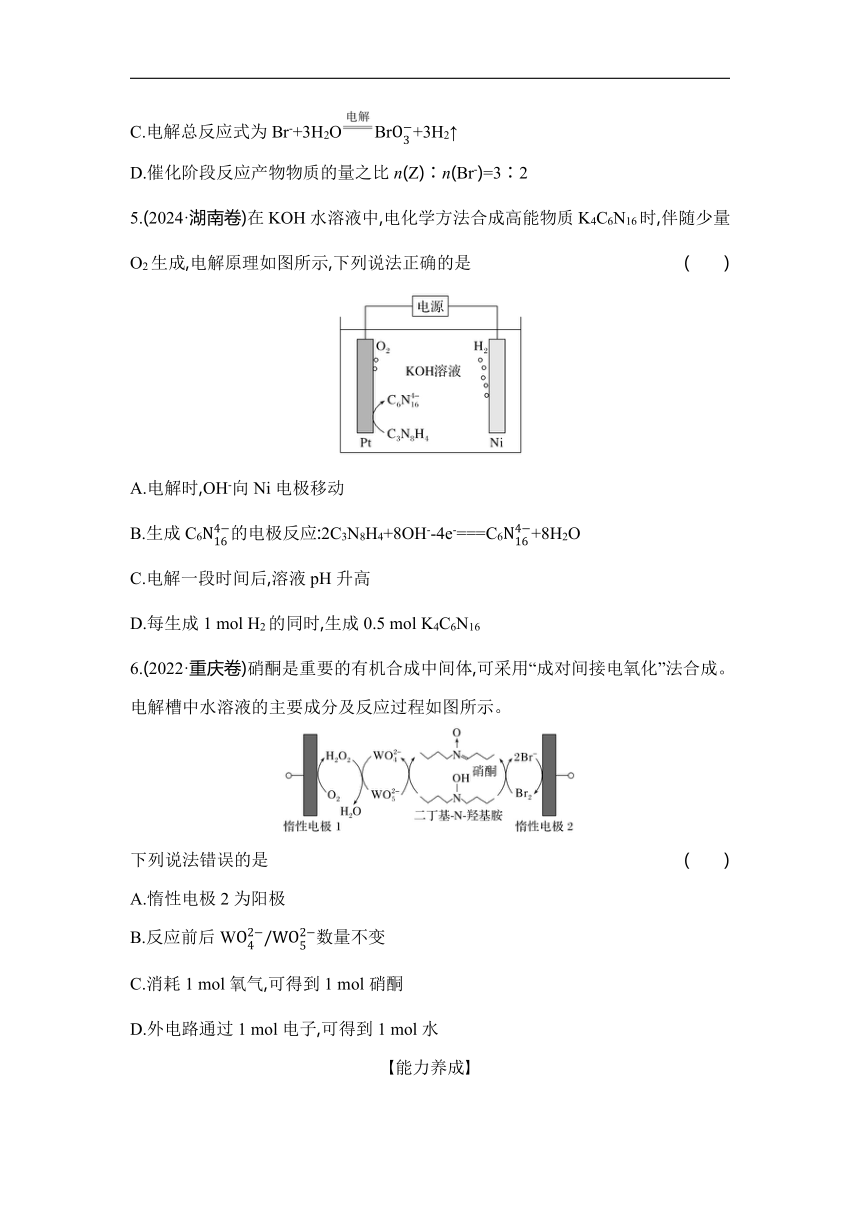
4.(2024·山东卷)以不同材料修饰的Pt为电极,一定浓度的NaBr溶液为电解液,采用电解和催化相结合的循环方式,可实现高效制H2和O2,装置如图所示。下列说法错误的是 ( )
A.电极a连接电源负极
B.加入Y的目的是补充NaBr
C.电解总反应式为Br-+3H2OBr+3H2↑
D.催化阶段反应产物物质的量之比n(Z)∶n(Br-)=3∶2
5.(2024·湖南卷)在KOH水溶液中,电化学方法合成高能物质K4C6N16时,伴随少量O2生成,电解原理如图所示,下列说法正确的是 ( )
A.电解时,OH-向Ni电极移动
B.生成C6的电极反应:2C3N8H4+8OH--4e-===C6+8H2O
C.电解一段时间后,溶液pH升高
D.每生成1 mol H2的同时,生成0.5 mol K4C6N16
6.(2022·重庆卷)硝酮是重要的有机合成中间体,可采用“成对间接电氧化”法合成。电解槽中水溶液的主要成分及反应过程如图所示。
下列说法错误的是 ( )
A.惰性电极2为阳极
B.反应前后W数量不变
C.消耗1 mol氧气,可得到1 mol硝酮
D.外电路通过1 mol电子,可得到1 mol水
【能力养成】
1.原电池电极反应式书写思路
(1)列变价——写出电极上发生变价的主要反应物和主要产物。
(2)标电子——由化合价写出得失电子数。
(3)调电荷——由电荷守恒依据介质环境将反应式两边的电荷调平,酸性溶液用H+,碱性溶液用OH-,若是熔融电解质,则依据具体题目信息,一般熔融氧化物用O2-,熔融碳酸盐用C。
(4)后补水——由原子守恒配平电极反应,一般看氢原子,哪边少氢原子就在哪边以水的形式补上相应数目的氢原子。也被称为“氢不够,水来凑。”
(5)检查氧——最后用“O”守恒检查是否正确。
如乙醇在碱性介质中的电极反应式分别为:
负极:C2H5OH-12e-+16OH-===2C+11H2O
正极:O2+4e-+2H2O===4OH-
2.电解装置的分析模型
【模拟演练】
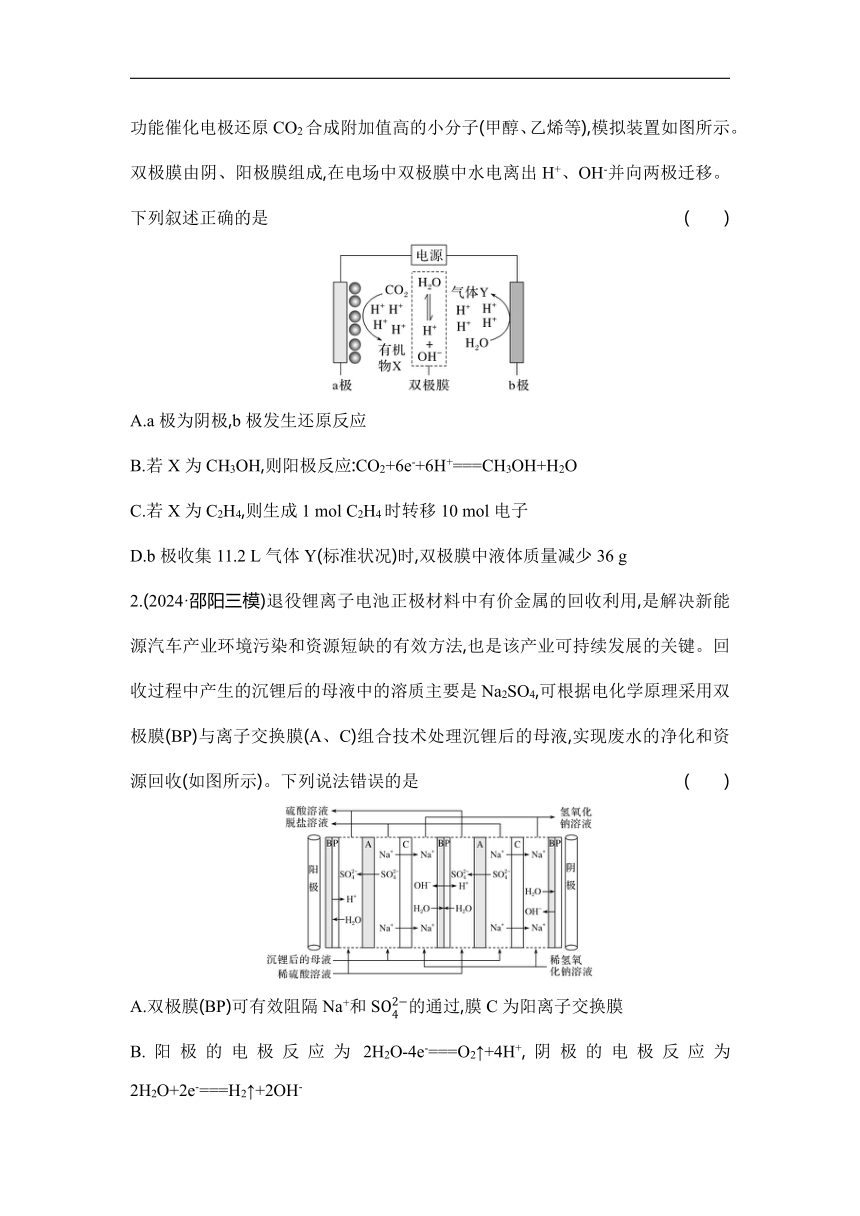
1.(2024·衡阳三模)CO2回收和利用是实现“碳中和”的重要途径。我国科学家开发功能催化电极还原CO2合成附加值高的小分子(甲醇、乙烯等),模拟装置如图所示。双极膜由阴、阳极膜组成,在电场中双极膜中水电离出H+、OH-并向两极迁移。下列叙述正确的是 ( )
A.a极为阴极,b极发生还原反应
B.若X为CH3OH,则阳极反应:CO2+6e-+6H+===CH3OH+H2O
C.若X为C2H4,则生成1 mol C2H4时转移10 mol电子
D.b极收集11.2 L气体Y(标准状况)时,双极膜中液体质量减少36 g
2.(2024·邵阳三模)退役锂离子电池正极材料中有价金属的回收利用,是解决新能源汽车产业环境污染和资源短缺的有效方法,也是该产业可持续发展的关键。回收过程中产生的沉锂后的母液中的溶质主要是Na2SO4,可根据电化学原理采用双极膜(BP)与离子交换膜(A、C)组合技术处理沉锂后的母液,实现废水的净化和资源回收(如图所示)。下列说法错误的是 ( )
A.双极膜(BP)可有效阻隔Na+和S的通过,膜C为阳离子交换膜
B.阳极的电极反应为2H2O-4e-===O2↑+4H+,阴极的电极反应为2H2O+2e-===H2↑+2OH-
C.阳极与直流电源的正极相连,阳极上的电势比阴极上的高
D.当阳极上放出22.4 L(标准状况)气体时,该装置有2 mol H2SO4和4 mol NaOH生成
3.(2023·石家庄一模)电化学合成具有反应条件温和、反应试剂纯净和生产效率高等优点,利用下图所示装置可合成己二腈[NC(CH2)4CN]。充电时生成己二腈,放电时生成O2,其中a、b是互为反置的双极膜,双极膜中的H2O会解离出H+和OH-向两极移动。下列说法正确的是 ( )
A.N极的电势高于M极的电势
B.放电时,双极膜中OH-向M极移动
C.充电时,阴极的电极反应式为2CH2CHCN+2e-+2H+===NC(CH2)4CN
D.若充电时制得1 mol NC(CH2)4CN,则放电时需生成1 mol O2,才能使左室溶液恢复至初始状态
4.(2023·丹东一模)偏钨酸铵(NH4)6(H2W12O40)是制备金属钨、合金钢以及陶瓷工业的重要原料。采用如下电化学装置可制备偏钨酸铵,双极膜中间层中的水解离为H+和OH-,并在直流电场作用下分别向两极迁移,下列说法正确的是 ( )
A.a膜为阴离子交换膜
B.阳极电极反应为4NH3·H2O-4e-===4N+O2↑+2H2O
C.双极膜中间层中的OH-向右侧迁移进入产品室
D.当电路中通过0.1 mol e-时,双极膜中解离水的质量为2.0 g
5.(2024·邢台二模)钠离子电池比锂离子电池更稳定,造价更低。2023年星恒电源发布了第一代钠电池“超钠F1”结构如图,已知该电池电极材料为Na2Mn[Fe(CN)6](普鲁士白)和NaxCy(嵌钠硬碳),反应为Mn[Fe(CN)6]+2Na(x+1)CyNa2Mn[Fe(CN)6]+NaxCy。下列说法中错误的是 ( )
A.钠离子电池比锂离子电池内阻大,所以短路时发热少,升温慢,安全性更高
B.放电时,正极电极反应为Mn[Fe(CN)6]+2Na++2e-===Na2Mn[Fe(CN)6]
C.充电时,普鲁士白极接电源的正极,阴极质量减小
D.电池充电时,Na+移向硬碳并得电子变为Na嵌入其中
答案精析
提分点十三 电化学原理及应用
真题再现
1.C [MnO2转化为MnOOH,Mn由+4价降为+3价,MnO2作氧化剂,发生还原反应,A错误;原电池工作时阴离子向负极移动,B错误;温度较低时,反应速率会降低,C正确;MnO2转化为MnOOH,Mn由+4价降为+3价,每生成1 mol MnOOH,转移电子数为1×6.02×1023,D错误。]
2.C [分析可知,该电池的总反应为2C6H12O6+O2===2C6H12O7,A正确;由题图可知,b电极上发生转化:CuO→Cu2O→CuO,反应前后CuO的性质和数目不变,故b电极上CuO通过Cu(Ⅱ)和Cu(Ⅰ)相互转变起催化作用,B正确;根据负极的电极反应式可知当消耗18 mg(0.1 mmol)葡萄糖时,转移0.2 mmol 电子,故理论上a电极有0.2 mmol电子流入,C错误;原电池中,阳离子向正极迁移,由分析知,b电极为负极,a电极为正极,故两电极间血液中的Na+在电场驱动下的迁移方向为b→a,D正确。]
3.CD [A.向甲室加入足量氨水后电池开始工作,则甲室Cu电极溶解,变为铜离子与氨气形成[Cu(NH3)4]2+,因此甲室Cu电极为负极,A错误;B.在原电池内电路中阳离子向正极移动,若隔膜为阳离子膜,电极溶解生成的铜离子要向右侧移动,通入氨气要消耗铜离子,显然左侧阳离子不断减小,明显不利于电池反应正常进行,B错误;C.左侧负极是Cu-2e-+4NH3===[Cu(NH3)4]2+,正极是Cu2++2e-===Cu,则电池总反应为:Cu2++4NH3===[Cu(NH3)4]2+,C正确;D.NH3扩散到乙室会与铜离子反应生成[Cu(NH3)4]2+,铜离子浓度降低,铜离子得电子能力减弱,因此将对电池电动势产生影响,D正确。]
4.B [电极b上Br-发生失电子的氧化反应转化成Br,电极b为阳极,电极反应为Br--6e-+3H2O===Br+6H+;则电极a为阴极,电极a的电极反应为6H2O+6e-===3H2↑+6OH-;电解总反应式为Br-+3H2OBr+3H2↑;催化循环阶段Br被还原成Br-循环使用、同时生成O2,实现高效制H2和O2,即Z为O2。A.根据分析,电极a为阴极,连接电源负极,A项正确;B.根据分析电解过程中消耗H2O和Br-,而催化阶段Br被还原成Br-循环使用,故加入Y的目的是补充H2O,维持NaBr溶液为一定浓度,B项错误;C.根据分析电解总反应式为Br-+3H2OBr+3H2↑,C项正确;D.催化阶段,Br元素的化合价由+5价降至-1价,生成1 mol Br-得到6 mol电子,O元素的化合价由-2价升至0价,生成1 mol O2失去4 mol电子,根据得失电子守恒,反应产物物质的量之比n(O2) ∶n(Br-)=6∶4=3∶2,D项正确。]
5.B [由电解原理图可知,Ni电极产生氢气,作阴极,发生还原反应,电解质溶液为KOH水溶液,则电极反应为2H2O+2e-===H2↑+2OH-;Pt电极C3N8H4失去电子生成C6,作阳极,电极反应为2C3N8H4+8OH--4e-===C6+8H2O,同时,Pt电极还伴随少量O2生成,电极反应为4OH--4e-===O2↑+2H2O。由分析可知,Ni电极为阴极,Pt电极为阳极,电解过程中,阴离子向阳极移动,即OH-向Pt电极移动,A错误;由分析可知,Pt电极C3N8H4失去电子生成C6,电解质溶液为KOH水溶液,电极反应为2C3N8H4+8OH--4e-===C6+8H2O,B正确;由分析可知,阳极主要反应为2C3N8H4-4e-+8OH-===C6+8H2O,阴极反应为:2H2O+2e-===H2↑+2OH-,则电解过程中发生的总反应主要为2C3N8H4+4OH-===C6+4H2O+2H2↑,反应消耗OH-,生成H2O,电解一段时间后,溶液pH降低,C错误;根据电解总反应2C3N8H4+4OH-===C6+4H2O+2H2↑可知,每生成1 mol H2,生成0.5 mol K4C6N16,但Pt电极伴随少量O2生成,发生电极反应:4OH--4e-===O2↑+2H2O,则生成1 mol H2时得到的部分电子由OH-放电产生O2提供,所以生成K4C6N16小于0.5 mol,D错误。]
6.C [A.惰性电极2,Br-被氧化为Br2,惰性电极2为阳极,故A正确;B.W循环反应,反应前后W数量不变,故B正确;C.总反应为氧气把二丁基 N 羟基胺氧化为硝酮,1 mol二丁基 N 羟基胺失去2 mol H原子生成1 mol硝酮,氧气最终生成水,根据氧原子守恒,消耗1 mol氧气,可得到2 mol硝酮,故C错误;D.外电路通过1 mol电子,生成0.5 mol H2O2,H2O2最终生成水,根据氧原子守恒,可得到1 mol水,故D正确。]
模拟演练
1.D [从图中可知,电极a上CO2转化为有机物X(甲醇、乙烯等),说明电极a上CO2得电子被还原,电极a为阴极,则电极b为阳极,阳极上水失电子生成O2和氢离子。CO2中碳元素为+4价,达到碳元素最高价,CO2转化成有机物X,碳元素的化合价降低,发生还原反应,故a极为阴极,b极为阳极,阳极上水失电子发生氧化反应,A错误;若X为甲醇,阳极上水失电子生成氧气和氢离子,电极反应式为2H2O-4e-===4H++O2↑,B错误;若X为乙烯,阴极反应式为2CO2+12e-+12H+===C2H4+4H2O,生成1 mol乙烯转移12 mol电子,C错误;b极反应式为2H2O-4e-===4H++O2↑,标准状况下11.2 L O2即0.5 mol O2,生成0.5 mol O2,转移2 mol电子,向a极迁移2 mol H+,向b极迁移2 mol OH-,双极膜中水质量减少36 g,D正确。]
2.D [根据图中Na+、S移动方向可知,膜A为阴离子交换膜,膜C为阳离子交换膜,故A正确;阳极的电极反应为2H2O-4e-===O2↑+4H+,阴极的电极反应为2H2O+2e-===H2↑+2OH-,故B正确;阳极与直流电源的正极相连,阳极上的电势比阴极上的高,故C正确;当阳极上放出22.4 L(标准状况)气体时,外电路中转移4 mol电子,该装置中有2个阴离子交换膜和2个阳离子交换膜,每个阴离子交换膜有2 mol S通过,每个阳离子交换膜有4 mol Na+通过,即该装置有 4 mol H2SO4和8 mol NaOH生成,故D错误。]
3.C [充电时生成己二腈,放电时生成O2,则充电时,N极发生还原反应,为阴极;放电时,N极发生氧化反应,为负极;A.当放电时,N极发生氧化反应,为负极,电势低于正极M极,A错误; B.放电时,阴离子向负极移动,则双极膜中OH-向N极移动,B错误;C.充电时,N极为阴极,阴极发生还原反应生成己二腈,电极反应式为2CH2==CHCN+2e-+2H+===NC(CH2)4CN,C正确; D.若充电时制得1 mol NC(CH2)4CN转移2 mol电子,放电时反应为2H2O-4e-===4H++O2↑,根据电子守恒可知,需生成0.5 mol O2,才能使左室溶液恢复至初始状态,D错误。]
4.B [由图可知,左侧石墨电极为电解池的阳极,一水合氨在阳极失去电子发生氧化反应生成铵根离子、氧气和水,碱室中碳酸氢根离子通过阴膜加入阳极室,双极膜中间层中的氢氧根离子进入碱室、氢离子加入产品室,产品室中氢离子与溶液中铵根离子、钨酸根离子反应生成偏钨酸铵,过量的铵根离子通过阳膜进入阴极室,右侧电极为阴极,水在阴极得到电子发生还原反应生成氢气和氢氧根离子,铵根离子与氢氧根离子反应生成一水合氨。A.由分析可知,a膜为阳离子交换膜,故A错误;B.由分析可知,左侧石墨电极为电解池的阳极,一水合氨在阳极失去电子发生氧化反应生成铵根离子、氧气和水,电极反应式为4NH3·H2O-4e-===4N+O2↑+2H2O,故B正确;C.由分析可知,双极膜中间层中的氢氧根离子进入碱室、氢离子加入产品室,故C错误;D.当电路中通过0.1 mol电子时,双极膜中有0.1 mol氢氧根离子进入碱室,则双极膜中解离水的质量为0.1 mol×18 g·mol-1=1.8 g,故D错误。]
5.C [根据图示,放电时NaxCy中的钠失去电子生成Na+,因此NaxCy为负极,左电极为原电池的正极,正极电势高于负极。充电时左电极为阳极,发生氧化反应;右电极为阴极,发生还原反应,据此答题。钠离子相比锂离子,电荷数相同,离子更大,电荷定向移动慢,故比锂离子电池内阻大,所以短路时发热少,升温慢,安全性更高,A正确;放电时,左侧电极为正极,Mn[Fe(CN)6]得电子转化为Na2Mn[Fe(CN)6],电极反应为Mn[Fe(CN)6]+2Na++2e-===Na2Mn[Fe(CN)6],B正确;左侧普鲁士白放电时为正极,充电时接电源正极做阳极,硬碳为阴极,充电时Na+得电子变为Na嵌入硬碳,阴极质量增大,C错误;充电时硬碳为阴极,Na+得电子变为Na移向硬碳并嵌入硬碳,D正确。]
提分点十三 电化学原理及应用
【真题再现】
考向1 原电池原理与应用
1.(2024·江苏卷)碱性锌锰电池的总反应为Zn+2MnO2+H2O===ZnO+2MnOOH,电池构造示意图如图所示。下列有关说法正确的是 ( )
A.电池工作时,MnO2发生氧化反应
B.电池工作时,OH-通过隔膜向正极移动
C.环境温度过低,不利于电池放电
D.反应中每生成1 mol MnOOH,转移电子数为2×6.02×1023
2.(2024·新课标卷)一种可植入体内的微型电池工作原理如图所示,通过CuO催化消耗血糖发电,从而控制血糖浓度。当传感器检测到血糖浓度高于标准,电池启动。血糖浓度下降至标准,电池停止工作。(血糖浓度以葡萄糖浓度计)
电池工作时,下列叙述错误的是 ( )
A.电池总反应为:2C6H12O6+O2===2C6H12O7
B.b电极上CuO通过Cu(Ⅱ)和Cu(Ⅰ)相互转变起催化作用
C.消耗18 mg葡萄糖,理论上a电极有0.4 mmol 电子流入
D.两电极间血液中的Na+在电场驱动下的迁移方向为b→a
3.(双选)(2023·山东卷)利用热再生氨电池可实现CuSO4 电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的CuSO4电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是 ( )
A.甲室Cu电极为正极
B.隔膜为阳离子膜
C.电池总反应为:Cu2++4NH3===[Cu(NH3)4]2+
D.NH3扩散到乙室将对电池电动势产生影响
考向2 电解原理与应用
4.(2024·山东卷)以不同材料修饰的Pt为电极,一定浓度的NaBr溶液为电解液,采用电解和催化相结合的循环方式,可实现高效制H2和O2,装置如图所示。下列说法错误的是 ( )
A.电极a连接电源负极
B.加入Y的目的是补充NaBr
C.电解总反应式为Br-+3H2OBr+3H2↑
D.催化阶段反应产物物质的量之比n(Z)∶n(Br-)=3∶2
5.(2024·湖南卷)在KOH水溶液中,电化学方法合成高能物质K4C6N16时,伴随少量O2生成,电解原理如图所示,下列说法正确的是 ( )
A.电解时,OH-向Ni电极移动
B.生成C6的电极反应:2C3N8H4+8OH--4e-===C6+8H2O
C.电解一段时间后,溶液pH升高
D.每生成1 mol H2的同时,生成0.5 mol K4C6N16
6.(2022·重庆卷)硝酮是重要的有机合成中间体,可采用“成对间接电氧化”法合成。电解槽中水溶液的主要成分及反应过程如图所示。
下列说法错误的是 ( )
A.惰性电极2为阳极
B.反应前后W数量不变
C.消耗1 mol氧气,可得到1 mol硝酮
D.外电路通过1 mol电子,可得到1 mol水
【能力养成】
1.原电池电极反应式书写思路
(1)列变价——写出电极上发生变价的主要反应物和主要产物。
(2)标电子——由化合价写出得失电子数。
(3)调电荷——由电荷守恒依据介质环境将反应式两边的电荷调平,酸性溶液用H+,碱性溶液用OH-,若是熔融电解质,则依据具体题目信息,一般熔融氧化物用O2-,熔融碳酸盐用C。
(4)后补水——由原子守恒配平电极反应,一般看氢原子,哪边少氢原子就在哪边以水的形式补上相应数目的氢原子。也被称为“氢不够,水来凑。”
(5)检查氧——最后用“O”守恒检查是否正确。
如乙醇在碱性介质中的电极反应式分别为:
负极:C2H5OH-12e-+16OH-===2C+11H2O
正极:O2+4e-+2H2O===4OH-
2.电解装置的分析模型
【模拟演练】
1.(2024·衡阳三模)CO2回收和利用是实现“碳中和”的重要途径。我国科学家开发功能催化电极还原CO2合成附加值高的小分子(甲醇、乙烯等),模拟装置如图所示。双极膜由阴、阳极膜组成,在电场中双极膜中水电离出H+、OH-并向两极迁移。下列叙述正确的是 ( )
A.a极为阴极,b极发生还原反应
B.若X为CH3OH,则阳极反应:CO2+6e-+6H+===CH3OH+H2O
C.若X为C2H4,则生成1 mol C2H4时转移10 mol电子
D.b极收集11.2 L气体Y(标准状况)时,双极膜中液体质量减少36 g
2.(2024·邵阳三模)退役锂离子电池正极材料中有价金属的回收利用,是解决新能源汽车产业环境污染和资源短缺的有效方法,也是该产业可持续发展的关键。回收过程中产生的沉锂后的母液中的溶质主要是Na2SO4,可根据电化学原理采用双极膜(BP)与离子交换膜(A、C)组合技术处理沉锂后的母液,实现废水的净化和资源回收(如图所示)。下列说法错误的是 ( )
A.双极膜(BP)可有效阻隔Na+和S的通过,膜C为阳离子交换膜
B.阳极的电极反应为2H2O-4e-===O2↑+4H+,阴极的电极反应为2H2O+2e-===H2↑+2OH-
C.阳极与直流电源的正极相连,阳极上的电势比阴极上的高
D.当阳极上放出22.4 L(标准状况)气体时,该装置有2 mol H2SO4和4 mol NaOH生成
3.(2023·石家庄一模)电化学合成具有反应条件温和、反应试剂纯净和生产效率高等优点,利用下图所示装置可合成己二腈[NC(CH2)4CN]。充电时生成己二腈,放电时生成O2,其中a、b是互为反置的双极膜,双极膜中的H2O会解离出H+和OH-向两极移动。下列说法正确的是 ( )
A.N极的电势高于M极的电势
B.放电时,双极膜中OH-向M极移动
C.充电时,阴极的电极反应式为2CH2CHCN+2e-+2H+===NC(CH2)4CN
D.若充电时制得1 mol NC(CH2)4CN,则放电时需生成1 mol O2,才能使左室溶液恢复至初始状态
4.(2023·丹东一模)偏钨酸铵(NH4)6(H2W12O40)是制备金属钨、合金钢以及陶瓷工业的重要原料。采用如下电化学装置可制备偏钨酸铵,双极膜中间层中的水解离为H+和OH-,并在直流电场作用下分别向两极迁移,下列说法正确的是 ( )
A.a膜为阴离子交换膜
B.阳极电极反应为4NH3·H2O-4e-===4N+O2↑+2H2O
C.双极膜中间层中的OH-向右侧迁移进入产品室
D.当电路中通过0.1 mol e-时,双极膜中解离水的质量为2.0 g
5.(2024·邢台二模)钠离子电池比锂离子电池更稳定,造价更低。2023年星恒电源发布了第一代钠电池“超钠F1”结构如图,已知该电池电极材料为Na2Mn[Fe(CN)6](普鲁士白)和NaxCy(嵌钠硬碳),反应为Mn[Fe(CN)6]+2Na(x+1)CyNa2Mn[Fe(CN)6]+NaxCy。下列说法中错误的是 ( )
A.钠离子电池比锂离子电池内阻大,所以短路时发热少,升温慢,安全性更高
B.放电时,正极电极反应为Mn[Fe(CN)6]+2Na++2e-===Na2Mn[Fe(CN)6]
C.充电时,普鲁士白极接电源的正极,阴极质量减小
D.电池充电时,Na+移向硬碳并得电子变为Na嵌入其中
答案精析
提分点十三 电化学原理及应用
真题再现
1.C [MnO2转化为MnOOH,Mn由+4价降为+3价,MnO2作氧化剂,发生还原反应,A错误;原电池工作时阴离子向负极移动,B错误;温度较低时,反应速率会降低,C正确;MnO2转化为MnOOH,Mn由+4价降为+3价,每生成1 mol MnOOH,转移电子数为1×6.02×1023,D错误。]
2.C [分析可知,该电池的总反应为2C6H12O6+O2===2C6H12O7,A正确;由题图可知,b电极上发生转化:CuO→Cu2O→CuO,反应前后CuO的性质和数目不变,故b电极上CuO通过Cu(Ⅱ)和Cu(Ⅰ)相互转变起催化作用,B正确;根据负极的电极反应式可知当消耗18 mg(0.1 mmol)葡萄糖时,转移0.2 mmol 电子,故理论上a电极有0.2 mmol电子流入,C错误;原电池中,阳离子向正极迁移,由分析知,b电极为负极,a电极为正极,故两电极间血液中的Na+在电场驱动下的迁移方向为b→a,D正确。]
3.CD [A.向甲室加入足量氨水后电池开始工作,则甲室Cu电极溶解,变为铜离子与氨气形成[Cu(NH3)4]2+,因此甲室Cu电极为负极,A错误;B.在原电池内电路中阳离子向正极移动,若隔膜为阳离子膜,电极溶解生成的铜离子要向右侧移动,通入氨气要消耗铜离子,显然左侧阳离子不断减小,明显不利于电池反应正常进行,B错误;C.左侧负极是Cu-2e-+4NH3===[Cu(NH3)4]2+,正极是Cu2++2e-===Cu,则电池总反应为:Cu2++4NH3===[Cu(NH3)4]2+,C正确;D.NH3扩散到乙室会与铜离子反应生成[Cu(NH3)4]2+,铜离子浓度降低,铜离子得电子能力减弱,因此将对电池电动势产生影响,D正确。]
4.B [电极b上Br-发生失电子的氧化反应转化成Br,电极b为阳极,电极反应为Br--6e-+3H2O===Br+6H+;则电极a为阴极,电极a的电极反应为6H2O+6e-===3H2↑+6OH-;电解总反应式为Br-+3H2OBr+3H2↑;催化循环阶段Br被还原成Br-循环使用、同时生成O2,实现高效制H2和O2,即Z为O2。A.根据分析,电极a为阴极,连接电源负极,A项正确;B.根据分析电解过程中消耗H2O和Br-,而催化阶段Br被还原成Br-循环使用,故加入Y的目的是补充H2O,维持NaBr溶液为一定浓度,B项错误;C.根据分析电解总反应式为Br-+3H2OBr+3H2↑,C项正确;D.催化阶段,Br元素的化合价由+5价降至-1价,生成1 mol Br-得到6 mol电子,O元素的化合价由-2价升至0价,生成1 mol O2失去4 mol电子,根据得失电子守恒,反应产物物质的量之比n(O2) ∶n(Br-)=6∶4=3∶2,D项正确。]
5.B [由电解原理图可知,Ni电极产生氢气,作阴极,发生还原反应,电解质溶液为KOH水溶液,则电极反应为2H2O+2e-===H2↑+2OH-;Pt电极C3N8H4失去电子生成C6,作阳极,电极反应为2C3N8H4+8OH--4e-===C6+8H2O,同时,Pt电极还伴随少量O2生成,电极反应为4OH--4e-===O2↑+2H2O。由分析可知,Ni电极为阴极,Pt电极为阳极,电解过程中,阴离子向阳极移动,即OH-向Pt电极移动,A错误;由分析可知,Pt电极C3N8H4失去电子生成C6,电解质溶液为KOH水溶液,电极反应为2C3N8H4+8OH--4e-===C6+8H2O,B正确;由分析可知,阳极主要反应为2C3N8H4-4e-+8OH-===C6+8H2O,阴极反应为:2H2O+2e-===H2↑+2OH-,则电解过程中发生的总反应主要为2C3N8H4+4OH-===C6+4H2O+2H2↑,反应消耗OH-,生成H2O,电解一段时间后,溶液pH降低,C错误;根据电解总反应2C3N8H4+4OH-===C6+4H2O+2H2↑可知,每生成1 mol H2,生成0.5 mol K4C6N16,但Pt电极伴随少量O2生成,发生电极反应:4OH--4e-===O2↑+2H2O,则生成1 mol H2时得到的部分电子由OH-放电产生O2提供,所以生成K4C6N16小于0.5 mol,D错误。]
6.C [A.惰性电极2,Br-被氧化为Br2,惰性电极2为阳极,故A正确;B.W循环反应,反应前后W数量不变,故B正确;C.总反应为氧气把二丁基 N 羟基胺氧化为硝酮,1 mol二丁基 N 羟基胺失去2 mol H原子生成1 mol硝酮,氧气最终生成水,根据氧原子守恒,消耗1 mol氧气,可得到2 mol硝酮,故C错误;D.外电路通过1 mol电子,生成0.5 mol H2O2,H2O2最终生成水,根据氧原子守恒,可得到1 mol水,故D正确。]
模拟演练
1.D [从图中可知,电极a上CO2转化为有机物X(甲醇、乙烯等),说明电极a上CO2得电子被还原,电极a为阴极,则电极b为阳极,阳极上水失电子生成O2和氢离子。CO2中碳元素为+4价,达到碳元素最高价,CO2转化成有机物X,碳元素的化合价降低,发生还原反应,故a极为阴极,b极为阳极,阳极上水失电子发生氧化反应,A错误;若X为甲醇,阳极上水失电子生成氧气和氢离子,电极反应式为2H2O-4e-===4H++O2↑,B错误;若X为乙烯,阴极反应式为2CO2+12e-+12H+===C2H4+4H2O,生成1 mol乙烯转移12 mol电子,C错误;b极反应式为2H2O-4e-===4H++O2↑,标准状况下11.2 L O2即0.5 mol O2,生成0.5 mol O2,转移2 mol电子,向a极迁移2 mol H+,向b极迁移2 mol OH-,双极膜中水质量减少36 g,D正确。]
2.D [根据图中Na+、S移动方向可知,膜A为阴离子交换膜,膜C为阳离子交换膜,故A正确;阳极的电极反应为2H2O-4e-===O2↑+4H+,阴极的电极反应为2H2O+2e-===H2↑+2OH-,故B正确;阳极与直流电源的正极相连,阳极上的电势比阴极上的高,故C正确;当阳极上放出22.4 L(标准状况)气体时,外电路中转移4 mol电子,该装置中有2个阴离子交换膜和2个阳离子交换膜,每个阴离子交换膜有2 mol S通过,每个阳离子交换膜有4 mol Na+通过,即该装置有 4 mol H2SO4和8 mol NaOH生成,故D错误。]
3.C [充电时生成己二腈,放电时生成O2,则充电时,N极发生还原反应,为阴极;放电时,N极发生氧化反应,为负极;A.当放电时,N极发生氧化反应,为负极,电势低于正极M极,A错误; B.放电时,阴离子向负极移动,则双极膜中OH-向N极移动,B错误;C.充电时,N极为阴极,阴极发生还原反应生成己二腈,电极反应式为2CH2==CHCN+2e-+2H+===NC(CH2)4CN,C正确; D.若充电时制得1 mol NC(CH2)4CN转移2 mol电子,放电时反应为2H2O-4e-===4H++O2↑,根据电子守恒可知,需生成0.5 mol O2,才能使左室溶液恢复至初始状态,D错误。]
4.B [由图可知,左侧石墨电极为电解池的阳极,一水合氨在阳极失去电子发生氧化反应生成铵根离子、氧气和水,碱室中碳酸氢根离子通过阴膜加入阳极室,双极膜中间层中的氢氧根离子进入碱室、氢离子加入产品室,产品室中氢离子与溶液中铵根离子、钨酸根离子反应生成偏钨酸铵,过量的铵根离子通过阳膜进入阴极室,右侧电极为阴极,水在阴极得到电子发生还原反应生成氢气和氢氧根离子,铵根离子与氢氧根离子反应生成一水合氨。A.由分析可知,a膜为阳离子交换膜,故A错误;B.由分析可知,左侧石墨电极为电解池的阳极,一水合氨在阳极失去电子发生氧化反应生成铵根离子、氧气和水,电极反应式为4NH3·H2O-4e-===4N+O2↑+2H2O,故B正确;C.由分析可知,双极膜中间层中的氢氧根离子进入碱室、氢离子加入产品室,故C错误;D.当电路中通过0.1 mol电子时,双极膜中有0.1 mol氢氧根离子进入碱室,则双极膜中解离水的质量为0.1 mol×18 g·mol-1=1.8 g,故D错误。]
5.C [根据图示,放电时NaxCy中的钠失去电子生成Na+,因此NaxCy为负极,左电极为原电池的正极,正极电势高于负极。充电时左电极为阳极,发生氧化反应;右电极为阴极,发生还原反应,据此答题。钠离子相比锂离子,电荷数相同,离子更大,电荷定向移动慢,故比锂离子电池内阻大,所以短路时发热少,升温慢,安全性更高,A正确;放电时,左侧电极为正极,Mn[Fe(CN)6]得电子转化为Na2Mn[Fe(CN)6],电极反应为Mn[Fe(CN)6]+2Na++2e-===Na2Mn[Fe(CN)6],B正确;左侧普鲁士白放电时为正极,充电时接电源正极做阳极,硬碳为阴极,充电时Na+得电子变为Na嵌入硬碳,阴极质量增大,C错误;充电时硬碳为阴极,Na+得电子变为Na移向硬碳并嵌入硬碳,D正确。]
同课章节目录
