第2节 金属的化学性质(第2课时)
图片预览


文档简介
课件6张PPT。2.2 金属的化学性质
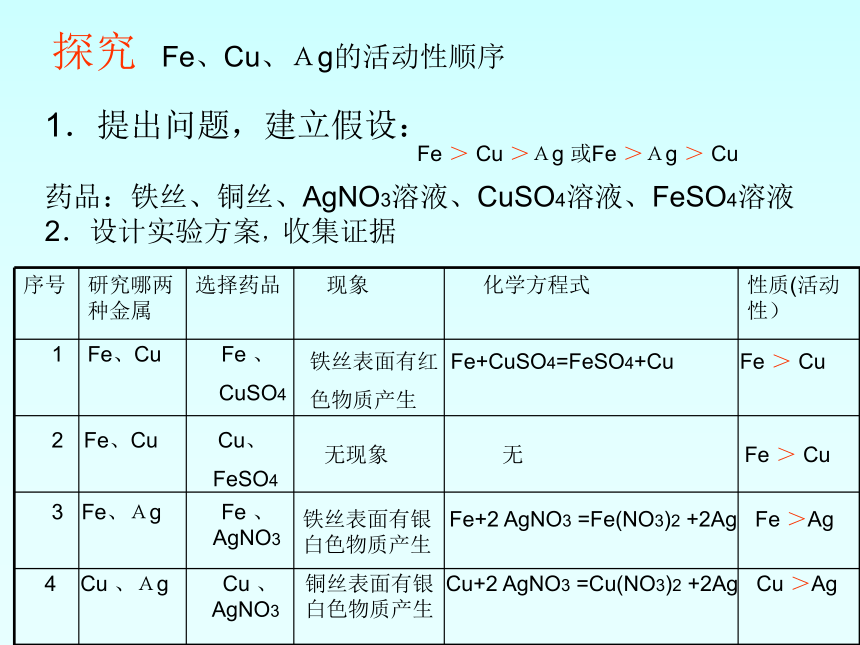
第二课时探究 Fe、Cu、Ag的活动性顺序 1.提出问题,建立假设:
药品:铁丝、铜丝、AgNO3溶液、CuSO4溶液、FeSO4溶液
2.设计实验方案,收集证据
Fe > Cu >Ag 或Fe >Ag > Cu1 Fe、Cu Fe 、
CuSO4 Fe、Cu Cu、
FeSO43 Fe、Ag Fe 、
AgNO3
4 Cu 、Ag Cu 、
AgNO3
铁丝表面有红 Fe+CuSO4=FeSO4+Cu Fe > Cu
色物质产生铁丝表面有银 Fe+2 AgNO3 =Fe(NO3)2 +2Ag Fe >Ag
白色物质产生
铜丝表面有银 Cu+2 AgNO3 =Cu(NO3)2 +2Ag Cu >Ag
白色物质产生无现象 无 Fe > Cu 3.得出结论:通过以上的实验事实,铁、铜、银的活动性是________________
铁>铜>银金属活动性顺序: k Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
?
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2.在金属活动性顺序中,一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液里置换出来。
3. 在金属活动性顺序中,位于氢前面的金属可以把酸里的氢置换出来。
讨论:
1.根据金属活动性顺序表判断能否用锡壶装酸性物质,并说出理由。
2.能否用铁制的容器配制浸种用的波尔多液(含硫酸铜)?为什么? 要证明镁、铁、锌的活动性(1)提供一种单质两种溶液,如何设计?(2)提供一种溶液,两种单质,如何设计? 拓展练习:再 见!
第二课时探究 Fe、Cu、Ag的活动性顺序 1.提出问题,建立假设:
药品:铁丝、铜丝、AgNO3溶液、CuSO4溶液、FeSO4溶液
2.设计实验方案,收集证据
Fe > Cu >Ag 或Fe >Ag > Cu1 Fe、Cu Fe 、
CuSO4 Fe、Cu Cu、
FeSO43 Fe、Ag Fe 、
AgNO3
4 Cu 、Ag Cu 、
AgNO3
铁丝表面有红 Fe+CuSO4=FeSO4+Cu Fe > Cu
色物质产生铁丝表面有银 Fe+2 AgNO3 =Fe(NO3)2 +2Ag Fe >Ag
白色物质产生
铜丝表面有银 Cu+2 AgNO3 =Cu(NO3)2 +2Ag Cu >Ag
白色物质产生无现象 无 Fe > Cu 3.得出结论:通过以上的实验事实,铁、铜、银的活动性是________________
铁>铜>银金属活动性顺序: k Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
?
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2.在金属活动性顺序中,一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液里置换出来。
3. 在金属活动性顺序中,位于氢前面的金属可以把酸里的氢置换出来。
讨论:
1.根据金属活动性顺序表判断能否用锡壶装酸性物质,并说出理由。
2.能否用铁制的容器配制浸种用的波尔多液(含硫酸铜)?为什么? 要证明镁、铁、锌的活动性(1)提供一种单质两种溶液,如何设计?(2)提供一种溶液,两种单质,如何设计? 拓展练习:再 见!
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
