化学反应与能量 阶段评估检测(五)(学生版+教师版)2025年高考化学总复习(含解析)
文档属性
| 名称 | 化学反应与能量 阶段评估检测(五)(学生版+教师版)2025年高考化学总复习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 621.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-06 11:43:43 | ||
图片预览


文档简介
化学反应与能量 阶段评估检测(五)
(75分钟 100分)
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.我国首创光伏发电—固态储氢技术,解决了“绿电”与“绿氢”灵活转换的难题。下列说法不正确的是 ( )
A.该技术直接将光能转换成化学能储存起来
B.规模化使用氢能有助于实现“碳达峰”
C.“绿电”电解水制氢成本比煤炭等化石燃料制氢成本低
D.固态储氢技术使新能源汽车电池加氢更加便捷
2.下列设备工作时,将化学能转化为热能的是 ( )
A B C D
碱性锌锰电池 水轮发电机 太阳能热水器 燃气灶
3.下列有关反应热和热化学方程式的描述不正确的是 ( )
A.已知:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀氨水和稀H2SO4溶液完全反应生成1 mol H2O(l)时,放出热量少于57.3 kJ
B.热化学方程式各物质前的化学计量数既可以是整数也可以是分数,既表示分子数也表示物质的量
C.101 kPa,20 ℃和25 ℃时,CH4的燃烧热不同
D.键能数值为平均值,用键能求出的反应热是估算值
4.甲醇与水蒸气在催化剂作用下发生如下反应:
反应Ⅰ:CH3OH(g)===CO(g)+2H2(g) ΔH1
反应Ⅱ:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2
根据能量变化示意图,下列说法正确的是 ( )
A.E3-E2>E4-E1
B.反应Ⅱ决定整个反应的速率
C.催化剂可以降低总反应的焓变
D.CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=ΔH1-ΔH2
5.(2024·兰州一中期中)氢卤酸的能量关系如图所示:
下列说法正确的是 ( )
A.ΔH=ΔH1+ΔH2+ΔH3+ΔH4
B.相同条件下,HCl的ΔH2比HBr的小
C.相同条件下,HCl的(ΔH3+ΔH4)比HI的大
D.一定条件下,气态原子生成1 mol H—X键放出a kJ能量,则ΔH2=+a kJ·mol-1
6. (2024·开封联考)太阳能是理想的清洁能源,通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。下列说法错误的是 ( )
A.过程Ⅰ中氧化产物是O2
B.过程Ⅱ化学方程式为CO2+6FeO2Fe3O4+C
C.过程Ⅱ产物中只有离子键形成
D.总反应式为CO2(g)C(s)+O2(g),是吸热反应
7.火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时
( )
A.负极上发生还原反应
B.CO2在正极上得电子
C.阳离子由正极移向负极
D.将电能转化为化学能
8.二十大报告指出要深入推进环境污染防治,持续深入打好蓝天、碧水、净土保卫战。二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是 ( )
A.该电池放电时质子从Pt2电极经过内电路移向Pt1电极
B.Pt1电极附近发生的反应为SO2+2H2O-2e-===H2SO4+2H+
C.Pt2电极附近发生的反应为O2+4e-+2H2O===4OH-
D.相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
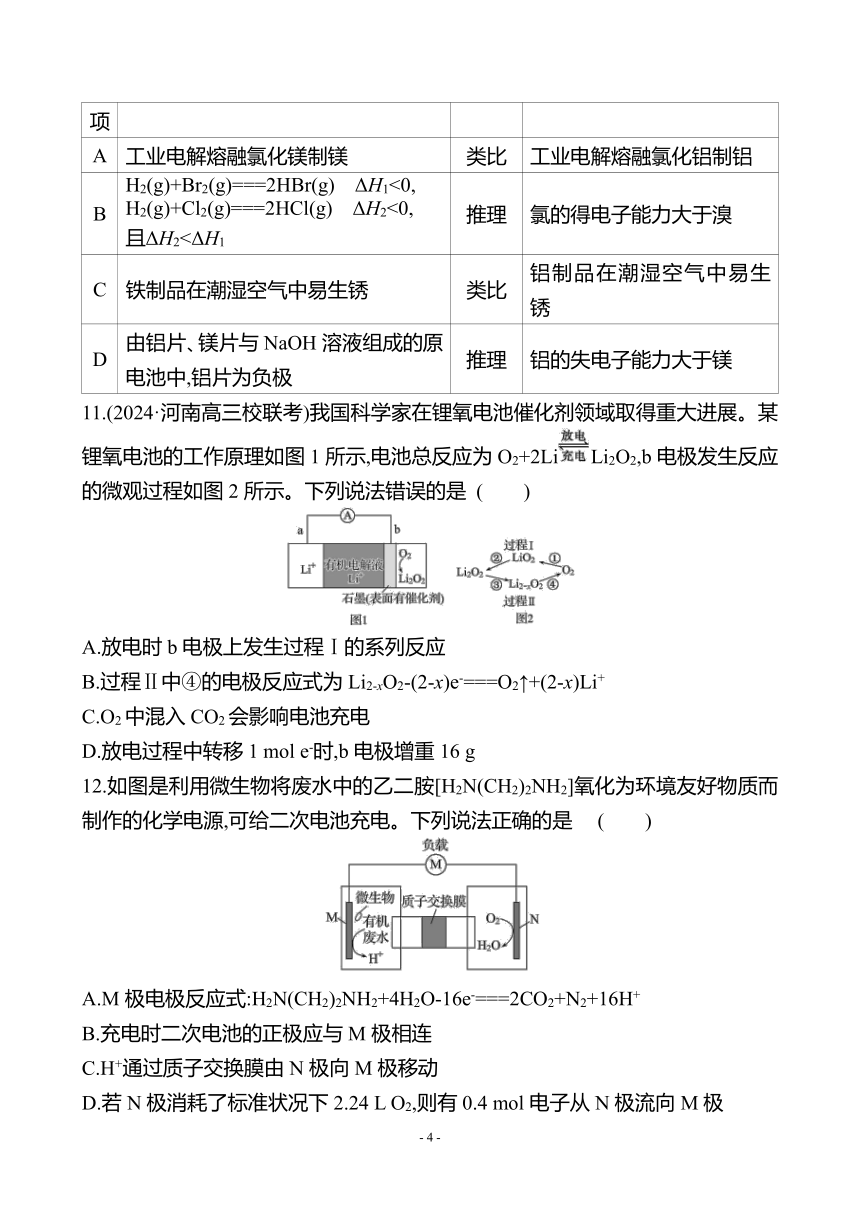
9. K-O2电池结构如图,a和b为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是 ( )
A.隔膜允许K+通过,不允许O2通过
B.放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极
C.产生1 Ah电量时,生成KO2的质量与消耗O2的质量比值约为2.22
D.用此电池为铅酸蓄电池充电,消耗3.9 g钾时,铅酸蓄电池消耗0.9 g水
10.(2024·南阳模拟)类比和推理是重要的学习方法。下列类比或推理合理的是
( )
选项 已知 方法 结论
A 工业电解熔融氯化镁制镁 类比 工业电解熔融氯化铝制铝
B H2(g)+Br2(g)===2HBr(g) ΔH1<0, H2(g)+Cl2(g)===2HCl(g) ΔH2<0, 且ΔH2<ΔH1 推理 氯的得电子能力大于溴
C 铁制品在潮湿空气中易生锈 类比 铝制品在潮湿空气中易生锈
D 由铝片、镁片与NaOH溶液组成的原电池中,铝片为负极 推理 铝的失电子能力大于镁
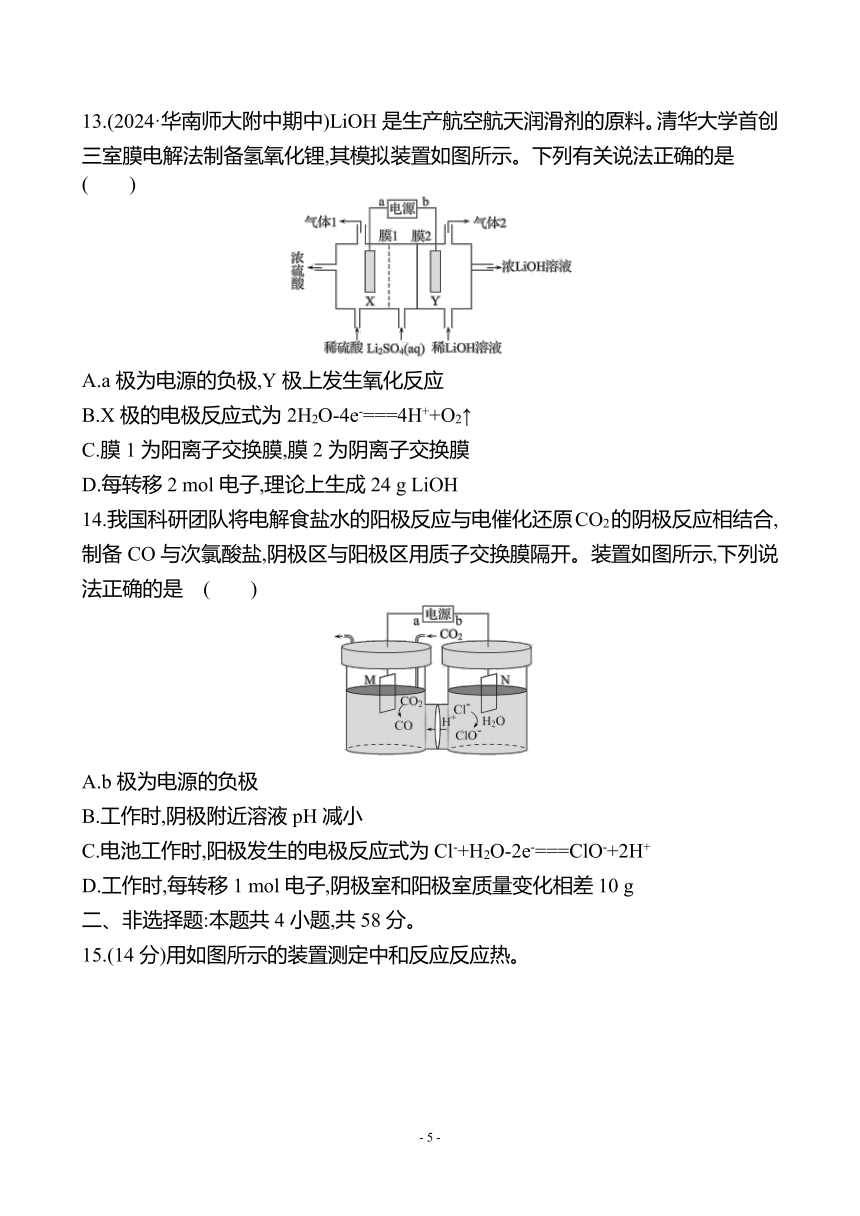
11.(2024·河南高三校联考)我国科学家在锂氧电池催化剂领域取得重大进展。某锂氧电池的工作原理如图1所示,电池总反应为O2+2LiLi2O2,b电极发生反应的微观过程如图2所示。下列说法错误的是 ( )
A.放电时b电极上发生过程Ⅰ的系列反应
B.过程Ⅱ中④的电极反应式为Li2-xO2-(2-x)e-===O2↑+(2-x)Li+
C.O2中混入CO2会影响电池充电
D.放电过程中转移1 mol e-时,b电极增重16 g
12.如图是利用微生物将废水中的乙二胺[H2N(CH2)2NH2]氧化为环境友好物质而制作的化学电源,可给二次电池充电。下列说法正确的是 ( )
A.M极电极反应式:H2N(CH2)2NH2+4H2O-16e-===2CO2+N2+16H+
B.充电时二次电池的正极应与M极相连
C.H+通过质子交换膜由N极向M极移动
D.若N极消耗了标准状况下2.24 L O2,则有0.4 mol电子从N极流向M极
13.(2024·华南师大附中期中)LiOH是生产航空航天润滑剂的原料。清华大学首创三室膜电解法制备氢氧化锂,其模拟装置如图所示。下列有关说法正确的是
( )
A.a极为电源的负极,Y极上发生氧化反应
B.X极的电极反应式为2H2O-4e-===4H++O2↑
C.膜1为阳离子交换膜,膜2为阴离子交换膜
D.每转移2 mol电子,理论上生成24 g LiOH
14.我国科研团队将电解食盐水的阳极反应与电催化还原CO2的阴极反应相结合,制备CO与次氯酸盐,阴极区与阳极区用质子交换膜隔开。装置如图所示,下列说法正确的是 ( )
A.b极为电源的负极
B.工作时,阴极附近溶液pH减小
C.电池工作时,阳极发生的电极反应式为Cl-+H2O-2e-===ClO-+2H+
D.工作时,每转移1 mol电子,阴极室和阳极室质量变化相差10 g
二、非选择题:本题共4小题,共58分。
15.(14分)用如图所示的装置测定中和反应反应热。
实验药品:100 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1NaOH溶液、
50 mL 0.55 mol·L-1氨水。已知弱碱电离时吸热。回答下列问题:
(1)从实验装置上看,还缺少 ,其能否用铜质材料替代
(填“能”或“不能”),理由是 。
(2)装置中隔热层的作用是 。
(3)将浓度为0.50 mol·L-1的酸溶液和0.55 mol·L-1的碱溶液各50 mL混合(溶液密度均为1 g·mL-1),生成的溶液的比热容c=4.18 J·g-1·℃-1,测得温度如下:
反应物 起始温度t1/℃ 最高温度t2/℃
甲组(HCl+NaOH) 15.0 18.3
乙组(HCl+NH3·H2O) 15.0 18.1
①两组实验结果存在差异的原因是 。
②HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l)的ΔH= (保留一位小数)。
③某同学利用上述装置重新做甲组实验,测得反应热ΔH偏大,则可能的原因是
(填字母)。
A.测完盐酸的温度直接测NaOH溶液温度
B.做该实验时室温较高
C.杯盖未盖严
D.NaOH溶液一次性迅速倒入
④实验中若改用60 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”,下同),若实验操作均正确,则所求中和热 。
16.(14分)(2024·酒泉模拟)2030年前实现碳达峰的承诺,体现了中国的大国风范。天然气的综合利用是各国科学家研究的重要课题。
(1)天然气的主要成分为甲烷,甲烷的结构式是 ,甲烷燃烧反应过程中的能量变化符合如图中的 (填字母)。
(2)a g CH4燃烧生成二氧化碳气体和液态水,放出热量44.5 kJ。经测定,生成的CO2与足量澄清石灰水反应得到5 g沉淀,则CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH= kJ·mol-1,其中a= 。
(3)甲烷和二氧化碳重整制合成气的研究是实现碳达峰的手段之一,甲烷和二氧化碳重整制合成气的反应为CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH1
副反应I:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.5 kJ·mol-1
副反应Ⅱ:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH3
已知:部分化学键键能数据如表(1 mol CO中含有1 mol C≡O键)。
化学键 C—H C=O H—H C≡O
键能/(kJ·mol-1) 413 745 436 1 011
则ΔH1= kJ·mol-1,ΔH3= kJ·mol-1。
(4)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
若标准状况下用1.12 L CH4还原NO2至N2,整个过程中转移电子总数为
(阿伏加德罗常数的值用NA表示),放出的热量为 kJ。
17.(16分)电化学原理在工业生产中发挥着巨大的作用。
Ⅰ.Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂, 在工业上通常利用如图装置生产Na2FeO4
(1)阳极的电极反应式为 。
(2)阴极产生的气体为 。
(3)右侧的离子交换膜为 (填“阴”或“阳”)离子交换膜,
阴极区a% b%(填“>” “=” 或“<”)。
Ⅱ.如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。
(4)Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为 。
(5)理论上电路中每转移3 mol电子,最多可以处理废氨水中溶质(以NH3计)的质量是 g。
18.(14分)(2023·石家庄模拟)低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)C2H4(g)+2H2O(g),该反应体系的能量随反应过程的变化关系如图所示,则该反应的ΔH= (用含a、b的式子表示)。相关化学键的键能如表,实验测得上述反应的ΔH=-152 kJ·mol-1,则表中的x= 。
化学键 C=O H—H C=C C—H H—O
键能 (kJ·mol-1) x 436 764 414 464
(2)工业上用CO2和H2反应合成二甲醚。
已知:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
②CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4 kJ·mol-1
则2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH3= kJ·mol-1。
(3)用NA表示阿伏加德罗常数的值,在C2H2(g)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。已知1 g燃料完全燃烧时放出的热量叫作该燃料的热值,则C2H2的热值为 。
(4)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由CO2制取C的工艺如图。
①工艺过程中的能量转化形式为 。
②已知“重整系统”发生的反应中=6,则FexOy(y<8)的化学式为 ,“热分解系统”中每转移2 mol电子,需消耗FexOy mol。
阶段评估检测(五)
(75分钟 100分)
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.我国首创光伏发电—固态储氢技术,解决了“绿电”与“绿氢”灵活转换的难题。下列说法不正确的是 ( )
A.该技术直接将光能转换成化学能储存起来
B.规模化使用氢能有助于实现“碳达峰”
C.“绿电”电解水制氢成本比煤炭等化石燃料制氢成本低
D.固态储氢技术使新能源汽车电池加氢更加便捷
【解析】选A。光伏发电将光能转化为电能,利用光伏发电产生的电能电解水,将电能转化为化学能,而不是将光能直接转化为化学能储存起来,A错误;规模化使用氢能,可以有效减少化石能源的使用,有助于实现“碳达峰”,B正确;用“绿电”电解水制氢的能源利用率高,故用“绿电”电解水制氢的成本比煤炭等化石燃料制氢成本低,C正确;气体储存比较困难,故固态储氢技术使新能源汽车电池加氢更加便捷,D正确。
2.下列设备工作时,将化学能转化为热能的是 ( )
A B C D
碱性锌锰电池 水轮发电机 太阳能热水器 燃气灶
【解析】选D。碱性锌锰电池是化学能转化为电能,A不符合题意;水轮发电机为机械能转化为电能,B不符合题意;太阳能热水器是太阳能转化为热能,C不符合题意;燃气灶是化学能转化为热能,D符合题意。
3.下列有关反应热和热化学方程式的描述不正确的是 ( )
A.已知:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀氨水和稀H2SO4溶液完全反应生成1 mol H2O(l)时,放出热量少于57.3 kJ
B.热化学方程式各物质前的化学计量数既可以是整数也可以是分数,既表示分子数也表示物质的量
C.101 kPa,20 ℃和25 ℃时,CH4的燃烧热不同
D.键能数值为平均值,用键能求出的反应热是估算值
【解析】选B。已知:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,由于氨水是弱碱,属于弱电解质,其在水溶液中边反应边电离,电离是一个吸热过程,则稀氨水和稀H2SO4溶液完全反应生成1 mol H2O(l)时,放出热量少于57.3 kJ,A正确;热化学方程式各物质前的化学计量数用于表示其物质的量,而不是其分子数,故热化学方程式各物质前的化学计量数既可以是整数也可以是分数,B错误;燃烧热与外界的压强和温度有关,相同质量的物质在不同温度下具有的总能量不同,故101 kPa,20 ℃和25 ℃时,CH4的燃烧热不同,C正确;化学反应的微观本质为旧化学键的断裂和新化学键的形成过程,可以用反应物的总键能减去生成物的总键能来计算反应热,因为键能数值为平均值,所以用键能求出的反应热是估算值,D正确。
4.甲醇与水蒸气在催化剂作用下发生如下反应:
反应Ⅰ:CH3OH(g)===CO(g)+2H2(g) ΔH1
反应Ⅱ:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2
根据能量变化示意图,下列说法正确的是 ( )
A.E3-E2>E4-E1
B.反应Ⅱ决定整个反应的速率
C.催化剂可以降低总反应的焓变
D.CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=ΔH1-ΔH2
【解析】选A。由于绝对值|E3-E2|<|E4-E1|,两值均为负值,去掉绝对值后,E3-E2>E4-E1,A正确;由图可知,反应Ⅰ的活化能为E1-E5,反应Ⅱ的活化能为E2-E3,反应Ⅰ的活化能较大,则反应Ⅰ的反应速率慢于反应Ⅱ,反应Ⅰ决定整个反应的速率,B错误;催化剂可改变反应的活化能,反应的焓变由始态和终态决定,催化剂不改变焓变,C错误;根据盖斯定律,反应Ⅰ+Ⅱ可得目标化学方程式CH3OH(g)+H2O(g)===CO2(g)+3H2(g),则ΔH=ΔH1+ΔH2,D错误。
5.(2024·兰州一中期中)氢卤酸的能量关系如图所示:
下列说法正确的是 ( )
A.ΔH=ΔH1+ΔH2+ΔH3+ΔH4
B.相同条件下,HCl的ΔH2比HBr的小
C.相同条件下,HCl的(ΔH3+ΔH4)比HI的大
D.一定条件下,气态原子生成1 mol H—X键放出a kJ能量,则ΔH2=+a kJ·mol-1
【解析】选D。根据盖斯定律,ΔH=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6,A错误;断键吸收能量,由于HCl比HBr稳定,所以相同条件下HCl的ΔH2比HBr的大,B错误;ΔH3+ΔH4代表H(g)→H+(aq)的焓变,与物质种类无关,C错误;一定条件下,气态原子生成1 mol H—X键放出a kJ能量,则断开1 mol H—X键形成气态原子吸收a kJ的能量,即为ΔH2=+a kJ·mol-1,D正确。
6. (2024·开封联考)太阳能是理想的清洁能源,通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。下列说法错误的是 ( )
A.过程Ⅰ中氧化产物是O2
B.过程Ⅱ化学方程式为CO2+6FeO2Fe3O4+C
C.过程Ⅱ产物中只有离子键形成
D.总反应式为CO2(g)C(s)+O2(g),是吸热反应
【解析】选C。过程Ⅰ中氧元素化合价升高,故O2是氧化产物,A正确;由图知过程Ⅱ的反应物是CO2、FeO,生成物是Fe3O4,B正确;产物单质碳中含有“碳碳共价键”,C错误;碳与O2反应是放热反应,D正确。
7.火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时
( )
A.负极上发生还原反应
B.CO2在正极上得电子
C.阳离子由正极移向负极
D.将电能转化为化学能
【解析】选B。根据题干信息可知,放电时总反应为4Na+3CO2===2Na2CO3+C。放电时负极上Na发生氧化反应失去电子生成Na+,故A错误;放电时正极为CO2得到电子生成C,故B正确;放电时阳离子由负极移向正极,故C错误;放电时装置为原电池,能量转化关系为化学能转化为电能,故D错误。
8.二十大报告指出要深入推进环境污染防治,持续深入打好蓝天、碧水、净土保卫战。二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是 ( )
A.该电池放电时质子从Pt2电极经过内电路移向Pt1电极
B.Pt1电极附近发生的反应为SO2+2H2O-2e-===H2SO4+2H+
C.Pt2电极附近发生的反应为O2+4e-+2H2O===4OH-
D.相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
【解析】选D。放电时为原电池,质子向正极移动,Pt1电极为负极,则该电池放电时质子从Pt1电极移向Pt2电极,A错误;Pt1电极为负极,发生氧化反应,SO2被氧化为硫酸,电极反应式为SO2+2H2O-2e-===S+4H+,硫酸应当拆为离子形式,B错误;酸性条件下,氧气得电子生成水,C错误;根据转移电子数相等可知,放电过程中消耗的SO2和O2的体积比为2∶1,D正确。
9. K-O2电池结构如图,a和b为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是 ( )
A.隔膜允许K+通过,不允许O2通过
B.放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极
C.产生1 Ah电量时,生成KO2的质量与消耗O2的质量比值约为2.22
D.用此电池为铅酸蓄电池充电,消耗3.9 g钾时,铅酸蓄电池消耗0.9 g水
【解析】选D。由图可知,a电极为原电池的负极,电极反应式为K-e-===K+,b电极为正极,在钾离子作用下,氧气在正极得到电子发生还原反应生成超氧化钾;金属性强的金属钾易与氧气反应,为防止钾与氧气反应,电池所选择隔膜应允许K+通过,不允许O2通过,A正确;放电时,a为负极,b为正极,电流由b电极沿导线流向a电极,充电时,b电极应与直流电源的正极相连,作电解池的阳极,B正确;生成1 mol超氧化钾时,消耗1 mol氧气,两者的质量比值为(1 mol×71 g·mol-1)∶
(1 mol×32 g·mol-1)≈2.22∶1,C正确;铅酸蓄电池充电时的总反应方程式为2PbSO4+2H2O===PbO2+Pb+2H2SO4,反应消耗2 mol水,转移2 mol电子,由得失电子数目守恒可知,消耗3.9 g钾时,铅酸蓄电池消耗水的质量为×
18 g·mol-1=1.8 g,D错误。
10.(2024·南阳模拟)类比和推理是重要的学习方法。下列类比或推理合理的是
( )
选项 已知 方法 结论
A 工业电解熔融氯化镁制镁 类比 工业电解熔融氯化铝制铝
B H2(g)+Br2(g)===2HBr(g) ΔH1<0, H2(g)+Cl2(g)===2HCl(g) ΔH2<0, 且ΔH2<ΔH1 推理 氯的得电子能力大于溴
C 铁制品在潮湿空气中易生锈 类比 铝制品在潮湿空气中易生锈
D 由铝片、镁片与NaOH溶液组成的原电池中,铝片为负极 推理 铝的失电子能力大于镁
【解析】选B。工业电解熔融氯化镁制镁,但由于AlCl3是共价化合物,熔融时不导电,故工业上要电解熔融的氧化铝制铝,A不合题意;由题干信息可知,H2(g)+Br2(g)===2HBr(g) ΔH1<0,H2(g)+Cl2(g)===2HCl(g) ΔH2<0,且ΔH2<ΔH1说明Cl2与H2化合比Br2与H2化合更容易,即说明Cl2的氧化性强于Br2,故可得出氯的得电子能力大于溴,B符合题意;铁单质在潮湿的空气中容易生锈,因为铁锈是疏松多孔的,氧化铝薄膜比较致密,会阻止内层金属继续被氧化,故铝在潮湿的空气中不易生锈,C不合题意;Mg的金属性强于Al,由铝片、镁片与NaOH溶液组成的原电池中,铝片为负极是由于Al能与NaOH溶液反应,无法通过此方法判断Al、Mg的失电子能力,D不合题意。
11.(2024·河南高三校联考)我国科学家在锂氧电池催化剂领域取得重大进展。某锂氧电池的工作原理如图1所示,电池总反应为O2+2LiLi2O2,b电极发生反应的微观过程如图2所示。下列说法错误的是 ( )
A.放电时b电极上发生过程Ⅰ的系列反应
B.过程Ⅱ中④的电极反应式为Li2-xO2-(2-x)e-===O2↑+(2-x)Li+
C.O2中混入CO2会影响电池充电
D.放电过程中转移1 mol e-时,b电极增重16 g
【解析】选D。放电时,Li作负极,发生失电子的氧化反应,电极反应式:Li-e-===Li+;石墨作正极,氧气在石墨电极发生得电子的还原反应。放电时b电极O2→Li2O2,发生过程Ⅰ系列反应,A正确;根据分析可知,充电过程中,④的电极反应式为Li2-xO2-(2-x)e-===O2↑+(2-x)Li+,B正确;O2中混入CO2会影响电池充电,C正确;放电过程中,b极电极反应式:O2+2e-+2Li+===Li2O2,转移1 mol e-时,b电极增重23 g,D错误。
12.如图是利用微生物将废水中的乙二胺[H2N(CH2)2NH2]氧化为环境友好物质而制作的化学电源,可给二次电池充电。下列说法正确的是 ( )
A.M极电极反应式:H2N(CH2)2NH2+4H2O-16e-===2CO2+N2+16H+
B.充电时二次电池的正极应与M极相连
C.H+通过质子交换膜由N极向M极移动
D.若N极消耗了标准状况下2.24 L O2,则有0.4 mol电子从N极流向M极
【解析】选A。由题图知,M极为负极,N极为正极,H2N(CH2)2NH2 在负极上失电子发生氧化反应,电极反应式为H2N(CH2)2NH2+4H2O-16e-===2CO2+N2+16H+,A正确;充电时二次电池的正极应与外接电源的正极相连,即与N极相连,B错误;H+通过质子交换膜由M极移向N极,C错误;当N电极消耗标准状况下2.24 L O2时,则转移×4=0.4 mol电子,所以有0.4 mol电子从M极流向N极,D错误。
13.(2024·华南师大附中期中)LiOH是生产航空航天润滑剂的原料。清华大学首创三室膜电解法制备氢氧化锂,其模拟装置如图所示。下列有关说法正确的是
( )
A.a极为电源的负极,Y极上发生氧化反应
B.X极的电极反应式为2H2O-4e-===4H++O2↑
C.膜1为阳离子交换膜,膜2为阴离子交换膜
D.每转移2 mol电子,理论上生成24 g LiOH
【解析】选B。电解池实质是电解水,根据图知:X极导出的是浓硫酸,则X极应为水电离出的OH-放电,则X极为阳极,阳极反应式为2H2O-4e-===4H++O2↑,气体1为O2。Y极导出的是浓LiOH,则Y极是水电离出的氢离子放电生成H2和OH-,则Y为电解池的阴极,气体2为H2,阴极电极反应式为2H2O+2e-===2OH-+H2↑;据此分析解答。根据分析,X极为阳极,所以a极为正极,b极为负极,则Y极为阴极,发生还原反应,A错误;根据分析,X极上水电离产生的OH-失去电子发生氧化反应产生O2,电极反应式为2H2O-4e-===4H++O2↑,B正确;根据分析,X极为阳极,导出的是浓硫酸,则S向阳极移动,膜1为阴离子交换膜,Y极为阴极,导出的是浓LiOH,则Li+向阴极移动,膜2为阳离子交换膜,C错误;Y极为阴极,电极反应式为2H2O+2e-===2OH-+H2↑,每转移2 mol电子,理论上有2 mol Li+向Y极迁移形成
2 mol LiOH,其质量是48 g,D错误。
14.我国科研团队将电解食盐水的阳极反应与电催化还原CO2的阴极反应相结合,制备CO与次氯酸盐,阴极区与阳极区用质子交换膜隔开。装置如图所示,下列说法正确的是 ( )
A.b极为电源的负极
B.工作时,阴极附近溶液pH减小
C.电池工作时,阳极发生的电极反应式为Cl-+H2O-2e-===ClO-+2H+
D.工作时,每转移1 mol电子,阴极室和阳极室质量变化相差10 g
【解析】选D。A.左侧通入二氧化碳生成一氧化碳,说明M为阴极,则a为电源的负极,A项错误;B.工作时,阴极电极反应式为CO2+2H++2e-===CO+H2O,消耗氢离子,溶液的pH增大,B项错误;C.阳极为氯离子失去电子结合氢氧根离子生成次氯酸根离子和水,C项错误;D.每转移1 mol电子,有1 mol氢离子从阳极室移动到阴极室,阴极室由电极反应CO2+2H++2e-===CO+H2O分析,质量增加了8克,故阴极室和阳极室质量相差10克,D项正确。
二、非选择题:本题共4小题,共58分。
15.(14分)用如图所示的装置测定中和反应反应热。
实验药品:100 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1NaOH溶液、
50 mL 0.55 mol·L-1氨水。已知弱碱电离时吸热。回答下列问题:
(1)从实验装置上看,还缺少 ,其能否用铜质材料替代
(填“能”或“不能”),理由是 。
【解析】(1)由量热计的构造可知该装置缺少的仪器是环形玻璃搅拌棒;金属材质易散热,使实验误差增大,所以不可以用铜质材料替代。
(2)装置中隔热层的作用是 。
【解析】(2)中和热测定实验成败关键是保温工作,装置中隔热层的作用是减少实验过程中的热量损失。
(3)将浓度为0.50 mol·L-1的酸溶液和0.55 mol·L-1的碱溶液各50 mL混合(溶液密度均为1 g·mL-1),生成的溶液的比热容c=4.18 J·g-1·℃-1,测得温度如下:
反应物 起始温度t1/℃ 最高温度t2/℃
甲组(HCl+NaOH) 15.0 18.3
乙组(HCl+NH3·H2O) 15.0 18.1
①两组实验结果存在差异的原因是 。
②HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l)的ΔH= (保留一位小数)。
③某同学利用上述装置重新做甲组实验,测得反应热ΔH偏大,则可能的原因是
(填字母)。
A.测完盐酸的温度直接测NaOH溶液温度
B.做该实验时室温较高
C.杯盖未盖严
D.NaOH溶液一次性迅速倒入
④实验中若改用60 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”,下同),若实验操作均正确,则所求中和热 。
【解析】(3)①两组实验一个是强酸和强碱的反应,一个是强酸和弱碱的反应,NH3·H2O在中和过程中要吸热,导致放热较少。②50 mL 0.50 mol·L-1盐酸、
50 mL 0.55 mol·L-1氨水溶液的质量和m=100 mL×1 g·mL-1=100 g,c=4.18 J·g-1·℃-1,代入公式Q=cmΔT得生成0.025 mol的水放出热量Q=4.18 J·g-1·℃-1×100 g×3.10 ℃×10-3=1.295 8 kJ,即生成0.025 mol的水放出热量1.295 8 kJ,所以生成1 mol的水放出热量约为51.8 kJ,ΔH=-51.8 kJ·mol-1;③反应热偏大,则放热的数值偏小。A.测量完盐酸的温度直接测NaOH溶液温度时,温度计上残留的酸液未用水冲洗干净,酸碱中和会放热,导致一部分反应物损失,测定数值偏小,故A符合题意;B.做本实验时室温较高,不会影响实验结果,故B不符合题意;C.杯盖未盖严,会导致热量散失,数值偏小,故C符合题意;D.NaOH溶液一次性迅速倒入可以减少实验误差,减少能量损失,故D不符合题意。④反应放出的热量和所用酸以及碱的量的多少有关,若改用60 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,放出的热量增大,但是中和热均是强酸和强碱反应生成1 mol水时放出的热,与酸碱的用量无关,所以用60 mL 0.50 mol·L-1盐酸和
50 mL 0.55 mol·L-1NaOH溶液进行反应,测得中和热数值相等。
答案:(1)环形玻璃搅拌棒(或玻璃搅拌器) 不能 金属材质易散热,使实验误差增大
(2)保温隔热、减少实验过程中的热量损失
(3)①NH3·H2O在中和过程中要吸热,导致放热较少 ②-51.8 kJ·mol-1 ③AC ④不相等 相等
16.(14分)(2024·酒泉模拟)2030年前实现碳达峰的承诺,体现了中国的大国风范。天然气的综合利用是各国科学家研究的重要课题。
(1)天然气的主要成分为甲烷,甲烷的结构式是 ,甲烷燃烧反应过程中的能量变化符合如图中的 (填字母)。
【解析】(1)甲烷的分子式为CH4,碳原子和四个氢原子形成四个共价键,则甲烷的结构式为;甲烷燃烧放热,反应物的总能量大于生成物的总能量,故反应过程中的能量变化符合a。
(2)a g CH4燃烧生成二氧化碳气体和液态水,放出热量44.5 kJ。经测定,生成的CO2与足量澄清石灰水反应得到5 g沉淀,则CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH= kJ·mol-1,其中a= 。
【解析】(2)生成的碳酸钙沉淀的物质的量为=0.05 mol,
CO2+Ca(OH)2===CaCO3↓+H2O
0.05 mol 0.05 mol
CH4(g)+2O2(g)===CO2(g)+2H2O(l)
0.05 mol 0.05 mol
0.05 mol CH4燃烧放出热量为44.5 kJ,则1 mol CH4燃烧释放的热量为44.5×20=890 kJ,故CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1;
0.05 mol CH4的质量为0.05 mol×16 g·mol-1=0.8 g。
(3)甲烷和二氧化碳重整制合成气的研究是实现碳达峰的手段之一,甲烷和二氧化碳重整制合成气的反应为CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH1
副反应I:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.5 kJ·mol-1
副反应Ⅱ:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH3
已知:部分化学键键能数据如表(1 mol CO中含有1 mol C≡O键)。
化学键 C—H C=O H—H C≡O
键能/(kJ·mol-1) 413 745 436 1 011
则ΔH1= kJ·mol-1,ΔH3= kJ·mol-1。
【解析】(3)ΔH1=反应物的总键能-生成物的总键能=4×413 kJ·mol-1+2×
745 kJ·mol-1-2×
436 kJ·mol-1-2×1 011 kJ·mol-1=+248 kJ·mol-1;根据盖斯定律得,
ΔH3=ΔH1-ΔH2=+248 kJ·mol-1-41.5 kJ·mol-1=+206.5 kJ·mol-1。
(4)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
若标准状况下用1.12 L CH4还原NO2至N2,整个过程中转移电子总数为
(阿伏加德罗常数的值用NA表示),放出的热量为 kJ。
【解析】(4)CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH3
由盖斯定律可计算:ΔH3=(ΔH1+ΔH2)×=-867 kJ·mol-1,在标准状况下1.12 L CH4的物质的量为=0.05 mol,整个过程中转移电子总数为0.05 mol×8=0.4 mol,即0.4NA,放出的热量为0.05 mol×867 kJ·mol-1=43.35 kJ·mol-1。
答案:(1) a (2)-890 0.8
(3)+248 +206.5 (4)0.4NA 43.35
17.(16分)电化学原理在工业生产中发挥着巨大的作用。
Ⅰ.Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂, 在工业上通常利用如图装置生产Na2FeO4
(1)阳极的电极反应式为 。
【解析】(1)根据图示,Cu电极为阴极,Fe电极为阳极。阳极上Fe失去电子,发生氧化反应生成Fe,电极反应式为Fe+8OH--6e-===Fe+4H2O;
(2)阴极产生的气体为 。
【解析】(2)H+的放电能力大于Na+,Cu电极上水电离产生的H+得电子产生氢气,电极反应式为2H2O+2e-===H2↑+2OH-,故阴极产生的气体为H2;
(3)右侧的离子交换膜为 (填“阴”或“阳”)离子交换膜,
阴极区a% b%(填“>” “=” 或“<”)。
【解析】(3)根据阳极电极反应式Fe+8OH--6e-===Fe+4H2O,OH-参与反应,OH-移向右侧,即右侧的离子交换膜为阴离子交换膜;根据阴极反应式2H2O+2e-===H2↑+2OH-,阴极上产生OH-,即Na+通过交换膜移向左侧,生成NaOH,氢氧化钠浓度增大,即a%Ⅱ.如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。
(4)Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为 。
【解析】(4)利用电解法制H2O2,在该电解池中,Ir-Ru惰性电极有吸附O2的作用,为氧气得电子发生还原反应:O2+2H++2e-===H2O2;
(5)理论上电路中每转移3 mol电子,最多可以处理废氨水中溶质(以NH3计)的质量是 g。
【解析】(5)4NH3+3O22N2+6H2O中,氨气中的氮元素从-3价变为氮气中的0价,4 mol氨气转移12 mol电子,所以转移3 mol电子,最多可以处理废氨水中溶质(以NH3计)的物质的量是1 mol,质量为1 mol×17 g·mol-1=17 g。
答案:(1)Fe+8OH--6e-===Fe+4H2O
(2)H2 (3)阴 <
(4)O2+2H++2e-===H2O2 (5)17
18.(14分)(2023·石家庄模拟)低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)C2H4(g)+2H2O(g),该反应体系的能量随反应过程的变化关系如图所示,则该反应的ΔH= (用含a、b的式子表示)。相关化学键的键能如表,实验测得上述反应的ΔH=-152 kJ·mol-1,则表中的x= 。
化学键 C=O H—H C=C C—H H—O
键能 (kJ·mol-1) x 436 764 414 464
【解析】(1)根据反应热等于正反应活化能-逆反应的活化能分析,该反应热为-(b-a)kJ·mol-1。根据反应热=反应物的键能总和-生成物的键能总和计算,有2x+3×436-×(764+414×4)-4×464=-152,解x=803。
(2)工业上用CO2和H2反应合成二甲醚。
已知:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
②CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4 kJ·mol-1
则2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH3= kJ·mol-1。
【解析】(2)根据盖斯定律分析,①CO2(g)+3H2(g)CH3OH(g)+H2O(g)
ΔH1=-53.7 kJ·mol-1,②CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4 kJ·mol-1,
有①×2-②得2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)
ΔH3=-53.7×2-23.4=-130.8 kJ·mol-1。
(3)用NA表示阿伏加德罗常数的值,在C2H2(g)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。已知1 g燃料完全燃烧时放出的热量叫作该燃料的热值,则C2H2的热值为 。
【解析】(3)NA表示阿伏加德罗常数的值,在C2H2(g)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,说明有0.5 mol乙炔反应,放出650 kJ的热量,则1 mol乙炔完全燃烧放出的热量为1 300 kJ,则C2H2的热值为=50 kJ·g-1 。
(4)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由CO2制取C的工艺如图。
①工艺过程中的能量转化形式为 。
②已知“重整系统”发生的反应中=6,则FexOy(y<8)的化学式为 ,“热分解系统”中每转移2 mol电子,需消耗FexOy mol。
【解析】(4)①工艺过程中的能量转化形式为太阳能转化为化学能。
②已知“重整系统”发生的反应中=6,根据反应中的原子守恒分析,则x∶y=6∶8,则FexOy(y<8)的化学式为Fe3O4,“热分解系统”中Fe3O4分解为FeO与O2,发生反应:2Fe3O46FeO+O2↑,每转移2 mol e-,产生0.5 mol O2,消耗1 mol Fe3O4。
答案:(1)-(b-a) kJ·mol-1 803
(2)-130.8 (3)50 kJ·g-1
(4)①太阳能转化为化学能 ②Fe3O4 1
- 12 -
(75分钟 100分)
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.我国首创光伏发电—固态储氢技术,解决了“绿电”与“绿氢”灵活转换的难题。下列说法不正确的是 ( )
A.该技术直接将光能转换成化学能储存起来
B.规模化使用氢能有助于实现“碳达峰”
C.“绿电”电解水制氢成本比煤炭等化石燃料制氢成本低
D.固态储氢技术使新能源汽车电池加氢更加便捷
2.下列设备工作时,将化学能转化为热能的是 ( )
A B C D
碱性锌锰电池 水轮发电机 太阳能热水器 燃气灶
3.下列有关反应热和热化学方程式的描述不正确的是 ( )
A.已知:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀氨水和稀H2SO4溶液完全反应生成1 mol H2O(l)时,放出热量少于57.3 kJ
B.热化学方程式各物质前的化学计量数既可以是整数也可以是分数,既表示分子数也表示物质的量
C.101 kPa,20 ℃和25 ℃时,CH4的燃烧热不同
D.键能数值为平均值,用键能求出的反应热是估算值
4.甲醇与水蒸气在催化剂作用下发生如下反应:
反应Ⅰ:CH3OH(g)===CO(g)+2H2(g) ΔH1
反应Ⅱ:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2
根据能量变化示意图,下列说法正确的是 ( )
A.E3-E2>E4-E1
B.反应Ⅱ决定整个反应的速率
C.催化剂可以降低总反应的焓变
D.CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=ΔH1-ΔH2
5.(2024·兰州一中期中)氢卤酸的能量关系如图所示:
下列说法正确的是 ( )
A.ΔH=ΔH1+ΔH2+ΔH3+ΔH4
B.相同条件下,HCl的ΔH2比HBr的小
C.相同条件下,HCl的(ΔH3+ΔH4)比HI的大
D.一定条件下,气态原子生成1 mol H—X键放出a kJ能量,则ΔH2=+a kJ·mol-1
6. (2024·开封联考)太阳能是理想的清洁能源,通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。下列说法错误的是 ( )
A.过程Ⅰ中氧化产物是O2
B.过程Ⅱ化学方程式为CO2+6FeO2Fe3O4+C
C.过程Ⅱ产物中只有离子键形成
D.总反应式为CO2(g)C(s)+O2(g),是吸热反应
7.火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时
( )
A.负极上发生还原反应
B.CO2在正极上得电子
C.阳离子由正极移向负极
D.将电能转化为化学能
8.二十大报告指出要深入推进环境污染防治,持续深入打好蓝天、碧水、净土保卫战。二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是 ( )
A.该电池放电时质子从Pt2电极经过内电路移向Pt1电极
B.Pt1电极附近发生的反应为SO2+2H2O-2e-===H2SO4+2H+
C.Pt2电极附近发生的反应为O2+4e-+2H2O===4OH-
D.相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
9. K-O2电池结构如图,a和b为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是 ( )
A.隔膜允许K+通过,不允许O2通过
B.放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极
C.产生1 Ah电量时,生成KO2的质量与消耗O2的质量比值约为2.22
D.用此电池为铅酸蓄电池充电,消耗3.9 g钾时,铅酸蓄电池消耗0.9 g水
10.(2024·南阳模拟)类比和推理是重要的学习方法。下列类比或推理合理的是
( )
选项 已知 方法 结论
A 工业电解熔融氯化镁制镁 类比 工业电解熔融氯化铝制铝
B H2(g)+Br2(g)===2HBr(g) ΔH1<0, H2(g)+Cl2(g)===2HCl(g) ΔH2<0, 且ΔH2<ΔH1 推理 氯的得电子能力大于溴
C 铁制品在潮湿空气中易生锈 类比 铝制品在潮湿空气中易生锈
D 由铝片、镁片与NaOH溶液组成的原电池中,铝片为负极 推理 铝的失电子能力大于镁
11.(2024·河南高三校联考)我国科学家在锂氧电池催化剂领域取得重大进展。某锂氧电池的工作原理如图1所示,电池总反应为O2+2LiLi2O2,b电极发生反应的微观过程如图2所示。下列说法错误的是 ( )
A.放电时b电极上发生过程Ⅰ的系列反应
B.过程Ⅱ中④的电极反应式为Li2-xO2-(2-x)e-===O2↑+(2-x)Li+
C.O2中混入CO2会影响电池充电
D.放电过程中转移1 mol e-时,b电极增重16 g
12.如图是利用微生物将废水中的乙二胺[H2N(CH2)2NH2]氧化为环境友好物质而制作的化学电源,可给二次电池充电。下列说法正确的是 ( )
A.M极电极反应式:H2N(CH2)2NH2+4H2O-16e-===2CO2+N2+16H+
B.充电时二次电池的正极应与M极相连
C.H+通过质子交换膜由N极向M极移动
D.若N极消耗了标准状况下2.24 L O2,则有0.4 mol电子从N极流向M极
13.(2024·华南师大附中期中)LiOH是生产航空航天润滑剂的原料。清华大学首创三室膜电解法制备氢氧化锂,其模拟装置如图所示。下列有关说法正确的是
( )
A.a极为电源的负极,Y极上发生氧化反应
B.X极的电极反应式为2H2O-4e-===4H++O2↑
C.膜1为阳离子交换膜,膜2为阴离子交换膜
D.每转移2 mol电子,理论上生成24 g LiOH
14.我国科研团队将电解食盐水的阳极反应与电催化还原CO2的阴极反应相结合,制备CO与次氯酸盐,阴极区与阳极区用质子交换膜隔开。装置如图所示,下列说法正确的是 ( )
A.b极为电源的负极
B.工作时,阴极附近溶液pH减小
C.电池工作时,阳极发生的电极反应式为Cl-+H2O-2e-===ClO-+2H+
D.工作时,每转移1 mol电子,阴极室和阳极室质量变化相差10 g
二、非选择题:本题共4小题,共58分。
15.(14分)用如图所示的装置测定中和反应反应热。
实验药品:100 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1NaOH溶液、
50 mL 0.55 mol·L-1氨水。已知弱碱电离时吸热。回答下列问题:
(1)从实验装置上看,还缺少 ,其能否用铜质材料替代
(填“能”或“不能”),理由是 。
(2)装置中隔热层的作用是 。
(3)将浓度为0.50 mol·L-1的酸溶液和0.55 mol·L-1的碱溶液各50 mL混合(溶液密度均为1 g·mL-1),生成的溶液的比热容c=4.18 J·g-1·℃-1,测得温度如下:
反应物 起始温度t1/℃ 最高温度t2/℃
甲组(HCl+NaOH) 15.0 18.3
乙组(HCl+NH3·H2O) 15.0 18.1
①两组实验结果存在差异的原因是 。
②HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l)的ΔH= (保留一位小数)。
③某同学利用上述装置重新做甲组实验,测得反应热ΔH偏大,则可能的原因是
(填字母)。
A.测完盐酸的温度直接测NaOH溶液温度
B.做该实验时室温较高
C.杯盖未盖严
D.NaOH溶液一次性迅速倒入
④实验中若改用60 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”,下同),若实验操作均正确,则所求中和热 。
16.(14分)(2024·酒泉模拟)2030年前实现碳达峰的承诺,体现了中国的大国风范。天然气的综合利用是各国科学家研究的重要课题。
(1)天然气的主要成分为甲烷,甲烷的结构式是 ,甲烷燃烧反应过程中的能量变化符合如图中的 (填字母)。
(2)a g CH4燃烧生成二氧化碳气体和液态水,放出热量44.5 kJ。经测定,生成的CO2与足量澄清石灰水反应得到5 g沉淀,则CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH= kJ·mol-1,其中a= 。
(3)甲烷和二氧化碳重整制合成气的研究是实现碳达峰的手段之一,甲烷和二氧化碳重整制合成气的反应为CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH1
副反应I:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.5 kJ·mol-1
副反应Ⅱ:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH3
已知:部分化学键键能数据如表(1 mol CO中含有1 mol C≡O键)。
化学键 C—H C=O H—H C≡O
键能/(kJ·mol-1) 413 745 436 1 011
则ΔH1= kJ·mol-1,ΔH3= kJ·mol-1。
(4)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
若标准状况下用1.12 L CH4还原NO2至N2,整个过程中转移电子总数为
(阿伏加德罗常数的值用NA表示),放出的热量为 kJ。
17.(16分)电化学原理在工业生产中发挥着巨大的作用。
Ⅰ.Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂, 在工业上通常利用如图装置生产Na2FeO4
(1)阳极的电极反应式为 。
(2)阴极产生的气体为 。
(3)右侧的离子交换膜为 (填“阴”或“阳”)离子交换膜,
阴极区a% b%(填“>” “=” 或“<”)。
Ⅱ.如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。
(4)Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为 。
(5)理论上电路中每转移3 mol电子,最多可以处理废氨水中溶质(以NH3计)的质量是 g。
18.(14分)(2023·石家庄模拟)低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)C2H4(g)+2H2O(g),该反应体系的能量随反应过程的变化关系如图所示,则该反应的ΔH= (用含a、b的式子表示)。相关化学键的键能如表,实验测得上述反应的ΔH=-152 kJ·mol-1,则表中的x= 。
化学键 C=O H—H C=C C—H H—O
键能 (kJ·mol-1) x 436 764 414 464
(2)工业上用CO2和H2反应合成二甲醚。
已知:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
②CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4 kJ·mol-1
则2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH3= kJ·mol-1。
(3)用NA表示阿伏加德罗常数的值,在C2H2(g)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。已知1 g燃料完全燃烧时放出的热量叫作该燃料的热值,则C2H2的热值为 。
(4)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由CO2制取C的工艺如图。
①工艺过程中的能量转化形式为 。
②已知“重整系统”发生的反应中=6,则FexOy(y<8)的化学式为 ,“热分解系统”中每转移2 mol电子,需消耗FexOy mol。
阶段评估检测(五)
(75分钟 100分)
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.我国首创光伏发电—固态储氢技术,解决了“绿电”与“绿氢”灵活转换的难题。下列说法不正确的是 ( )
A.该技术直接将光能转换成化学能储存起来
B.规模化使用氢能有助于实现“碳达峰”
C.“绿电”电解水制氢成本比煤炭等化石燃料制氢成本低
D.固态储氢技术使新能源汽车电池加氢更加便捷
【解析】选A。光伏发电将光能转化为电能,利用光伏发电产生的电能电解水,将电能转化为化学能,而不是将光能直接转化为化学能储存起来,A错误;规模化使用氢能,可以有效减少化石能源的使用,有助于实现“碳达峰”,B正确;用“绿电”电解水制氢的能源利用率高,故用“绿电”电解水制氢的成本比煤炭等化石燃料制氢成本低,C正确;气体储存比较困难,故固态储氢技术使新能源汽车电池加氢更加便捷,D正确。
2.下列设备工作时,将化学能转化为热能的是 ( )
A B C D
碱性锌锰电池 水轮发电机 太阳能热水器 燃气灶
【解析】选D。碱性锌锰电池是化学能转化为电能,A不符合题意;水轮发电机为机械能转化为电能,B不符合题意;太阳能热水器是太阳能转化为热能,C不符合题意;燃气灶是化学能转化为热能,D符合题意。
3.下列有关反应热和热化学方程式的描述不正确的是 ( )
A.已知:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀氨水和稀H2SO4溶液完全反应生成1 mol H2O(l)时,放出热量少于57.3 kJ
B.热化学方程式各物质前的化学计量数既可以是整数也可以是分数,既表示分子数也表示物质的量
C.101 kPa,20 ℃和25 ℃时,CH4的燃烧热不同
D.键能数值为平均值,用键能求出的反应热是估算值
【解析】选B。已知:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,由于氨水是弱碱,属于弱电解质,其在水溶液中边反应边电离,电离是一个吸热过程,则稀氨水和稀H2SO4溶液完全反应生成1 mol H2O(l)时,放出热量少于57.3 kJ,A正确;热化学方程式各物质前的化学计量数用于表示其物质的量,而不是其分子数,故热化学方程式各物质前的化学计量数既可以是整数也可以是分数,B错误;燃烧热与外界的压强和温度有关,相同质量的物质在不同温度下具有的总能量不同,故101 kPa,20 ℃和25 ℃时,CH4的燃烧热不同,C正确;化学反应的微观本质为旧化学键的断裂和新化学键的形成过程,可以用反应物的总键能减去生成物的总键能来计算反应热,因为键能数值为平均值,所以用键能求出的反应热是估算值,D正确。
4.甲醇与水蒸气在催化剂作用下发生如下反应:
反应Ⅰ:CH3OH(g)===CO(g)+2H2(g) ΔH1
反应Ⅱ:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2
根据能量变化示意图,下列说法正确的是 ( )
A.E3-E2>E4-E1
B.反应Ⅱ决定整个反应的速率
C.催化剂可以降低总反应的焓变
D.CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=ΔH1-ΔH2
【解析】选A。由于绝对值|E3-E2|<|E4-E1|,两值均为负值,去掉绝对值后,E3-E2>E4-E1,A正确;由图可知,反应Ⅰ的活化能为E1-E5,反应Ⅱ的活化能为E2-E3,反应Ⅰ的活化能较大,则反应Ⅰ的反应速率慢于反应Ⅱ,反应Ⅰ决定整个反应的速率,B错误;催化剂可改变反应的活化能,反应的焓变由始态和终态决定,催化剂不改变焓变,C错误;根据盖斯定律,反应Ⅰ+Ⅱ可得目标化学方程式CH3OH(g)+H2O(g)===CO2(g)+3H2(g),则ΔH=ΔH1+ΔH2,D错误。
5.(2024·兰州一中期中)氢卤酸的能量关系如图所示:
下列说法正确的是 ( )
A.ΔH=ΔH1+ΔH2+ΔH3+ΔH4
B.相同条件下,HCl的ΔH2比HBr的小
C.相同条件下,HCl的(ΔH3+ΔH4)比HI的大
D.一定条件下,气态原子生成1 mol H—X键放出a kJ能量,则ΔH2=+a kJ·mol-1
【解析】选D。根据盖斯定律,ΔH=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6,A错误;断键吸收能量,由于HCl比HBr稳定,所以相同条件下HCl的ΔH2比HBr的大,B错误;ΔH3+ΔH4代表H(g)→H+(aq)的焓变,与物质种类无关,C错误;一定条件下,气态原子生成1 mol H—X键放出a kJ能量,则断开1 mol H—X键形成气态原子吸收a kJ的能量,即为ΔH2=+a kJ·mol-1,D正确。
6. (2024·开封联考)太阳能是理想的清洁能源,通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。下列说法错误的是 ( )
A.过程Ⅰ中氧化产物是O2
B.过程Ⅱ化学方程式为CO2+6FeO2Fe3O4+C
C.过程Ⅱ产物中只有离子键形成
D.总反应式为CO2(g)C(s)+O2(g),是吸热反应
【解析】选C。过程Ⅰ中氧元素化合价升高,故O2是氧化产物,A正确;由图知过程Ⅱ的反应物是CO2、FeO,生成物是Fe3O4,B正确;产物单质碳中含有“碳碳共价键”,C错误;碳与O2反应是放热反应,D正确。
7.火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时
( )
A.负极上发生还原反应
B.CO2在正极上得电子
C.阳离子由正极移向负极
D.将电能转化为化学能
【解析】选B。根据题干信息可知,放电时总反应为4Na+3CO2===2Na2CO3+C。放电时负极上Na发生氧化反应失去电子生成Na+,故A错误;放电时正极为CO2得到电子生成C,故B正确;放电时阳离子由负极移向正极,故C错误;放电时装置为原电池,能量转化关系为化学能转化为电能,故D错误。
8.二十大报告指出要深入推进环境污染防治,持续深入打好蓝天、碧水、净土保卫战。二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是 ( )
A.该电池放电时质子从Pt2电极经过内电路移向Pt1电极
B.Pt1电极附近发生的反应为SO2+2H2O-2e-===H2SO4+2H+
C.Pt2电极附近发生的反应为O2+4e-+2H2O===4OH-
D.相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
【解析】选D。放电时为原电池,质子向正极移动,Pt1电极为负极,则该电池放电时质子从Pt1电极移向Pt2电极,A错误;Pt1电极为负极,发生氧化反应,SO2被氧化为硫酸,电极反应式为SO2+2H2O-2e-===S+4H+,硫酸应当拆为离子形式,B错误;酸性条件下,氧气得电子生成水,C错误;根据转移电子数相等可知,放电过程中消耗的SO2和O2的体积比为2∶1,D正确。
9. K-O2电池结构如图,a和b为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是 ( )
A.隔膜允许K+通过,不允许O2通过
B.放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极
C.产生1 Ah电量时,生成KO2的质量与消耗O2的质量比值约为2.22
D.用此电池为铅酸蓄电池充电,消耗3.9 g钾时,铅酸蓄电池消耗0.9 g水
【解析】选D。由图可知,a电极为原电池的负极,电极反应式为K-e-===K+,b电极为正极,在钾离子作用下,氧气在正极得到电子发生还原反应生成超氧化钾;金属性强的金属钾易与氧气反应,为防止钾与氧气反应,电池所选择隔膜应允许K+通过,不允许O2通过,A正确;放电时,a为负极,b为正极,电流由b电极沿导线流向a电极,充电时,b电极应与直流电源的正极相连,作电解池的阳极,B正确;生成1 mol超氧化钾时,消耗1 mol氧气,两者的质量比值为(1 mol×71 g·mol-1)∶
(1 mol×32 g·mol-1)≈2.22∶1,C正确;铅酸蓄电池充电时的总反应方程式为2PbSO4+2H2O===PbO2+Pb+2H2SO4,反应消耗2 mol水,转移2 mol电子,由得失电子数目守恒可知,消耗3.9 g钾时,铅酸蓄电池消耗水的质量为×
18 g·mol-1=1.8 g,D错误。
10.(2024·南阳模拟)类比和推理是重要的学习方法。下列类比或推理合理的是
( )
选项 已知 方法 结论
A 工业电解熔融氯化镁制镁 类比 工业电解熔融氯化铝制铝
B H2(g)+Br2(g)===2HBr(g) ΔH1<0, H2(g)+Cl2(g)===2HCl(g) ΔH2<0, 且ΔH2<ΔH1 推理 氯的得电子能力大于溴
C 铁制品在潮湿空气中易生锈 类比 铝制品在潮湿空气中易生锈
D 由铝片、镁片与NaOH溶液组成的原电池中,铝片为负极 推理 铝的失电子能力大于镁
【解析】选B。工业电解熔融氯化镁制镁,但由于AlCl3是共价化合物,熔融时不导电,故工业上要电解熔融的氧化铝制铝,A不合题意;由题干信息可知,H2(g)+Br2(g)===2HBr(g) ΔH1<0,H2(g)+Cl2(g)===2HCl(g) ΔH2<0,且ΔH2<ΔH1说明Cl2与H2化合比Br2与H2化合更容易,即说明Cl2的氧化性强于Br2,故可得出氯的得电子能力大于溴,B符合题意;铁单质在潮湿的空气中容易生锈,因为铁锈是疏松多孔的,氧化铝薄膜比较致密,会阻止内层金属继续被氧化,故铝在潮湿的空气中不易生锈,C不合题意;Mg的金属性强于Al,由铝片、镁片与NaOH溶液组成的原电池中,铝片为负极是由于Al能与NaOH溶液反应,无法通过此方法判断Al、Mg的失电子能力,D不合题意。
11.(2024·河南高三校联考)我国科学家在锂氧电池催化剂领域取得重大进展。某锂氧电池的工作原理如图1所示,电池总反应为O2+2LiLi2O2,b电极发生反应的微观过程如图2所示。下列说法错误的是 ( )
A.放电时b电极上发生过程Ⅰ的系列反应
B.过程Ⅱ中④的电极反应式为Li2-xO2-(2-x)e-===O2↑+(2-x)Li+
C.O2中混入CO2会影响电池充电
D.放电过程中转移1 mol e-时,b电极增重16 g
【解析】选D。放电时,Li作负极,发生失电子的氧化反应,电极反应式:Li-e-===Li+;石墨作正极,氧气在石墨电极发生得电子的还原反应。放电时b电极O2→Li2O2,发生过程Ⅰ系列反应,A正确;根据分析可知,充电过程中,④的电极反应式为Li2-xO2-(2-x)e-===O2↑+(2-x)Li+,B正确;O2中混入CO2会影响电池充电,C正确;放电过程中,b极电极反应式:O2+2e-+2Li+===Li2O2,转移1 mol e-时,b电极增重23 g,D错误。
12.如图是利用微生物将废水中的乙二胺[H2N(CH2)2NH2]氧化为环境友好物质而制作的化学电源,可给二次电池充电。下列说法正确的是 ( )
A.M极电极反应式:H2N(CH2)2NH2+4H2O-16e-===2CO2+N2+16H+
B.充电时二次电池的正极应与M极相连
C.H+通过质子交换膜由N极向M极移动
D.若N极消耗了标准状况下2.24 L O2,则有0.4 mol电子从N极流向M极
【解析】选A。由题图知,M极为负极,N极为正极,H2N(CH2)2NH2 在负极上失电子发生氧化反应,电极反应式为H2N(CH2)2NH2+4H2O-16e-===2CO2+N2+16H+,A正确;充电时二次电池的正极应与外接电源的正极相连,即与N极相连,B错误;H+通过质子交换膜由M极移向N极,C错误;当N电极消耗标准状况下2.24 L O2时,则转移×4=0.4 mol电子,所以有0.4 mol电子从M极流向N极,D错误。
13.(2024·华南师大附中期中)LiOH是生产航空航天润滑剂的原料。清华大学首创三室膜电解法制备氢氧化锂,其模拟装置如图所示。下列有关说法正确的是
( )
A.a极为电源的负极,Y极上发生氧化反应
B.X极的电极反应式为2H2O-4e-===4H++O2↑
C.膜1为阳离子交换膜,膜2为阴离子交换膜
D.每转移2 mol电子,理论上生成24 g LiOH
【解析】选B。电解池实质是电解水,根据图知:X极导出的是浓硫酸,则X极应为水电离出的OH-放电,则X极为阳极,阳极反应式为2H2O-4e-===4H++O2↑,气体1为O2。Y极导出的是浓LiOH,则Y极是水电离出的氢离子放电生成H2和OH-,则Y为电解池的阴极,气体2为H2,阴极电极反应式为2H2O+2e-===2OH-+H2↑;据此分析解答。根据分析,X极为阳极,所以a极为正极,b极为负极,则Y极为阴极,发生还原反应,A错误;根据分析,X极上水电离产生的OH-失去电子发生氧化反应产生O2,电极反应式为2H2O-4e-===4H++O2↑,B正确;根据分析,X极为阳极,导出的是浓硫酸,则S向阳极移动,膜1为阴离子交换膜,Y极为阴极,导出的是浓LiOH,则Li+向阴极移动,膜2为阳离子交换膜,C错误;Y极为阴极,电极反应式为2H2O+2e-===2OH-+H2↑,每转移2 mol电子,理论上有2 mol Li+向Y极迁移形成
2 mol LiOH,其质量是48 g,D错误。
14.我国科研团队将电解食盐水的阳极反应与电催化还原CO2的阴极反应相结合,制备CO与次氯酸盐,阴极区与阳极区用质子交换膜隔开。装置如图所示,下列说法正确的是 ( )
A.b极为电源的负极
B.工作时,阴极附近溶液pH减小
C.电池工作时,阳极发生的电极反应式为Cl-+H2O-2e-===ClO-+2H+
D.工作时,每转移1 mol电子,阴极室和阳极室质量变化相差10 g
【解析】选D。A.左侧通入二氧化碳生成一氧化碳,说明M为阴极,则a为电源的负极,A项错误;B.工作时,阴极电极反应式为CO2+2H++2e-===CO+H2O,消耗氢离子,溶液的pH增大,B项错误;C.阳极为氯离子失去电子结合氢氧根离子生成次氯酸根离子和水,C项错误;D.每转移1 mol电子,有1 mol氢离子从阳极室移动到阴极室,阴极室由电极反应CO2+2H++2e-===CO+H2O分析,质量增加了8克,故阴极室和阳极室质量相差10克,D项正确。
二、非选择题:本题共4小题,共58分。
15.(14分)用如图所示的装置测定中和反应反应热。
实验药品:100 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1NaOH溶液、
50 mL 0.55 mol·L-1氨水。已知弱碱电离时吸热。回答下列问题:
(1)从实验装置上看,还缺少 ,其能否用铜质材料替代
(填“能”或“不能”),理由是 。
【解析】(1)由量热计的构造可知该装置缺少的仪器是环形玻璃搅拌棒;金属材质易散热,使实验误差增大,所以不可以用铜质材料替代。
(2)装置中隔热层的作用是 。
【解析】(2)中和热测定实验成败关键是保温工作,装置中隔热层的作用是减少实验过程中的热量损失。
(3)将浓度为0.50 mol·L-1的酸溶液和0.55 mol·L-1的碱溶液各50 mL混合(溶液密度均为1 g·mL-1),生成的溶液的比热容c=4.18 J·g-1·℃-1,测得温度如下:
反应物 起始温度t1/℃ 最高温度t2/℃
甲组(HCl+NaOH) 15.0 18.3
乙组(HCl+NH3·H2O) 15.0 18.1
①两组实验结果存在差异的原因是 。
②HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l)的ΔH= (保留一位小数)。
③某同学利用上述装置重新做甲组实验,测得反应热ΔH偏大,则可能的原因是
(填字母)。
A.测完盐酸的温度直接测NaOH溶液温度
B.做该实验时室温较高
C.杯盖未盖严
D.NaOH溶液一次性迅速倒入
④实验中若改用60 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”,下同),若实验操作均正确,则所求中和热 。
【解析】(3)①两组实验一个是强酸和强碱的反应,一个是强酸和弱碱的反应,NH3·H2O在中和过程中要吸热,导致放热较少。②50 mL 0.50 mol·L-1盐酸、
50 mL 0.55 mol·L-1氨水溶液的质量和m=100 mL×1 g·mL-1=100 g,c=4.18 J·g-1·℃-1,代入公式Q=cmΔT得生成0.025 mol的水放出热量Q=4.18 J·g-1·℃-1×100 g×3.10 ℃×10-3=1.295 8 kJ,即生成0.025 mol的水放出热量1.295 8 kJ,所以生成1 mol的水放出热量约为51.8 kJ,ΔH=-51.8 kJ·mol-1;③反应热偏大,则放热的数值偏小。A.测量完盐酸的温度直接测NaOH溶液温度时,温度计上残留的酸液未用水冲洗干净,酸碱中和会放热,导致一部分反应物损失,测定数值偏小,故A符合题意;B.做本实验时室温较高,不会影响实验结果,故B不符合题意;C.杯盖未盖严,会导致热量散失,数值偏小,故C符合题意;D.NaOH溶液一次性迅速倒入可以减少实验误差,减少能量损失,故D不符合题意。④反应放出的热量和所用酸以及碱的量的多少有关,若改用60 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,放出的热量增大,但是中和热均是强酸和强碱反应生成1 mol水时放出的热,与酸碱的用量无关,所以用60 mL 0.50 mol·L-1盐酸和
50 mL 0.55 mol·L-1NaOH溶液进行反应,测得中和热数值相等。
答案:(1)环形玻璃搅拌棒(或玻璃搅拌器) 不能 金属材质易散热,使实验误差增大
(2)保温隔热、减少实验过程中的热量损失
(3)①NH3·H2O在中和过程中要吸热,导致放热较少 ②-51.8 kJ·mol-1 ③AC ④不相等 相等
16.(14分)(2024·酒泉模拟)2030年前实现碳达峰的承诺,体现了中国的大国风范。天然气的综合利用是各国科学家研究的重要课题。
(1)天然气的主要成分为甲烷,甲烷的结构式是 ,甲烷燃烧反应过程中的能量变化符合如图中的 (填字母)。
【解析】(1)甲烷的分子式为CH4,碳原子和四个氢原子形成四个共价键,则甲烷的结构式为;甲烷燃烧放热,反应物的总能量大于生成物的总能量,故反应过程中的能量变化符合a。
(2)a g CH4燃烧生成二氧化碳气体和液态水,放出热量44.5 kJ。经测定,生成的CO2与足量澄清石灰水反应得到5 g沉淀,则CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH= kJ·mol-1,其中a= 。
【解析】(2)生成的碳酸钙沉淀的物质的量为=0.05 mol,
CO2+Ca(OH)2===CaCO3↓+H2O
0.05 mol 0.05 mol
CH4(g)+2O2(g)===CO2(g)+2H2O(l)
0.05 mol 0.05 mol
0.05 mol CH4燃烧放出热量为44.5 kJ,则1 mol CH4燃烧释放的热量为44.5×20=890 kJ,故CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1;
0.05 mol CH4的质量为0.05 mol×16 g·mol-1=0.8 g。
(3)甲烷和二氧化碳重整制合成气的研究是实现碳达峰的手段之一,甲烷和二氧化碳重整制合成气的反应为CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH1
副反应I:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.5 kJ·mol-1
副反应Ⅱ:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH3
已知:部分化学键键能数据如表(1 mol CO中含有1 mol C≡O键)。
化学键 C—H C=O H—H C≡O
键能/(kJ·mol-1) 413 745 436 1 011
则ΔH1= kJ·mol-1,ΔH3= kJ·mol-1。
【解析】(3)ΔH1=反应物的总键能-生成物的总键能=4×413 kJ·mol-1+2×
745 kJ·mol-1-2×
436 kJ·mol-1-2×1 011 kJ·mol-1=+248 kJ·mol-1;根据盖斯定律得,
ΔH3=ΔH1-ΔH2=+248 kJ·mol-1-41.5 kJ·mol-1=+206.5 kJ·mol-1。
(4)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
若标准状况下用1.12 L CH4还原NO2至N2,整个过程中转移电子总数为
(阿伏加德罗常数的值用NA表示),放出的热量为 kJ。
【解析】(4)CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH3
由盖斯定律可计算:ΔH3=(ΔH1+ΔH2)×=-867 kJ·mol-1,在标准状况下1.12 L CH4的物质的量为=0.05 mol,整个过程中转移电子总数为0.05 mol×8=0.4 mol,即0.4NA,放出的热量为0.05 mol×867 kJ·mol-1=43.35 kJ·mol-1。
答案:(1) a (2)-890 0.8
(3)+248 +206.5 (4)0.4NA 43.35
17.(16分)电化学原理在工业生产中发挥着巨大的作用。
Ⅰ.Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂, 在工业上通常利用如图装置生产Na2FeO4
(1)阳极的电极反应式为 。
【解析】(1)根据图示,Cu电极为阴极,Fe电极为阳极。阳极上Fe失去电子,发生氧化反应生成Fe,电极反应式为Fe+8OH--6e-===Fe+4H2O;
(2)阴极产生的气体为 。
【解析】(2)H+的放电能力大于Na+,Cu电极上水电离产生的H+得电子产生氢气,电极反应式为2H2O+2e-===H2↑+2OH-,故阴极产生的气体为H2;
(3)右侧的离子交换膜为 (填“阴”或“阳”)离子交换膜,
阴极区a% b%(填“>” “=” 或“<”)。
【解析】(3)根据阳极电极反应式Fe+8OH--6e-===Fe+4H2O,OH-参与反应,OH-移向右侧,即右侧的离子交换膜为阴离子交换膜;根据阴极反应式2H2O+2e-===H2↑+2OH-,阴极上产生OH-,即Na+通过交换膜移向左侧,生成NaOH,氢氧化钠浓度增大,即a%
(4)Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为 。
【解析】(4)利用电解法制H2O2,在该电解池中,Ir-Ru惰性电极有吸附O2的作用,为氧气得电子发生还原反应:O2+2H++2e-===H2O2;
(5)理论上电路中每转移3 mol电子,最多可以处理废氨水中溶质(以NH3计)的质量是 g。
【解析】(5)4NH3+3O22N2+6H2O中,氨气中的氮元素从-3价变为氮气中的0价,4 mol氨气转移12 mol电子,所以转移3 mol电子,最多可以处理废氨水中溶质(以NH3计)的物质的量是1 mol,质量为1 mol×17 g·mol-1=17 g。
答案:(1)Fe+8OH--6e-===Fe+4H2O
(2)H2 (3)阴 <
(4)O2+2H++2e-===H2O2 (5)17
18.(14分)(2023·石家庄模拟)低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)C2H4(g)+2H2O(g),该反应体系的能量随反应过程的变化关系如图所示,则该反应的ΔH= (用含a、b的式子表示)。相关化学键的键能如表,实验测得上述反应的ΔH=-152 kJ·mol-1,则表中的x= 。
化学键 C=O H—H C=C C—H H—O
键能 (kJ·mol-1) x 436 764 414 464
【解析】(1)根据反应热等于正反应活化能-逆反应的活化能分析,该反应热为-(b-a)kJ·mol-1。根据反应热=反应物的键能总和-生成物的键能总和计算,有2x+3×436-×(764+414×4)-4×464=-152,解x=803。
(2)工业上用CO2和H2反应合成二甲醚。
已知:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
②CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4 kJ·mol-1
则2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH3= kJ·mol-1。
【解析】(2)根据盖斯定律分析,①CO2(g)+3H2(g)CH3OH(g)+H2O(g)
ΔH1=-53.7 kJ·mol-1,②CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4 kJ·mol-1,
有①×2-②得2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)
ΔH3=-53.7×2-23.4=-130.8 kJ·mol-1。
(3)用NA表示阿伏加德罗常数的值,在C2H2(g)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。已知1 g燃料完全燃烧时放出的热量叫作该燃料的热值,则C2H2的热值为 。
【解析】(3)NA表示阿伏加德罗常数的值,在C2H2(g)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,说明有0.5 mol乙炔反应,放出650 kJ的热量,则1 mol乙炔完全燃烧放出的热量为1 300 kJ,则C2H2的热值为=50 kJ·g-1 。
(4)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由CO2制取C的工艺如图。
①工艺过程中的能量转化形式为 。
②已知“重整系统”发生的反应中=6,则FexOy(y<8)的化学式为 ,“热分解系统”中每转移2 mol电子,需消耗FexOy mol。
【解析】(4)①工艺过程中的能量转化形式为太阳能转化为化学能。
②已知“重整系统”发生的反应中=6,根据反应中的原子守恒分析,则x∶y=6∶8,则FexOy(y<8)的化学式为Fe3O4,“热分解系统”中Fe3O4分解为FeO与O2,发生反应:2Fe3O46FeO+O2↑,每转移2 mol e-,产生0.5 mol O2,消耗1 mol Fe3O4。
答案:(1)-(b-a) kJ·mol-1 803
(2)-130.8 (3)50 kJ·g-1
(4)①太阳能转化为化学能 ②Fe3O4 1
- 12 -
同课章节目录
