水溶液中的离子反应与平衡 阶段评估检测(七)(学生版+教师版)2025年高考化学总复习(含解析)
文档属性
| 名称 | 水溶液中的离子反应与平衡 阶段评估检测(七)(学生版+教师版)2025年高考化学总复习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 626.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-06 11:46:25 | ||
图片预览


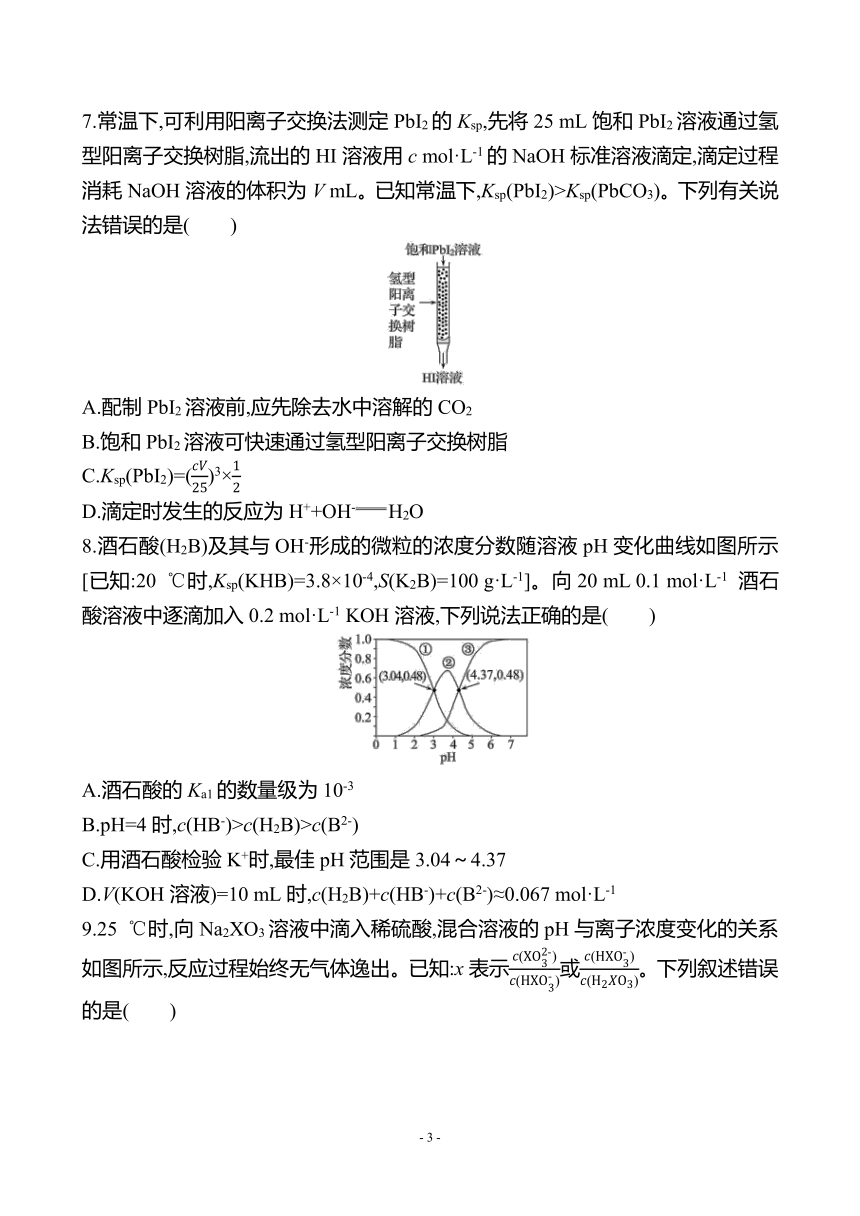
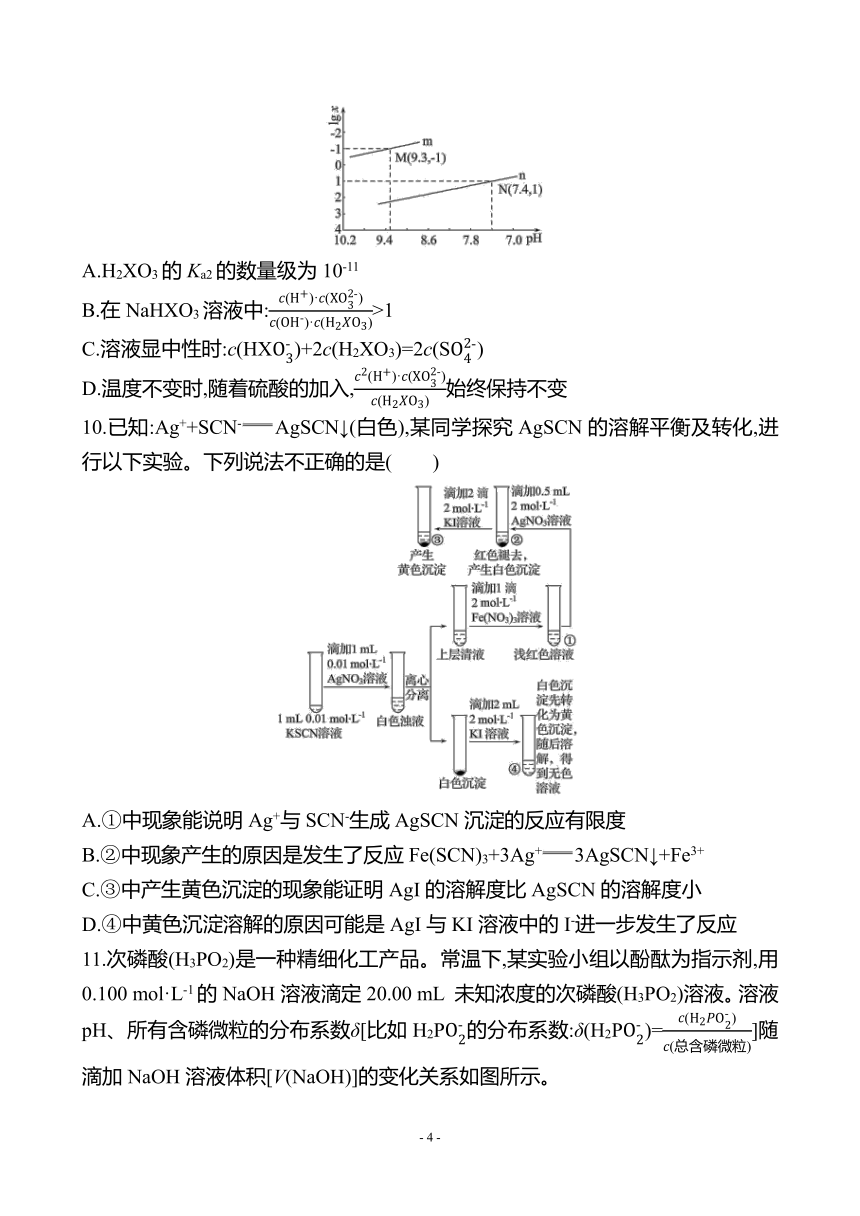
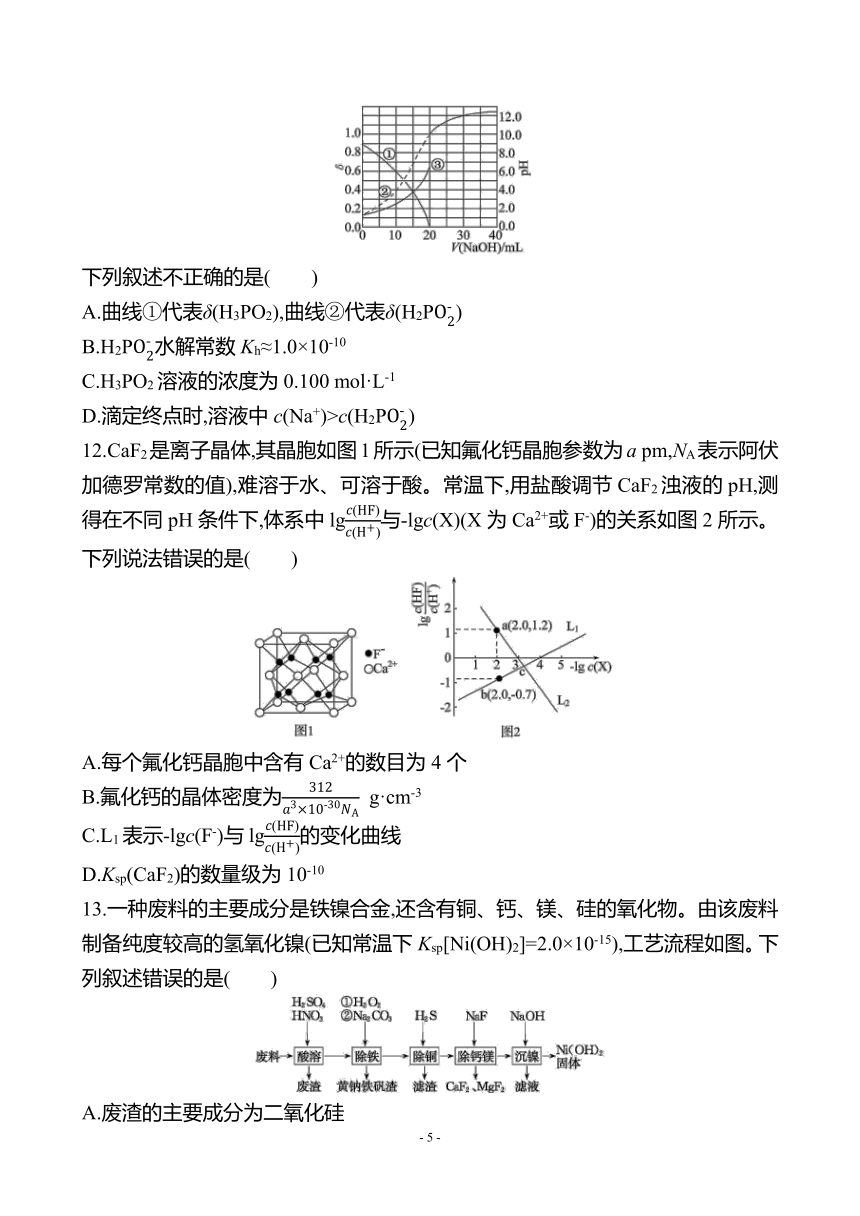
文档简介
水溶液中的离子反应与平衡 阶段评估检测(七)
(75分钟 100分)
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列有关电解质溶液的说法正确的是( )
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中减小
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中增大
C.向盐酸中加入氨水至中性,溶液中>1
D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液,所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
2.溴甲酚绿(用HBb表示)指示剂是一元弱酸,HBb为黄色,Bb-为蓝色。下列叙述正确的是( )
A.0.01 mol·L-1HBb溶液的pH=2
B.HBb溶液的pH随温度升高而减小
C.向NaOH溶液中滴加HBb指示剂,溶液显黄色
D.0.01 mol·L-1NaBb溶液中,c(H+)+c(Na+)=c(Bb-)+c(HBb)
3.联氨(N2H4)为二元弱碱,可溶于水,在水中的电离方式与氨相似。下列说法正确的是 ( )
A.联氨的电离方程式可表示为N2H4+2H2ON2+2OH-
B.联氨与硫酸形成的酸式盐的化学式为N2H5HSO4
C.联氨水溶液加水稀释,促进联氨的电离,c(OH-)增大
D.室温下,N2H6Cl2水溶液的pH<7
4.室温下,通过下列实验探究NaHSO3溶液的性质。
实验1:用pH试纸测量0.1 mol·L-1 NaHSO3溶液的pH,测得pH约为5。
实验2:向10 mL 0.1 mol·L-1 NaHSO3溶液中加入等体积0.1 mol·L-1氨水,充分混合,溶液pH约为9。
实验3:向10 mL 0.1 mol·L-1 Na2CO3溶液中滴加几滴0.1 mol·L-1 NaHSO3溶液,无明显现象。
实验4:向10 mL 0.1 mol·L-1 NaHSO3溶液中加入10 mL 0.05 mol·L-1 Ba(ClO)2溶液,产生白色沉淀。
下列有关说法正确的是( )
A.实验1可得出:Ka1(H2SO3)·Ka2(H2SO3)B.实验2所得溶液中存在:c(H+)+2c(H2SO3)+c(HS)=c(OH-)+c(NH3·H2O)
C.实验3可得出:Ka2(H2SO3)D.实验4所发生反应的离子方程式为HS+Ba2++ClO-BaSO3↓+HClO
5.室温下,下列实验探究方案不能达到实验目的的是( )
选项 探究方案 实验目的
A 向2 mL 1 mol·L-1 CH3COOH溶液中滴加1 mol·L-1 Na2CO3溶液,观察现象 比较 Ka(CH3COOH)和 Ka1(H2CO3)的大小
B 向4 mL 0.1 mol·L-1 CuSO4溶液中滴加1 mol·L-1氨水至沉淀溶解,再加入8 mL 95%乙醇,过滤 制备 [Cu(NH3)4]SO4·H2O晶体
C 把两个体积相同、密封装有等量NO2和N2O4混合气体的烧瓶分别同时浸泡在热水和冰水中,观察混合气体的颜色变化 探究温度对化学平衡的影响
D 向溶液X中滴加少量稀硝酸,然后滴入几滴Ba(NO3)2溶液,观察现象 检验溶液X是否含有S
6.向x mL 0.1mol·L-1氨水中滴加等浓度的高氯酸,测得混合溶液的温度和pOH[pOH=-lgc(OH-)]随加入高氯酸的体积变化如图所示(图中实线为温度变化,虚线为pOH变化)。下列说法错误的是( )
A.x=20
B.b、c点由水电离出的c(OH-):b>c
C.b点时溶液中:c(N)+c(NH3·H2O)=c(H+)+c(Cl)
D.a、d点对应NH3·H2O的电离常数:Kb(a)7.常温下,可利用阳离子交换法测定PbI2的Ksp,先将25 mL饱和PbI2溶液通过氢型阳离子交换树脂,流出的HI溶液用c mol·L-1的NaOH标准溶液滴定,滴定过程消耗NaOH溶液的体积为V mL。已知常温下,Ksp(PbI2)>Ksp(PbCO3)。下列有关说法错误的是( )
A.配制PbI2溶液前,应先除去水中溶解的CO2
B.饱和PbI2溶液可快速通过氢型阳离子交换树脂
C.Ksp(PbI2)=()3×
D.滴定时发生的反应为H++OH-H2O
8.酒石酸(H2B)及其与OH-形成的微粒的浓度分数随溶液pH变化曲线如图所示[已知:20 ℃时,Ksp(KHB)=3.8×10-4,S(K2B)=100 g·L-1]。向20 mL 0.1 mol·L-1 酒石酸溶液中逐滴加入0.2 mol·L-1 KOH溶液,下列说法正确的是( )
A.酒石酸的Ka1的数量级为10-3
B.pH=4时,c(HB-)>c(H2B)>c(B2-)
C.用酒石酸检验K+时,最佳pH范围是3.04~4.37
D.V(KOH溶液)=10 mL时,c(H2B)+c(HB-)+c(B2-)≈0.067 mol·L-1
9.25 ℃时,向Na2XO3溶液中滴入稀硫酸,混合溶液的pH与离子浓度变化的关系如图所示,反应过程始终无气体逸出。已知:x表示或。下列叙述错误的是( )
A.H2XO3的Ka2的数量级为10-11
B.在NaHXO3溶液中:>1
C.溶液显中性时:c(HX)+2c(H2XO3)=2c(S)
D.温度不变时,随着硫酸的加入,始终保持不变
10.已知:Ag++SCN-AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。下列说法不正确的是( )
A.①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B.②中现象产生的原因是发生了反应Fe(SCN)3+3Ag+3AgSCN↓+Fe3+
C.③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D.④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
11.次磷酸(H3PO2)是一种精细化工产品。常温下,某实验小组以酚酞为指示剂,用0.100 mol·L-1的NaOH溶液滴定20.00 mL 未知浓度的次磷酸(H3PO2)溶液。溶液pH、所有含磷微粒的分布系数δ[比如H2P的分布系数:δ(H2P)=]随滴加NaOH溶液体积[V(NaOH)]的变化关系如图所示。
下列叙述不正确的是( )
A.曲线①代表δ(H3PO2),曲线②代表δ(H2P)
B.H2P水解常数Kh≈1.0×10-10
C.H3PO2溶液的浓度为0.100 mol·L-1
D.滴定终点时,溶液中c(Na+)>c(H2P)
12.CaF2是离子晶体,其晶胞如图1所示(已知氟化钙晶胞参数为a pm,NA表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节CaF2浊液的pH,测得在不同pH条件下,体系中lg与-lgc(X)(X为Ca2+或F-)的关系如图2所示。下列说法错误的是( )
A.每个氟化钙晶胞中含有Ca2+的数目为4个
B.氟化钙的晶体密度为 g·cm-3
C.L1表示-lgc(F-)与lg的变化曲线
D.Ksp(CaF2)的数量级为10-10
13.一种废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍(已知常温下Ksp[Ni(OH)2]=2.0×10-15),工艺流程如图。下列叙述错误的是( )
A.废渣的主要成分为二氧化硅
B.黄钠铁矾渣中铁元素为+3价
C.除钙镁过程中,为了提高钙镁的去除率,氟化钠实际用量应该越多越好
D.“沉镍”过程中为了将镍沉淀完全,需要调节溶液pH>9
14.已知:AgA、Ag2B都是难溶盐。室温下,向体积均为10 mL、浓度均为0.1 mol·L-1的NaA溶液、Na2B溶液中分别滴加0.1 mol·L-1的AgNO3溶液,溶液中pX与AgNO3溶液体积的关系如图所示[已知:pX=-lgc(A-)或-lgc(B2-)]。下列推断错误的是( )
A.室温下,Ksp(Ag2B)=4×10-3a
B.对应溶液中c(Ag+):e>f
C.室温下,在等量的水中,AgA溶解的物质的量更多
D.若c(AgNO3)变为0.05 mol·L-1,则NaA溶液中的反应终点移至d点
二、非选择题:本题共4小题,共58分。
15.(14分)25 ℃时,三种酸的电离平衡常数如下表所示。
名称 醋酸 氢氟酸 草酸
化学式 CH3COOH HF H2C2O4
电离平衡常数 1.8×10-5 3.5×10-4 Ka1=5.9×10-2 Ka2=6.5×10-5
(1)三种酸由强到弱的顺序为__________。
(2)写出H2C2O4的第一步电离方程式: __________________________。
(3)将 pH 和体积均相同的CH3COOH 溶液和 HF 溶液分别稀释,其 pH 随加水体积的变化如图所示。
①稀释前c(HF)__________0.01 mol·L-1(填“>”“=”或“<”)。
②a、b 两点:c(CH3COO-)__________c(F-)(填“>”“=”或“<”)。
(4)常温下,CH3COOH 的稀释过程中,下列说法正确的是__________(填字母)。
a.减小
b.电离平衡正向移动
c.c(H+)·c(OH-)减小
d.溶液的导电能力增强
(5)浓度均为0.1 mol·L-1的下列四种溶液:
a.CH3COONa b.NaF c.Na2C2O4 d.NaHC2O4。
其 pH 由大到小顺序是______(填字母)。
16.(14分)Ⅰ.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005 mg·L-1。处理含镉废水可采用化学沉淀法。
(1)写出磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式:Ksp[Cd3(PO4)2]= ____________________。
(2)一定温度下,CdCO3的Ksp=4.0×10-12,Cd(OH)2的Ksp=3.2×10-14,该温度下____________[填“CdCO3”或“Cd(OH)2”]的饱和溶液中Cd2+浓度较大。
(3)向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol·L-1时,废水中Cd2+的浓度为__________mol·L-1[已知:Ksp(CdS)=7.9×10-27],此时__________(填“符合”或“不符合”)《生活饮用水卫生标准》。
Ⅱ.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25 ℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH <8.0 8.0~9.6 >9.6
颜色 黄色 绿色 蓝色
25 ℃时,向Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为____________。
(5)常温下,向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下,Ksp(AgCl)=1.8×10-10,忽略溶液体积的变化。
①反应后,溶液中c(Ag+)=________ mol·L-1。
②反应后,溶液的pH=__________。
③如果向反应后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,____________(填“有”或“无”)白色沉淀生成。
17.(14分)按要求回答下列问题:
(1)一定温度下,现有a.盐酸,b.硫酸,c.醋酸三种酸。
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是____________(用a、b、c表示)。
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是____________(用a、b、c表示)。
③当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 __________(用a、b、c表示)。
(2)现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如表:
滴定序号 待测液体积/mL 所消耗盐酸标准液的体积/mL
滴定前 滴定后 消耗的体积
1 25.00 0.50 26.80 26.30
2 25.00 - - -
3 25.00 5.00 31.34 26.34
①用____________式滴定管盛装0.250 0 mol·L-1 盐酸标准液。如图表示第二次滴定前后50 mL滴定管中液面的位置。
该次滴定所用标准盐酸体积为____________________mL。
②现实验室中有石蕊和酚酞两种指示剂,该实验应选用__________作指示剂。
③根据所给数据,该烧碱样品的物质的量浓度为____________。
④若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则会造成测定结果______________ (填“偏低”“偏高”或“无影响”)。
18.(16分)利用废镍电池的金属电极芯(主要成分为Co、Ni,还含少量Fe、Al等)生产醋酸钴晶体、硫酸镍晶体的工艺流程如下。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Co(OH)3 Al(OH)3 Ni(OH)2
开始沉淀的pH 2.2 7.4 7.6 0.1 4.0 7.6
完全沉淀的pH 3.2 8.9 9.2 1.1 5.2 9.2
(1)用硫酸浸取金属电极芯时,提高浸取率的方法有_____________(写出一种合理方法即可)。
(2)沉淀A的主要成分是Fe(OH)3、__________________,“浸出液”调节pH的范围为______________,调节pH选用的试剂可以是______________ (填字母)。
a.铁 b.氨水 c.碳酸钠溶液 d.稀硫酸
(3)“母液1”中加入NaClO反应的离子方程式为________________。
(4)向Co(OH)3中加入H2SO4 -H2O2混合液,H2O2的作用是________________。
(5)“母液3”中应控制Na2CO3用量,使终点pH为8.5为宜,此时c(Co2+)小于______________mol·L-1;为防止生成Co(OH)2 沉淀,可用NH4HCO3代替Na2CO3制得CoCO3,写出该反应的离子方程式: ________________。
(已知:Ksp[Co(OH)2]=2×10-15)
(6)由“母液4”获取NiSO4·7H2O的操作是______________、__________________、过滤、洗涤。
阶段评估检测(七)
(75分钟 100分)
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列有关电解质溶液的说法正确的是( )
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中减小
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中增大
C.向盐酸中加入氨水至中性,溶液中>1
D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液,所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
【解析】选D。向 CH3COOH溶液中加入少量水促进醋酸电离,n(H+)增大,n(CH3COOH)减少,则溶液中=增大,A错误;将CH3COONa溶液从20 ℃升温至30 ℃,升温促进CH3COONa的水解,使c(CH3COO-)减小,c(CH3COOH)和c(OH-)增大,则溶液中减小,B错误;向盐酸中加入氨水,溶液中存在电荷守恒:c(N)+c(H+)=c(OH-)+c(Cl-),溶液显中性时,c(H+)=c(OH-),则c(N)=c(Cl-),所以溶液中=1,C错误;若pH=2的醋酸溶液浓度为c1,Ka≈,pH=3的醋酸溶液浓度为c2,Ka≈,则有=,故c1=100c2>10c2,由于NaOH是等量的,则消耗的醋酸的物质的量相等,有c2Va=c1Vb,结合c1>10c2,故Va>10Vb,D正确。
2.溴甲酚绿(用HBb表示)指示剂是一元弱酸,HBb为黄色,Bb-为蓝色。下列叙述正确的是( )
A.0.01 mol·L-1HBb溶液的pH=2
B.HBb溶液的pH随温度升高而减小
C.向NaOH溶液中滴加HBb指示剂,溶液显黄色
D.0.01 mol·L-1NaBb溶液中,c(H+)+c(Na+)=c(Bb-)+c(HBb)
【解析】选B。A项,已知HBb指示剂是一元弱酸,HBb在溶液中部分电离,因此0.01 mol·L-1HBb溶液的pH>2,错误;B项,温度升高,HBb的电离程度增大,溶液的酸性增强,pH减小,正确;C项,向NaOH溶液中滴加HBb指示剂,二者发生酸碱中和反应产生Bb-,溶液显蓝色,错误;D项,0.01 mol·L-1NaBb溶液中,根据元素守恒可知c(Na+)=c(Bb-)+c(HBb),根据电荷守恒可知c(H+)+c(Na+)=c(Bb-)+c(OH-),错误。
3.联氨(N2H4)为二元弱碱,可溶于水,在水中的电离方式与氨相似。下列说法正确的是 ( )
A.联氨的电离方程式可表示为N2H4+2H2ON2+2OH-
B.联氨与硫酸形成的酸式盐的化学式为N2H5HSO4
C.联氨水溶液加水稀释,促进联氨的电离,c(OH-)增大
D.室温下,N2H6Cl2水溶液的pH<7
【解析】选D。A项,联氨为二元弱碱,在水中的电离方式与氨相似,联氨第一步电离方程式为N2H4+H2ON2+OH-,第二步电离方程式为N2+H2ON2+OH-,错误;B项,由联氨的第二步电离可知,联氨与硫酸形成的酸式盐的化学式为N2H6(HSO4)2,错误;C项,联氨为二元弱碱,加水稀释,促进联氨的电离,但c(OH-)减小,错误;D项,室温下,N2H6Cl2水溶液中N2发生水解反应生成H+,溶液呈酸性,pH<7,正确。
4.室温下,通过下列实验探究NaHSO3溶液的性质。
实验1:用pH试纸测量0.1 mol·L-1 NaHSO3溶液的pH,测得pH约为5。
实验2:向10 mL 0.1 mol·L-1 NaHSO3溶液中加入等体积0.1 mol·L-1氨水,充分混合,溶液pH约为9。
实验3:向10 mL 0.1 mol·L-1 Na2CO3溶液中滴加几滴0.1 mol·L-1 NaHSO3溶液,无明显现象。
实验4:向10 mL 0.1 mol·L-1 NaHSO3溶液中加入10 mL 0.05 mol·L-1 Ba(ClO)2溶液,产生白色沉淀。
下列有关说法正确的是( )
A.实验1可得出:Ka1(H2SO3)·Ka2(H2SO3)B.实验2所得溶液中存在:c(H+)+2c(H2SO3)+c(HS)=c(OH-)+c(NH3·H2O)
C.实验3可得出:Ka2(H2SO3)D.实验4所发生反应的离子方程式为HS+Ba2++ClO-BaSO3↓+HClO
【解析】选B。0.1 mol·L-1 NaHSO3溶液的pH约为5,说明HS的电离程度大于水解程度,即Ka2>Ka1=,所以Ka1·Ka2>Kw,A错误;实验2所得溶液为等浓度的Na2SO3、(NH4)2SO3混合溶液,根据质子守恒可得:c(H+)+2c(H2SO3)+c(HS)=c(OH-)+c(NH3·H2O),B正确;实验3中NaHSO3的量不足,无明显现象,不能得出Ka2(H2SO3)5.室温下,下列实验探究方案不能达到实验目的的是( )
选项 探究方案 实验目的
A 向2 mL 1 mol·L-1 CH3COOH溶液中滴加1 mol·L-1 Na2CO3溶液,观察现象 比较 Ka(CH3COOH)和 Ka1(H2CO3)的大小
B 向4 mL 0.1 mol·L-1 CuSO4溶液中滴加1 mol·L-1氨水至沉淀溶解,再加入8 mL 95%乙醇,过滤 制备 [Cu(NH3)4]SO4·H2O晶体
C 把两个体积相同、密封装有等量NO2和N2O4混合气体的烧瓶分别同时浸泡在热水和冰水中,观察混合气体的颜色变化 探究温度对化学平衡的影响
D 向溶液X中滴加少量稀硝酸,然后滴入几滴Ba(NO3)2溶液,观察现象 检验溶液X是否含有S
【解析】选D。Na2CO3和CH3COOH反应生成CO2,说明乙酸酸性强于碳酸,Ka(CH3COOH)大于Ka1(H2CO3),A项正确;实验先得到铜氨溶液,再加入8 mL 95%乙醇,[Cu(NH3)4]SO4溶解度减小,析出[Cu(NH3)4]SO4·H2O晶体,B项正确;NO2和N2O4分别为红棕色气体和无色气体,且两者的转化为可逆反应,将两个体积相同、装有等量NO2和N2O4混合气体的烧瓶分别同时浸泡在热水和冰水中,观察混合气体的颜色变化,可以判断平衡移动情况,能探究温度对化学平衡的影响,C项正确;若溶液中含有S,S会被硝酸氧化为S,S和Ba2+反应生成BaSO4沉淀,故不能检验溶液X是否含有S,D项错误。
6.向x mL 0.1mol·L-1氨水中滴加等浓度的高氯酸,测得混合溶液的温度和pOH[pOH=-lgc(OH-)]随加入高氯酸的体积变化如图所示(图中实线为温度变化,虚线为pOH变化)。下列说法错误的是( )
A.x=20
B.b、c点由水电离出的c(OH-):b>c
C.b点时溶液中:c(N)+c(NH3·H2O)=c(H+)+c(Cl)
D.a、d点对应NH3·H2O的电离常数:Kb(a)【解析】选C。
结合题图诠释①知,b点时n(HClO4)=n(NH3·H2O),则有20 mL×0.1 mol·L-1=
x mL×0.1 mol·L-1,解得x=20,A正确;盐促进水的电离,酸抑制水的电离,根据题图诠释①③可知,由水电离出的c(OH-):b>c,B正确;结合题图诠释①可知,b点溶液中存在物料守恒:c(NH3·H2O)+c(N)=c(Cl),C错误;电离常数与温度有关,升高温度,促进电离平衡正向移动,电离常数增大,由图中温度变化曲线知,温度:a点7.常温下,可利用阳离子交换法测定PbI2的Ksp,先将25 mL饱和PbI2溶液通过氢型阳离子交换树脂,流出的HI溶液用c mol·L-1的NaOH标准溶液滴定,滴定过程消耗NaOH溶液的体积为V mL。已知常温下,Ksp(PbI2)>Ksp(PbCO3)。下列有关说法错误的是( )
A.配制PbI2溶液前,应先除去水中溶解的CO2
B.饱和PbI2溶液可快速通过氢型阳离子交换树脂
C.Ksp(PbI2)=()3×
D.滴定时发生的反应为H++OH-H2O
【解析】选B。由于Ksp(PbI2)>Ksp(PbCO3),溶液中CO2转化为H2CO3,H2CO3能与PbI2反应生成更难溶的PbCO3,故配制PbI2溶液前,需先除去水中溶解的CO2,A正确;为了使饱和PbI2溶液与氢型阳离子交换树脂充分接触,饱和PbI2溶液应缓慢通过氢型阳离子交换树脂,B错误;根据题中信息可知PbI2+2H+2HI+Pb2+,HI+NaOHNaI+H2O,可得关系式Pb2+~2HI~2NaOH,则n(Pb2+)=n(NaOH),即c(Pb2+)×25×10-3 L=cV×10-3 L,解得c(Pb2+)= mol·L-1,根据PbI2(s)Pb2+(aq)+2I-(aq),即饱和PbI2溶液中c(I-)= mol·L-1,则Ksp(PbI2)=c(Pb2+)·c2(I-)=()3×,C正确;滴定时是HI与NaOH溶液反应,其离子方程式为H++OH-H2O,D正确。
8.酒石酸(H2B)及其与OH-形成的微粒的浓度分数随溶液pH变化曲线如图所示[已知:20 ℃时,Ksp(KHB)=3.8×10-4,S(K2B)=100 g·L-1]。向20 mL 0.1 mol·L-1 酒石酸溶液中逐滴加入0.2 mol·L-1 KOH溶液,下列说法正确的是( )
A.酒石酸的Ka1的数量级为10-3
B.pH=4时,c(HB-)>c(H2B)>c(B2-)
C.用酒石酸检验K+时,最佳pH范围是3.04~4.37
D.V(KOH溶液)=10 mL时,c(H2B)+c(HB-)+c(B2-)≈0.067 mol·L-1
【解析】选C。分析题图可知,①、②、③分别表示H2B、HB-、B2-的浓度分数随溶液pH的变化。A项,当pH=3.04时,c(H2B)=c(HB-),则H2B的电离常数Ka1==1×10-3.04,Ka1的数量级为10-4,错误;B项,由题图可知,pH=4时,溶液中离子的浓度大小顺序为c(HB-)>c(B2-)>c(H2B),错误;C项,由题图可知,pH在3.04~4.37,溶液中HB-浓度较大,有利于钾离子转化为酒石酸氢钾,正确;D项,当加入氢氧化钾溶液的体积为10 mL时,酒石酸溶液与氢氧化钾溶液恰好反应生成酒石酸氢钾,由酒石酸氢钾的溶度积可知,溶液中c(HB-)==
mol·L-1 ≈0.019 5 mol·L-1 ,由元素守恒可知,溶液中c(H2B)+c(HB-)+
c(B2-)≈0.019 5 mol·L-1 ,错误。
9.25 ℃时,向Na2XO3溶液中滴入稀硫酸,混合溶液的pH与离子浓度变化的关系如图所示,反应过程始终无气体逸出。已知:x表示或。下列叙述错误的是( )
A.H2XO3的Ka2的数量级为10-11
B.在NaHXO3溶液中:>1
C.溶液显中性时:c(HX)+2c(H2XO3)=2c(S)
D.温度不变时,随着硫酸的加入,始终保持不变
【解析】选B。M点对应的电离常数为10-1×10-9.3=10-10.3,N点对应的电离常数为10×10-7.4=10-6.4,根据弱电解质的第一步电离常数大于第二步电离常数,则直线m表示与pH的关系,直线n表示与pH的关系,故H2XO3的Ka2==10-1×10-9.3=10-10.3,则Ka2的数量级为10-11,A正确;NaHXO3溶液中,HX的电离常数为Ka2==10-10.3,水解常数Kh2===10-7.6,故Kh2>Ka2,即>,得出<1,B错误;溶液显中性时,依据电荷守恒可得c(HX)+2c(X)+2c(S)=c(Na+),依据元素守恒可得2c(HX)+2c(X)+2c(H2XO3)=c(Na+),两式联立消去c(Na+)可得c(HX)+2c(H2XO3)=2c(S),C正确;=Ka1·Ka2,温度不变时,Ka1、Ka2不变,所以随着硫酸的加入,始终保持不变,D正确。
10.已知:Ag++SCN-AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。下列说法不正确的是( )
A.①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B.②中现象产生的原因是发生了反应Fe(SCN)3+3Ag+3AgSCN↓+Fe3+
C.③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D.④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
【解析】选C。A.①产生浅红色溶液,说明溶液中存在SCN-,也就说明Ag+与SCN-反应存在化学平衡,因此可以说明Ag+与SCN-生成AgSCN沉淀的反应有限度,故A正确;B.②中现象为红色褪去,产生白色沉淀,说明加入AgNO3溶液与Fe(SCN)3反应生成了AgSCN,发生反应的化学方程式为Fe(SCN)3+3Ag+3AgSCN↓+Fe3+,故B正确;C.③中现象为产生黄色沉淀,加入KI溶液产生黄色沉淀,黄色沉淀为AgI,但是①→②中加入了Ag+,可以直接与I-反应生成AgI,不能说明是由AgSCN转化而来,也就不能说明AgI的溶解度比AgSCN的溶解度小,故C错误;D.④中现象为白色沉淀先转化为黄色沉淀,随后溶解得到无色溶液,产生黄色沉淀是AgSCN转化为AgI,得到无色溶液则可能是Ag+与I-进一步发生配位反应,故D正确。
11.次磷酸(H3PO2)是一种精细化工产品。常温下,某实验小组以酚酞为指示剂,用0.100 mol·L-1的NaOH溶液滴定20.00 mL 未知浓度的次磷酸(H3PO2)溶液。溶液pH、所有含磷微粒的分布系数δ[比如H2P的分布系数:δ(H2P)=]随滴加NaOH溶液体积[V(NaOH)]的变化关系如图所示。
下列叙述不正确的是( )
A.曲线①代表δ(H3PO2),曲线②代表δ(H2P)
B.H2P水解常数Kh≈1.0×10-10
C.H3PO2溶液的浓度为0.100 mol·L-1
D.滴定终点时,溶液中c(Na+)>c(H2P)
【解析】选B。分析随着NaOH溶液的加入相关曲线的变化,可知含磷微粒只有2种,曲线①表示随着NaOH溶液的加入,相关粒子的分布系数越来越小,当加入的NaOH溶液的体积达到20 mL 时,曲线①代表的粒子恰好完全反应,推知曲线①代表δ(H3PO2),曲线②代表的粒子的分布系数随着NaOH溶液的加入逐渐增大,故曲线②代表δ(H2P),曲线③代表溶液pH随滴加NaOH溶液体积的变化,当加入NaOH溶液的体积达到20 mL 时,酸碱恰好完全反应,结合起点溶液的pH,可推出H3PO2为一元弱酸,A正确;由曲线①②交点可知,c(H3PO2)=c(H2P),对应曲线③pH≈3,即c(H+)≈10-3 mol·L-1,Ka(H3PO2)=≈10-3,故H2P的水解常数Kh=≈1.0×10-11,B错误;H3PO2为一元弱酸,达到滴定终点时n(NaOH)=n(H3PO2),即c(NaOH)·V(NaOH)=c(H3PO2)·V(H3PO2),由V(NaOH)=20 mL 时达到滴定终点可知,次磷酸溶液的浓度为0.100 mol·L-1,C正确;由溶液中的电荷守恒得c(Na+)+c(H+)=c(H2P)+c(OH-),酚酞作指示剂,滴定终点时溶液呈碱性,即c(OH-)>c(H+),推知c(Na+)>c(H2P),D正确。
12.CaF2是离子晶体,其晶胞如图1所示(已知氟化钙晶胞参数为a pm,NA表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节CaF2浊液的pH,测得在不同pH条件下,体系中lg与-lgc(X)(X为Ca2+或F-)的关系如图2所示。下列说法错误的是( )
A.每个氟化钙晶胞中含有Ca2+的数目为4个
B.氟化钙的晶体密度为 g·cm-3
C.L1表示-lgc(F-)与lg的变化曲线
D.Ksp(CaF2)的数量级为10-10
【解析】选C。已知HF的Ka=,则有=,即有lg越大,c(F-)越大,lgc(F-)越大,-lgc(F-)越小,c(F-)越大,c(Ca2+)越小,则-lgc(Ca2+)越大,故可知L1代表-lgc(Ca2+)的变化曲线,L2代表-lgc(F-)的变化曲线。A.每个氟化钙晶胞中含有Ca2+的数目为8×+6×=4,故A正确;B.晶胞体积V=(a×10-10 cm)3,该晶胞中相当于含有4个CaF2,晶胞质量为m= g,则氟化钙的密度ρ== g·cm-3,故B正确;C.由分析可知,L1表示-lgc(Ca2+)与lg的变化曲线,故C错误;D.由a点坐标可知,==101.2,c(F-)=10-2 mol·L-1,则Ka==10-3.2,由b点坐标可知,c(Ca2+)=10-2 mol·L-1 ,此时=10-0.7,故可求出此时溶液中c(F-)=10-0.7×10-3.2=10-3.9 mol·L-1,故Ksp(CaF2)=c(Ca2+)c2(F-)=10-2×(10-3.9)2=10-9.8,故其数量级为10-10,故D正确。
13.一种废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍(已知常温下Ksp[Ni(OH)2]=2.0×10-15),工艺流程如图。下列叙述错误的是( )
A.废渣的主要成分为二氧化硅
B.黄钠铁矾渣中铁元素为+3价
C.除钙镁过程中,为了提高钙镁的去除率,氟化钠实际用量应该越多越好
D.“沉镍”过程中为了将镍沉淀完全,需要调节溶液pH>9
【解析】选C。酸溶后过滤所得废渣的主要成分为二氧化硅,A正确;双氧水具有强氧化性,加入双氧水将Fe2+全部氧化为Fe3+,所以黄钠铁矾渣中铁元素为+3价,B正确;根据流程图可知除铜后的滤液应显酸性,若NaF的用量过大,会生成剧毒物质HF,污染环境,还会浪费原料、增加成本,故氟化钠的用量不是越多越好,C错误;Ksp[Ni(OH)2]=c(Ni2+)c2(OH-)=1.0×10-5×c2(OH-)=2.0×10-15,则c(OH-)=×10-5 mol·L-1,c(H+)=×10-9 mol·L-1,则“沉镍”过程中为了将镍沉淀完全,需要调节溶液pH>9,D正确。
14.已知:AgA、Ag2B都是难溶盐。室温下,向体积均为10 mL、浓度均为0.1 mol·L-1的NaA溶液、Na2B溶液中分别滴加0.1 mol·L-1的AgNO3溶液,溶液中pX与AgNO3溶液体积的关系如图所示[已知:pX=-lgc(A-)或-lgc(B2-)]。下列推断错误的是( )
A.室温下,Ksp(Ag2B)=4×10-3a
B.对应溶液中c(Ag+):e>f
C.室温下,在等量的水中,AgA溶解的物质的量更多
D.若c(AgNO3)变为0.05 mol·L-1,则NaA溶液中的反应终点移至d点
【解析】选C。由题图可知,室温下,加入10 mL硝酸银溶液时,NaA溶液完全反应得到AgA饱和溶液,溶液中A-和Ag+浓度都为10-b mol·L-1,AgA的溶度积为1,加入20 mL硝酸银溶液时,Na2B溶液完全反应得到Ag2B饱和溶液,溶液中B2-浓度为10-a mol·L-1、Ag+为2×10-a mol·L-1,Ag2B的溶度积为4×1,以此解题。
由分析可知,室温下,Ksp(Ag2B)=4×1,A正确;由图可知,f点时Na2B过量,e点时Na2B恰好完全反应,由温度不变,溶度积不变可知,e点Ag+浓度大于f点,B正确;由题图可知,AgA饱和溶液中A-的浓度小于Ag2B饱和溶液中B2-的浓度,故在等量的水中,AgA溶解的物质的量更少,C错误;若c(AgNO3)变为0.05 mol·L-1,则加入20 mL硝酸银溶液时,NaA完全反应得到AgA饱和溶液,由温度不变,溶度积不变可知,溶液中Ag+的浓度不变,则NaA溶液中的反应终点c移至d点,D正确。
二、非选择题:本题共4小题,共58分。
15.(14分)25 ℃时,三种酸的电离平衡常数如下表所示。
名称 醋酸 氢氟酸 草酸
化学式 CH3COOH HF H2C2O4
电离平衡常数 1.8×10-5 3.5×10-4 Ka1=5.9×10-2 Ka2=6.5×10-5
(1)三种酸由强到弱的顺序为__________。
【解析】(1)由电离平衡常数判断,酸的电离平衡常数越大,酸的酸性越强,酸性强弱为H2C2O4>HF>CH3COOH。
(2)写出H2C2O4的第一步电离方程式: __________________________。
【解析】(2)H2C2O4为二元弱酸,溶液中分步电离,第一步电离方程式:H2C2O4HC2+H+。
(3)将 pH 和体积均相同的CH3COOH 溶液和 HF 溶液分别稀释,其 pH 随加水体积的变化如图所示。
①稀释前c(HF)__________0.01 mol·L-1(填“>”“=”或“<”)。
②a、b 两点:c(CH3COO-)__________c(F-)(填“>”“=”或“<”)。
【解析】(3)①HF为弱酸,存在电离平衡,稀释前溶液pH=2,则稀释前c(HF)>
0.01 mol·L-1;
②两种酸稀释前pH相同,稀释相同倍数,a、b两点,a点溶液中c(F-)、c(H+)较小,c(CH3COO-)>c(F-)。
(4)常温下,CH3COOH 的稀释过程中,下列说法正确的是__________(填字母)。
a.减小
b.电离平衡正向移动
c.c(H+)·c(OH-)减小
d.溶液的导电能力增强
【解析】(4)a.=Ka,温度不变,比值不变,故a错误; b.稀释促进电离,电离平衡正向移动,故b正确; c.c(H+)·c(OH-)=Kw,温度不变,乘积不变,故c错误; d.溶液稀释,离子浓度减小,导电性减弱,故d错误;
(5)浓度均为0.1 mol·L-1的下列四种溶液:
a.CH3COONa b.NaF c.Na2C2O4 d.NaHC2O4。
其 pH 由大到小顺序是______(填字母)。
【解析】(5)电离常数Ka越大,酸性越强,则酸性为H2C2O4>HF>HC2>CH3COOH,
a.CH3COONa、b.NaF、c.Na2C2O4、d.NaHC2O4均为强碱弱酸盐,水解程度为CH3COONa>Na2C2O4>NaF>NaHC2O4,盐溶液pH大小:a>c>b>d。
答案:(1)H2C2O4>HF>CH3COOH (2)H2C2O4HC2+H+
(3)①> ②> (4)b (5)a>c>b>d
16.(14分)Ⅰ.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005 mg·L-1。处理含镉废水可采用化学沉淀法。
(1)写出磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式:Ksp[Cd3(PO4)2]= ____________________。
【解析】(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式:Ksp[Cd3(PO4)2]=
c3(Cd2+)·c2(P)。
(2)一定温度下,CdCO3的Ksp=4.0×10-12,Cd(OH)2的Ksp=3.2×10-14,该温度下____________[填“CdCO3”或“Cd(OH)2”]的饱和溶液中Cd2+浓度较大。
【解析】(2)当CdCO3达到沉淀溶解平衡时有CdCO3(s)Cd2+(aq)+C(aq),则该温度下CdCO3饱和溶液中c(Cd2+)== mol·L-1
=2.0×10-6 mol·L-1,当Cd(OH)2达到沉淀溶解平衡时有Cd(OH)2(s)Cd2+(aq)+2OH-(aq),则该温度下Cd(OH)2饱和溶液中c(Cd2+)=
= mol·L-1=2.0×10-5 mol·L-1,则Cd(OH)2的饱和溶液中Cd2+浓度较大。
(3)向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol·L-1时,废水中Cd2+的浓度为__________mol·L-1[已知:Ksp(CdS)=7.9×10-27],此时__________(填“符合”或“不符合”)《生活饮用水卫生标准》。
【解析】(3)当c(S2-)=7.9×10-8 mol·L-1时,c(Cd2+)= mol·L-1=1.0×
10-19 mol·L-1=10-19×112×103 mg·L-1<0.005 mg·L-1,符合《生活饮用水卫生标准》。
Ⅱ.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25 ℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH <8.0 8.0~9.6 >9.6
颜色 黄色 绿色 蓝色
25 ℃时,向Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为____________。
【解析】(4)25 ℃时,Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-)=5.6×10-12,设Mg(OH)2饱和溶液中c(OH-)=x mol·L-1,则0.5x×x2=5.6×10-12,解得x≈2.24×10-4;c(H+)=
mol·L-1≈4.5×10-11 mol·L-1,pH≈10.4>9.6,所以溶液呈蓝色。
(5)常温下,向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下,Ksp(AgCl)=1.8×10-10,忽略溶液体积的变化。
①反应后,溶液中c(Ag+)=________ mol·L-1。
②反应后,溶液的pH=__________。
③如果向反应后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,____________(填“有”或“无”)白色沉淀生成。
【解析】(5)①常温下,向50 mL 0.018 mol·L-1的AgNO3溶液中加入
50 mL 0.020 mol·L-1的盐酸,反应后溶液中c(Cl-)= mol·L-1=
10-3 mol·L-1,则溶液中c(Ag+)== mol·L-1=1.8×10-7 mol·L-1;
②反应后,溶液中c(H+)==0.010 mol·L-1,则溶液的pH=-lgc(H+)=2;
③再向反应后的溶液中加入50 mL 0.001 mol·L-1盐酸,溶液中c(Ag+)=×1.8×
10-7 mol·L-1=1.2×10-7 mol·L-1、c(Cl-)=10-3 mol·L-1,Q=10-3×1.2×10-7=1.2×10-10<1.8×
10-10,故无沉淀产生。
答案:(1)c3(Cd2+)·c2(P)
(2)Cd(OH)2 (3)1.0×10-19 符合
(4)蓝色 (5)①1.8×10-7 ②2 ③无
17.(14分)按要求回答下列问题:
(1)一定温度下,现有a.盐酸,b.硫酸,c.醋酸三种酸。
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是____________(用a、b、c表示)。
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是____________(用a、b、c表示)。
③当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 __________(用a、b、c表示)。
【解析】(1)①三种酸体积相同、物质的量浓度也相同,即物质的量相同,盐酸和醋酸都是一元酸,和NaOH完全中和时,需要的NaOH的物质的量相等,所以盐酸和醋酸消耗的氢氧化钠的物质的量相等;硫酸是二元酸,和NaOH完全中和时,需要的NaOH的物质的量是硫酸的物质的量的2倍,所以三种酸和NaOH恰好完全中和,所需NaOH的物质的量由大到小的顺序是b>a=c;
②三者c(H+)相同时 ,由于醋酸是弱酸,醋酸的浓度要大于盐酸的浓度,所以当盐酸和醋酸体积相同时,醋酸的物质的量大于盐酸的物质的量,和足量的锌反应时,醋酸生成氢气的物质的量大于盐酸生成氢气的物质的量。盐酸和硫酸都是强酸,完全电离,H+的物质的量相等,和足量的锌反应,生成氢气的物质的量相等。相同状况下,气体体积和气体的物质的量成正比,所以相同状况下产生气体的体积由大到小的顺序是c>a=b;
③形状、密度、质量完全相同的锌和三种酸反应,反应的实质是锌和H+反应,反应速率由c(H+)决定,所以三种酸溶液中c(H+)相同时,开始时反应速率相等,即a=b=c。
(2)现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如表:
滴定序号 待测液体积/mL 所消耗盐酸标准液的体积/mL
滴定前 滴定后 消耗的体积
1 25.00 0.50 26.80 26.30
2 25.00 - - -
3 25.00 5.00 31.34 26.34
①用____________式滴定管盛装0.250 0 mol·L-1 盐酸标准液。如图表示第二次滴定前后50 mL滴定管中液面的位置。
该次滴定所用标准盐酸体积为____________________mL。
【解析】(2)①盐酸要用酸式滴定管盛装。从滴定管液面可以看出,滴定前液面在0.30 mL处,滴定后液面在24.90 mL处,所以该次滴定所用标准盐酸溶液的体积为24.60 mL;
②现实验室中有石蕊和酚酞两种指示剂,该实验应选用__________作指示剂。
【解析】(2)②石蕊颜色变化不明显,通常不用作酸碱中和滴定的指示剂,应选用酚酞作指示剂;
③根据所给数据,该烧碱样品的物质的量浓度为____________。
【解析】(2)③分析三组数据,消耗盐酸的体积中的第二组数据和其他两组差别较大,舍去,第一组和第三组消耗盐酸的体积的平均值为26.32 mL,盐酸和NaOH等物质的量反应,所以有0.250 0 mol·L-1 ×0.026 32 L=c(NaOH)×0.025 00 L,可计算出c(NaOH)=0.263 2 mol·L-1 ;
④若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则会造成测定结果______________ (填“偏低”“偏高”或“无影响”)。
【解析】(2)④滴定操作开始时滴加盐酸的速率可以快一些,当快达到滴定终点时,一定要逐滴滴入,直到指示剂颜色改变,且摇动半分钟颜色不恢复,才可以停止滴定,等液面稳定之后再读数。若操作过程中滴加盐酸速率过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则滴入的盐酸的体积偏小,会造成测定结果偏低。
答案:(1)①b>a=c ②c>a=b
③a=b=c (2)①酸 24.60 ②酚酞
③0.263 2 mol·L-1 ④偏低
18.(16分)利用废镍电池的金属电极芯(主要成分为Co、Ni,还含少量Fe、Al等)生产醋酸钴晶体、硫酸镍晶体的工艺流程如下。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Co(OH)3 Al(OH)3 Ni(OH)2
开始沉淀的pH 2.2 7.4 7.6 0.1 4.0 7.6
完全沉淀的pH 3.2 8.9 9.2 1.1 5.2 9.2
(1)用硫酸浸取金属电极芯时,提高浸取率的方法有_____________(写出一种合理方法即可)。
【解析】(1)提高浸取率的措施有将金属电极芯研成粉末,增大反应物的接触面积、充分搅拌、适当升高温度、适当增大硫酸浓度、延长浸取时间等。
(2)沉淀A的主要成分是Fe(OH)3、__________________,“浸出液”调节pH的范围为______________,调节pH选用的试剂可以是______________ (填字母)。
a.铁 b.氨水 c.碳酸钠溶液 d.稀硫酸
【解析】(2)由上述分析知,沉淀A的主要成分是Al(OH)3和Fe(OH)3,调节“浸出液”的pH,使Al3+和Fe3+沉淀完全,但Co2+和Ni2+不沉淀,由表中数据可知,调节pH范围为5.2≤pH<7.6;为中和溶液中的酸且不引入杂质,可用氨水或碳酸钠溶液调节pH。
(3)“母液1”中加入NaClO反应的离子方程式为________________。
【解析】(3)母液1中加入NaClO的目的是将Co2+氧化成Co3+,并形成Co(OH)3沉淀,故离子反应方程式为ClO-+2Co2++5H2O===2Co(OH)3↓+Cl-+4H+。
(4)向Co(OH)3中加入H2SO4 -H2O2混合液,H2O2的作用是________________。
【解析】(4)由流程图可知,加入H2O2的作用是将Co3+还原成Co2+,即H2O2作还原剂。
(5)“母液3”中应控制Na2CO3用量,使终点pH为8.5为宜,此时c(Co2+)小于______________mol·L-1;为防止生成Co(OH)2 沉淀,可用NH4HCO3代替Na2CO3制得CoCO3,写出该反应的离子方程式: ________________。
(已知:Ksp[Co(OH)2]=2×10-15)
【解析】(5)pH=8.5,即c(H+)=10-8.5 mol·L-1,c(OH-)=10-5.5 mol·L-1,则由Ksp[Co(OH)2]=2×10-15=c(Co2+)·c2(OH-),可得c(Co2+)<2×10-4 mol·L-1;反应物为HC和Co2+,生成物中含CoCO3,则反应的离子方程式为2HC+Co2+===CoCO3↓+CO2↑+H2O。
(6)由“母液4”获取NiSO4·7H2O的操作是______________、__________________、过滤、洗涤。
【解析】(6)由母液4获得NiSO4·7H2O的操作为蒸发浓缩、冷却结晶、过滤、洗涤。
答案:(1)适当升高温度(或将金属电极芯研成粉末等) (2)Al(OH)3 5.2≤pH<7.6 bc
(3)ClO-+2Co2++5H2O===2Co(OH)3↓+Cl-+4H+
(4)作还原剂 (5)2×10-4 2HC+Co2+===CoCO3↓+CO2↑+H2O (6)蒸发浓缩 冷却结晶
- 17 -
(75分钟 100分)
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列有关电解质溶液的说法正确的是( )
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中减小
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中增大
C.向盐酸中加入氨水至中性,溶液中>1
D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液,所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
2.溴甲酚绿(用HBb表示)指示剂是一元弱酸,HBb为黄色,Bb-为蓝色。下列叙述正确的是( )
A.0.01 mol·L-1HBb溶液的pH=2
B.HBb溶液的pH随温度升高而减小
C.向NaOH溶液中滴加HBb指示剂,溶液显黄色
D.0.01 mol·L-1NaBb溶液中,c(H+)+c(Na+)=c(Bb-)+c(HBb)
3.联氨(N2H4)为二元弱碱,可溶于水,在水中的电离方式与氨相似。下列说法正确的是 ( )
A.联氨的电离方程式可表示为N2H4+2H2ON2+2OH-
B.联氨与硫酸形成的酸式盐的化学式为N2H5HSO4
C.联氨水溶液加水稀释,促进联氨的电离,c(OH-)增大
D.室温下,N2H6Cl2水溶液的pH<7
4.室温下,通过下列实验探究NaHSO3溶液的性质。
实验1:用pH试纸测量0.1 mol·L-1 NaHSO3溶液的pH,测得pH约为5。
实验2:向10 mL 0.1 mol·L-1 NaHSO3溶液中加入等体积0.1 mol·L-1氨水,充分混合,溶液pH约为9。
实验3:向10 mL 0.1 mol·L-1 Na2CO3溶液中滴加几滴0.1 mol·L-1 NaHSO3溶液,无明显现象。
实验4:向10 mL 0.1 mol·L-1 NaHSO3溶液中加入10 mL 0.05 mol·L-1 Ba(ClO)2溶液,产生白色沉淀。
下列有关说法正确的是( )
A.实验1可得出:Ka1(H2SO3)·Ka2(H2SO3)
C.实验3可得出:Ka2(H2SO3)
5.室温下,下列实验探究方案不能达到实验目的的是( )
选项 探究方案 实验目的
A 向2 mL 1 mol·L-1 CH3COOH溶液中滴加1 mol·L-1 Na2CO3溶液,观察现象 比较 Ka(CH3COOH)和 Ka1(H2CO3)的大小
B 向4 mL 0.1 mol·L-1 CuSO4溶液中滴加1 mol·L-1氨水至沉淀溶解,再加入8 mL 95%乙醇,过滤 制备 [Cu(NH3)4]SO4·H2O晶体
C 把两个体积相同、密封装有等量NO2和N2O4混合气体的烧瓶分别同时浸泡在热水和冰水中,观察混合气体的颜色变化 探究温度对化学平衡的影响
D 向溶液X中滴加少量稀硝酸,然后滴入几滴Ba(NO3)2溶液,观察现象 检验溶液X是否含有S
6.向x mL 0.1mol·L-1氨水中滴加等浓度的高氯酸,测得混合溶液的温度和pOH[pOH=-lgc(OH-)]随加入高氯酸的体积变化如图所示(图中实线为温度变化,虚线为pOH变化)。下列说法错误的是( )
A.x=20
B.b、c点由水电离出的c(OH-):b>c
C.b点时溶液中:c(N)+c(NH3·H2O)=c(H+)+c(Cl)
D.a、d点对应NH3·H2O的电离常数:Kb(a)
A.配制PbI2溶液前,应先除去水中溶解的CO2
B.饱和PbI2溶液可快速通过氢型阳离子交换树脂
C.Ksp(PbI2)=()3×
D.滴定时发生的反应为H++OH-H2O
8.酒石酸(H2B)及其与OH-形成的微粒的浓度分数随溶液pH变化曲线如图所示[已知:20 ℃时,Ksp(KHB)=3.8×10-4,S(K2B)=100 g·L-1]。向20 mL 0.1 mol·L-1 酒石酸溶液中逐滴加入0.2 mol·L-1 KOH溶液,下列说法正确的是( )
A.酒石酸的Ka1的数量级为10-3
B.pH=4时,c(HB-)>c(H2B)>c(B2-)
C.用酒石酸检验K+时,最佳pH范围是3.04~4.37
D.V(KOH溶液)=10 mL时,c(H2B)+c(HB-)+c(B2-)≈0.067 mol·L-1
9.25 ℃时,向Na2XO3溶液中滴入稀硫酸,混合溶液的pH与离子浓度变化的关系如图所示,反应过程始终无气体逸出。已知:x表示或。下列叙述错误的是( )
A.H2XO3的Ka2的数量级为10-11
B.在NaHXO3溶液中:>1
C.溶液显中性时:c(HX)+2c(H2XO3)=2c(S)
D.温度不变时,随着硫酸的加入,始终保持不变
10.已知:Ag++SCN-AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。下列说法不正确的是( )
A.①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B.②中现象产生的原因是发生了反应Fe(SCN)3+3Ag+3AgSCN↓+Fe3+
C.③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D.④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
11.次磷酸(H3PO2)是一种精细化工产品。常温下,某实验小组以酚酞为指示剂,用0.100 mol·L-1的NaOH溶液滴定20.00 mL 未知浓度的次磷酸(H3PO2)溶液。溶液pH、所有含磷微粒的分布系数δ[比如H2P的分布系数:δ(H2P)=]随滴加NaOH溶液体积[V(NaOH)]的变化关系如图所示。
下列叙述不正确的是( )
A.曲线①代表δ(H3PO2),曲线②代表δ(H2P)
B.H2P水解常数Kh≈1.0×10-10
C.H3PO2溶液的浓度为0.100 mol·L-1
D.滴定终点时,溶液中c(Na+)>c(H2P)
12.CaF2是离子晶体,其晶胞如图1所示(已知氟化钙晶胞参数为a pm,NA表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节CaF2浊液的pH,测得在不同pH条件下,体系中lg与-lgc(X)(X为Ca2+或F-)的关系如图2所示。下列说法错误的是( )
A.每个氟化钙晶胞中含有Ca2+的数目为4个
B.氟化钙的晶体密度为 g·cm-3
C.L1表示-lgc(F-)与lg的变化曲线
D.Ksp(CaF2)的数量级为10-10
13.一种废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍(已知常温下Ksp[Ni(OH)2]=2.0×10-15),工艺流程如图。下列叙述错误的是( )
A.废渣的主要成分为二氧化硅
B.黄钠铁矾渣中铁元素为+3价
C.除钙镁过程中,为了提高钙镁的去除率,氟化钠实际用量应该越多越好
D.“沉镍”过程中为了将镍沉淀完全,需要调节溶液pH>9
14.已知:AgA、Ag2B都是难溶盐。室温下,向体积均为10 mL、浓度均为0.1 mol·L-1的NaA溶液、Na2B溶液中分别滴加0.1 mol·L-1的AgNO3溶液,溶液中pX与AgNO3溶液体积的关系如图所示[已知:pX=-lgc(A-)或-lgc(B2-)]。下列推断错误的是( )
A.室温下,Ksp(Ag2B)=4×10-3a
B.对应溶液中c(Ag+):e>f
C.室温下,在等量的水中,AgA溶解的物质的量更多
D.若c(AgNO3)变为0.05 mol·L-1,则NaA溶液中的反应终点移至d点
二、非选择题:本题共4小题,共58分。
15.(14分)25 ℃时,三种酸的电离平衡常数如下表所示。
名称 醋酸 氢氟酸 草酸
化学式 CH3COOH HF H2C2O4
电离平衡常数 1.8×10-5 3.5×10-4 Ka1=5.9×10-2 Ka2=6.5×10-5
(1)三种酸由强到弱的顺序为__________。
(2)写出H2C2O4的第一步电离方程式: __________________________。
(3)将 pH 和体积均相同的CH3COOH 溶液和 HF 溶液分别稀释,其 pH 随加水体积的变化如图所示。
①稀释前c(HF)__________0.01 mol·L-1(填“>”“=”或“<”)。
②a、b 两点:c(CH3COO-)__________c(F-)(填“>”“=”或“<”)。
(4)常温下,CH3COOH 的稀释过程中,下列说法正确的是__________(填字母)。
a.减小
b.电离平衡正向移动
c.c(H+)·c(OH-)减小
d.溶液的导电能力增强
(5)浓度均为0.1 mol·L-1的下列四种溶液:
a.CH3COONa b.NaF c.Na2C2O4 d.NaHC2O4。
其 pH 由大到小顺序是______(填字母)。
16.(14分)Ⅰ.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005 mg·L-1。处理含镉废水可采用化学沉淀法。
(1)写出磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式:Ksp[Cd3(PO4)2]= ____________________。
(2)一定温度下,CdCO3的Ksp=4.0×10-12,Cd(OH)2的Ksp=3.2×10-14,该温度下____________[填“CdCO3”或“Cd(OH)2”]的饱和溶液中Cd2+浓度较大。
(3)向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol·L-1时,废水中Cd2+的浓度为__________mol·L-1[已知:Ksp(CdS)=7.9×10-27],此时__________(填“符合”或“不符合”)《生活饮用水卫生标准》。
Ⅱ.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25 ℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH <8.0 8.0~9.6 >9.6
颜色 黄色 绿色 蓝色
25 ℃时,向Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为____________。
(5)常温下,向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下,Ksp(AgCl)=1.8×10-10,忽略溶液体积的变化。
①反应后,溶液中c(Ag+)=________ mol·L-1。
②反应后,溶液的pH=__________。
③如果向反应后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,____________(填“有”或“无”)白色沉淀生成。
17.(14分)按要求回答下列问题:
(1)一定温度下,现有a.盐酸,b.硫酸,c.醋酸三种酸。
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是____________(用a、b、c表示)。
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是____________(用a、b、c表示)。
③当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 __________(用a、b、c表示)。
(2)现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如表:
滴定序号 待测液体积/mL 所消耗盐酸标准液的体积/mL
滴定前 滴定后 消耗的体积
1 25.00 0.50 26.80 26.30
2 25.00 - - -
3 25.00 5.00 31.34 26.34
①用____________式滴定管盛装0.250 0 mol·L-1 盐酸标准液。如图表示第二次滴定前后50 mL滴定管中液面的位置。
该次滴定所用标准盐酸体积为____________________mL。
②现实验室中有石蕊和酚酞两种指示剂,该实验应选用__________作指示剂。
③根据所给数据,该烧碱样品的物质的量浓度为____________。
④若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则会造成测定结果______________ (填“偏低”“偏高”或“无影响”)。
18.(16分)利用废镍电池的金属电极芯(主要成分为Co、Ni,还含少量Fe、Al等)生产醋酸钴晶体、硫酸镍晶体的工艺流程如下。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Co(OH)3 Al(OH)3 Ni(OH)2
开始沉淀的pH 2.2 7.4 7.6 0.1 4.0 7.6
完全沉淀的pH 3.2 8.9 9.2 1.1 5.2 9.2
(1)用硫酸浸取金属电极芯时,提高浸取率的方法有_____________(写出一种合理方法即可)。
(2)沉淀A的主要成分是Fe(OH)3、__________________,“浸出液”调节pH的范围为______________,调节pH选用的试剂可以是______________ (填字母)。
a.铁 b.氨水 c.碳酸钠溶液 d.稀硫酸
(3)“母液1”中加入NaClO反应的离子方程式为________________。
(4)向Co(OH)3中加入H2SO4 -H2O2混合液,H2O2的作用是________________。
(5)“母液3”中应控制Na2CO3用量,使终点pH为8.5为宜,此时c(Co2+)小于______________mol·L-1;为防止生成Co(OH)2 沉淀,可用NH4HCO3代替Na2CO3制得CoCO3,写出该反应的离子方程式: ________________。
(已知:Ksp[Co(OH)2]=2×10-15)
(6)由“母液4”获取NiSO4·7H2O的操作是______________、__________________、过滤、洗涤。
阶段评估检测(七)
(75分钟 100分)
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列有关电解质溶液的说法正确的是( )
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中减小
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中增大
C.向盐酸中加入氨水至中性,溶液中>1
D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液,所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
【解析】选D。向 CH3COOH溶液中加入少量水促进醋酸电离,n(H+)增大,n(CH3COOH)减少,则溶液中=增大,A错误;将CH3COONa溶液从20 ℃升温至30 ℃,升温促进CH3COONa的水解,使c(CH3COO-)减小,c(CH3COOH)和c(OH-)增大,则溶液中减小,B错误;向盐酸中加入氨水,溶液中存在电荷守恒:c(N)+c(H+)=c(OH-)+c(Cl-),溶液显中性时,c(H+)=c(OH-),则c(N)=c(Cl-),所以溶液中=1,C错误;若pH=2的醋酸溶液浓度为c1,Ka≈,pH=3的醋酸溶液浓度为c2,Ka≈,则有=,故c1=100c2>10c2,由于NaOH是等量的,则消耗的醋酸的物质的量相等,有c2Va=c1Vb,结合c1>10c2,故Va>10Vb,D正确。
2.溴甲酚绿(用HBb表示)指示剂是一元弱酸,HBb为黄色,Bb-为蓝色。下列叙述正确的是( )
A.0.01 mol·L-1HBb溶液的pH=2
B.HBb溶液的pH随温度升高而减小
C.向NaOH溶液中滴加HBb指示剂,溶液显黄色
D.0.01 mol·L-1NaBb溶液中,c(H+)+c(Na+)=c(Bb-)+c(HBb)
【解析】选B。A项,已知HBb指示剂是一元弱酸,HBb在溶液中部分电离,因此0.01 mol·L-1HBb溶液的pH>2,错误;B项,温度升高,HBb的电离程度增大,溶液的酸性增强,pH减小,正确;C项,向NaOH溶液中滴加HBb指示剂,二者发生酸碱中和反应产生Bb-,溶液显蓝色,错误;D项,0.01 mol·L-1NaBb溶液中,根据元素守恒可知c(Na+)=c(Bb-)+c(HBb),根据电荷守恒可知c(H+)+c(Na+)=c(Bb-)+c(OH-),错误。
3.联氨(N2H4)为二元弱碱,可溶于水,在水中的电离方式与氨相似。下列说法正确的是 ( )
A.联氨的电离方程式可表示为N2H4+2H2ON2+2OH-
B.联氨与硫酸形成的酸式盐的化学式为N2H5HSO4
C.联氨水溶液加水稀释,促进联氨的电离,c(OH-)增大
D.室温下,N2H6Cl2水溶液的pH<7
【解析】选D。A项,联氨为二元弱碱,在水中的电离方式与氨相似,联氨第一步电离方程式为N2H4+H2ON2+OH-,第二步电离方程式为N2+H2ON2+OH-,错误;B项,由联氨的第二步电离可知,联氨与硫酸形成的酸式盐的化学式为N2H6(HSO4)2,错误;C项,联氨为二元弱碱,加水稀释,促进联氨的电离,但c(OH-)减小,错误;D项,室温下,N2H6Cl2水溶液中N2发生水解反应生成H+,溶液呈酸性,pH<7,正确。
4.室温下,通过下列实验探究NaHSO3溶液的性质。
实验1:用pH试纸测量0.1 mol·L-1 NaHSO3溶液的pH,测得pH约为5。
实验2:向10 mL 0.1 mol·L-1 NaHSO3溶液中加入等体积0.1 mol·L-1氨水,充分混合,溶液pH约为9。
实验3:向10 mL 0.1 mol·L-1 Na2CO3溶液中滴加几滴0.1 mol·L-1 NaHSO3溶液,无明显现象。
实验4:向10 mL 0.1 mol·L-1 NaHSO3溶液中加入10 mL 0.05 mol·L-1 Ba(ClO)2溶液,产生白色沉淀。
下列有关说法正确的是( )
A.实验1可得出:Ka1(H2SO3)·Ka2(H2SO3)
C.实验3可得出:Ka2(H2SO3)
【解析】选B。0.1 mol·L-1 NaHSO3溶液的pH约为5,说明HS的电离程度大于水解程度,即Ka2>Ka1=,所以Ka1·Ka2>Kw,A错误;实验2所得溶液为等浓度的Na2SO3、(NH4)2SO3混合溶液,根据质子守恒可得:c(H+)+2c(H2SO3)+c(HS)=c(OH-)+c(NH3·H2O),B正确;实验3中NaHSO3的量不足,无明显现象,不能得出Ka2(H2SO3)
选项 探究方案 实验目的
A 向2 mL 1 mol·L-1 CH3COOH溶液中滴加1 mol·L-1 Na2CO3溶液,观察现象 比较 Ka(CH3COOH)和 Ka1(H2CO3)的大小
B 向4 mL 0.1 mol·L-1 CuSO4溶液中滴加1 mol·L-1氨水至沉淀溶解,再加入8 mL 95%乙醇,过滤 制备 [Cu(NH3)4]SO4·H2O晶体
C 把两个体积相同、密封装有等量NO2和N2O4混合气体的烧瓶分别同时浸泡在热水和冰水中,观察混合气体的颜色变化 探究温度对化学平衡的影响
D 向溶液X中滴加少量稀硝酸,然后滴入几滴Ba(NO3)2溶液,观察现象 检验溶液X是否含有S
【解析】选D。Na2CO3和CH3COOH反应生成CO2,说明乙酸酸性强于碳酸,Ka(CH3COOH)大于Ka1(H2CO3),A项正确;实验先得到铜氨溶液,再加入8 mL 95%乙醇,[Cu(NH3)4]SO4溶解度减小,析出[Cu(NH3)4]SO4·H2O晶体,B项正确;NO2和N2O4分别为红棕色气体和无色气体,且两者的转化为可逆反应,将两个体积相同、装有等量NO2和N2O4混合气体的烧瓶分别同时浸泡在热水和冰水中,观察混合气体的颜色变化,可以判断平衡移动情况,能探究温度对化学平衡的影响,C项正确;若溶液中含有S,S会被硝酸氧化为S,S和Ba2+反应生成BaSO4沉淀,故不能检验溶液X是否含有S,D项错误。
6.向x mL 0.1mol·L-1氨水中滴加等浓度的高氯酸,测得混合溶液的温度和pOH[pOH=-lgc(OH-)]随加入高氯酸的体积变化如图所示(图中实线为温度变化,虚线为pOH变化)。下列说法错误的是( )
A.x=20
B.b、c点由水电离出的c(OH-):b>c
C.b点时溶液中:c(N)+c(NH3·H2O)=c(H+)+c(Cl)
D.a、d点对应NH3·H2O的电离常数:Kb(a)
结合题图诠释①知,b点时n(HClO4)=n(NH3·H2O),则有20 mL×0.1 mol·L-1=
x mL×0.1 mol·L-1,解得x=20,A正确;盐促进水的电离,酸抑制水的电离,根据题图诠释①③可知,由水电离出的c(OH-):b>c,B正确;结合题图诠释①可知,b点溶液中存在物料守恒:c(NH3·H2O)+c(N)=c(Cl),C错误;电离常数与温度有关,升高温度,促进电离平衡正向移动,电离常数增大,由图中温度变化曲线知,温度:a点
A.配制PbI2溶液前,应先除去水中溶解的CO2
B.饱和PbI2溶液可快速通过氢型阳离子交换树脂
C.Ksp(PbI2)=()3×
D.滴定时发生的反应为H++OH-H2O
【解析】选B。由于Ksp(PbI2)>Ksp(PbCO3),溶液中CO2转化为H2CO3,H2CO3能与PbI2反应生成更难溶的PbCO3,故配制PbI2溶液前,需先除去水中溶解的CO2,A正确;为了使饱和PbI2溶液与氢型阳离子交换树脂充分接触,饱和PbI2溶液应缓慢通过氢型阳离子交换树脂,B错误;根据题中信息可知PbI2+2H+2HI+Pb2+,HI+NaOHNaI+H2O,可得关系式Pb2+~2HI~2NaOH,则n(Pb2+)=n(NaOH),即c(Pb2+)×25×10-3 L=cV×10-3 L,解得c(Pb2+)= mol·L-1,根据PbI2(s)Pb2+(aq)+2I-(aq),即饱和PbI2溶液中c(I-)= mol·L-1,则Ksp(PbI2)=c(Pb2+)·c2(I-)=()3×,C正确;滴定时是HI与NaOH溶液反应,其离子方程式为H++OH-H2O,D正确。
8.酒石酸(H2B)及其与OH-形成的微粒的浓度分数随溶液pH变化曲线如图所示[已知:20 ℃时,Ksp(KHB)=3.8×10-4,S(K2B)=100 g·L-1]。向20 mL 0.1 mol·L-1 酒石酸溶液中逐滴加入0.2 mol·L-1 KOH溶液,下列说法正确的是( )
A.酒石酸的Ka1的数量级为10-3
B.pH=4时,c(HB-)>c(H2B)>c(B2-)
C.用酒石酸检验K+时,最佳pH范围是3.04~4.37
D.V(KOH溶液)=10 mL时,c(H2B)+c(HB-)+c(B2-)≈0.067 mol·L-1
【解析】选C。分析题图可知,①、②、③分别表示H2B、HB-、B2-的浓度分数随溶液pH的变化。A项,当pH=3.04时,c(H2B)=c(HB-),则H2B的电离常数Ka1==1×10-3.04,Ka1的数量级为10-4,错误;B项,由题图可知,pH=4时,溶液中离子的浓度大小顺序为c(HB-)>c(B2-)>c(H2B),错误;C项,由题图可知,pH在3.04~4.37,溶液中HB-浓度较大,有利于钾离子转化为酒石酸氢钾,正确;D项,当加入氢氧化钾溶液的体积为10 mL时,酒石酸溶液与氢氧化钾溶液恰好反应生成酒石酸氢钾,由酒石酸氢钾的溶度积可知,溶液中c(HB-)==
mol·L-1 ≈0.019 5 mol·L-1 ,由元素守恒可知,溶液中c(H2B)+c(HB-)+
c(B2-)≈0.019 5 mol·L-1 ,错误。
9.25 ℃时,向Na2XO3溶液中滴入稀硫酸,混合溶液的pH与离子浓度变化的关系如图所示,反应过程始终无气体逸出。已知:x表示或。下列叙述错误的是( )
A.H2XO3的Ka2的数量级为10-11
B.在NaHXO3溶液中:>1
C.溶液显中性时:c(HX)+2c(H2XO3)=2c(S)
D.温度不变时,随着硫酸的加入,始终保持不变
【解析】选B。M点对应的电离常数为10-1×10-9.3=10-10.3,N点对应的电离常数为10×10-7.4=10-6.4,根据弱电解质的第一步电离常数大于第二步电离常数,则直线m表示与pH的关系,直线n表示与pH的关系,故H2XO3的Ka2==10-1×10-9.3=10-10.3,则Ka2的数量级为10-11,A正确;NaHXO3溶液中,HX的电离常数为Ka2==10-10.3,水解常数Kh2===10-7.6,故Kh2>Ka2,即>,得出<1,B错误;溶液显中性时,依据电荷守恒可得c(HX)+2c(X)+2c(S)=c(Na+),依据元素守恒可得2c(HX)+2c(X)+2c(H2XO3)=c(Na+),两式联立消去c(Na+)可得c(HX)+2c(H2XO3)=2c(S),C正确;=Ka1·Ka2,温度不变时,Ka1、Ka2不变,所以随着硫酸的加入,始终保持不变,D正确。
10.已知:Ag++SCN-AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。下列说法不正确的是( )
A.①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B.②中现象产生的原因是发生了反应Fe(SCN)3+3Ag+3AgSCN↓+Fe3+
C.③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D.④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
【解析】选C。A.①产生浅红色溶液,说明溶液中存在SCN-,也就说明Ag+与SCN-反应存在化学平衡,因此可以说明Ag+与SCN-生成AgSCN沉淀的反应有限度,故A正确;B.②中现象为红色褪去,产生白色沉淀,说明加入AgNO3溶液与Fe(SCN)3反应生成了AgSCN,发生反应的化学方程式为Fe(SCN)3+3Ag+3AgSCN↓+Fe3+,故B正确;C.③中现象为产生黄色沉淀,加入KI溶液产生黄色沉淀,黄色沉淀为AgI,但是①→②中加入了Ag+,可以直接与I-反应生成AgI,不能说明是由AgSCN转化而来,也就不能说明AgI的溶解度比AgSCN的溶解度小,故C错误;D.④中现象为白色沉淀先转化为黄色沉淀,随后溶解得到无色溶液,产生黄色沉淀是AgSCN转化为AgI,得到无色溶液则可能是Ag+与I-进一步发生配位反应,故D正确。
11.次磷酸(H3PO2)是一种精细化工产品。常温下,某实验小组以酚酞为指示剂,用0.100 mol·L-1的NaOH溶液滴定20.00 mL 未知浓度的次磷酸(H3PO2)溶液。溶液pH、所有含磷微粒的分布系数δ[比如H2P的分布系数:δ(H2P)=]随滴加NaOH溶液体积[V(NaOH)]的变化关系如图所示。
下列叙述不正确的是( )
A.曲线①代表δ(H3PO2),曲线②代表δ(H2P)
B.H2P水解常数Kh≈1.0×10-10
C.H3PO2溶液的浓度为0.100 mol·L-1
D.滴定终点时,溶液中c(Na+)>c(H2P)
【解析】选B。分析随着NaOH溶液的加入相关曲线的变化,可知含磷微粒只有2种,曲线①表示随着NaOH溶液的加入,相关粒子的分布系数越来越小,当加入的NaOH溶液的体积达到20 mL 时,曲线①代表的粒子恰好完全反应,推知曲线①代表δ(H3PO2),曲线②代表的粒子的分布系数随着NaOH溶液的加入逐渐增大,故曲线②代表δ(H2P),曲线③代表溶液pH随滴加NaOH溶液体积的变化,当加入NaOH溶液的体积达到20 mL 时,酸碱恰好完全反应,结合起点溶液的pH,可推出H3PO2为一元弱酸,A正确;由曲线①②交点可知,c(H3PO2)=c(H2P),对应曲线③pH≈3,即c(H+)≈10-3 mol·L-1,Ka(H3PO2)=≈10-3,故H2P的水解常数Kh=≈1.0×10-11,B错误;H3PO2为一元弱酸,达到滴定终点时n(NaOH)=n(H3PO2),即c(NaOH)·V(NaOH)=c(H3PO2)·V(H3PO2),由V(NaOH)=20 mL 时达到滴定终点可知,次磷酸溶液的浓度为0.100 mol·L-1,C正确;由溶液中的电荷守恒得c(Na+)+c(H+)=c(H2P)+c(OH-),酚酞作指示剂,滴定终点时溶液呈碱性,即c(OH-)>c(H+),推知c(Na+)>c(H2P),D正确。
12.CaF2是离子晶体,其晶胞如图1所示(已知氟化钙晶胞参数为a pm,NA表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节CaF2浊液的pH,测得在不同pH条件下,体系中lg与-lgc(X)(X为Ca2+或F-)的关系如图2所示。下列说法错误的是( )
A.每个氟化钙晶胞中含有Ca2+的数目为4个
B.氟化钙的晶体密度为 g·cm-3
C.L1表示-lgc(F-)与lg的变化曲线
D.Ksp(CaF2)的数量级为10-10
【解析】选C。已知HF的Ka=,则有=,即有lg越大,c(F-)越大,lgc(F-)越大,-lgc(F-)越小,c(F-)越大,c(Ca2+)越小,则-lgc(Ca2+)越大,故可知L1代表-lgc(Ca2+)的变化曲线,L2代表-lgc(F-)的变化曲线。A.每个氟化钙晶胞中含有Ca2+的数目为8×+6×=4,故A正确;B.晶胞体积V=(a×10-10 cm)3,该晶胞中相当于含有4个CaF2,晶胞质量为m= g,则氟化钙的密度ρ== g·cm-3,故B正确;C.由分析可知,L1表示-lgc(Ca2+)与lg的变化曲线,故C错误;D.由a点坐标可知,==101.2,c(F-)=10-2 mol·L-1,则Ka==10-3.2,由b点坐标可知,c(Ca2+)=10-2 mol·L-1 ,此时=10-0.7,故可求出此时溶液中c(F-)=10-0.7×10-3.2=10-3.9 mol·L-1,故Ksp(CaF2)=c(Ca2+)c2(F-)=10-2×(10-3.9)2=10-9.8,故其数量级为10-10,故D正确。
13.一种废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍(已知常温下Ksp[Ni(OH)2]=2.0×10-15),工艺流程如图。下列叙述错误的是( )
A.废渣的主要成分为二氧化硅
B.黄钠铁矾渣中铁元素为+3价
C.除钙镁过程中,为了提高钙镁的去除率,氟化钠实际用量应该越多越好
D.“沉镍”过程中为了将镍沉淀完全,需要调节溶液pH>9
【解析】选C。酸溶后过滤所得废渣的主要成分为二氧化硅,A正确;双氧水具有强氧化性,加入双氧水将Fe2+全部氧化为Fe3+,所以黄钠铁矾渣中铁元素为+3价,B正确;根据流程图可知除铜后的滤液应显酸性,若NaF的用量过大,会生成剧毒物质HF,污染环境,还会浪费原料、增加成本,故氟化钠的用量不是越多越好,C错误;Ksp[Ni(OH)2]=c(Ni2+)c2(OH-)=1.0×10-5×c2(OH-)=2.0×10-15,则c(OH-)=×10-5 mol·L-1,c(H+)=×10-9 mol·L-1,则“沉镍”过程中为了将镍沉淀完全,需要调节溶液pH>9,D正确。
14.已知:AgA、Ag2B都是难溶盐。室温下,向体积均为10 mL、浓度均为0.1 mol·L-1的NaA溶液、Na2B溶液中分别滴加0.1 mol·L-1的AgNO3溶液,溶液中pX与AgNO3溶液体积的关系如图所示[已知:pX=-lgc(A-)或-lgc(B2-)]。下列推断错误的是( )
A.室温下,Ksp(Ag2B)=4×10-3a
B.对应溶液中c(Ag+):e>f
C.室温下,在等量的水中,AgA溶解的物质的量更多
D.若c(AgNO3)变为0.05 mol·L-1,则NaA溶液中的反应终点移至d点
【解析】选C。由题图可知,室温下,加入10 mL硝酸银溶液时,NaA溶液完全反应得到AgA饱和溶液,溶液中A-和Ag+浓度都为10-b mol·L-1,AgA的溶度积为1,加入20 mL硝酸银溶液时,Na2B溶液完全反应得到Ag2B饱和溶液,溶液中B2-浓度为10-a mol·L-1、Ag+为2×10-a mol·L-1,Ag2B的溶度积为4×1,以此解题。
由分析可知,室温下,Ksp(Ag2B)=4×1,A正确;由图可知,f点时Na2B过量,e点时Na2B恰好完全反应,由温度不变,溶度积不变可知,e点Ag+浓度大于f点,B正确;由题图可知,AgA饱和溶液中A-的浓度小于Ag2B饱和溶液中B2-的浓度,故在等量的水中,AgA溶解的物质的量更少,C错误;若c(AgNO3)变为0.05 mol·L-1,则加入20 mL硝酸银溶液时,NaA完全反应得到AgA饱和溶液,由温度不变,溶度积不变可知,溶液中Ag+的浓度不变,则NaA溶液中的反应终点c移至d点,D正确。
二、非选择题:本题共4小题,共58分。
15.(14分)25 ℃时,三种酸的电离平衡常数如下表所示。
名称 醋酸 氢氟酸 草酸
化学式 CH3COOH HF H2C2O4
电离平衡常数 1.8×10-5 3.5×10-4 Ka1=5.9×10-2 Ka2=6.5×10-5
(1)三种酸由强到弱的顺序为__________。
【解析】(1)由电离平衡常数判断,酸的电离平衡常数越大,酸的酸性越强,酸性强弱为H2C2O4>HF>CH3COOH。
(2)写出H2C2O4的第一步电离方程式: __________________________。
【解析】(2)H2C2O4为二元弱酸,溶液中分步电离,第一步电离方程式:H2C2O4HC2+H+。
(3)将 pH 和体积均相同的CH3COOH 溶液和 HF 溶液分别稀释,其 pH 随加水体积的变化如图所示。
①稀释前c(HF)__________0.01 mol·L-1(填“>”“=”或“<”)。
②a、b 两点:c(CH3COO-)__________c(F-)(填“>”“=”或“<”)。
【解析】(3)①HF为弱酸,存在电离平衡,稀释前溶液pH=2,则稀释前c(HF)>
0.01 mol·L-1;
②两种酸稀释前pH相同,稀释相同倍数,a、b两点,a点溶液中c(F-)、c(H+)较小,c(CH3COO-)>c(F-)。
(4)常温下,CH3COOH 的稀释过程中,下列说法正确的是__________(填字母)。
a.减小
b.电离平衡正向移动
c.c(H+)·c(OH-)减小
d.溶液的导电能力增强
【解析】(4)a.=Ka,温度不变,比值不变,故a错误; b.稀释促进电离,电离平衡正向移动,故b正确; c.c(H+)·c(OH-)=Kw,温度不变,乘积不变,故c错误; d.溶液稀释,离子浓度减小,导电性减弱,故d错误;
(5)浓度均为0.1 mol·L-1的下列四种溶液:
a.CH3COONa b.NaF c.Na2C2O4 d.NaHC2O4。
其 pH 由大到小顺序是______(填字母)。
【解析】(5)电离常数Ka越大,酸性越强,则酸性为H2C2O4>HF>HC2>CH3COOH,
a.CH3COONa、b.NaF、c.Na2C2O4、d.NaHC2O4均为强碱弱酸盐,水解程度为CH3COONa>Na2C2O4>NaF>NaHC2O4,盐溶液pH大小:a>c>b>d。
答案:(1)H2C2O4>HF>CH3COOH (2)H2C2O4HC2+H+
(3)①> ②> (4)b (5)a>c>b>d
16.(14分)Ⅰ.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005 mg·L-1。处理含镉废水可采用化学沉淀法。
(1)写出磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式:Ksp[Cd3(PO4)2]= ____________________。
【解析】(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式:Ksp[Cd3(PO4)2]=
c3(Cd2+)·c2(P)。
(2)一定温度下,CdCO3的Ksp=4.0×10-12,Cd(OH)2的Ksp=3.2×10-14,该温度下____________[填“CdCO3”或“Cd(OH)2”]的饱和溶液中Cd2+浓度较大。
【解析】(2)当CdCO3达到沉淀溶解平衡时有CdCO3(s)Cd2+(aq)+C(aq),则该温度下CdCO3饱和溶液中c(Cd2+)== mol·L-1
=2.0×10-6 mol·L-1,当Cd(OH)2达到沉淀溶解平衡时有Cd(OH)2(s)Cd2+(aq)+2OH-(aq),则该温度下Cd(OH)2饱和溶液中c(Cd2+)=
= mol·L-1=2.0×10-5 mol·L-1,则Cd(OH)2的饱和溶液中Cd2+浓度较大。
(3)向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol·L-1时,废水中Cd2+的浓度为__________mol·L-1[已知:Ksp(CdS)=7.9×10-27],此时__________(填“符合”或“不符合”)《生活饮用水卫生标准》。
【解析】(3)当c(S2-)=7.9×10-8 mol·L-1时,c(Cd2+)= mol·L-1=1.0×
10-19 mol·L-1=10-19×112×103 mg·L-1<0.005 mg·L-1,符合《生活饮用水卫生标准》。
Ⅱ.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25 ℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH <8.0 8.0~9.6 >9.6
颜色 黄色 绿色 蓝色
25 ℃时,向Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为____________。
【解析】(4)25 ℃时,Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-)=5.6×10-12,设Mg(OH)2饱和溶液中c(OH-)=x mol·L-1,则0.5x×x2=5.6×10-12,解得x≈2.24×10-4;c(H+)=
mol·L-1≈4.5×10-11 mol·L-1,pH≈10.4>9.6,所以溶液呈蓝色。
(5)常温下,向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下,Ksp(AgCl)=1.8×10-10,忽略溶液体积的变化。
①反应后,溶液中c(Ag+)=________ mol·L-1。
②反应后,溶液的pH=__________。
③如果向反应后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,____________(填“有”或“无”)白色沉淀生成。
【解析】(5)①常温下,向50 mL 0.018 mol·L-1的AgNO3溶液中加入
50 mL 0.020 mol·L-1的盐酸,反应后溶液中c(Cl-)= mol·L-1=
10-3 mol·L-1,则溶液中c(Ag+)== mol·L-1=1.8×10-7 mol·L-1;
②反应后,溶液中c(H+)==0.010 mol·L-1,则溶液的pH=-lgc(H+)=2;
③再向反应后的溶液中加入50 mL 0.001 mol·L-1盐酸,溶液中c(Ag+)=×1.8×
10-7 mol·L-1=1.2×10-7 mol·L-1、c(Cl-)=10-3 mol·L-1,Q=10-3×1.2×10-7=1.2×10-10<1.8×
10-10,故无沉淀产生。
答案:(1)c3(Cd2+)·c2(P)
(2)Cd(OH)2 (3)1.0×10-19 符合
(4)蓝色 (5)①1.8×10-7 ②2 ③无
17.(14分)按要求回答下列问题:
(1)一定温度下,现有a.盐酸,b.硫酸,c.醋酸三种酸。
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是____________(用a、b、c表示)。
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是____________(用a、b、c表示)。
③当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 __________(用a、b、c表示)。
【解析】(1)①三种酸体积相同、物质的量浓度也相同,即物质的量相同,盐酸和醋酸都是一元酸,和NaOH完全中和时,需要的NaOH的物质的量相等,所以盐酸和醋酸消耗的氢氧化钠的物质的量相等;硫酸是二元酸,和NaOH完全中和时,需要的NaOH的物质的量是硫酸的物质的量的2倍,所以三种酸和NaOH恰好完全中和,所需NaOH的物质的量由大到小的顺序是b>a=c;
②三者c(H+)相同时 ,由于醋酸是弱酸,醋酸的浓度要大于盐酸的浓度,所以当盐酸和醋酸体积相同时,醋酸的物质的量大于盐酸的物质的量,和足量的锌反应时,醋酸生成氢气的物质的量大于盐酸生成氢气的物质的量。盐酸和硫酸都是强酸,完全电离,H+的物质的量相等,和足量的锌反应,生成氢气的物质的量相等。相同状况下,气体体积和气体的物质的量成正比,所以相同状况下产生气体的体积由大到小的顺序是c>a=b;
③形状、密度、质量完全相同的锌和三种酸反应,反应的实质是锌和H+反应,反应速率由c(H+)决定,所以三种酸溶液中c(H+)相同时,开始时反应速率相等,即a=b=c。
(2)现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如表:
滴定序号 待测液体积/mL 所消耗盐酸标准液的体积/mL
滴定前 滴定后 消耗的体积
1 25.00 0.50 26.80 26.30
2 25.00 - - -
3 25.00 5.00 31.34 26.34
①用____________式滴定管盛装0.250 0 mol·L-1 盐酸标准液。如图表示第二次滴定前后50 mL滴定管中液面的位置。
该次滴定所用标准盐酸体积为____________________mL。
【解析】(2)①盐酸要用酸式滴定管盛装。从滴定管液面可以看出,滴定前液面在0.30 mL处,滴定后液面在24.90 mL处,所以该次滴定所用标准盐酸溶液的体积为24.60 mL;
②现实验室中有石蕊和酚酞两种指示剂,该实验应选用__________作指示剂。
【解析】(2)②石蕊颜色变化不明显,通常不用作酸碱中和滴定的指示剂,应选用酚酞作指示剂;
③根据所给数据,该烧碱样品的物质的量浓度为____________。
【解析】(2)③分析三组数据,消耗盐酸的体积中的第二组数据和其他两组差别较大,舍去,第一组和第三组消耗盐酸的体积的平均值为26.32 mL,盐酸和NaOH等物质的量反应,所以有0.250 0 mol·L-1 ×0.026 32 L=c(NaOH)×0.025 00 L,可计算出c(NaOH)=0.263 2 mol·L-1 ;
④若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则会造成测定结果______________ (填“偏低”“偏高”或“无影响”)。
【解析】(2)④滴定操作开始时滴加盐酸的速率可以快一些,当快达到滴定终点时,一定要逐滴滴入,直到指示剂颜色改变,且摇动半分钟颜色不恢复,才可以停止滴定,等液面稳定之后再读数。若操作过程中滴加盐酸速率过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则滴入的盐酸的体积偏小,会造成测定结果偏低。
答案:(1)①b>a=c ②c>a=b
③a=b=c (2)①酸 24.60 ②酚酞
③0.263 2 mol·L-1 ④偏低
18.(16分)利用废镍电池的金属电极芯(主要成分为Co、Ni,还含少量Fe、Al等)生产醋酸钴晶体、硫酸镍晶体的工艺流程如下。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Co(OH)3 Al(OH)3 Ni(OH)2
开始沉淀的pH 2.2 7.4 7.6 0.1 4.0 7.6
完全沉淀的pH 3.2 8.9 9.2 1.1 5.2 9.2
(1)用硫酸浸取金属电极芯时,提高浸取率的方法有_____________(写出一种合理方法即可)。
【解析】(1)提高浸取率的措施有将金属电极芯研成粉末,增大反应物的接触面积、充分搅拌、适当升高温度、适当增大硫酸浓度、延长浸取时间等。
(2)沉淀A的主要成分是Fe(OH)3、__________________,“浸出液”调节pH的范围为______________,调节pH选用的试剂可以是______________ (填字母)。
a.铁 b.氨水 c.碳酸钠溶液 d.稀硫酸
【解析】(2)由上述分析知,沉淀A的主要成分是Al(OH)3和Fe(OH)3,调节“浸出液”的pH,使Al3+和Fe3+沉淀完全,但Co2+和Ni2+不沉淀,由表中数据可知,调节pH范围为5.2≤pH<7.6;为中和溶液中的酸且不引入杂质,可用氨水或碳酸钠溶液调节pH。
(3)“母液1”中加入NaClO反应的离子方程式为________________。
【解析】(3)母液1中加入NaClO的目的是将Co2+氧化成Co3+,并形成Co(OH)3沉淀,故离子反应方程式为ClO-+2Co2++5H2O===2Co(OH)3↓+Cl-+4H+。
(4)向Co(OH)3中加入H2SO4 -H2O2混合液,H2O2的作用是________________。
【解析】(4)由流程图可知,加入H2O2的作用是将Co3+还原成Co2+,即H2O2作还原剂。
(5)“母液3”中应控制Na2CO3用量,使终点pH为8.5为宜,此时c(Co2+)小于______________mol·L-1;为防止生成Co(OH)2 沉淀,可用NH4HCO3代替Na2CO3制得CoCO3,写出该反应的离子方程式: ________________。
(已知:Ksp[Co(OH)2]=2×10-15)
【解析】(5)pH=8.5,即c(H+)=10-8.5 mol·L-1,c(OH-)=10-5.5 mol·L-1,则由Ksp[Co(OH)2]=2×10-15=c(Co2+)·c2(OH-),可得c(Co2+)<2×10-4 mol·L-1;反应物为HC和Co2+,生成物中含CoCO3,则反应的离子方程式为2HC+Co2+===CoCO3↓+CO2↑+H2O。
(6)由“母液4”获取NiSO4·7H2O的操作是______________、__________________、过滤、洗涤。
【解析】(6)由母液4获得NiSO4·7H2O的操作为蒸发浓缩、冷却结晶、过滤、洗涤。
答案:(1)适当升高温度(或将金属电极芯研成粉末等) (2)Al(OH)3 5.2≤pH<7.6 bc
(3)ClO-+2Co2++5H2O===2Co(OH)3↓+Cl-+4H+
(4)作还原剂 (5)2×10-4 2HC+Co2+===CoCO3↓+CO2↑+H2O (6)蒸发浓缩 冷却结晶
- 17 -
同课章节目录
