2025届高三高考化学二轮复习 “1-16”选择题标准卷(八)(含解析)
文档属性
| 名称 | 2025届高三高考化学二轮复习 “1-16”选择题标准卷(八)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-07 09:40:25 | ||
图片预览

文档简介
2025届高三高考化学二轮复习
“1-16”选择题标准卷(八)
选择题(本大题共16小题,每小题3分,共48分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.下列不属于新能源的是 ( )
A.潮汐能 B.波浪能
C.石油 D.氢能
2.工业上利用焦炭还原石英砂制备含有少量杂质的粗硅,将粗硅转化为三氯硅烷,再经氢气还原得到高纯硅。下列说法不正确的是 ( )
A.石英砂的主要成分是SiO2
B.焦炭过多容易生成副产物SiC
C.制备三氯硅烷的反应:Si+3HClSiHCl3+H2
D.高纯硅导电性好,可用于制作计算机、通讯设备和家用电器等的芯片
3.化学用语是化学专业术语。下列化学用语错误的是 ( )
A.基态Cu原子的价层电子排布式为3d104s1
B.AsH3分子的VSEPR模型为
C.乙炔分子中π键的形成表示为
D.基态Ca原子核外电子占据的最高能级原子轨道示意图为
4.物质的性质决定用途,下列两者对应关系不正确的是 ( )
A.Na2S2O3溶液具有氧化性,可用酸式滴定管盛放
B.铝粉与NaOH溶液能反应生成H2,可用于疏通厨卫管道
C.单质硫为非极性分子,附着硫的试管可用CS2洗涤
D.青铜比纯铜熔点低、硬度大、耐腐蚀,古代用青铜铸剑
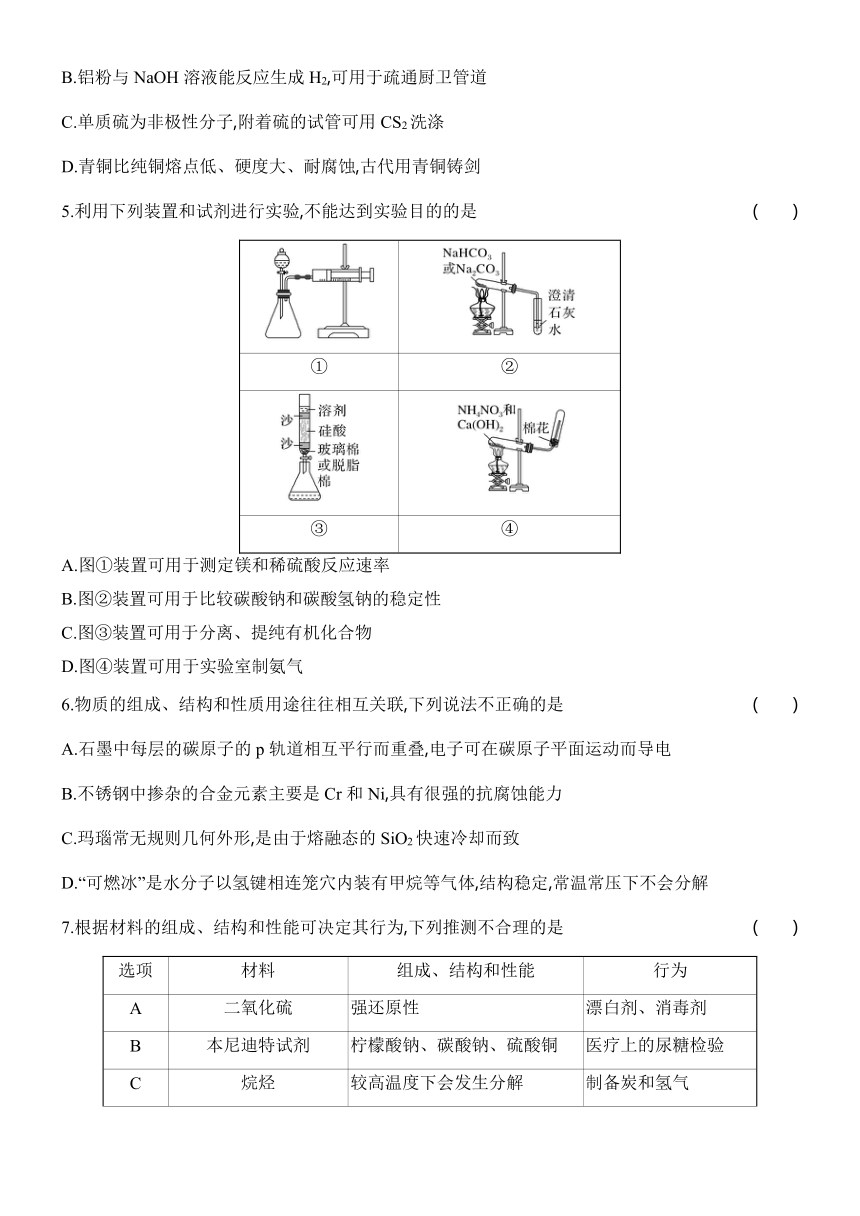
5.利用下列装置和试剂进行实验,不能达到实验目的的是 ( )
① ②
③ ④
A.图①装置可用于测定镁和稀硫酸反应速率
B.图②装置可用于比较碳酸钠和碳酸氢钠的稳定性
C.图③装置可用于分离、提纯有机化合物
D.图④装置可用于实验室制氨气
6.物质的组成、结构和性质用途往往相互关联,下列说法不正确的是 ( )
A.石墨中每层的碳原子的p轨道相互平行而重叠,电子可在碳原子平面运动而导电
B.不锈钢中掺杂的合金元素主要是Cr和Ni,具有很强的抗腐蚀能力
C.玛瑙常无规则几何外形,是由于熔融态的SiO2快速冷却而致
D.“可燃冰”是水分子以氢键相连笼穴内装有甲烷等气体,结构稳定,常温常压下不会分解
7.根据材料的组成、结构和性能可决定其行为,下列推测不合理的是 ( )
选项 材料 组成、结构和性能 行为
A 二氧化硫 强还原性 漂白剂、消毒剂
B 本尼迪特试剂 柠檬酸钠、碳酸钠、硫酸铜 医疗上的尿糖检验
C 烷烃 较高温度下会发生分解 制备炭和氢气
D 氯化镁、硫酸钙 能使蛋白质聚沉 制作兰溪游埠豆腐
8.下列有关实验设计、操作说法正确的是 ( )
A.甲图可用于制备Fe(OH)3胶体
B.乙图在溶液中加入一些氨水,制成铜氨溶液,可使镀层光亮
C.丙图是转移操作
D.丁图配成同浓度的溶液,有利于比较乙醇和苯酚中羟基的活性
9.下列有关实验方案设计、现象和结论都正确的是 ( )
选项 实验方案 现象 结论
A 将某烃进行核磁共振氢谱检测 谱图出现两组吸收峰 该烃可能为丙烷
B 将乙醇和浓硫酸共热后生成的气体通入溴水中 溴水褪色 该气体为乙烯
C 向乙醇和酸性重铬酸钾溶液充分反应后的溶液中滴加石蕊 溶液变红 乙醇被氧化为乙酸
D 往废水中滴入氯化铁溶液 出现紫色沉淀 该废水中含有酚类物质
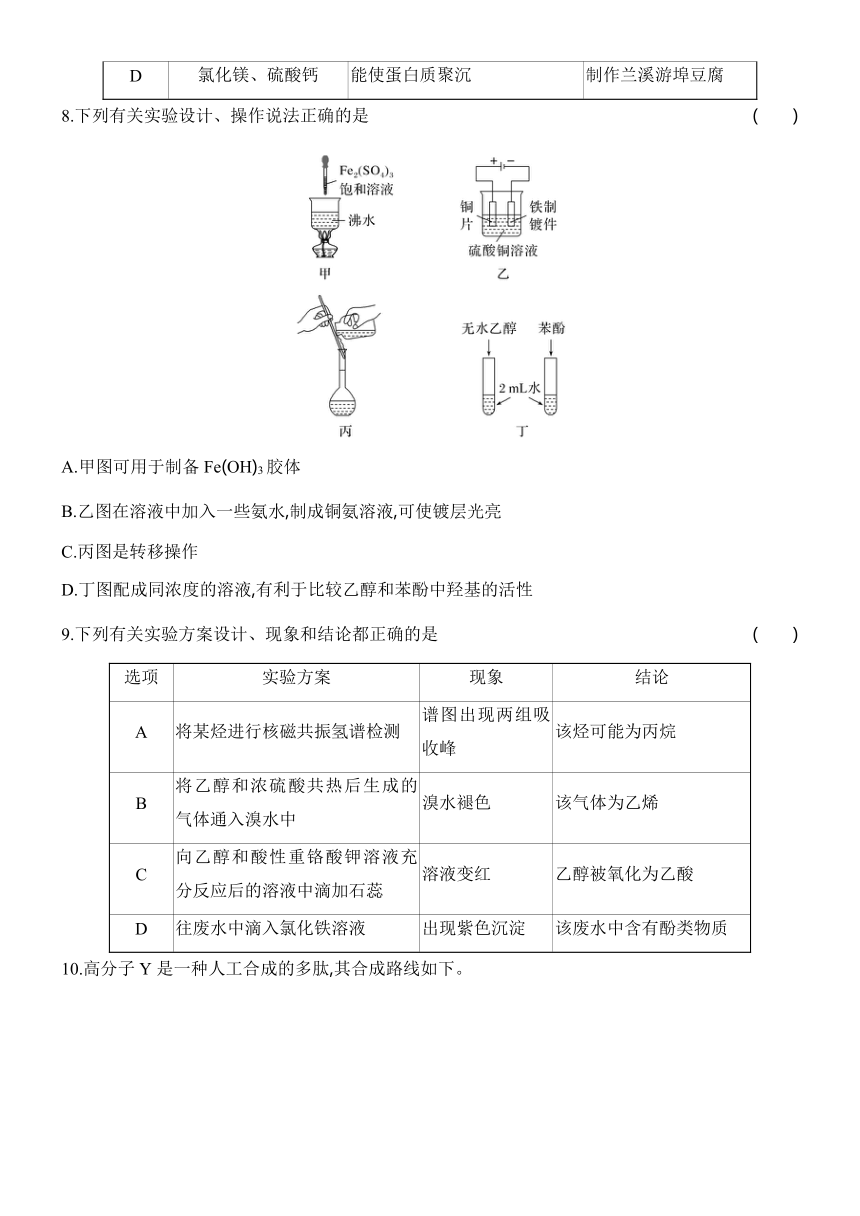
10.高分子Y是一种人工合成的多肽,其合成路线如下。
下列说法不正确的是 ( )
A.F中含有2个酰胺基
B.高分子Y水解可得到E和G
C.高分子X中存在氢键
D.高分子Y的合成过程中进行了官能团保护
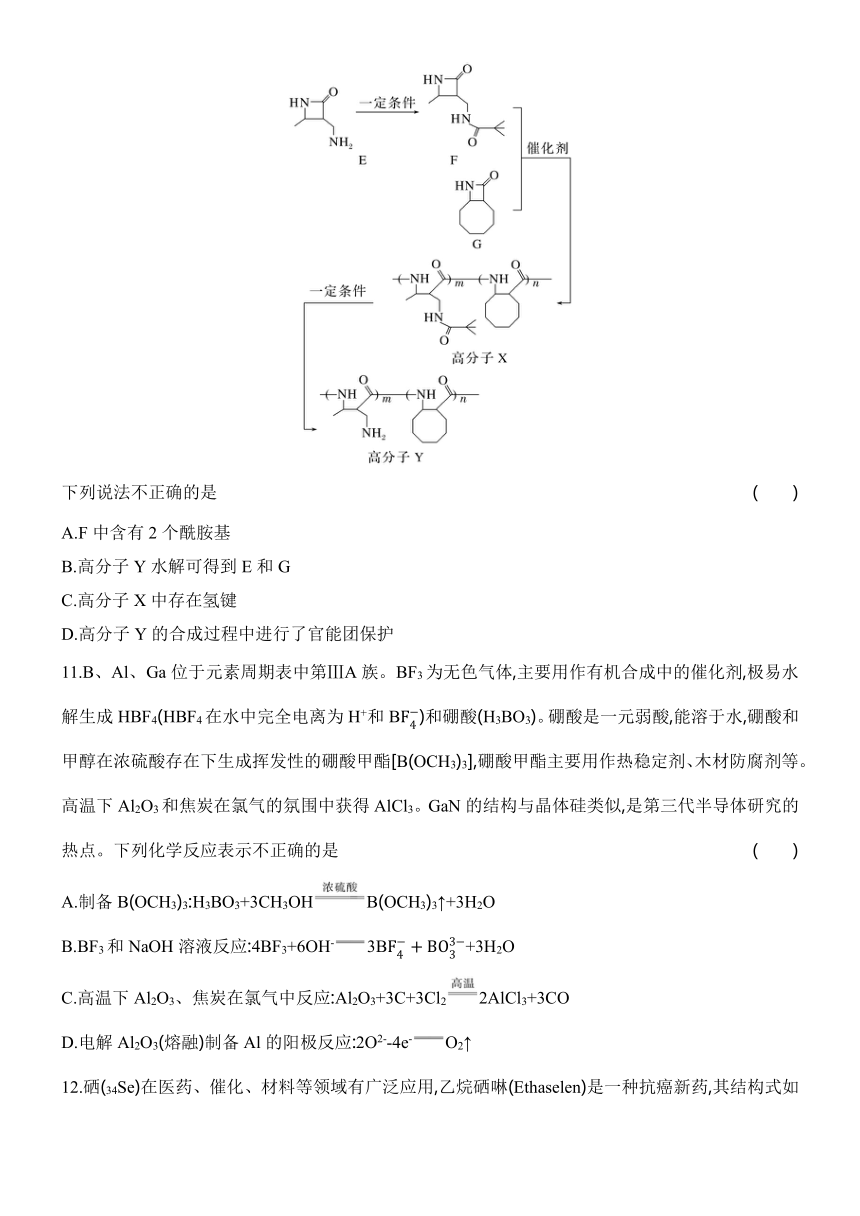
11.B、Al、Ga位于元素周期表中第ⅢA族。BF3为无色气体,主要用作有机合成中的催化剂,极易水解生成HBF4(HBF4在水中完全电离为H+和B)和硼酸(H3BO3)。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下Al2O3和焦炭在氯气的氛围中获得AlCl3。GaN的结构与晶体硅类似,是第三代半导体研究的热点。下列化学反应表示不正确的是 ( )
A.制备B(OCH3)3:H3BO3+3CH3OHB(OCH3)3↑+3H2O
B.BF3和NaOH溶液反应:4BF3+6OH-3B+3H2O
C.高温下Al2O3、焦炭在氯气中反应:Al2O3+3C+3Cl22AlCl3+3CO
D.电解Al2O3(熔融)制备Al的阳极反应:2O2--4e-O2↑
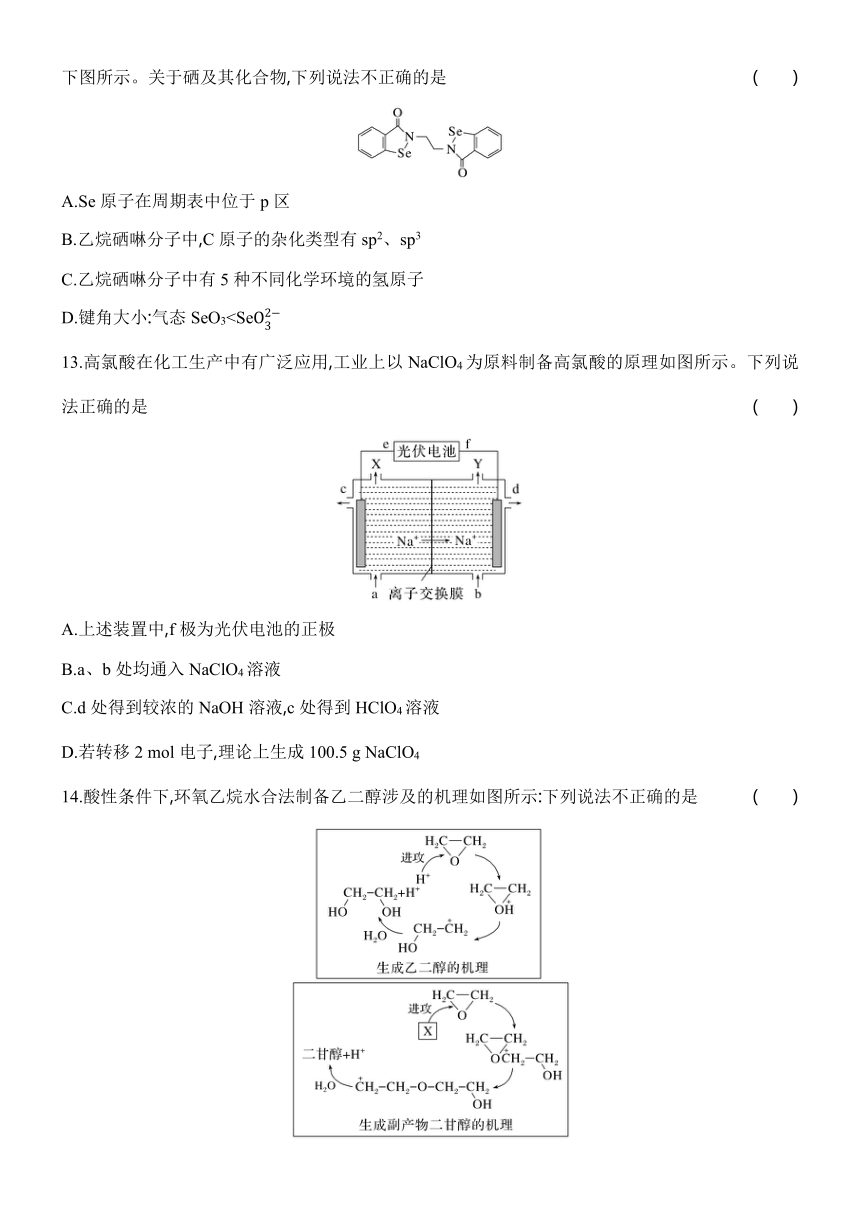
12.硒(34Se)在医药、催化、材料等领域有广泛应用,乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下图所示。关于硒及其化合物,下列说法不正确的是 ( )
A.Se原子在周期表中位于p区
B.乙烷硒啉分子中,C原子的杂化类型有sp2、sp3
C.乙烷硒啉分子中有5种不同化学环境的氢原子
D.键角大小:气态SeO313.高氯酸在化工生产中有广泛应用,工业上以NaClO4为原料制备高氯酸的原理如图所示。下列说法正确的是 ( )
A.上述装置中,f极为光伏电池的正极
B.a、b处均通入NaClO4溶液
C.d处得到较浓的NaOH溶液,c处得到HClO4溶液
D.若转移2 mol电子,理论上生成100.5 g NaClO4
14.酸性条件下,环氧乙烷水合法制备乙二醇涉及的机理如图所示:下列说法不正确的是 ( )
A.制备乙二醇总反应为+H2O
B.H+进攻环氧乙烷中的氧原子是因为碳氧键的共用电子对偏向氧
C.X的结构简式为
D.二甘醇的分子式是C4H10O3
15.某小组利用不同膜反应器(可选择性地让某些气体通过而离开体系)研究HI的分解率,工作原理如下图所示。图a、b和c反应区温度维持恒定且相等,仅发生2HI(g)H2(g)+I2(g)且在反应区内进行。投料均为1 mol的HI(g),反应同时开始,80 s时图b反应区处于瞬时平衡状态,其化学平衡常数K(b)=。
图a装置 图b装置 图c装置
80 s时反应区I2(g) 的物质的量/mol 0.10 0.30 x
下列说法正确的是 ( )
A.图a装置的化学平衡常数K(a)<
B.图a装置中,HI(g)分解率为10%
C.图b装置中,前80 s内H2的平均渗透速率约为3.6×10-3 mol·s-1
D.图c装置中,x一定大于0.3
16.将X滴入圆底烧瓶中与Y发生反应,产生足量气体通入Z中,Z中实验现象错误的是 ( )
选项 X Y Z Z中实验现象
A 浓硫酸 蔗糖 品红溶液 褪色
B 饱和食盐水 电石 溴的CCl4 溶液 褪色
C 饱和Na2S溶液 AlCl3 H2SO3溶液 溶液变浑浊
D 浓氨水 生石灰 CuSO4溶液 有蓝色絮状沉淀
参考答案
“1-16”选择题标准卷(八)
1.C 2.D 3.B 4.A
5.D [A.镁和稀硫酸反应生成氢气,通过注射器测量单位时间内生成气体的体积,测定镁和稀硫酸反应速率,A正确;B.碳酸氢钠受热分解产生二氧化碳,二氧化碳可以使澄清石灰水变浑浊,碳酸钠受热不分解,图②装置可用于比较碳酸钠和碳酸氢钠的稳定性,B正确;C.利用不同有机物在固定相和流动相中的相对吸附或溶解能力差异来分离、提纯有机化合物,该方法为色谱法,图③装置可用于分离、提纯有机化合物,C正确;D.硝酸铵是一种铵盐,受猛烈撞击或受热会发生爆炸性分解,不能用来制备氨气,D错误。]
6.D [A.石墨中每层的碳原子的p轨道相互平行而重叠,故电子可在碳原子平面运动而导电,A正确;B.在钢铁中掺杂Cr和Ni形成不锈钢,使其具有很强的抗腐蚀能力,B正确;C.熔融态的二氧化硅冷却过快得到没有晶体外形的玛瑙,缓慢冷却得到水晶晶体,C正确;D.常温常压下,冰会融化为水,因此常温常压下可燃冰的结构不稳定,会分解,D错误。]
7.A [A项,二氧化硫能和有色物质结合,可以做漂白剂;二氧化硫能杀灭病菌,能做消毒剂,A错误;B项,本尼迪特试剂是斐林试剂的改良试剂,可以检验还原性糖,故能用于医疗上的尿糖检验,B正确;C项,烷烃含有碳、氢元素,可以用于高温下分解制取炭和氢气,C正确;D项,氯化镁、硫酸钙能破坏胶体的介稳性,使得其发生聚沉,用于制作兰溪游埠豆腐,D正确。]
8.B [A.甲图中Fe2(SO4)3水解生成H2SO4为难挥发性酸,不能制胶体Fe(OH)3,应选用饱和FeCl3溶液,A错误;B.镀铜时,加入氨水可以生成铜配离子,使铜离子浓度降低,而且配合物平衡的存在能使铜离子浓度稳定在一定的范围内,这样使镀层更加紧密均匀光亮,工业上常采用这种方法,B正确;C.转移时,玻璃棒应靠在容量瓶刻度线以下,C错误;D.通常用活泼金属与羟基的反应来比较乙醇和苯酚中羟基的活性,而加水配置成溶液后,活泼金属会优先与水反应,无法达到目的,D错误。]
9.A [A.将某烃进行核磁共振氢谱检测,谱图出现两组吸收峰,说明有两种环境的H原子,丙烷有两种环境的H原子,该烃可能是丙烷,A正确;B.将乙醇和浓硫酸共热后生成的乙烯气体中混有SO2,SO2也能使溴水褪色,则该操作不能证明气体为乙烯,B错误;C.乙醇和酸性重铬酸钾溶液充分反应后的溶液呈酸性可能是因为溶液中原本就存在的H+,该操作不能说明乙醇被氧化为乙酸,C错误;D.酚类物质遇FeCl3溶液,溶液变为紫色,但不是紫色沉淀,D错误。]
10.B [A.由结构简式可知,F中含有2个酰胺基,A正确,B.由结构简式可知,高分子Y一定条件下发生水解反应生成和,B错误;C.由结构简式可知,高分子X中含有的酰胺基能形成氢键,C正确;D.由结构简式可知,E分子和高分子Y中都含有氨基,则高分子Y的合成过程中进行了官能团氨基的保护,D正确。]
11.B [A.根据硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],则制备B(OCH3)3:H3BO3+3CH3OHB(OCH3)3↑+3H2O,故A正确;B.BF3为无色气体,主要用作有机合成中的催化剂,极易水解生成HBF4(HBF4在水中完全电离为H+和B)和硼酸(H3BO3),硼酸是一元弱酸,则BF3和NaOH溶液反应:4BF3+4OH-3B+H2O,故B错误;C.高温下Al2O3和焦炭在氯气的氛围中获得AlCl3,则高温下Al2O3、焦炭在氯气中反应:Al2O3+3C+3Cl22AlCl3+3CO,故C正确;D.电解Al2O3(熔融)制备Al的阳极反应:2O2--4e-O2↑,故D正确。]
12.D [A.Se原子在周期表的位置是第四周期第ⅥA族,价层电子排布式为4s24p4,位于p区,A正确;B.乙烷硒啉分子中,C原子的杂化类型有sp2、sp3,苯环上的C为sp2杂化,上带*号的C为sp3杂化,B正确;C.乙烷硒啉分子中有5种不同化学环境的氢原子,C正确;D.SeO3中硒原子的价层电子对数为3,孤电子对数为0,分子的空间结构为平面三角形,键角为120°,Se中硒原子的价层电子对数4,孤电子对数为1,离子的空间结构为三角锥形,键角小于120°,键角大小:气态SeO3>Se,D错误。]
13.C [根据钠离子通过离子交换膜的移动方向可知:电解池左侧为阳极,与光伏电池的正极e相接,f极为光伏电池的负极,阳极H2O失去电子生成氧气和氢离子,电极反应式为2H2O-4e-4H++O2↑,生成的H+与加入的a物质结合成高氯酸,所以a为高氯酸钠,电解池右侧阴极上H2O得电子发生还原反应生成氢气和氢氧根离子,电极反应式为2H2O+2e-2OH-+H2↑,OH-与Na+结合成NaOH,所以物质b为稀NaOH溶液,以此来解答。A.图中Na+由左侧移动到右侧,即电解池左侧为阳极,阳极电极与光伏电池的正极相接,所以e极为光伏电池的正极、f极为负极,故A错误;B.由以上分析可知,物质b为稀NaOH溶液,故B错误;C.左侧阳极上生成的H+与加入的高氯酸钠结合成高氯酸,右侧阴极上生成的OH-与Na+结合成NaOH,所以d处得到较浓的NaOH溶液,c处得到HClO4,故C正确;D.电解NaClO4溶液生成HClO4时阳极电极反应式为2H2O-4e-4H++O2↑,转移2 mol电子则生成2 mol H+,即生成2 mol HClO4,m(HClO4)=nM=2 mol×100.5 g·mol-1=201 g,故D错误。]
14.C [A.由图可知,环氧乙烷与水反应生成乙二醇,反应过程中氢离子为催化剂,则制备乙二醇总反应为+H2O,A正确;B.氧的电负性强于碳,从而使得碳氧键的共用电子对偏向氧,故H+进攻环氧乙烷中的氧原子,B正确;C.由图可知,X的结构简式为,C错误;D.根据图示可知,二甘醇的分子式为C4H10O3,D正确。]
15.C [A.化学平衡常数与温度和反应有关,图a、b和c反应区温度维持恒定且相等,仅发生反应2HI(g)H2(g)+I2(g),故图a、b、c装置的化学平衡常数相等,K(a)=K(b)=K(c)=,A项错误;B.图a装置中列三段式
,
HI(g)分解率为×100%=20%,B项错误;C.图b装置中80 s时反应区I2(g)的物质的量为0.3 mol,则消耗HI(g)物质的量为0.6 mol、生成H2物质的量为0.3 mol,80 s时反应区HI(g)物质的量为1 mol-0.6 mol=0.4 mol,80 s时图b反应区处于瞬时平衡状态,其化学平衡常数K(b)=,该反应前后气体分子数不变,可用物质的量代入平衡常数表达式,选择性膜1只使H2通过而离开体系,则反应区瞬时平衡时,解得n(H2)反应区=,则前80 s内H2的平均渗透速率约为=3.6×10-3 mol·s-1,C项正确;D.图c装置中,选择性膜2使H2(g)和I2(g)通过而离开体系,故80 s时c装置反应区I2(g)物质的量x不一定大于0.3,D项错误。]
16.D [A.浓硫酸与蔗糖反应生成二氧化硫气体,能使品红溶液褪色,A正确;B.饱和食盐水与电石反应生成乙炔气体,能使溴的CCl4溶液褪色,B正确;C.Na2S与AlCl3在水溶液中反应生成氢氧化铝沉淀和硫化氢气体,足量硫化氢通入H2SO3溶液生成硫单质,产生淡黄色浑浊,C正确;D.浓氨水与生石灰反应生成氨气,足量氨气通入CuSO4溶液,先生成蓝色沉淀,后沉淀溶解得到深蓝色溶液,D错误。]
“1-16”选择题标准卷(八)
选择题(本大题共16小题,每小题3分,共48分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.下列不属于新能源的是 ( )
A.潮汐能 B.波浪能
C.石油 D.氢能
2.工业上利用焦炭还原石英砂制备含有少量杂质的粗硅,将粗硅转化为三氯硅烷,再经氢气还原得到高纯硅。下列说法不正确的是 ( )
A.石英砂的主要成分是SiO2
B.焦炭过多容易生成副产物SiC
C.制备三氯硅烷的反应:Si+3HClSiHCl3+H2
D.高纯硅导电性好,可用于制作计算机、通讯设备和家用电器等的芯片
3.化学用语是化学专业术语。下列化学用语错误的是 ( )
A.基态Cu原子的价层电子排布式为3d104s1
B.AsH3分子的VSEPR模型为
C.乙炔分子中π键的形成表示为
D.基态Ca原子核外电子占据的最高能级原子轨道示意图为
4.物质的性质决定用途,下列两者对应关系不正确的是 ( )
A.Na2S2O3溶液具有氧化性,可用酸式滴定管盛放
B.铝粉与NaOH溶液能反应生成H2,可用于疏通厨卫管道
C.单质硫为非极性分子,附着硫的试管可用CS2洗涤
D.青铜比纯铜熔点低、硬度大、耐腐蚀,古代用青铜铸剑
5.利用下列装置和试剂进行实验,不能达到实验目的的是 ( )
① ②
③ ④
A.图①装置可用于测定镁和稀硫酸反应速率
B.图②装置可用于比较碳酸钠和碳酸氢钠的稳定性
C.图③装置可用于分离、提纯有机化合物
D.图④装置可用于实验室制氨气
6.物质的组成、结构和性质用途往往相互关联,下列说法不正确的是 ( )
A.石墨中每层的碳原子的p轨道相互平行而重叠,电子可在碳原子平面运动而导电
B.不锈钢中掺杂的合金元素主要是Cr和Ni,具有很强的抗腐蚀能力
C.玛瑙常无规则几何外形,是由于熔融态的SiO2快速冷却而致
D.“可燃冰”是水分子以氢键相连笼穴内装有甲烷等气体,结构稳定,常温常压下不会分解
7.根据材料的组成、结构和性能可决定其行为,下列推测不合理的是 ( )
选项 材料 组成、结构和性能 行为
A 二氧化硫 强还原性 漂白剂、消毒剂
B 本尼迪特试剂 柠檬酸钠、碳酸钠、硫酸铜 医疗上的尿糖检验
C 烷烃 较高温度下会发生分解 制备炭和氢气
D 氯化镁、硫酸钙 能使蛋白质聚沉 制作兰溪游埠豆腐
8.下列有关实验设计、操作说法正确的是 ( )
A.甲图可用于制备Fe(OH)3胶体
B.乙图在溶液中加入一些氨水,制成铜氨溶液,可使镀层光亮
C.丙图是转移操作
D.丁图配成同浓度的溶液,有利于比较乙醇和苯酚中羟基的活性
9.下列有关实验方案设计、现象和结论都正确的是 ( )
选项 实验方案 现象 结论
A 将某烃进行核磁共振氢谱检测 谱图出现两组吸收峰 该烃可能为丙烷
B 将乙醇和浓硫酸共热后生成的气体通入溴水中 溴水褪色 该气体为乙烯
C 向乙醇和酸性重铬酸钾溶液充分反应后的溶液中滴加石蕊 溶液变红 乙醇被氧化为乙酸
D 往废水中滴入氯化铁溶液 出现紫色沉淀 该废水中含有酚类物质
10.高分子Y是一种人工合成的多肽,其合成路线如下。
下列说法不正确的是 ( )
A.F中含有2个酰胺基
B.高分子Y水解可得到E和G
C.高分子X中存在氢键
D.高分子Y的合成过程中进行了官能团保护
11.B、Al、Ga位于元素周期表中第ⅢA族。BF3为无色气体,主要用作有机合成中的催化剂,极易水解生成HBF4(HBF4在水中完全电离为H+和B)和硼酸(H3BO3)。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下Al2O3和焦炭在氯气的氛围中获得AlCl3。GaN的结构与晶体硅类似,是第三代半导体研究的热点。下列化学反应表示不正确的是 ( )
A.制备B(OCH3)3:H3BO3+3CH3OHB(OCH3)3↑+3H2O
B.BF3和NaOH溶液反应:4BF3+6OH-3B+3H2O
C.高温下Al2O3、焦炭在氯气中反应:Al2O3+3C+3Cl22AlCl3+3CO
D.电解Al2O3(熔融)制备Al的阳极反应:2O2--4e-O2↑
12.硒(34Se)在医药、催化、材料等领域有广泛应用,乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下图所示。关于硒及其化合物,下列说法不正确的是 ( )
A.Se原子在周期表中位于p区
B.乙烷硒啉分子中,C原子的杂化类型有sp2、sp3
C.乙烷硒啉分子中有5种不同化学环境的氢原子
D.键角大小:气态SeO3
A.上述装置中,f极为光伏电池的正极
B.a、b处均通入NaClO4溶液
C.d处得到较浓的NaOH溶液,c处得到HClO4溶液
D.若转移2 mol电子,理论上生成100.5 g NaClO4
14.酸性条件下,环氧乙烷水合法制备乙二醇涉及的机理如图所示:下列说法不正确的是 ( )
A.制备乙二醇总反应为+H2O
B.H+进攻环氧乙烷中的氧原子是因为碳氧键的共用电子对偏向氧
C.X的结构简式为
D.二甘醇的分子式是C4H10O3
15.某小组利用不同膜反应器(可选择性地让某些气体通过而离开体系)研究HI的分解率,工作原理如下图所示。图a、b和c反应区温度维持恒定且相等,仅发生2HI(g)H2(g)+I2(g)且在反应区内进行。投料均为1 mol的HI(g),反应同时开始,80 s时图b反应区处于瞬时平衡状态,其化学平衡常数K(b)=。
图a装置 图b装置 图c装置
80 s时反应区I2(g) 的物质的量/mol 0.10 0.30 x
下列说法正确的是 ( )
A.图a装置的化学平衡常数K(a)<
B.图a装置中,HI(g)分解率为10%
C.图b装置中,前80 s内H2的平均渗透速率约为3.6×10-3 mol·s-1
D.图c装置中,x一定大于0.3
16.将X滴入圆底烧瓶中与Y发生反应,产生足量气体通入Z中,Z中实验现象错误的是 ( )
选项 X Y Z Z中实验现象
A 浓硫酸 蔗糖 品红溶液 褪色
B 饱和食盐水 电石 溴的CCl4 溶液 褪色
C 饱和Na2S溶液 AlCl3 H2SO3溶液 溶液变浑浊
D 浓氨水 生石灰 CuSO4溶液 有蓝色絮状沉淀
参考答案
“1-16”选择题标准卷(八)
1.C 2.D 3.B 4.A
5.D [A.镁和稀硫酸反应生成氢气,通过注射器测量单位时间内生成气体的体积,测定镁和稀硫酸反应速率,A正确;B.碳酸氢钠受热分解产生二氧化碳,二氧化碳可以使澄清石灰水变浑浊,碳酸钠受热不分解,图②装置可用于比较碳酸钠和碳酸氢钠的稳定性,B正确;C.利用不同有机物在固定相和流动相中的相对吸附或溶解能力差异来分离、提纯有机化合物,该方法为色谱法,图③装置可用于分离、提纯有机化合物,C正确;D.硝酸铵是一种铵盐,受猛烈撞击或受热会发生爆炸性分解,不能用来制备氨气,D错误。]
6.D [A.石墨中每层的碳原子的p轨道相互平行而重叠,故电子可在碳原子平面运动而导电,A正确;B.在钢铁中掺杂Cr和Ni形成不锈钢,使其具有很强的抗腐蚀能力,B正确;C.熔融态的二氧化硅冷却过快得到没有晶体外形的玛瑙,缓慢冷却得到水晶晶体,C正确;D.常温常压下,冰会融化为水,因此常温常压下可燃冰的结构不稳定,会分解,D错误。]
7.A [A项,二氧化硫能和有色物质结合,可以做漂白剂;二氧化硫能杀灭病菌,能做消毒剂,A错误;B项,本尼迪特试剂是斐林试剂的改良试剂,可以检验还原性糖,故能用于医疗上的尿糖检验,B正确;C项,烷烃含有碳、氢元素,可以用于高温下分解制取炭和氢气,C正确;D项,氯化镁、硫酸钙能破坏胶体的介稳性,使得其发生聚沉,用于制作兰溪游埠豆腐,D正确。]
8.B [A.甲图中Fe2(SO4)3水解生成H2SO4为难挥发性酸,不能制胶体Fe(OH)3,应选用饱和FeCl3溶液,A错误;B.镀铜时,加入氨水可以生成铜配离子,使铜离子浓度降低,而且配合物平衡的存在能使铜离子浓度稳定在一定的范围内,这样使镀层更加紧密均匀光亮,工业上常采用这种方法,B正确;C.转移时,玻璃棒应靠在容量瓶刻度线以下,C错误;D.通常用活泼金属与羟基的反应来比较乙醇和苯酚中羟基的活性,而加水配置成溶液后,活泼金属会优先与水反应,无法达到目的,D错误。]
9.A [A.将某烃进行核磁共振氢谱检测,谱图出现两组吸收峰,说明有两种环境的H原子,丙烷有两种环境的H原子,该烃可能是丙烷,A正确;B.将乙醇和浓硫酸共热后生成的乙烯气体中混有SO2,SO2也能使溴水褪色,则该操作不能证明气体为乙烯,B错误;C.乙醇和酸性重铬酸钾溶液充分反应后的溶液呈酸性可能是因为溶液中原本就存在的H+,该操作不能说明乙醇被氧化为乙酸,C错误;D.酚类物质遇FeCl3溶液,溶液变为紫色,但不是紫色沉淀,D错误。]
10.B [A.由结构简式可知,F中含有2个酰胺基,A正确,B.由结构简式可知,高分子Y一定条件下发生水解反应生成和,B错误;C.由结构简式可知,高分子X中含有的酰胺基能形成氢键,C正确;D.由结构简式可知,E分子和高分子Y中都含有氨基,则高分子Y的合成过程中进行了官能团氨基的保护,D正确。]
11.B [A.根据硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],则制备B(OCH3)3:H3BO3+3CH3OHB(OCH3)3↑+3H2O,故A正确;B.BF3为无色气体,主要用作有机合成中的催化剂,极易水解生成HBF4(HBF4在水中完全电离为H+和B)和硼酸(H3BO3),硼酸是一元弱酸,则BF3和NaOH溶液反应:4BF3+4OH-3B+H2O,故B错误;C.高温下Al2O3和焦炭在氯气的氛围中获得AlCl3,则高温下Al2O3、焦炭在氯气中反应:Al2O3+3C+3Cl22AlCl3+3CO,故C正确;D.电解Al2O3(熔融)制备Al的阳极反应:2O2--4e-O2↑,故D正确。]
12.D [A.Se原子在周期表的位置是第四周期第ⅥA族,价层电子排布式为4s24p4,位于p区,A正确;B.乙烷硒啉分子中,C原子的杂化类型有sp2、sp3,苯环上的C为sp2杂化,上带*号的C为sp3杂化,B正确;C.乙烷硒啉分子中有5种不同化学环境的氢原子,C正确;D.SeO3中硒原子的价层电子对数为3,孤电子对数为0,分子的空间结构为平面三角形,键角为120°,Se中硒原子的价层电子对数4,孤电子对数为1,离子的空间结构为三角锥形,键角小于120°,键角大小:气态SeO3>Se,D错误。]
13.C [根据钠离子通过离子交换膜的移动方向可知:电解池左侧为阳极,与光伏电池的正极e相接,f极为光伏电池的负极,阳极H2O失去电子生成氧气和氢离子,电极反应式为2H2O-4e-4H++O2↑,生成的H+与加入的a物质结合成高氯酸,所以a为高氯酸钠,电解池右侧阴极上H2O得电子发生还原反应生成氢气和氢氧根离子,电极反应式为2H2O+2e-2OH-+H2↑,OH-与Na+结合成NaOH,所以物质b为稀NaOH溶液,以此来解答。A.图中Na+由左侧移动到右侧,即电解池左侧为阳极,阳极电极与光伏电池的正极相接,所以e极为光伏电池的正极、f极为负极,故A错误;B.由以上分析可知,物质b为稀NaOH溶液,故B错误;C.左侧阳极上生成的H+与加入的高氯酸钠结合成高氯酸,右侧阴极上生成的OH-与Na+结合成NaOH,所以d处得到较浓的NaOH溶液,c处得到HClO4,故C正确;D.电解NaClO4溶液生成HClO4时阳极电极反应式为2H2O-4e-4H++O2↑,转移2 mol电子则生成2 mol H+,即生成2 mol HClO4,m(HClO4)=nM=2 mol×100.5 g·mol-1=201 g,故D错误。]
14.C [A.由图可知,环氧乙烷与水反应生成乙二醇,反应过程中氢离子为催化剂,则制备乙二醇总反应为+H2O,A正确;B.氧的电负性强于碳,从而使得碳氧键的共用电子对偏向氧,故H+进攻环氧乙烷中的氧原子,B正确;C.由图可知,X的结构简式为,C错误;D.根据图示可知,二甘醇的分子式为C4H10O3,D正确。]
15.C [A.化学平衡常数与温度和反应有关,图a、b和c反应区温度维持恒定且相等,仅发生反应2HI(g)H2(g)+I2(g),故图a、b、c装置的化学平衡常数相等,K(a)=K(b)=K(c)=,A项错误;B.图a装置中列三段式
,
HI(g)分解率为×100%=20%,B项错误;C.图b装置中80 s时反应区I2(g)的物质的量为0.3 mol,则消耗HI(g)物质的量为0.6 mol、生成H2物质的量为0.3 mol,80 s时反应区HI(g)物质的量为1 mol-0.6 mol=0.4 mol,80 s时图b反应区处于瞬时平衡状态,其化学平衡常数K(b)=,该反应前后气体分子数不变,可用物质的量代入平衡常数表达式,选择性膜1只使H2通过而离开体系,则反应区瞬时平衡时,解得n(H2)反应区=,则前80 s内H2的平均渗透速率约为=3.6×10-3 mol·s-1,C项正确;D.图c装置中,选择性膜2使H2(g)和I2(g)通过而离开体系,故80 s时c装置反应区I2(g)物质的量x不一定大于0.3,D项错误。]
16.D [A.浓硫酸与蔗糖反应生成二氧化硫气体,能使品红溶液褪色,A正确;B.饱和食盐水与电石反应生成乙炔气体,能使溴的CCl4溶液褪色,B正确;C.Na2S与AlCl3在水溶液中反应生成氢氧化铝沉淀和硫化氢气体,足量硫化氢通入H2SO3溶液生成硫单质,产生淡黄色浑浊,C正确;D.浓氨水与生石灰反应生成氨气,足量氨气通入CuSO4溶液,先生成蓝色沉淀,后沉淀溶解得到深蓝色溶液,D错误。]
同课章节目录
