10.3常见的盐第1课时 氯化钠课件 (共30张PPT)2024-2025学年九年级化学人教版2024下册
文档属性
| 名称 | 10.3常见的盐第1课时 氯化钠课件 (共30张PPT)2024-2025学年九年级化学人教版2024下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-07 18:49:41 | ||
图片预览









文档简介
(共30张PPT)
课题3 常见的盐
人教版九年级化学下同步教学课件
第十单元 常见的酸、碱、盐
第1课时 氯化钠
学习目标:
2.学习氯化钠的性质及主要用途。
1. 复习回顾盐的概念,认识生活中常见的盐。
3.充分认识到生活中处处有化学、了解我国科学家做出的杰出贡献,从而激发爱国热情和学习激情。
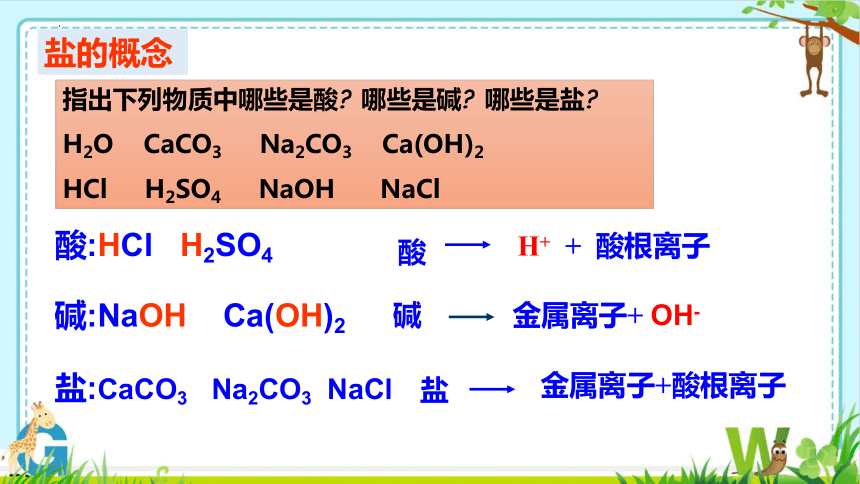
指出下列物质中哪些是酸 哪些是碱 哪些是盐
H2O CaCO3 Na2CO3 Ca(OH)2
HCl H2SO4 NaOH NaCl
酸:HCl H2SO4
碱:NaOH Ca(OH)2
盐:CaCO3 Na2CO3 NaCl
盐的概念
酸
H+ + 酸根离子
碱
金属离子+ OH-
盐
金属离子+酸根离子
,
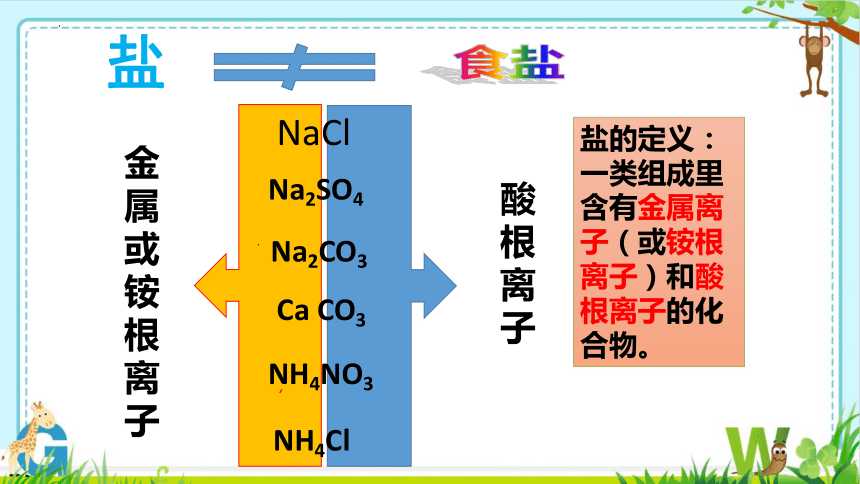
盐
Ca CO3
NaCl
NH4Cl
NH4NO3
Na2CO3
Na2SO4
金属或铵根离子
酸根离子
盐的定义:一类组成里含有金属离子(或铵根离子)和酸根离子的化合物。
Na2SO4
NaNO3
NaCl
Na2CO3
CaSO4
Ca(NO3)2
CaCl2
CaCO3
(NH4)2SO4
NH4NO3
NH4Cl
(NH4)2CO3
钠盐
钙盐
铵盐
硫酸盐
硝酸盐
碳酸盐
盐酸盐
盐的命名及分类
根据所含阴离子分类
根据所含阳离子分类
读法:酸根离子+阳离子
二、氯化钠(NaCl)
白色固体,有咸味。易溶于水,其溶解度随温度的变化影响很小。
1.物理性质
你看到过粗盐在夏天“出汗”吗?这是粗盐里含的杂质(CaCl2,MgCl2)吸收空气里的水分变潮的结果,纯净的食盐是不容易受潮的。
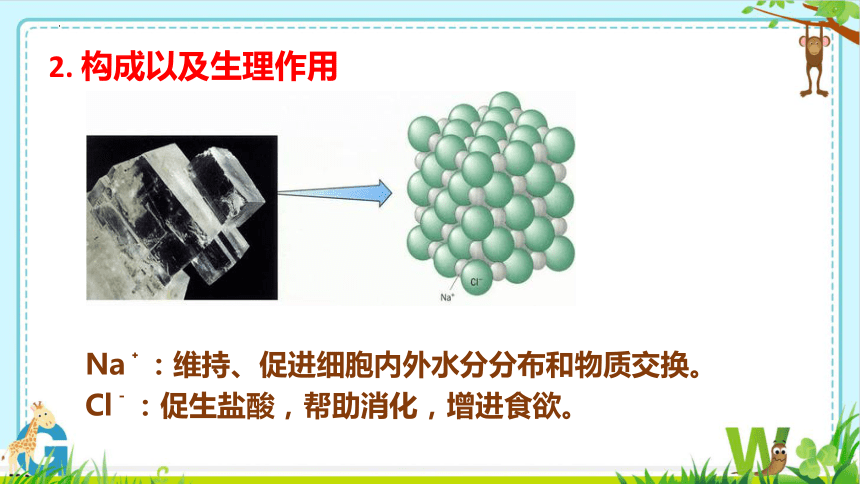
2. 构成以及生理作用
Na﹢:维持、促进细胞内外水分分布和物质交换。
Cl﹣:促生盐酸,帮助消化,增进食欲。
3. 氯化钠的用途
(1)医疗上用NaCl来配制生理盐水。
(2)农业上用NaCl溶液来选种。
(3)工业上用NaCl为原料制取Na2CO3 、NaOH、Cl2 和盐酸等。
(4)生活中作调味品。
(5)作融雪剂。
交通上消除公路上的积雪
工业上做化工原料
农业上用食盐水选种
医疗上配生理盐水
生活上做调味品
亚硝酸钠
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
4. 氯化钠在自然界中的分布
海水,盐湖,盐井,盐矿
(1)晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐。
(2)粗盐通过溶解、沉淀、过滤、蒸发、结晶等处理,可以得到初步提纯。
粗盐
5. 粗盐的初步提纯
粗盐
可溶性:MgCl2、CaCl2等
不溶性:泥沙
【实验步骤】
(2)溶解
玻璃棒:搅拌,加速溶解
称取粗盐/g 剩余粗盐/g 溶解粗盐/g
10.0 2.5 7.5
(1)称量
(3)过滤:
一贴、二低、三靠 玻璃棒:引流
(4)蒸发结晶
(1)玻璃棒:搅拌,防止因局部温度过高,造成液滴飞溅
(2)待蒸发皿中出现较多固体时停止加热
(5)计算产率
溶解粗盐/g 精盐/g 精盐产率/g
7.5 6.8 90.7%
经典例题
例1.食盐是重要的调味品,精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是( )
A. 蒸发 B. 吸附 C. 过滤 D. 溶解
【解析】粗盐提纯第一步溶解,第二步过滤,第三步蒸发结晶。故选B
B
【解析】A、氯化钙是钙离子和氯离子构成的化合物,符合盐的特点,属于盐,选项错误;B、氧化钙由钙元素与氧元素组成,符合氧化物的特点,属于氧化物,不属于盐,选项错误;C、碳酸钙是钙离子与碳酸根离子构成的化合物,符合盐的特点,属于盐,选项错误;D、硫酸钙是钙离子与硫酸根离子构成的化合物,符合盐的特点,属于盐,选项错误;故选B。
B
例2.下列物质不属于盐的是( )
A. 氯化钙 B. 氧化钙 C. 碳酸钙 D. 硫酸钙
D
例3.物质的分类非常重要。下列按酸、碱、盐的顺序排列的一组是( )
A. H2SO4、Na2CO3、NaCl B. Ca(OH)2、HCl、Na2SO4
C. NaOH、H2CO3、NaCl D. H2SO4、NaOH、Na2CO3
【解析】A、H2SO4由氢离子和酸根离子组成,属于酸,Na2CO3由钠离子和酸根离子组成,属于盐,NaCl是由钠离子和酸根离子组成,属于盐,故A错误;B、Ca(OH)2由钙离子和氢氧根离子组成,属于碱,HCl由氢离子和酸根离子组成,属于酸,Na2SO4由钠离子和酸根离子组成,属于盐,故B错误;C、H2CO3由氢离子和酸根离子组成,属于酸,NaOH由钠离子和氢氧离子根组成,属于碱,NaCl是由钠离子和酸根离子组成,属于盐,故C错误;D、H2SO4由氢离子和酸根离子组成,属于酸,NaOH由钠离子和氢氧离子根组成,属于碱,Na2CO3由钠离子和酸根离子组成,属于盐,符合题目要求,故D正确。故选D。
例4.下列各项不属于NaCl用途的是( )
A. 做净水剂 B. 生产烧碱
C. 做调味品 D. 生产氯气
【解析】氯化钠含有钠元素用途的是生产烧碱,食盐的主要成分是氯化钠故可做调味品,氯化钠含有氯元素用途的是还可以生产氯气。故选A。
A
例5.盐是一类物质,有的能食用,有的不能食用。误作食盐使用会引起中毒死亡的是( )
A.NaNO3 B.Na2CO3
C.KCl D.NaNO2
【解析】NaN02亚硝酸钠外观与食盐相似,有咸味,但是它有毒,能使人中毒,所以正确.故选D.
D
例6.化学就在我们身边,它与我们的生活和生产息息相关。现有如下几种物质:
A.熟石灰 B.石墨 C.盐酸 D.氯化钠
请用上述物质的字母序号填空(每空只填一种物质):
(1)生活中重要的调味品是___________。
(2)可用于制铅笔芯的是___________。
(3)能用于改良酸性土壤的是___________。
(4)可用于金属除锈的是___________。
【答案】(1)D (2)B(3)A(4)C
【解析】(1)食盐具有咸味,常用作调味品和防腐剂。(2)石墨质软,能在纸上留下灰黑色的痕迹,可用来制铅笔芯。(3)氢氧化钙具有碱性,属于碱,可用于改良酸性土壤。(4)可用于金属表面除锈的是盐酸。
2.学习氯化钠的性质及主要用途。
1. 复习回顾了盐的概念,认识生活中常见的盐。
3.了解了海水晒盐,粗盐初步提純的一般过程。
课堂小结
随堂练习
1. “一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是( )
A.熟石灰 B.碳酸钾
C.乙醇 D.烧碱
B
【解析】 碳酸钾是由钾离子与碳酸根离子构成的化合物,属于盐。
2.下列属于纯净物的是( )
A.盐酸 B.加碘食盐
C.碳酸钙 D.加热KMnO4后剩余的固体
【解析】A、盐酸中含有氯化氢和水,属于混合物,故A错; B、加碘食盐中含有碘酸钾和氯化钠,属于混合物,故B错;
C、碳酸钙是由一种物质组成,属于纯净物,故C正确;
D、加热KMnO4后剩余的固体中含有锰酸钾、二氧化锰,属于混合物,故D错.故选C.
C
3. 食盐中含有氯化钠。下列说法错误的是 ( )
A.食盐是重要的调味品,需要密封保存
B.医疗上的生理盐水是用氯化钠配制成的
C.可用食盐腌渍蔬菜、鱼、肉、蛋等,不仅风味独特,还可延长保质期
D.氯化钠可用作融雪剂
【解析】A、食盐是重要的调味品,不具有挥发性、吸水性等,也不与空气成分发生反应,不需要密封保存,故选项说法错误。B、生理盐水是0.9%的氯化钠溶液,医疗上的生理盐水是用氯化钠配制成的,故选项说法正确。C、可用食盐腌渍蔬菜、鱼、肉、蛋等,不仅风味独特,还可延长保质期,故选项说法正确。D、氯化钠溶于水形成的溶液,凝固点降低,可用作融雪剂,故选项说法正确。故选:A。
A
【解析】A、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程,无需进行蒸馏。故选:D。
D
4.做“粗盐中难溶性杂质的去除”实验时,不需要进行的操作是 ( )
A.溶解 B.过滤 C.蒸发 D.蒸馏
【解析】H2SO4解离出的阳离子全部是H+,属于酸类物质;CaCO3由金属离子和酸根离子构成,属于盐类物质;
Ca(OH)2解离出的阴离子全部是OH-,属于碱类物质;
MnO2由两种元素组成,其中一种元素是氧元素,属于氧化物。
B
5.下列物质属于盐的是( )
A.H2SO4 B.CaCO3
C.Ca(OH)2 D.MnO2
6.提纯含少量泥沙的粗盐样品,实验过程和氯化钠的溶解度数据如下:
(1)20 ℃时氯化钠的溶解度是________g/100 g水。
(2)该实验是利用泥沙难溶于水而氯化钠_______________________的性质进行提纯,操作Ⅲ的名称是_______________。
(3)关于蒸发叙述正确的是_______(选填编号)。
a、蒸发是通过加热的方法将水汽化除去
b、所需仪器为酒精灯、蒸发皿、温度计
c、搅拌可以防止蒸发过程中食盐水飞溅
d、加热过程中用试管夹夹住蒸发皿移动,使其均匀受热
(4)溶解时,加入水的合适的量约为______(选填“15”、“30”或“60”)mL,理由是_______________。
温度(℃) 溶解度(g/100g水)
20 36.0
40 36.6
60 37.3
【答案】(1)36.0 (2)易溶于水 过滤 (3)ac (4)30 20 ℃时,氯化钠的溶解度为36 g/100 g水,实验中称取的粗盐质量为10 g,加入约30 mL水既可使粗盐中的氯化钠充分溶解,又不会因加水过多而影响后续蒸发操作的效率
【解析】(1)由题中信息可知,20℃时氯化钠的溶解度是36.0gc(2)氯化钠易溶于水,而泥沙不溶于水,加水后成为氯化钠溶液和难溶性固体的混合物,过滤将溶液和泥沙分离。(3)蒸发是通过加热的方法使水变成水蒸气逸散到空气,而除掉水;蒸发过程中用玻璃棒搅拌,可以使液体受热均匀,防止蒸发过程中食盐水受热不均而飞溅。(4)10g粗盐中氯化钠的质量小于10g,20℃时,氯化钠的溶解度为36g,实验中称取的粗盐质量为10g,加入约30mL水既可使粗盐中的氯化钠充分溶解,又不会因加水过多而影响后续蒸发操作的效率。
化学就象你头顶上的果实,
只要肯稍作努力,成功的
甜蜜就属于你!
祝你成功!
See You
课题3 常见的盐
人教版九年级化学下同步教学课件
第十单元 常见的酸、碱、盐
第1课时 氯化钠
学习目标:
2.学习氯化钠的性质及主要用途。
1. 复习回顾盐的概念,认识生活中常见的盐。
3.充分认识到生活中处处有化学、了解我国科学家做出的杰出贡献,从而激发爱国热情和学习激情。
指出下列物质中哪些是酸 哪些是碱 哪些是盐
H2O CaCO3 Na2CO3 Ca(OH)2
HCl H2SO4 NaOH NaCl
酸:HCl H2SO4
碱:NaOH Ca(OH)2
盐:CaCO3 Na2CO3 NaCl
盐的概念
酸
H+ + 酸根离子
碱
金属离子+ OH-
盐
金属离子+酸根离子
,
盐
Ca CO3
NaCl
NH4Cl
NH4NO3
Na2CO3
Na2SO4
金属或铵根离子
酸根离子
盐的定义:一类组成里含有金属离子(或铵根离子)和酸根离子的化合物。
Na2SO4
NaNO3
NaCl
Na2CO3
CaSO4
Ca(NO3)2
CaCl2
CaCO3
(NH4)2SO4
NH4NO3
NH4Cl
(NH4)2CO3
钠盐
钙盐
铵盐
硫酸盐
硝酸盐
碳酸盐
盐酸盐
盐的命名及分类
根据所含阴离子分类
根据所含阳离子分类
读法:酸根离子+阳离子
二、氯化钠(NaCl)
白色固体,有咸味。易溶于水,其溶解度随温度的变化影响很小。
1.物理性质
你看到过粗盐在夏天“出汗”吗?这是粗盐里含的杂质(CaCl2,MgCl2)吸收空气里的水分变潮的结果,纯净的食盐是不容易受潮的。
2. 构成以及生理作用
Na﹢:维持、促进细胞内外水分分布和物质交换。
Cl﹣:促生盐酸,帮助消化,增进食欲。
3. 氯化钠的用途
(1)医疗上用NaCl来配制生理盐水。
(2)农业上用NaCl溶液来选种。
(3)工业上用NaCl为原料制取Na2CO3 、NaOH、Cl2 和盐酸等。
(4)生活中作调味品。
(5)作融雪剂。
交通上消除公路上的积雪
工业上做化工原料
农业上用食盐水选种
医疗上配生理盐水
生活上做调味品
亚硝酸钠
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
4. 氯化钠在自然界中的分布
海水,盐湖,盐井,盐矿
(1)晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐。
(2)粗盐通过溶解、沉淀、过滤、蒸发、结晶等处理,可以得到初步提纯。
粗盐
5. 粗盐的初步提纯
粗盐
可溶性:MgCl2、CaCl2等
不溶性:泥沙
【实验步骤】
(2)溶解
玻璃棒:搅拌,加速溶解
称取粗盐/g 剩余粗盐/g 溶解粗盐/g
10.0 2.5 7.5
(1)称量
(3)过滤:
一贴、二低、三靠 玻璃棒:引流
(4)蒸发结晶
(1)玻璃棒:搅拌,防止因局部温度过高,造成液滴飞溅
(2)待蒸发皿中出现较多固体时停止加热
(5)计算产率
溶解粗盐/g 精盐/g 精盐产率/g
7.5 6.8 90.7%
经典例题
例1.食盐是重要的调味品,精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是( )
A. 蒸发 B. 吸附 C. 过滤 D. 溶解
【解析】粗盐提纯第一步溶解,第二步过滤,第三步蒸发结晶。故选B
B
【解析】A、氯化钙是钙离子和氯离子构成的化合物,符合盐的特点,属于盐,选项错误;B、氧化钙由钙元素与氧元素组成,符合氧化物的特点,属于氧化物,不属于盐,选项错误;C、碳酸钙是钙离子与碳酸根离子构成的化合物,符合盐的特点,属于盐,选项错误;D、硫酸钙是钙离子与硫酸根离子构成的化合物,符合盐的特点,属于盐,选项错误;故选B。
B
例2.下列物质不属于盐的是( )
A. 氯化钙 B. 氧化钙 C. 碳酸钙 D. 硫酸钙
D
例3.物质的分类非常重要。下列按酸、碱、盐的顺序排列的一组是( )
A. H2SO4、Na2CO3、NaCl B. Ca(OH)2、HCl、Na2SO4
C. NaOH、H2CO3、NaCl D. H2SO4、NaOH、Na2CO3
【解析】A、H2SO4由氢离子和酸根离子组成,属于酸,Na2CO3由钠离子和酸根离子组成,属于盐,NaCl是由钠离子和酸根离子组成,属于盐,故A错误;B、Ca(OH)2由钙离子和氢氧根离子组成,属于碱,HCl由氢离子和酸根离子组成,属于酸,Na2SO4由钠离子和酸根离子组成,属于盐,故B错误;C、H2CO3由氢离子和酸根离子组成,属于酸,NaOH由钠离子和氢氧离子根组成,属于碱,NaCl是由钠离子和酸根离子组成,属于盐,故C错误;D、H2SO4由氢离子和酸根离子组成,属于酸,NaOH由钠离子和氢氧离子根组成,属于碱,Na2CO3由钠离子和酸根离子组成,属于盐,符合题目要求,故D正确。故选D。
例4.下列各项不属于NaCl用途的是( )
A. 做净水剂 B. 生产烧碱
C. 做调味品 D. 生产氯气
【解析】氯化钠含有钠元素用途的是生产烧碱,食盐的主要成分是氯化钠故可做调味品,氯化钠含有氯元素用途的是还可以生产氯气。故选A。
A
例5.盐是一类物质,有的能食用,有的不能食用。误作食盐使用会引起中毒死亡的是( )
A.NaNO3 B.Na2CO3
C.KCl D.NaNO2
【解析】NaN02亚硝酸钠外观与食盐相似,有咸味,但是它有毒,能使人中毒,所以正确.故选D.
D
例6.化学就在我们身边,它与我们的生活和生产息息相关。现有如下几种物质:
A.熟石灰 B.石墨 C.盐酸 D.氯化钠
请用上述物质的字母序号填空(每空只填一种物质):
(1)生活中重要的调味品是___________。
(2)可用于制铅笔芯的是___________。
(3)能用于改良酸性土壤的是___________。
(4)可用于金属除锈的是___________。
【答案】(1)D (2)B(3)A(4)C
【解析】(1)食盐具有咸味,常用作调味品和防腐剂。(2)石墨质软,能在纸上留下灰黑色的痕迹,可用来制铅笔芯。(3)氢氧化钙具有碱性,属于碱,可用于改良酸性土壤。(4)可用于金属表面除锈的是盐酸。
2.学习氯化钠的性质及主要用途。
1. 复习回顾了盐的概念,认识生活中常见的盐。
3.了解了海水晒盐,粗盐初步提純的一般过程。
课堂小结
随堂练习
1. “一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是( )
A.熟石灰 B.碳酸钾
C.乙醇 D.烧碱
B
【解析】 碳酸钾是由钾离子与碳酸根离子构成的化合物,属于盐。
2.下列属于纯净物的是( )
A.盐酸 B.加碘食盐
C.碳酸钙 D.加热KMnO4后剩余的固体
【解析】A、盐酸中含有氯化氢和水,属于混合物,故A错; B、加碘食盐中含有碘酸钾和氯化钠,属于混合物,故B错;
C、碳酸钙是由一种物质组成,属于纯净物,故C正确;
D、加热KMnO4后剩余的固体中含有锰酸钾、二氧化锰,属于混合物,故D错.故选C.
C
3. 食盐中含有氯化钠。下列说法错误的是 ( )
A.食盐是重要的调味品,需要密封保存
B.医疗上的生理盐水是用氯化钠配制成的
C.可用食盐腌渍蔬菜、鱼、肉、蛋等,不仅风味独特,还可延长保质期
D.氯化钠可用作融雪剂
【解析】A、食盐是重要的调味品,不具有挥发性、吸水性等,也不与空气成分发生反应,不需要密封保存,故选项说法错误。B、生理盐水是0.9%的氯化钠溶液,医疗上的生理盐水是用氯化钠配制成的,故选项说法正确。C、可用食盐腌渍蔬菜、鱼、肉、蛋等,不仅风味独特,还可延长保质期,故选项说法正确。D、氯化钠溶于水形成的溶液,凝固点降低,可用作融雪剂,故选项说法正确。故选:A。
A
【解析】A、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程,无需进行蒸馏。故选:D。
D
4.做“粗盐中难溶性杂质的去除”实验时,不需要进行的操作是 ( )
A.溶解 B.过滤 C.蒸发 D.蒸馏
【解析】H2SO4解离出的阳离子全部是H+,属于酸类物质;CaCO3由金属离子和酸根离子构成,属于盐类物质;
Ca(OH)2解离出的阴离子全部是OH-,属于碱类物质;
MnO2由两种元素组成,其中一种元素是氧元素,属于氧化物。
B
5.下列物质属于盐的是( )
A.H2SO4 B.CaCO3
C.Ca(OH)2 D.MnO2
6.提纯含少量泥沙的粗盐样品,实验过程和氯化钠的溶解度数据如下:
(1)20 ℃时氯化钠的溶解度是________g/100 g水。
(2)该实验是利用泥沙难溶于水而氯化钠_______________________的性质进行提纯,操作Ⅲ的名称是_______________。
(3)关于蒸发叙述正确的是_______(选填编号)。
a、蒸发是通过加热的方法将水汽化除去
b、所需仪器为酒精灯、蒸发皿、温度计
c、搅拌可以防止蒸发过程中食盐水飞溅
d、加热过程中用试管夹夹住蒸发皿移动,使其均匀受热
(4)溶解时,加入水的合适的量约为______(选填“15”、“30”或“60”)mL,理由是_______________。
温度(℃) 溶解度(g/100g水)
20 36.0
40 36.6
60 37.3
【答案】(1)36.0 (2)易溶于水 过滤 (3)ac (4)30 20 ℃时,氯化钠的溶解度为36 g/100 g水,实验中称取的粗盐质量为10 g,加入约30 mL水既可使粗盐中的氯化钠充分溶解,又不会因加水过多而影响后续蒸发操作的效率
【解析】(1)由题中信息可知,20℃时氯化钠的溶解度是36.0gc(2)氯化钠易溶于水,而泥沙不溶于水,加水后成为氯化钠溶液和难溶性固体的混合物,过滤将溶液和泥沙分离。(3)蒸发是通过加热的方法使水变成水蒸气逸散到空气,而除掉水;蒸发过程中用玻璃棒搅拌,可以使液体受热均匀,防止蒸发过程中食盐水受热不均而飞溅。(4)10g粗盐中氯化钠的质量小于10g,20℃时,氯化钠的溶解度为36g,实验中称取的粗盐质量为10g,加入约30mL水既可使粗盐中的氯化钠充分溶解,又不会因加水过多而影响后续蒸发操作的效率。
化学就象你头顶上的果实,
只要肯稍作努力,成功的
甜蜜就属于你!
祝你成功!
See You
同课章节目录
