浙江省宁波市慈溪市J5共同体联盟2024-2025学年九年级(上)期末科学试卷(含答案)
文档属性
| 名称 | 浙江省宁波市慈溪市J5共同体联盟2024-2025学年九年级(上)期末科学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 411.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-02-08 13:54:10 | ||
图片预览

文档简介
浙江省宁波市慈溪市J5共同体联盟2024-2025学年九年级(上)期末科学试卷
一、选择题:本大题共15小题,共45分。
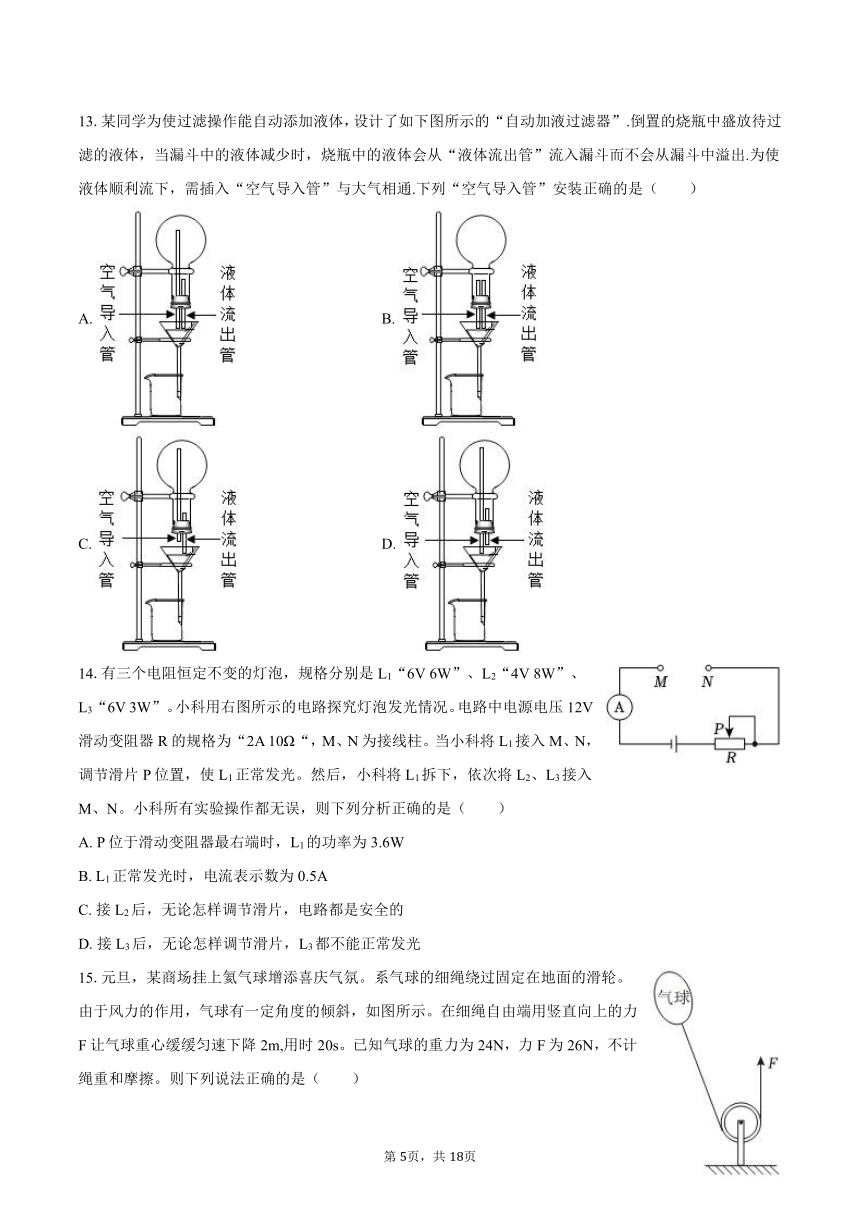
1.古代的农耕社会,到当下的现代文明,“逐水而居”的理念基本贯穿了中华文明族群繁衍与发展,人们喜欢住所附近有河流或湖泊,其原因之一是那里相对来说“冬暖夏凉”,这主要是因为水的哪个性质( )
A. 易蒸发 B. 较大的比热容 C. 较低的凝固点 D. 较高的沸点
2.科学实验要规范操作,下列实验操作你认为正确的是( )
A. 稀释浓硫酸 B. 干燥氧气
C. 测定某溶液的 pH D. 检查气密性
3.肉类的鲜度可以通过测试pH来判断。有资料显示,pH与肉类新鲜度的关系如表,则新鲜肉在变质过程中酸性如何变化( )
名称 新鲜肉 次鲜肉 变质肉
pH 5.8~6.2 6.3~6.6 >6.6
A. 变强 B. 变弱 C. 不变 D. 无法确定
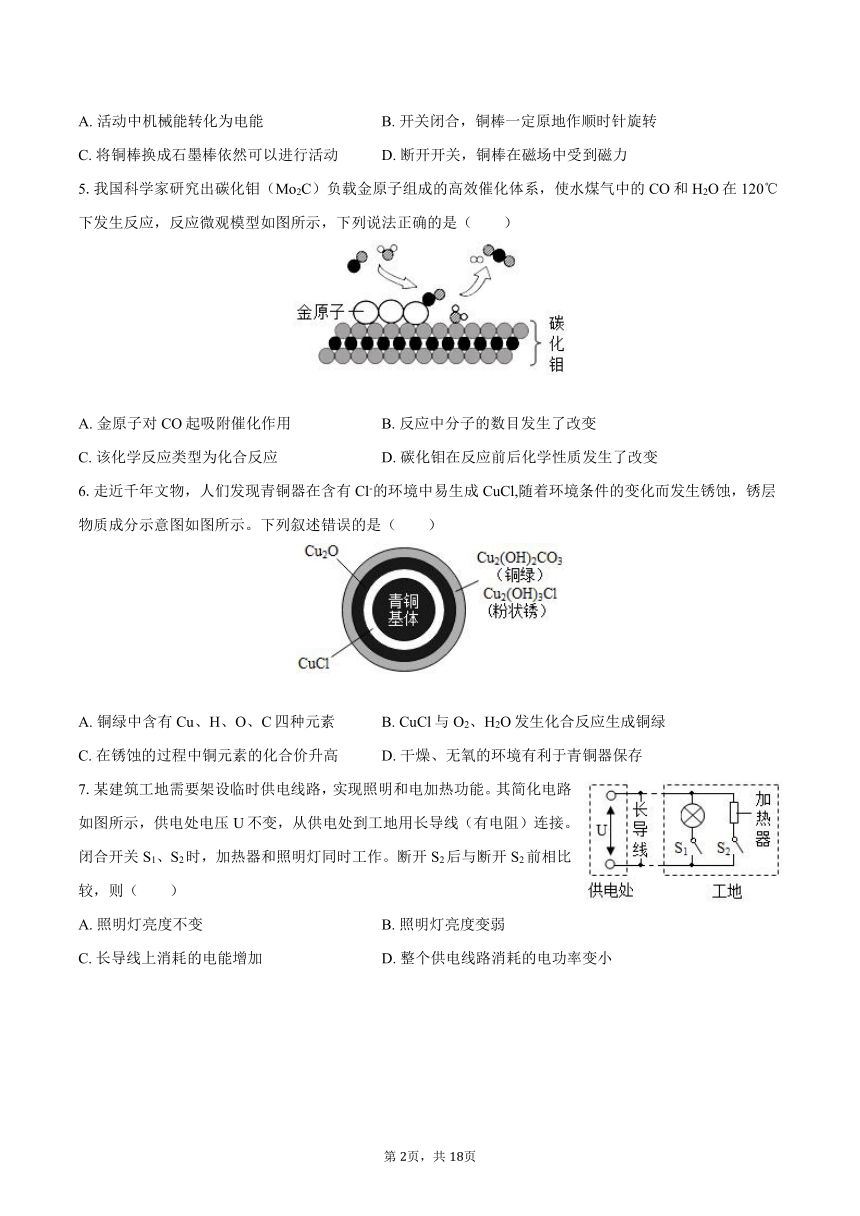
4.小科进行“观察通电导体在磁场中的受力情况”的活动,如图所示。实验中,他在轨道上放置的是一根铜棒。关于这个活动,下列说法正确的是( )
A. 活动中机械能转化为电能 B. 开关闭合,铜棒一定原地作顺时针旋转
C. 将铜棒换成石墨棒依然可以进行活动 D. 断开开关,铜棒在磁场中受到磁力
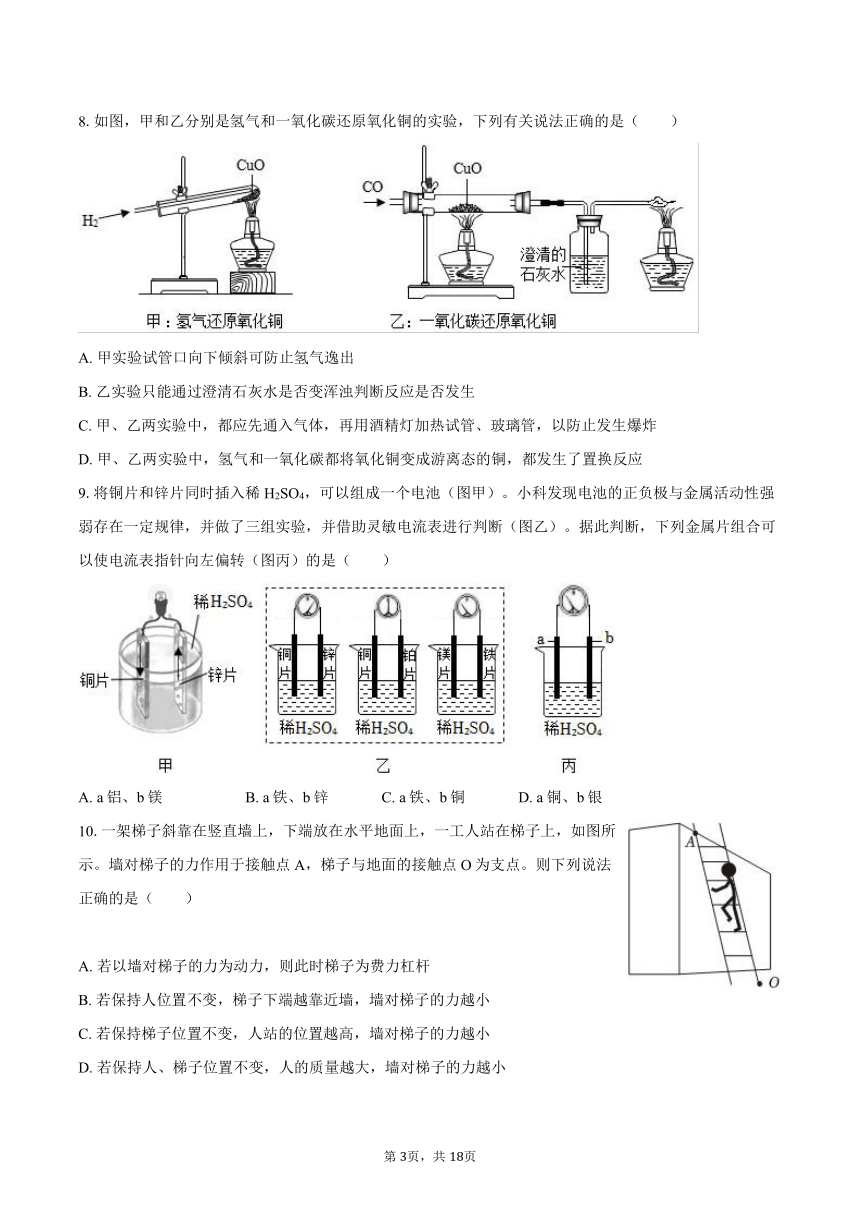
5.我国科学家研究出碳化钼(Mo2C)负载金原子组成的高效催化体系,使水煤气中的CO和H2O在120℃下发生反应,反应微观模型如图所示,下列说法正确的是( )
A. 金原子对CO起吸附催化作用 B. 反应中分子的数目发生了改变
C. 该化学反应类型为化合反应 D. 碳化钼在反应前后化学性质发生了改变
6.走近千年文物,人们发现青铜器在含有Cl-的环境中易生成CuCl,随着环境条件的变化而发生锈蚀,锈层物质成分示意图如图所示。下列叙述错误的是( )
A. 铜绿中含有Cu、H、O、C四种元素 B. CuCl与O2、H2O发生化合反应生成铜绿
C. 在锈蚀的过程中铜元素的化合价升高 D. 干燥、无氧的环境有利于青铜器保存
7.某建筑工地需要架设临时供电线路,实现照明和电加热功能。其简化电路如图所示,供电处电压U不变,从供电处到工地用长导线(有电阻)连接。闭合开关S1、S2时,加热器和照明灯同时工作。断开S2后与断开S2前相比较,则( )
A. 照明灯亮度不变 B. 照明灯亮度变弱
C. 长导线上消耗的电能增加 D. 整个供电线路消耗的电功率变小
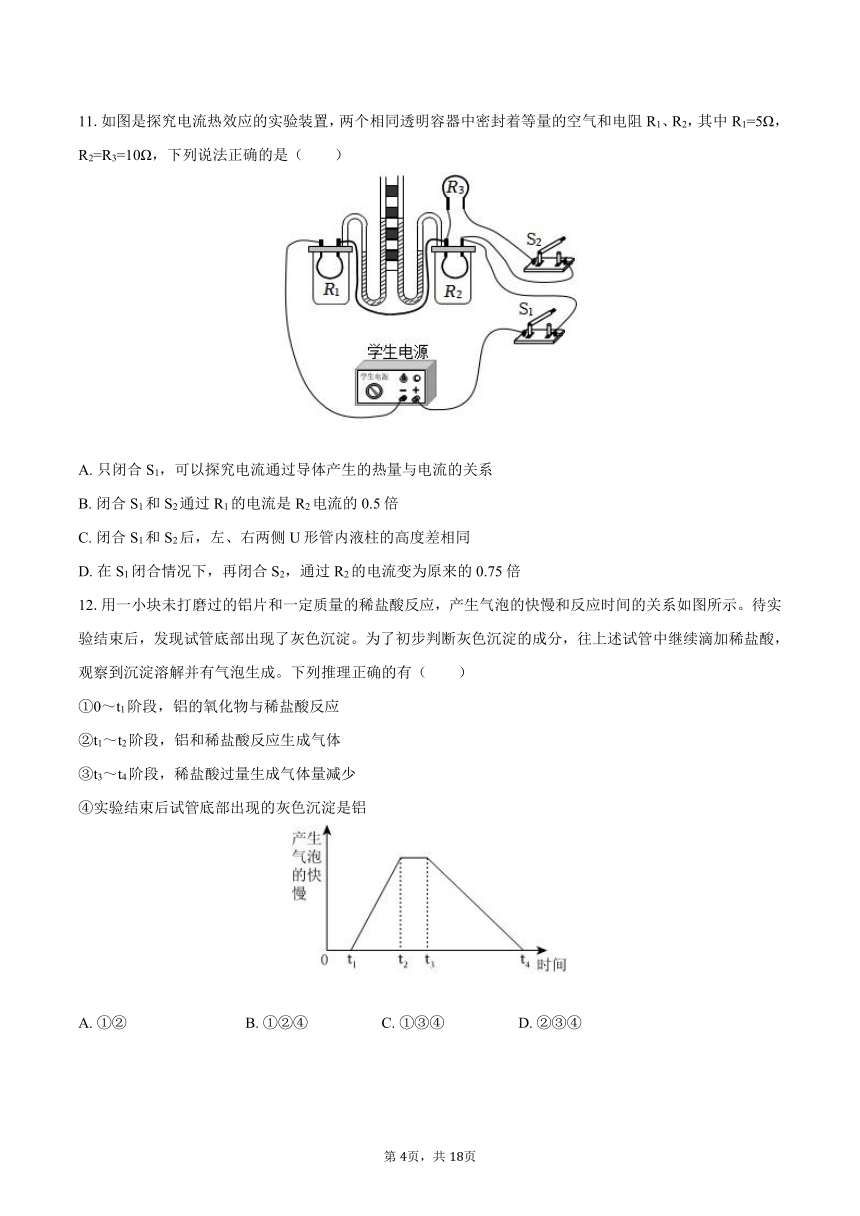
8.如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
A. 甲实验试管口向下倾斜可防止氢气逸出
B. 乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生
C. 甲、乙两实验中,都应先通入气体,再用酒精灯加热试管、玻璃管,以防止发生爆炸
D. 甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应
9.将铜片和锌片同时插入稀H2SO4,可以组成一个电池(图甲)。小科发现电池的正负极与金属活动性强弱存在一定规律,并做了三组实验,并借助灵敏电流表进行判断(图乙)。据此判断,下列金属片组合可以使电流表指针向左偏转(图丙)的是( )
A. a铝、b镁 B. a铁、b锌 C. a铁、b铜 D. a铜、b银
10.一架梯子斜靠在竖直墙上,下端放在水平地面上,一工人站在梯子上,如图所示。墙对梯子的力作用于接触点A,梯子与地面的接触点O为支点。则下列说法正确的是( )
A. 若以墙对梯子的力为动力,则此时梯子为费力杠杆
B. 若保持人位置不变,梯子下端越靠近墙,墙对梯子的力越小
C. 若保持梯子位置不变,人站的位置越高,墙对梯子的力越小
D. 若保持人、梯子位置不变,人的质量越大,墙对梯子的力越小
11.如图是探究电流热效应的实验装置,两个相同透明容器中密封着等量的空气和电阻R1、R2,其中R1=5Ω,R2=R3=10Ω,下列说法正确的是( )
A. 只闭合S1,可以探究电流通过导体产生的热量与电流的关系
B. 闭合S1和S2通过R1的电流是R2电流的0.5倍
C. 闭合S1和S2后,左、右两侧U形管内液柱的高度差相同
D. 在S1闭合情况下,再闭合S2,通过R2的电流变为原来的0.75倍
12.用一小块未打磨过的铝片和一定质量的稀盐酸反应,产生气泡的快慢和反应时间的关系如图所示。待实验结束后,发现试管底部出现了灰色沉淀。为了初步判断灰色沉淀的成分,往上述试管中继续滴加稀盐酸,观察到沉淀溶解并有气泡生成。下列推理正确的有( )
①0~t1阶段,铝的氧化物与稀盐酸反应
②t1~t2阶段,铝和稀盐酸反应生成气体
③t3~t4阶段,稀盐酸过量生成气体量减少
④实验结束后试管底部出现的灰色沉淀是铝
A. ①② B. ①②④ C. ①③④ D. ②③④
13.某同学为使过滤操作能自动添加液体,设计了如下图所示的“自动加液过滤器”.倒置的烧瓶中盛放待过滤的液体,当漏斗中的液体减少时,烧瓶中的液体会从“液体流出管”流入漏斗而不会从漏斗中溢出.为使液体顺利流下,需插入“空气导入管”与大气相通.下列“空气导入管”安装正确的是( )
A. B.
C. D.
14.有三个电阻恒定不变的灯泡,规格分别是L1“6V 6W”、L2“4V 8W”、L3“6V 3W”。小科用右图所示的电路探究灯泡发光情况。电路中电源电压12V,滑动变阻器R的规格为“2A 10Ω“,M、N为接线柱。当小科将L1接入M、N,调节滑片P位置,使L1正常发光。然后,小科将L1拆下,依次将L2、L3接入M、N。小科所有实验操作都无误,则下列分析正确的是( )
A. P位于滑动变阻器最右端时,L1的功率为3.6W
B. L1正常发光时,电流表示数为0.5A
C. 接L2后,无论怎样调节滑片,电路都是安全的
D. 接L3后,无论怎样调节滑片,L3都不能正常发光
15.元旦,某商场挂上氦气球增添喜庆气氛。系气球的细绳绕过固定在地面的滑轮。由于风力的作用,气球有一定角度的倾斜,如图所示。在细绳自由端用竖直向上的力F让气球重心缓缓匀速下降2m,用时20s。已知气球的重力为24N,力F为26N,不计绳重和摩擦。则下列说法正确的是( )
A. 细绳对气球的拉力小于26N
B. 气球的重力做功大于48J
C. 拉力F的功率大于2.6W
D. 这一过程气球的机械能守恒
二、填空题:本大题共6小题,共32分。
16.纯净的二氧化硅是现代光学及光纤制品的基本原料。
(1)二氧化硅的化学性质极稳定,氢氟酸(HF)是唯一可以与之发生反应的酸(生成物为H2O和SiF4气体),该反应的化学方程式为 ______ 。
(2)二氧化硅与碳酸钙在高温下反应生成硅酸钙(CaSiO3)和二氧化碳。据此事实可以判断,碳酸钙和硅酸钙热稳定性更好的是 ______ 。
17.如图是某型号手机电池的铭牌,该手机正常通话时平均电流为100mA,待机时平均电流为10mA。
(1)该手机电池的容量也可以标记为 ______ mA h。
(2)该手机电池理论上可让手机待机 ______ 。
(3)手机充电时,手机会出现发热现象。这个过程中电能转化为 ______ 。
18.图甲所示为抖音上售卖的喷气火箭,发射时猛踩气囊,气囊中的空气推动火箭向上飞出。图乙所示,大口玻璃瓶内装有一些水,用瓶塞将瓶口塞紧,瓶塞通过导管与打气筒相连,用打气筒给瓶中打气。图丙所示,B是一个被销钉K锁住的活塞,气缸A密封有压缩空气,C是一支温度计,活塞与气缸壁之间没有摩擦,请回答下列问题:
(1)火箭向上飞出过程相当于内燃机的 ______ 冲程。
(2)乙实验中,在研究气体对外做功内能变化时,应该注意观察的是 ______ 。
A.打气的过程中,水面的变化情况
B.瓶塞跳起瞬间,瓶内的变化情况
C.瓶塞跳起的高度
(3)试根据甲、乙实验的结论分析,当把销钉K拔出后温度计的示数 ______ (选填“升高”、“降低”或“不变”)。
19.如图所示,甲是高为H的光滑斜面,与一粗糙的水平面相连接,将重为G的物体M从甲斜面顶端A由静止释放,测出在水平面上滑行距离为s1。将甲斜面换成表面粗糙但形状大小相同的乙斜面,与同一粗糙水平面相连接,将M从乙斜面顶端A′由静止释放,测出在水平面上滑行距离为s2。若M在乙斜面中点B由静止释放,滑行距离为s3。
(1)M在粗糙水平面上的摩擦力f为 ______ 。
(2)M从乙斜面的A滑到底部的过程中,摩擦力对M做的功为 ______ 。
(3)s2:s3= ______ 。
20.小科自制滑轮组发电机并进行实验,如图所示。滑轮组下配置质量为1kg的重物,每个滑轮均重5N。静止释放,重物匀速下降,带动发电机线圈转动,使小灯泡发光。
(1)小灯泡能发光是利用了 ______ 原理。
(2)不考虑绳重及摩擦,A处对滑轮的拉力为 ______ N。
21.酚酞试液是实验室常用的一种指示剂。实验室配制酚酞试液的方法是:称取1g酚酞固体(化学式为C20H14O4)溶于少量体积分数为95%的乙醇溶液,再用相同的乙醇溶液稀释至100mL。
(1)从物质分类角度来判断,酚酞试液属于 ______ 。
(2)实验室配制体积分数为95%的乙醇的方法是用量筒分别量取95mL无水乙醇和5mL水,然后混合均匀。小科用下列方法配制体积分数为95%的乙醇,用100mL量筒量取95mL无水乙醇,然后向无水乙醇中加水至100mL。小科配制的乙醇溶液体积分数 ______ 95%(选填“<”、“=”或“>”)。
三、实验探究题:本大题共5小题,共36分。
22.科学探究小组利用图甲实验装置测定空气的比热容,电路图如乙所示。
其中,定值电阻和温度计经过特殊改装,温度计下方装有一个塑料长方体,能将定值电阻周围的一部分空气给密封起来便于测量温度。实验步骤如下:
①测量塑料长方体的体积V为60cm3,计算出这部分空气的质量m。
②按照如图乙所示电路图连接电路,所使用定值电阻阻值为R。
③记录初温T0后,闭合开关,记录电流表示数I。通电1min后断开,记录末温T1。
④根据实验数据计算空气的比热容。实验数据如表。
序号 电流I/A R阻值/Ω 初温T0/℃ 末温T1/℃
1 0.06 5 21 32
2 0.03 10 20 26
3 0.02 20 21 25
【实验分析】
(1)步骤①中,为了测长方体体积,需要用到的测量工具是 ______ 。
(2)已知ρ空气=1.3g/L,根据第2次实验数据,计算空气的比热容为 ______ 。
(3)事实上,电阻所产生的热量并不能被这部分空气完全吸收,计算所得的结果和空气实际的比热容相比会 ______ (选填“偏大”“偏小”或“相等”),如何让热量尽可能被装置内空气吸收?请你提出一个可行的改进方案: ______ 。
23.在研究锌和铜的金属活动性顺序时,小科用锌片与5%的硫酸铜溶液反应,发现实验现象不明显。小科用锌片与5%的氯化铜溶液反应,发现有红色物质析出,并且有气体产生。是什么原因导致了该反应现象的差异呢?
【问题提出】
从微观角度分析,硫酸铜、氯化铜溶液中,只是所含酸根不同。
【提出猜想】
猜想①:Cl-能促进锌和Cu2+的反应,S对反应无影响。
猜想②:Cl-对反应无影响,S有抑制锌和Cu2+反应的作用。
猜想③:Cl-能促进锌和Cu2+的反应,S有抑制锌和Cu2+反应的作用。
【实验探究】
组别 试管中的物质 反应现象 反应片刻后添加固体试剂 添加试剂后的实验现象
1 5%CuCl2溶液5mL
锌片1g 有大量的红色物质析出,且有大量气泡产生。 1gK2SO4 无明显改变
2 5%CuSO4溶液5mL
锌片1g 锌片边缘有很少量红色物质析出,有少量气泡逸出。 1gNaCl 明显加快
3 5%CuSO4溶液5mL
锌片1g 锌片边缘有很少量红色物质析出,有少量气泡逸出。 1gNaNO3 无明显改变
(1)为了保证实验结论的准确性,实验前对锌片的处理是 ______ 。
(2)根据上述探究,猜想 ______ 与实验结果相吻合。
(3)设计第3组实验的目的是 ______ 。
(4)经检验所得,锌片和CuCl2、CuSO4溶液反应所放出的气体为氢气。小科查阅资料后得到一个信息:CuCl2和CuSO4溶液都为酸性溶液。根据资料和实验结论可推断出,锌分别与相同H+浓度的稀盐酸、稀硫酸反应,反应比较剧烈的是 ______ 。
24.小明用如图1所示的电路测量额定电压为2.5V小灯泡的电功率。
(1)电源电压为6V,小灯泡的电阻约为10Ω,有两个不同规格的滑动变阻器:甲标有“10Ω 1A”乙标有“50Ω 2A”,实验时应该选择滑动变阻器 ______ (选填“甲”或“乙”)。
(2)小明将实验数据和现象填写在下表中。
次数 灯泡两端电压U/V 通过灯丝电流I/A 灯泡电功率P/W 灯泡亮度
1 2.20 0.28 比正常发光暗
2 2.50 0.30 正常发光
3 2.80 0.32 比正常发光亮
①可得出的实验结论: ______ (写出一条即可);
②小灯泡的额定功率为 ______ W。
(3)小明用上面的实验器材测量电阻Rx阻值时,发现电压表已损坏,重新设计电路,选了一个阻值已知的R1,连接电路如图2所示。他先将导线C端接到电流表“-”接线柱上,电流表读数为I1,后将导线C端接到电流表“3”接线柱上,电流表读数为I2,则Rx的阻值为 ______ (用已知字母表示)。
25.某科学研究小组以“有机物中碳、氢元素的质量分数测定”为课题进行了如下的实验设计。一定量样品和氧气混合气经过灼热的铜网时被充分氧化,产生二氧化碳和水蒸气。经B、C、D装置可以测得产生的二氧化碳和水蒸气的质量,进而推知样品中碳和氢元素的质量分数。
(1)产生的二氧化碳和水蒸气是否被充分吸收,会影响碳、氢元素的含量测定。研究小组的成员查找到了下列有关数据,试图了解吸收剂的吸收性能。如表是20℃时,1m3空气中经下列吸收剂吸收后水蒸气残留的克数:
吸收剂 浓硫酸 Mg(ClO4)2固体 CuSO4固体 硅胶固体 CaO固体 NaOH固体
残留质量 0.003 0.0005 1.4 0.03 0.2 0.14~0.25
根据上述数据,你认为吸收水蒸气时,最理想的吸收剂是 ______ 。
(2)C中的试剂为硫酸铜固体,B、D装置中的试剂也为固体,你认为研究小组在这一实验中,D中的试剂为 ______ 。
(3)某同学用上图装置测定维生素C中元素组成(可能含有氧元素),取维生素C样品研碎称取0.352g。生成物完全被吸收,测得装置B、D两者分别增重0.144g和0.528g。则样品中碳的质量分数为 ______ ,维生素C的最简化学式为 ______ 。
26.小科在探究杠杆平衡条件时,发现实验室有甲、乙两种实验杠杆,如图所示。
(1)为保证规律准确得出,应选用哪种杠杆更佳,并说明理由 ______ 。
(2)小科调节杠杆在水平位置平衡后,准备挂砝码。但右侧的平衡螺母已经生锈,而左侧平衡螺母依旧光亮。小科接下来操作是 ______ 。
A.继续实验
B.更换螺母
C.重新调平
D.更换实验器材
四、解答题:本大题共6小题,共45分。
27.(本小题6分)
现有A、B、C、D、E五种溶液,它们分别是氢氧化钠溶液、硫酸铜溶液、碳酸钠溶液、氯化钠溶液和稀硫酸中的一种。经鉴别后编写成如图的检索表,请据表回答下列问题。
(1)检索表★中填的是 ______ 。
(1)C中的溶质是 ______ 。
(2)在鉴别D、E时,除氢氧化钡溶液外,还可以选择的物质是 ______ 。
28.(本小题8分)
海洋化学资源的综合利用将是当下重点发展领域之一。
【利用1】海水晒盐。将海水引入蒸发池,经日晒蒸发到一定程度时,导入结晶池,继续日晒,海水成为食盐的饱和溶液,再晒就会析出粗盐,剩余的液体称为母液(也称卤水)。1L海水在逐渐浓缩过程中不断析出的盐的种类和质量(单位:g)关系如表所示:
海水密度(g/mL) CaSO4 NaCl MgCl2 MgSO4
1.20 0.91
1.21 0.05 3.26 0.004 0.008
1.22 0.015 9.65 0.01 0.04
1.26 0.01 2.64 0.02 0.02
1.31 1.40 0.54 0.03
【利用2】海水制镁。海水晒盐后,以其母液(卤水)和贝壳(主要成分是CaCO3)为原料制镁,其工艺流程如图所示。
(1)若得到纯度较高的粗盐和含浓度较高的卤水,卤水的密度应控制的范围是 ______ 。
(2)①所加的碱是 ______ (选填“氢氧化钠”或“石灰乳”),②反应的类型是 ______ 。
(3)Mg(OH)2加热分解生成MgO和H2OMgO是高熔点的化合物,某些阻燃剂的有效成分是Mg(OH)2倍Mg(OH)2能够阻燃的原因可能是 ______ 。
A.Mg(OH)2分解需要吸收大量的热,降低了可燃物的着火点
B.生成的氧化镁覆盖在可燃物表面,隔绝了空气
C.生成的水蒸气降低了可燃物周围氧气浓度
D.反应因吸热降低了环境温度,使可燃物不易达到着火点
29.(本小题7分)
小科利用如图装置制取氧气,实验过程如下。
步骤一:按图组装实验装置。
步骤二:_____。
步骤三:向锥形瓶中加入2.0g二氧化锰粉末,注射器中吸入20mL一定质量分数的双氧水(密度为1.02g/cm3)。
步骤四:将注射器中的双氧水平均分4次推入锥形瓶中:每次推入稀硫酸、待不再产生气泡后,记录收集气体的总体积(忽略其他因素对测量结果造成的影响),数据如表。
次数 1次 2次 3次 4次
收集气体的总体积/mL 105 210 315 420
步骤五:整理器材。
查阅资料所得,常温常压下,氧气的密度为1.43g/L。根据以上信息,回答下列问题。
(1)步骤二中横线的内容为 ______ 。
(2)完全反应后生成氧气的体积V= ______ mL。
(3)求该双氧水的质量分数(计算结果精确到1%)。
30.(本小题7分)
小科家里进行装修,装修的工人从建材市场运来1张质量均匀的矩形实木板。木板的规格是1.2m×2m×0.015m,密度为0.7×103kg/m3。
(2)小科和工人身形相近,他们一起将木板匀速抬上二楼,两人施力的方向都为竖直向上。在上楼过程中的某个瞬间(如图甲所示),小科对木板做功功率为P1,工人对木板做功功率为P2,则P1 ______ P2(选填“<”、“=”或“>”)。
(3)木板上放着一桶重50N的油漆,且保持木板水平(如图乙所示),工人抬着木板的A端,小科抬着木板的B端,两人施力的方向都为竖直向上。其中,AB为2m,桶底部的中心C离A端为0.8m,则小科对木板的力F2为多少?
31.(本小题8分)
某固体混合物中可能含有氢氧化钡、硝酸钠、硫酸钠、碳酸钠。为了研究该混合物的成分,某同学按下列流程进行了实验(各步均恰好完全反应),根据流程图回答问题:
(1)根据实验现象推断该混合物中一定含有的物质是 ______ (填化学式)。
(2)该同学为了进一步确定固体混合物的组成,取样品20.9g,按上述流程图进行实验,产生11.65g白色沉淀A,产生2.2g气体W。通过计算,判断并确定该混合物中所含物质的成分及其质量。
32.(本小题9分)
电压力锅是结合了传统高压钢和电饭煲优点的升级产品。如图甲为某品牌电压力锅的结构示意图和它的插头。使用电压力锅煮饭时,先将锅盖与机身的卡扣扣合,再接通电源。图乙为电压力锅简化的工作电路图,其中R1是规格为“220V 900W”的主加热电阻,R2是电阻为242Ω的副加热电阻,R0是阻值为484Ω保温电阻。压力开关是一个安装在电压力锅底部的压力传感器,根据所受压力的变化实现自动闭合断开。电压力锅煮饭分为加热升压→保压→保温三个阶段。通过如图丙所示正常煮饭时,锅内工作压强与时间p-t关系图像可了解其工作过程:接通电源,启动智能控制开关S,S自动接到a,同时压力开关自动闭合。电压力锅进入加热升压状态,当锅内工作压强达180kPa时压力开关自动断开,进入保压状态,当锅内工作压强降至160kPa时,压力开关又会自动闭合;当保压状态结束时,饭就熟了,S自动接到b进入保温状态。根据以上信息,回答下列问题。
(1)图甲插头中A端与家庭电路中 ______ 线相连。
(2)图乙中熔断器的作用是当内部电路故障导致电流过大时,自动熔断保护,为不影响电压力锅正常工作,其熔断电流至少要高于多少?
(3)在一次正常煮饭中,饭煮熟后,又保温了5min才切断电源,则这次煮饭总共消耗的电能是多少?(不考虑其它能量损失)
1.B
2.D
3.B
4.C
5.A
6.B
7.D
8.C
9.C
10.B
11.D
12.B
13.A
14.D
15.C
16.SiO2+4HF=2H2O+SiF4↑ CaSiO3
17.1700 170h 内能
18.做功 B 降低
19. (s1-s2) 2:1
20.电磁感应 27.5
21.混合物 >
22.刻度尺 1.15×103J/(kg ℃) 偏大 长方体隔热材料好
23.打磨 ① 验证钠离子对实验结果是否有影响 稀盐酸
24.乙 灯的实际功率越大,灯越亮 0.75
25.Mg(ClO4)2固体 碱石灰 40.9% C6H8O6
26.消除杠杆自重的影响 A
27.无色 氯化钠 稀盐酸或氯化钙溶液
28.1.21g/mL~1.26g/mL 石灰乳 复分解反应 BCD
29.解:(1)实验室用过氧化氢溶液和二氧化锰制取氧气的步骤是:检查装置的气密性;加入试剂;固定装置;加热;收集气体;实验完毕,撤导气管;熄灭酒精灯.因此步骤二中的横线处应为:检查装置的气密性;
(2)由表中数据可知,第4次推入双氧水时,不再产生气泡,说明此时双氧水已经完全反应,完全反应后生成氧气的体积V=420mL;
(3)生成氧气的质量为:1.43g/L×L=0.6g,
设过氧化氢的质量为x。
2H2O22H2O+O2↑
68 32
x 0.6g
x=1.275g
过氧化氢溶液的质量为:20mL×1.02g/mL=20.4g
过氧化氢的质量分数为:×100%≈6%
答:该双氧水的质量分数为6%。
故答案为:(1)检查装置的气密性;
(2)420;
(3)6%。
30.解:(1)力臂是支点到力的作用线的距离,质量均匀的矩形实木板,其重心在几何中心,重力为阻力,所以两人施力时其阻力臂相等,
两人施力的方向都为竖直向上,两人施力时的动力臂相等,根据杠杆平衡条件可得两人施力时的动力相同,根据P===Fv可知P1=P2;
(2)木板的规格是1.2m×2m×0.015m,密度为0.7×103kg/m3,木板的质量m=ρV=0.7×103kg/m3×1.2m×2m×0.015m=25.2kg;
木板的重力:G′=mg=25.2kg×10N/kg=252N,
根据杠杆平衡条件可得F2×AB=G×AC+G′×AB,代入数据可得F2×2m=50N×0.8m+252N×1m,解方程可得F2=146N。
答:(1)=;
(2)小科对木板的力F2为146N。
31.解:设碳酸钠的质量为x,硫酸钠的质量为y,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
=
x=5.3g;
Na2SO4+BaCl2=BaSO4↓+2NaCl
142 233
y 11.65g
=
y=7.1g;
设混合物的平均相对分子质量为Mr,
2.3g÷=8.5g
Mr=85;
由于氢氧化钠的相对分子质量为40,氯化钠的相对分子质量为58.5,氢氧化钠和氯化钠的相对分子质量都小于85,且硝酸钠的相对分子质量刚好为85,所以混合物中还含有的物质只可能且仅有硝酸钠。
通过计算,确定该混合物中还含有的物质是NaNO3,其质量为20.9g-7.1g-5.3g=8.5g。
故答案为:
(1)Na2SO4、Na2CO3;
(2)Na2SO4,7.1g;Na2CO3,5.3g;NaNO3,8.5。
32.
解:(1)三脚插头中稍长些的插脚是把用电器的外壳与大地相连接,插头插入插座时,电器外壳先接地;拨出时,电器外壳后离开地线,确保安全;
(2)当开关在b处时处于保温状态,只有电阻R0工作,电阻为484Ω,此时通过电路的电流为:I==≈0.45A;
当开关在a处时处于加热状态,电阻R1和R2并联,通过电路的电流为:I′=+=+≈5A,
所以熔断电流至少要高于5A;
(3)R2的功率为:P2===200W;
R0的保温功率为:P保温===100W;
由图丙知升压用了t1=6min+3min+3min=720s,保压用了t2=3min+3min=360s,保温用了t3=5min=300s,
这次煮饭总共消耗的电能为:W=(P1+P2)t1+P2t2+P保温t3=(900W+200W)×720s+200W×360s+100W×300s=8.94×105J。
第15页,共18页
一、选择题:本大题共15小题,共45分。
1.古代的农耕社会,到当下的现代文明,“逐水而居”的理念基本贯穿了中华文明族群繁衍与发展,人们喜欢住所附近有河流或湖泊,其原因之一是那里相对来说“冬暖夏凉”,这主要是因为水的哪个性质( )
A. 易蒸发 B. 较大的比热容 C. 较低的凝固点 D. 较高的沸点
2.科学实验要规范操作,下列实验操作你认为正确的是( )
A. 稀释浓硫酸 B. 干燥氧气
C. 测定某溶液的 pH D. 检查气密性
3.肉类的鲜度可以通过测试pH来判断。有资料显示,pH与肉类新鲜度的关系如表,则新鲜肉在变质过程中酸性如何变化( )
名称 新鲜肉 次鲜肉 变质肉
pH 5.8~6.2 6.3~6.6 >6.6
A. 变强 B. 变弱 C. 不变 D. 无法确定
4.小科进行“观察通电导体在磁场中的受力情况”的活动,如图所示。实验中,他在轨道上放置的是一根铜棒。关于这个活动,下列说法正确的是( )
A. 活动中机械能转化为电能 B. 开关闭合,铜棒一定原地作顺时针旋转
C. 将铜棒换成石墨棒依然可以进行活动 D. 断开开关,铜棒在磁场中受到磁力
5.我国科学家研究出碳化钼(Mo2C)负载金原子组成的高效催化体系,使水煤气中的CO和H2O在120℃下发生反应,反应微观模型如图所示,下列说法正确的是( )
A. 金原子对CO起吸附催化作用 B. 反应中分子的数目发生了改变
C. 该化学反应类型为化合反应 D. 碳化钼在反应前后化学性质发生了改变
6.走近千年文物,人们发现青铜器在含有Cl-的环境中易生成CuCl,随着环境条件的变化而发生锈蚀,锈层物质成分示意图如图所示。下列叙述错误的是( )
A. 铜绿中含有Cu、H、O、C四种元素 B. CuCl与O2、H2O发生化合反应生成铜绿
C. 在锈蚀的过程中铜元素的化合价升高 D. 干燥、无氧的环境有利于青铜器保存
7.某建筑工地需要架设临时供电线路,实现照明和电加热功能。其简化电路如图所示,供电处电压U不变,从供电处到工地用长导线(有电阻)连接。闭合开关S1、S2时,加热器和照明灯同时工作。断开S2后与断开S2前相比较,则( )
A. 照明灯亮度不变 B. 照明灯亮度变弱
C. 长导线上消耗的电能增加 D. 整个供电线路消耗的电功率变小
8.如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
A. 甲实验试管口向下倾斜可防止氢气逸出
B. 乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生
C. 甲、乙两实验中,都应先通入气体,再用酒精灯加热试管、玻璃管,以防止发生爆炸
D. 甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应
9.将铜片和锌片同时插入稀H2SO4,可以组成一个电池(图甲)。小科发现电池的正负极与金属活动性强弱存在一定规律,并做了三组实验,并借助灵敏电流表进行判断(图乙)。据此判断,下列金属片组合可以使电流表指针向左偏转(图丙)的是( )
A. a铝、b镁 B. a铁、b锌 C. a铁、b铜 D. a铜、b银
10.一架梯子斜靠在竖直墙上,下端放在水平地面上,一工人站在梯子上,如图所示。墙对梯子的力作用于接触点A,梯子与地面的接触点O为支点。则下列说法正确的是( )
A. 若以墙对梯子的力为动力,则此时梯子为费力杠杆
B. 若保持人位置不变,梯子下端越靠近墙,墙对梯子的力越小
C. 若保持梯子位置不变,人站的位置越高,墙对梯子的力越小
D. 若保持人、梯子位置不变,人的质量越大,墙对梯子的力越小
11.如图是探究电流热效应的实验装置,两个相同透明容器中密封着等量的空气和电阻R1、R2,其中R1=5Ω,R2=R3=10Ω,下列说法正确的是( )
A. 只闭合S1,可以探究电流通过导体产生的热量与电流的关系
B. 闭合S1和S2通过R1的电流是R2电流的0.5倍
C. 闭合S1和S2后,左、右两侧U形管内液柱的高度差相同
D. 在S1闭合情况下,再闭合S2,通过R2的电流变为原来的0.75倍
12.用一小块未打磨过的铝片和一定质量的稀盐酸反应,产生气泡的快慢和反应时间的关系如图所示。待实验结束后,发现试管底部出现了灰色沉淀。为了初步判断灰色沉淀的成分,往上述试管中继续滴加稀盐酸,观察到沉淀溶解并有气泡生成。下列推理正确的有( )
①0~t1阶段,铝的氧化物与稀盐酸反应
②t1~t2阶段,铝和稀盐酸反应生成气体
③t3~t4阶段,稀盐酸过量生成气体量减少
④实验结束后试管底部出现的灰色沉淀是铝
A. ①② B. ①②④ C. ①③④ D. ②③④
13.某同学为使过滤操作能自动添加液体,设计了如下图所示的“自动加液过滤器”.倒置的烧瓶中盛放待过滤的液体,当漏斗中的液体减少时,烧瓶中的液体会从“液体流出管”流入漏斗而不会从漏斗中溢出.为使液体顺利流下,需插入“空气导入管”与大气相通.下列“空气导入管”安装正确的是( )
A. B.
C. D.
14.有三个电阻恒定不变的灯泡,规格分别是L1“6V 6W”、L2“4V 8W”、L3“6V 3W”。小科用右图所示的电路探究灯泡发光情况。电路中电源电压12V,滑动变阻器R的规格为“2A 10Ω“,M、N为接线柱。当小科将L1接入M、N,调节滑片P位置,使L1正常发光。然后,小科将L1拆下,依次将L2、L3接入M、N。小科所有实验操作都无误,则下列分析正确的是( )
A. P位于滑动变阻器最右端时,L1的功率为3.6W
B. L1正常发光时,电流表示数为0.5A
C. 接L2后,无论怎样调节滑片,电路都是安全的
D. 接L3后,无论怎样调节滑片,L3都不能正常发光
15.元旦,某商场挂上氦气球增添喜庆气氛。系气球的细绳绕过固定在地面的滑轮。由于风力的作用,气球有一定角度的倾斜,如图所示。在细绳自由端用竖直向上的力F让气球重心缓缓匀速下降2m,用时20s。已知气球的重力为24N,力F为26N,不计绳重和摩擦。则下列说法正确的是( )
A. 细绳对气球的拉力小于26N
B. 气球的重力做功大于48J
C. 拉力F的功率大于2.6W
D. 这一过程气球的机械能守恒
二、填空题:本大题共6小题,共32分。
16.纯净的二氧化硅是现代光学及光纤制品的基本原料。
(1)二氧化硅的化学性质极稳定,氢氟酸(HF)是唯一可以与之发生反应的酸(生成物为H2O和SiF4气体),该反应的化学方程式为 ______ 。
(2)二氧化硅与碳酸钙在高温下反应生成硅酸钙(CaSiO3)和二氧化碳。据此事实可以判断,碳酸钙和硅酸钙热稳定性更好的是 ______ 。
17.如图是某型号手机电池的铭牌,该手机正常通话时平均电流为100mA,待机时平均电流为10mA。
(1)该手机电池的容量也可以标记为 ______ mA h。
(2)该手机电池理论上可让手机待机 ______ 。
(3)手机充电时,手机会出现发热现象。这个过程中电能转化为 ______ 。
18.图甲所示为抖音上售卖的喷气火箭,发射时猛踩气囊,气囊中的空气推动火箭向上飞出。图乙所示,大口玻璃瓶内装有一些水,用瓶塞将瓶口塞紧,瓶塞通过导管与打气筒相连,用打气筒给瓶中打气。图丙所示,B是一个被销钉K锁住的活塞,气缸A密封有压缩空气,C是一支温度计,活塞与气缸壁之间没有摩擦,请回答下列问题:
(1)火箭向上飞出过程相当于内燃机的 ______ 冲程。
(2)乙实验中,在研究气体对外做功内能变化时,应该注意观察的是 ______ 。
A.打气的过程中,水面的变化情况
B.瓶塞跳起瞬间,瓶内的变化情况
C.瓶塞跳起的高度
(3)试根据甲、乙实验的结论分析,当把销钉K拔出后温度计的示数 ______ (选填“升高”、“降低”或“不变”)。
19.如图所示,甲是高为H的光滑斜面,与一粗糙的水平面相连接,将重为G的物体M从甲斜面顶端A由静止释放,测出在水平面上滑行距离为s1。将甲斜面换成表面粗糙但形状大小相同的乙斜面,与同一粗糙水平面相连接,将M从乙斜面顶端A′由静止释放,测出在水平面上滑行距离为s2。若M在乙斜面中点B由静止释放,滑行距离为s3。
(1)M在粗糙水平面上的摩擦力f为 ______ 。
(2)M从乙斜面的A滑到底部的过程中,摩擦力对M做的功为 ______ 。
(3)s2:s3= ______ 。
20.小科自制滑轮组发电机并进行实验,如图所示。滑轮组下配置质量为1kg的重物,每个滑轮均重5N。静止释放,重物匀速下降,带动发电机线圈转动,使小灯泡发光。
(1)小灯泡能发光是利用了 ______ 原理。
(2)不考虑绳重及摩擦,A处对滑轮的拉力为 ______ N。
21.酚酞试液是实验室常用的一种指示剂。实验室配制酚酞试液的方法是:称取1g酚酞固体(化学式为C20H14O4)溶于少量体积分数为95%的乙醇溶液,再用相同的乙醇溶液稀释至100mL。
(1)从物质分类角度来判断,酚酞试液属于 ______ 。
(2)实验室配制体积分数为95%的乙醇的方法是用量筒分别量取95mL无水乙醇和5mL水,然后混合均匀。小科用下列方法配制体积分数为95%的乙醇,用100mL量筒量取95mL无水乙醇,然后向无水乙醇中加水至100mL。小科配制的乙醇溶液体积分数 ______ 95%(选填“<”、“=”或“>”)。
三、实验探究题:本大题共5小题,共36分。
22.科学探究小组利用图甲实验装置测定空气的比热容,电路图如乙所示。
其中,定值电阻和温度计经过特殊改装,温度计下方装有一个塑料长方体,能将定值电阻周围的一部分空气给密封起来便于测量温度。实验步骤如下:
①测量塑料长方体的体积V为60cm3,计算出这部分空气的质量m。
②按照如图乙所示电路图连接电路,所使用定值电阻阻值为R。
③记录初温T0后,闭合开关,记录电流表示数I。通电1min后断开,记录末温T1。
④根据实验数据计算空气的比热容。实验数据如表。
序号 电流I/A R阻值/Ω 初温T0/℃ 末温T1/℃
1 0.06 5 21 32
2 0.03 10 20 26
3 0.02 20 21 25
【实验分析】
(1)步骤①中,为了测长方体体积,需要用到的测量工具是 ______ 。
(2)已知ρ空气=1.3g/L,根据第2次实验数据,计算空气的比热容为 ______ 。
(3)事实上,电阻所产生的热量并不能被这部分空气完全吸收,计算所得的结果和空气实际的比热容相比会 ______ (选填“偏大”“偏小”或“相等”),如何让热量尽可能被装置内空气吸收?请你提出一个可行的改进方案: ______ 。
23.在研究锌和铜的金属活动性顺序时,小科用锌片与5%的硫酸铜溶液反应,发现实验现象不明显。小科用锌片与5%的氯化铜溶液反应,发现有红色物质析出,并且有气体产生。是什么原因导致了该反应现象的差异呢?
【问题提出】
从微观角度分析,硫酸铜、氯化铜溶液中,只是所含酸根不同。
【提出猜想】
猜想①:Cl-能促进锌和Cu2+的反应,S对反应无影响。
猜想②:Cl-对反应无影响,S有抑制锌和Cu2+反应的作用。
猜想③:Cl-能促进锌和Cu2+的反应,S有抑制锌和Cu2+反应的作用。
【实验探究】
组别 试管中的物质 反应现象 反应片刻后添加固体试剂 添加试剂后的实验现象
1 5%CuCl2溶液5mL
锌片1g 有大量的红色物质析出,且有大量气泡产生。 1gK2SO4 无明显改变
2 5%CuSO4溶液5mL
锌片1g 锌片边缘有很少量红色物质析出,有少量气泡逸出。 1gNaCl 明显加快
3 5%CuSO4溶液5mL
锌片1g 锌片边缘有很少量红色物质析出,有少量气泡逸出。 1gNaNO3 无明显改变
(1)为了保证实验结论的准确性,实验前对锌片的处理是 ______ 。
(2)根据上述探究,猜想 ______ 与实验结果相吻合。
(3)设计第3组实验的目的是 ______ 。
(4)经检验所得,锌片和CuCl2、CuSO4溶液反应所放出的气体为氢气。小科查阅资料后得到一个信息:CuCl2和CuSO4溶液都为酸性溶液。根据资料和实验结论可推断出,锌分别与相同H+浓度的稀盐酸、稀硫酸反应,反应比较剧烈的是 ______ 。
24.小明用如图1所示的电路测量额定电压为2.5V小灯泡的电功率。
(1)电源电压为6V,小灯泡的电阻约为10Ω,有两个不同规格的滑动变阻器:甲标有“10Ω 1A”乙标有“50Ω 2A”,实验时应该选择滑动变阻器 ______ (选填“甲”或“乙”)。
(2)小明将实验数据和现象填写在下表中。
次数 灯泡两端电压U/V 通过灯丝电流I/A 灯泡电功率P/W 灯泡亮度
1 2.20 0.28 比正常发光暗
2 2.50 0.30 正常发光
3 2.80 0.32 比正常发光亮
①可得出的实验结论: ______ (写出一条即可);
②小灯泡的额定功率为 ______ W。
(3)小明用上面的实验器材测量电阻Rx阻值时,发现电压表已损坏,重新设计电路,选了一个阻值已知的R1,连接电路如图2所示。他先将导线C端接到电流表“-”接线柱上,电流表读数为I1,后将导线C端接到电流表“3”接线柱上,电流表读数为I2,则Rx的阻值为 ______ (用已知字母表示)。
25.某科学研究小组以“有机物中碳、氢元素的质量分数测定”为课题进行了如下的实验设计。一定量样品和氧气混合气经过灼热的铜网时被充分氧化,产生二氧化碳和水蒸气。经B、C、D装置可以测得产生的二氧化碳和水蒸气的质量,进而推知样品中碳和氢元素的质量分数。
(1)产生的二氧化碳和水蒸气是否被充分吸收,会影响碳、氢元素的含量测定。研究小组的成员查找到了下列有关数据,试图了解吸收剂的吸收性能。如表是20℃时,1m3空气中经下列吸收剂吸收后水蒸气残留的克数:
吸收剂 浓硫酸 Mg(ClO4)2固体 CuSO4固体 硅胶固体 CaO固体 NaOH固体
残留质量 0.003 0.0005 1.4 0.03 0.2 0.14~0.25
根据上述数据,你认为吸收水蒸气时,最理想的吸收剂是 ______ 。
(2)C中的试剂为硫酸铜固体,B、D装置中的试剂也为固体,你认为研究小组在这一实验中,D中的试剂为 ______ 。
(3)某同学用上图装置测定维生素C中元素组成(可能含有氧元素),取维生素C样品研碎称取0.352g。生成物完全被吸收,测得装置B、D两者分别增重0.144g和0.528g。则样品中碳的质量分数为 ______ ,维生素C的最简化学式为 ______ 。
26.小科在探究杠杆平衡条件时,发现实验室有甲、乙两种实验杠杆,如图所示。
(1)为保证规律准确得出,应选用哪种杠杆更佳,并说明理由 ______ 。
(2)小科调节杠杆在水平位置平衡后,准备挂砝码。但右侧的平衡螺母已经生锈,而左侧平衡螺母依旧光亮。小科接下来操作是 ______ 。
A.继续实验
B.更换螺母
C.重新调平
D.更换实验器材
四、解答题:本大题共6小题,共45分。
27.(本小题6分)
现有A、B、C、D、E五种溶液,它们分别是氢氧化钠溶液、硫酸铜溶液、碳酸钠溶液、氯化钠溶液和稀硫酸中的一种。经鉴别后编写成如图的检索表,请据表回答下列问题。
(1)检索表★中填的是 ______ 。
(1)C中的溶质是 ______ 。
(2)在鉴别D、E时,除氢氧化钡溶液外,还可以选择的物质是 ______ 。
28.(本小题8分)
海洋化学资源的综合利用将是当下重点发展领域之一。
【利用1】海水晒盐。将海水引入蒸发池,经日晒蒸发到一定程度时,导入结晶池,继续日晒,海水成为食盐的饱和溶液,再晒就会析出粗盐,剩余的液体称为母液(也称卤水)。1L海水在逐渐浓缩过程中不断析出的盐的种类和质量(单位:g)关系如表所示:
海水密度(g/mL) CaSO4 NaCl MgCl2 MgSO4
1.20 0.91
1.21 0.05 3.26 0.004 0.008
1.22 0.015 9.65 0.01 0.04
1.26 0.01 2.64 0.02 0.02
1.31 1.40 0.54 0.03
【利用2】海水制镁。海水晒盐后,以其母液(卤水)和贝壳(主要成分是CaCO3)为原料制镁,其工艺流程如图所示。
(1)若得到纯度较高的粗盐和含浓度较高的卤水,卤水的密度应控制的范围是 ______ 。
(2)①所加的碱是 ______ (选填“氢氧化钠”或“石灰乳”),②反应的类型是 ______ 。
(3)Mg(OH)2加热分解生成MgO和H2OMgO是高熔点的化合物,某些阻燃剂的有效成分是Mg(OH)2倍Mg(OH)2能够阻燃的原因可能是 ______ 。
A.Mg(OH)2分解需要吸收大量的热,降低了可燃物的着火点
B.生成的氧化镁覆盖在可燃物表面,隔绝了空气
C.生成的水蒸气降低了可燃物周围氧气浓度
D.反应因吸热降低了环境温度,使可燃物不易达到着火点
29.(本小题7分)
小科利用如图装置制取氧气,实验过程如下。
步骤一:按图组装实验装置。
步骤二:_____。
步骤三:向锥形瓶中加入2.0g二氧化锰粉末,注射器中吸入20mL一定质量分数的双氧水(密度为1.02g/cm3)。
步骤四:将注射器中的双氧水平均分4次推入锥形瓶中:每次推入稀硫酸、待不再产生气泡后,记录收集气体的总体积(忽略其他因素对测量结果造成的影响),数据如表。
次数 1次 2次 3次 4次
收集气体的总体积/mL 105 210 315 420
步骤五:整理器材。
查阅资料所得,常温常压下,氧气的密度为1.43g/L。根据以上信息,回答下列问题。
(1)步骤二中横线的内容为 ______ 。
(2)完全反应后生成氧气的体积V= ______ mL。
(3)求该双氧水的质量分数(计算结果精确到1%)。
30.(本小题7分)
小科家里进行装修,装修的工人从建材市场运来1张质量均匀的矩形实木板。木板的规格是1.2m×2m×0.015m,密度为0.7×103kg/m3。
(2)小科和工人身形相近,他们一起将木板匀速抬上二楼,两人施力的方向都为竖直向上。在上楼过程中的某个瞬间(如图甲所示),小科对木板做功功率为P1,工人对木板做功功率为P2,则P1 ______ P2(选填“<”、“=”或“>”)。
(3)木板上放着一桶重50N的油漆,且保持木板水平(如图乙所示),工人抬着木板的A端,小科抬着木板的B端,两人施力的方向都为竖直向上。其中,AB为2m,桶底部的中心C离A端为0.8m,则小科对木板的力F2为多少?
31.(本小题8分)
某固体混合物中可能含有氢氧化钡、硝酸钠、硫酸钠、碳酸钠。为了研究该混合物的成分,某同学按下列流程进行了实验(各步均恰好完全反应),根据流程图回答问题:
(1)根据实验现象推断该混合物中一定含有的物质是 ______ (填化学式)。
(2)该同学为了进一步确定固体混合物的组成,取样品20.9g,按上述流程图进行实验,产生11.65g白色沉淀A,产生2.2g气体W。通过计算,判断并确定该混合物中所含物质的成分及其质量。
32.(本小题9分)
电压力锅是结合了传统高压钢和电饭煲优点的升级产品。如图甲为某品牌电压力锅的结构示意图和它的插头。使用电压力锅煮饭时,先将锅盖与机身的卡扣扣合,再接通电源。图乙为电压力锅简化的工作电路图,其中R1是规格为“220V 900W”的主加热电阻,R2是电阻为242Ω的副加热电阻,R0是阻值为484Ω保温电阻。压力开关是一个安装在电压力锅底部的压力传感器,根据所受压力的变化实现自动闭合断开。电压力锅煮饭分为加热升压→保压→保温三个阶段。通过如图丙所示正常煮饭时,锅内工作压强与时间p-t关系图像可了解其工作过程:接通电源,启动智能控制开关S,S自动接到a,同时压力开关自动闭合。电压力锅进入加热升压状态,当锅内工作压强达180kPa时压力开关自动断开,进入保压状态,当锅内工作压强降至160kPa时,压力开关又会自动闭合;当保压状态结束时,饭就熟了,S自动接到b进入保温状态。根据以上信息,回答下列问题。
(1)图甲插头中A端与家庭电路中 ______ 线相连。
(2)图乙中熔断器的作用是当内部电路故障导致电流过大时,自动熔断保护,为不影响电压力锅正常工作,其熔断电流至少要高于多少?
(3)在一次正常煮饭中,饭煮熟后,又保温了5min才切断电源,则这次煮饭总共消耗的电能是多少?(不考虑其它能量损失)
1.B
2.D
3.B
4.C
5.A
6.B
7.D
8.C
9.C
10.B
11.D
12.B
13.A
14.D
15.C
16.SiO2+4HF=2H2O+SiF4↑ CaSiO3
17.1700 170h 内能
18.做功 B 降低
19. (s1-s2) 2:1
20.电磁感应 27.5
21.混合物 >
22.刻度尺 1.15×103J/(kg ℃) 偏大 长方体隔热材料好
23.打磨 ① 验证钠离子对实验结果是否有影响 稀盐酸
24.乙 灯的实际功率越大,灯越亮 0.75
25.Mg(ClO4)2固体 碱石灰 40.9% C6H8O6
26.消除杠杆自重的影响 A
27.无色 氯化钠 稀盐酸或氯化钙溶液
28.1.21g/mL~1.26g/mL 石灰乳 复分解反应 BCD
29.解:(1)实验室用过氧化氢溶液和二氧化锰制取氧气的步骤是:检查装置的气密性;加入试剂;固定装置;加热;收集气体;实验完毕,撤导气管;熄灭酒精灯.因此步骤二中的横线处应为:检查装置的气密性;
(2)由表中数据可知,第4次推入双氧水时,不再产生气泡,说明此时双氧水已经完全反应,完全反应后生成氧气的体积V=420mL;
(3)生成氧气的质量为:1.43g/L×L=0.6g,
设过氧化氢的质量为x。
2H2O22H2O+O2↑
68 32
x 0.6g
x=1.275g
过氧化氢溶液的质量为:20mL×1.02g/mL=20.4g
过氧化氢的质量分数为:×100%≈6%
答:该双氧水的质量分数为6%。
故答案为:(1)检查装置的气密性;
(2)420;
(3)6%。
30.解:(1)力臂是支点到力的作用线的距离,质量均匀的矩形实木板,其重心在几何中心,重力为阻力,所以两人施力时其阻力臂相等,
两人施力的方向都为竖直向上,两人施力时的动力臂相等,根据杠杆平衡条件可得两人施力时的动力相同,根据P===Fv可知P1=P2;
(2)木板的规格是1.2m×2m×0.015m,密度为0.7×103kg/m3,木板的质量m=ρV=0.7×103kg/m3×1.2m×2m×0.015m=25.2kg;
木板的重力:G′=mg=25.2kg×10N/kg=252N,
根据杠杆平衡条件可得F2×AB=G×AC+G′×AB,代入数据可得F2×2m=50N×0.8m+252N×1m,解方程可得F2=146N。
答:(1)=;
(2)小科对木板的力F2为146N。
31.解:设碳酸钠的质量为x,硫酸钠的质量为y,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
=
x=5.3g;
Na2SO4+BaCl2=BaSO4↓+2NaCl
142 233
y 11.65g
=
y=7.1g;
设混合物的平均相对分子质量为Mr,
2.3g÷=8.5g
Mr=85;
由于氢氧化钠的相对分子质量为40,氯化钠的相对分子质量为58.5,氢氧化钠和氯化钠的相对分子质量都小于85,且硝酸钠的相对分子质量刚好为85,所以混合物中还含有的物质只可能且仅有硝酸钠。
通过计算,确定该混合物中还含有的物质是NaNO3,其质量为20.9g-7.1g-5.3g=8.5g。
故答案为:
(1)Na2SO4、Na2CO3;
(2)Na2SO4,7.1g;Na2CO3,5.3g;NaNO3,8.5。
32.
解:(1)三脚插头中稍长些的插脚是把用电器的外壳与大地相连接,插头插入插座时,电器外壳先接地;拨出时,电器外壳后离开地线,确保安全;
(2)当开关在b处时处于保温状态,只有电阻R0工作,电阻为484Ω,此时通过电路的电流为:I==≈0.45A;
当开关在a处时处于加热状态,电阻R1和R2并联,通过电路的电流为:I′=+=+≈5A,
所以熔断电流至少要高于5A;
(3)R2的功率为:P2===200W;
R0的保温功率为:P保温===100W;
由图丙知升压用了t1=6min+3min+3min=720s,保压用了t2=3min+3min=360s,保温用了t3=5min=300s,
这次煮饭总共消耗的电能为:W=(P1+P2)t1+P2t2+P保温t3=(900W+200W)×720s+200W×360s+100W×300s=8.94×105J。
第15页,共18页
同课章节目录
