10.3常见的盐第3课时 复分解反应课件(共40张PPT内嵌视频)-2024-2025学年人教版九年级化学下册课件
文档属性
| 名称 | 10.3常见的盐第3课时 复分解反应课件(共40张PPT内嵌视频)-2024-2025学年人教版九年级化学下册课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-07 22:25:44 | ||
图片预览











文档简介
(共40张PPT)
课题3 常见的盐
人教版九年级化学下同步教学课件
第十单元 常见的酸、碱、盐
第3课时 复分解反应
学习目标:
2.学会通过常见的酸碱盐溶解性表找出溶解规律,能判断常见物质的溶解性。
1. 通过探究,知道什么是复分解反应,并能写出化学方程式。
3. 通过实验探究知道复分解反应的条件,并能解决实际问题。
知识回顾:
写出下列反应的化学方程式,并归纳它们有什么共同特征
(1)氢氧化钠与硫酸
(2)碳酸钠与盐酸
(3)碳酸氢钠与盐酸
(4)碳酸钙与盐酸
(5)碳酸钠与澄清石灰水
2NaOH+H2SO4=Na2SO4+2H2O
Na2CO3+2HCl = 2NaCl+ H2CO3
NaHCO3+HCl = NaCl+ H2CO3
CaCO3+2HCl = CaCl2+H2CO3
Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH
CO2↑+H2O
CO2↑+H2O
CO2↑+H2O
共同特征:
AB+CD → AD+CB(两种化合物,双交换,价不变)
思考1:两种化合物发生反应生成另外两种化合物的反应一定是复分解反应吗?
不一定;只是由两种化合物互相交换成分,生成另外两种化合物的反应,才是复分解反应。而如:非金属氧化物+碱→盐+水,这类反应则不属于复分解反应。
思考2.酸、碱、盐之间任意两种化合物都能发生复分解反应吗?需要什么条件?
酸、碱、盐之间并不是都能发生反应。只有当两种化合物互相交换成分,生成物中有沉淀、水或气体时,复分解反应才能发生。复分解反应发生的要求:它对反应物、生成物均有条件要求,如若有酸参加反应,另一种反应物可溶于水,也可难溶于水;若无酸参加反应,两种反应物需都可溶于水;生成物中有沉淀或气体或水。
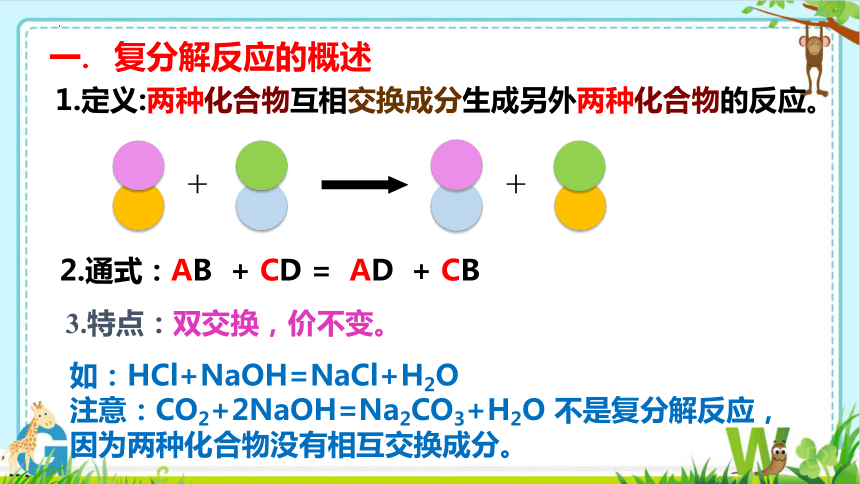
一. 复分解反应的概述
1.定义:两种化合物互相交换成分生成另外两种化合物的反应。
2.通式:AB + CD = AD + CB
3.特点:双交换,价不变。
如:HCl+NaOH=NaCl+H2O
注意:CO2+2NaOH=Na2CO3+H2O 不是复分解反应,因为两种化合物没有相互交换成分。
+
+
思考:1. 酸碱中和反应是不是复分解反应?
2. 酸与金属氧化物反应是不是复分解反应?
酸碱中和反应和酸与金属氧化物的反应都属于复分解反应,而碱与非金属氧化物的反应却不是复分解反应。
3. 碱与非金属氧化物反应是不是复分解反应?
酸 + 碱 → 盐 + 水
酸 + 金属氧化物 → 盐 + 水
碱 + 非金属氧化物 → 盐 + 水
NaOH + HCl NaCl + H2O
Fe2O3 + 6HCl 2FeCl3 + 3H2O
2NaOH + CO2 Na2CO3 + H2O
1、HCl+NaOH=NaCl+H2O
2、2HCl+Na2CO3=2NaCl+H2O+CO2↑
3、6HCl+Fe2O3=2FeCl3+3H2O
4、NaOH+CuSO4= Na2SO4 +Cu(OH)2↓
√
√
√
√
考考你:判断哪些属于复分解反应?
(1).酸和金属氧化物的反应
我们已经学过利用盐酸和硫酸除去金属表面的锈迹(如铁锈),你能写出相关反应的化学方程式吗?
Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 ===== Fe2(SO4)3 + 3H2O
这两个反应有何特点、都生成了什么?是否属于复分解反应?
4. 复分解反应常见类型
(2). 酸和碱的反应
请同学们写出氢氧化钠分别与硫酸和盐酸反应的化学方程式。
NaOH + HCl ===== NaCl + H2O
2NaOH + H2SO4 ===== Na2SO4 + 2H2O
这两个反应有何特点、都生成了什么?是否属于复分解反应?
(3)酸和盐的反应
请写出碳酸钠、碳酸钙和盐酸的反应方程式。
Na2CO3 + 2HCl ===== 2NaCl + H2O + CO2↑
CaCO3 + 2HCl ===== CaCl2 + H2O + CO2↑
这两个反应有何特点、都生成了什么?是否属于复分解反应?
(4)碱和盐的反应
氢氧化钠溶液与硫酸铜溶液反应实验
实验现象
有少量蓝色絮状沉淀生成
试写出反应的化学方程式
CuSO4 + 2NaOH ===== Cu(OH)2↓ + Na2SO4
(5)盐和盐的反应
氯化钡溶液与硫酸铜溶液反应实验
实验现象
有白色沉淀生成
试写出反应的化学方程式
CuSO4 + BaCl2 ===== BaSO4↓ + CuCl2
归纳: 复分解反应包括:
酸+碱 盐+水
酸+盐 新酸+新盐
碱+盐 新碱+新盐
盐+盐 新盐1+新盐2
酸+金属氧化物 盐+水
5.复分解反应的实质:
以盐酸和氢氧化钠反应为例
HCl + NaOH = NaCI + H2O
离子结合生成↓或↑或H2O的过程
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
二. 酸、碱、盐的溶解性(20℃)
酸
碱
红褐色沉淀
蓝色沉淀
碱
说明: “ 溶 ”表示那种物质可溶于水,“ 不 ” 表示不溶于水,“ 微 ”表示微溶于水,“ 挥 ”表示挥发性,“ — ”表示那种物质不存在或者遇到水就分解了.
酸碱盐的溶解性口诀
1.口诀一:钾、钠、铵盐,硝酸盐,都能溶解水中间。盐酸盐不溶银亚汞,硫酸盐不溶钡和铅,微溶有钙银。碳酸盐a多不溶,溶者只有钾钠铵。碳酸氢溶镁微溶,钾、钠、铵、钡碱都溶,氢氧化钙a是微溶。挥发者有氢氧铵,硝酸、氯化、碳酸氢。
2.口诀二:钾钠铵硝酸盐溶水快,硫酸盐除去钡铅钙。氯化物不溶氯化银,硝酸盐溶液都透明。口诀中未有皆下沉。
3.口诀三:钾钠铵盐硝酸盐,都可溶于水中间。氯化物除银亚汞,硫酸盐除钡钙铅。碳酸磷酸盐,只溶钾钠铵。
4.口诀四:钾钠铵硝皆可溶,盐酸盐不溶银亚汞。硫酸盐不溶钡和铅,碳磷酸盐多不溶。多数酸溶碱少溶,只有钾钠铵钡溶。
初中常见7大沉淀
白色沉淀:碳酸钙 CaCO3
碳酸钡 BaCO3
氢氧化镁 Mg(OH)2
硫酸钡 BaSO4
氯化银 AgCl
蓝色沉淀:氢氧化铜 Cu(OH)2
红褐色沉淀:氢氧化铁 Fe(OH)3
探究复分解反应发生的条件
现象
化学方程式
NaOH
+CuSO4
B aCl2
实验向两支分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液,观察现象并填写下表。
CuSO4+
CuSO4+2NaOH=
Na2SO4+Cu(OH)2 ↓
有蓝色沉淀生成
有白色沉淀生成
CuSO4+B aCl2=
BaSO4↓CuCi2
二.复分解反应发生的条件
2、分析归纳上述几个酸、碱、盐之间的复分解反应,它们的生成 物有什么特点?
生成物都含有气体或有水或有沉淀。
讨论
1、酸和碱作用生成盐和水的中和反应是否也属复分解反应?为什么?
属于复分解反应。因为“酸+碱→盐+水”符合复分解反应的概念,两种化合物相互交换成分,生成另外两种化合物。
Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 ===== Fe2(SO4)3 + 3H2O
Na2CO3 + 2HCl ===== 2NaCl + H2O + CO2↑
CaCO3 + 2HCl ===== CaCl2 + H2O + CO2↑
NaOH + HCl ===== NaCl + H2O
2NaOH + H2SO4 ===== Na2SO4 + 2H2O
CuSO4 + 2NaOH ===== Cu(OH)2↓ + Na2SO4
Na2CO3 +Ca(OH)2 ===== CaCO3 ↓ + 2NaOH
复分解反应
生成物中有沉淀或气体或水生成。
发生条件
归纳:复分解反应发生的条件
至少满足上述条件之一
稀硫酸
判断 依据
NaOH
NaCl
K2CO3
B a(NO3)2
复分解反应的条件:两种化合物互相交换成分,生成物中有沉淀、气体或水生成时,复分解反应才可以发生。
能
能
能
不能
有水生成
没有水,气体或沉淀生成
有气体和水生成
有沉淀生成
即时理解
第1组 第2组 第3组 第4组
H2SO4 NaOH Na2CO3 KNO3 CuSO4
H2SO4
NaOH
Na2CO3
KNO3
CuSO4
↑
-
-
-
-
-
-
-
-
-
-
-
-
-
↑
↓
↓
↓
↓
练一练:判断反应是否发生,并说明理由
√
√
√
√
√
√
√
经典例题
例1. 下列化学反应属于复分解反应的是( )
A. CH4+2O2 CO2+2H2O B. 3Fe+2O2 Fe3O4
C. NaOH+HCl===NaCl+H2O D. H2CO3===CO2↑+H2O
【解析】A、该反应的反应物中氧气是单质,不是两种化合物相互交换成分生成两种新的化合物的反应,不属于复分解反应,故A错误;B、该反应符合“多变一”的特征,属于化合反应,故B错误;C、该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应,故C正确;D、该反应符合“一变多”的特征,属于分解反应,故D错误。故答案为:C
C
B
例2.将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是( )
A. HNO3和FeCl3 B. NaOH和HCl
C. BaCl2和Na2SO4 D. KOH和CuSO4
【解析】A选项硝酸与氯化铁溶液混合,能得到黄色溶液;B选项氢氧化钠和盐酸反应生成氯化钠溶液无色;C选项氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,不符合题意;D选项氢氧化钾和硫酸铜溶液反应生成蓝色沉淀;故答案选择B。
C
例3.下列溶液混合后,不能发生复分解反应的一组是( )
A. HCl和NaOH B. Na2CO3和H2SO4
C. KNO3和NaCl D. NaOH和FeCl3
【解析】A、盐酸和氢氧化钠混合能反应生成水,复分解反应能够进行,故A不选;B、碳酸钠和硫酸混合能生成二氧化碳气体,复分解反应能够进行,故B不选;C、硝酸钾和氯化钠混合没有沉淀、气体或水生成,复分解反应不能进行,故C符合题意;D、氢氧化钠和氯化铁混合能生成氢氧化铁沉淀,复分解反应能够进行,故C不选;故选C。
例4.下列物质间发生的化学反应属于复分解反应的是( )
A. 镁条在空气中燃烧生成氧化镁
B. 锌粒和稀硫酸反应生成氢气
C. 氢氧化钠溶液和硫酸铜溶液混合生成氢氧化铜沉淀
D. 高温煅烧石灰石生成生石灰
【解析】A、镁条在空气中燃烧生成氧化镁,由两种物质生成一种物质,属于化合反应,故该项不符合题意;B、锌粒和稀硫酸反应生成硫酸锌和氢气,由一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应,故该项不符合题意;C、氢氧化钠溶液和硫酸铜溶液混合生成氢氧化铜沉淀和硫酸钠,由两种化合物相互交换成分形成另外两种化合物的反应,属于复分解反应,故该项符合题意;D、高温煅烧石灰石生成氧化钙和二氧化碳,由一种物质生成两种物质,属于分解反应,故该项不符合题意。故选C。
C
例5.下列物质之间的转化,经过一步反应不能实现的是( )
A.CuCl2→KCl B.KNO3→K2SO4
C.Fe(OH)3→Fe2(SO4)3 D.BaCl2→BaCO3
【解析】A、氯化铜与氢氧化钾溶液反应生成氢氧化铜沉淀和氯化钾,通过一步反应能实现;B、由KNO3转化为K2SO4,假设能反应,对应的是硝酸盐和钾盐,而硝酸盐和钾盐均是可溶性盐,不符合复分解反应的条件,通过一步反应不能实现;C、氢氧化铁与硫酸反应生成硫酸铁和水,通过一步反应能实现;D、氯化钡与碳酸钠溶液反应生成碳酸钡沉淀和氯化钠,转化能由一步反应实现。故选B。
B
例6.有一包白色粉末可能是CuSO4、CaCl2、Na2CO3、NaCl四种物质中的一种或几种组成,为确定该白色粉末的成分,进行了如下探究:
(1)取少量该白色粉末溶于水,得到无色溶液,说明一定不存在________,理由是________________。
(2)向该溶液中加入过量的稀HCl,产生大量的气泡,说明一定有________,一定没有________,理由是__________________。
(3)将(2)所得溶液蒸发后只得到NaCl一种物质,则原白色粉末________(填“一定”“一定不”或“不一定”)含有NaCl。理由是___________。
。
【答案】(1). CuSO4 CuSO4溶液呈蓝色 (2). Na2CO3 CaCl2 CaCl2和Na2CO3会发生化学反应生成难溶于水的CaCO3 (3). 不一定 ⑦. 步骤(2)中稀HCl与Na2CO3反应也会生成NaCl
【解析】(1)将该白色粉末溶于水,得到无色溶液,而无水硫酸铜溶于水变成蓝色,说明一定不存在CuSO4;(2)取上述所得无色透明溶液于另一试管中,向其中加入足量的稀盐酸,碳酸钠和盐酸反应会生成二氧化碳气体,所以观察到有气泡产生的现象,得出结论,白色粉末中一定含有Na2CO3,推出一定不含CaCl2,碳酸钠和氯化钙反应会生成碳酸钙沉淀和氯化钠,化学方程式是:Na2CO3+CaCl2=CaCO3↓+2NaCl;(3)将(2)所得溶液蒸发只得到NaCl一种物质,则原白色粉末不一定含有NaCl,理由是步骤(2)中稀HCl与Na2CO3也会反应生成NaCl。
2.学会了通过常见的酸碱盐溶解性表找出溶解规律,能判断常见物质的溶解性。
1. 通过探究,知道了什么是复分解反应,并能写出化学方程式。
3. 通过实验探究知道了复分解反应的条件,并能解决实际问题。
课堂小结
随堂练习
1.下列各组物质的溶液之间能发生复分解反应,且有沉淀生成的是( )
A.H2SO4、Na2CO3 B.NaCl、KNO3
C.NaOH、HCl D.FeCl3、NaOH
D
【解析】A中两物质反应有气体放出;B中两物质不反应;C中两物质反应但没有明显的现象;D中两物质可以反应得到Fe(OH)3红褐色沉淀。
2.向盛有少量碳酸钠溶液的试管中滴入澄清石灰水,对此反应的说法错误的是( )
A.反应会产生白色沉淀
B.化学方程式为Ca(OH)2+Na2CO3===CaCO3+2NaOH
C.两种化合物互相交换成分生成另两种化合物
D.属于复分解反应
【解析】在溶液中进行的反应,生成的碳酸钙是沉淀,应该加上沉淀符号。
B
3. 下列化学反应中属于复分解反应的是( )
A.Fe+CuSO4===Cu+FeSO4
B.CO2+Ca(OH)2===CaCO3↓+H2O
C.Fe2O3+3CO=====2Fe+3CO2
D.NaOH+HCl===NaCl+H2O
【解析】复分解反应要抓住两点:一是两种化合物生成两种新的化合物,二是一定要互相交换成分。B项虽然是两种化合物生成两种新的化合物,但没有交换成分。
D
【解析】分解反应的生成物中可能含有单质,也可能不含单质;置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,所以生成物中一定含单质;根据化合反应和复分解反应的特点可知,化合反应和复分解反应的生成物中一定不含单质。
D
4.在①分解反应、②化合反应、③置换反应、④复分解反应四种基本反应类型中,生成物中一定不含单质的是( )
A.①② B.②③ C.①③④ D.②④
【解析】根据复分解反应规律可判断X中有钙元素,而且X可溶,所以X可以为CaCl2、Ca(NO3)2、Ca(OH)2等可溶性含钙化合物。
C
5.对于化学反应X+Na2CO3 === 2Y+CaCO3↓的分析,错误的是( )
A.该反应属于复分解反应
B.Y中一定含有钠元素
C.X一定是熟石灰
D.X中阴离子的化合价是-1
6.下表是部分物质的溶解性表(室温),利用表中提供的信息回答下列问题。
(1)NaOH和BaCl2两种物质混合后________(填“能”或“不能”)发生反应,理由是________________________________________________。(2)利用表中阴离子和阳离子构成的物质,写出一个有BaSO4生成的化学方程式:_____________________________________________________
____________________。
OH- Cl- SO42-
Na+ 溶 溶 溶
Cu2+ 不 溶 溶
Ba2+ 溶 溶 不
【答案】(1)不能 不具备复分解反应发生的条件,没有水、气体或沉淀生成 (2)CuSO4+BaCl2===BaSO4↓+CuCl2(合理即可)
【解析】(1)根据溶解性表可知,NaOH、BaCl2、Ba(OH)2、NaCl都可溶,NaOH和BaCl2两种物质混合后没有沉淀、气体和水生成,不满足复分解反应的条件,不能发生反应。(2)Ba(OH)2或BaCl2都可以与可溶性硫酸盐反应生成硫酸钡。
化学就象你头顶上的果实,
只要肯稍作努力,成功的
甜蜜就属于你!
祝你成功!
See You
课题3 常见的盐
人教版九年级化学下同步教学课件
第十单元 常见的酸、碱、盐
第3课时 复分解反应
学习目标:
2.学会通过常见的酸碱盐溶解性表找出溶解规律,能判断常见物质的溶解性。
1. 通过探究,知道什么是复分解反应,并能写出化学方程式。
3. 通过实验探究知道复分解反应的条件,并能解决实际问题。
知识回顾:
写出下列反应的化学方程式,并归纳它们有什么共同特征
(1)氢氧化钠与硫酸
(2)碳酸钠与盐酸
(3)碳酸氢钠与盐酸
(4)碳酸钙与盐酸
(5)碳酸钠与澄清石灰水
2NaOH+H2SO4=Na2SO4+2H2O
Na2CO3+2HCl = 2NaCl+ H2CO3
NaHCO3+HCl = NaCl+ H2CO3
CaCO3+2HCl = CaCl2+H2CO3
Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH
CO2↑+H2O
CO2↑+H2O
CO2↑+H2O
共同特征:
AB+CD → AD+CB(两种化合物,双交换,价不变)
思考1:两种化合物发生反应生成另外两种化合物的反应一定是复分解反应吗?
不一定;只是由两种化合物互相交换成分,生成另外两种化合物的反应,才是复分解反应。而如:非金属氧化物+碱→盐+水,这类反应则不属于复分解反应。
思考2.酸、碱、盐之间任意两种化合物都能发生复分解反应吗?需要什么条件?
酸、碱、盐之间并不是都能发生反应。只有当两种化合物互相交换成分,生成物中有沉淀、水或气体时,复分解反应才能发生。复分解反应发生的要求:它对反应物、生成物均有条件要求,如若有酸参加反应,另一种反应物可溶于水,也可难溶于水;若无酸参加反应,两种反应物需都可溶于水;生成物中有沉淀或气体或水。
一. 复分解反应的概述
1.定义:两种化合物互相交换成分生成另外两种化合物的反应。
2.通式:AB + CD = AD + CB
3.特点:双交换,价不变。
如:HCl+NaOH=NaCl+H2O
注意:CO2+2NaOH=Na2CO3+H2O 不是复分解反应,因为两种化合物没有相互交换成分。
+
+
思考:1. 酸碱中和反应是不是复分解反应?
2. 酸与金属氧化物反应是不是复分解反应?
酸碱中和反应和酸与金属氧化物的反应都属于复分解反应,而碱与非金属氧化物的反应却不是复分解反应。
3. 碱与非金属氧化物反应是不是复分解反应?
酸 + 碱 → 盐 + 水
酸 + 金属氧化物 → 盐 + 水
碱 + 非金属氧化物 → 盐 + 水
NaOH + HCl NaCl + H2O
Fe2O3 + 6HCl 2FeCl3 + 3H2O
2NaOH + CO2 Na2CO3 + H2O
1、HCl+NaOH=NaCl+H2O
2、2HCl+Na2CO3=2NaCl+H2O+CO2↑
3、6HCl+Fe2O3=2FeCl3+3H2O
4、NaOH+CuSO4= Na2SO4 +Cu(OH)2↓
√
√
√
√
考考你:判断哪些属于复分解反应?
(1).酸和金属氧化物的反应
我们已经学过利用盐酸和硫酸除去金属表面的锈迹(如铁锈),你能写出相关反应的化学方程式吗?
Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 ===== Fe2(SO4)3 + 3H2O
这两个反应有何特点、都生成了什么?是否属于复分解反应?
4. 复分解反应常见类型
(2). 酸和碱的反应
请同学们写出氢氧化钠分别与硫酸和盐酸反应的化学方程式。
NaOH + HCl ===== NaCl + H2O
2NaOH + H2SO4 ===== Na2SO4 + 2H2O
这两个反应有何特点、都生成了什么?是否属于复分解反应?
(3)酸和盐的反应
请写出碳酸钠、碳酸钙和盐酸的反应方程式。
Na2CO3 + 2HCl ===== 2NaCl + H2O + CO2↑
CaCO3 + 2HCl ===== CaCl2 + H2O + CO2↑
这两个反应有何特点、都生成了什么?是否属于复分解反应?
(4)碱和盐的反应
氢氧化钠溶液与硫酸铜溶液反应实验
实验现象
有少量蓝色絮状沉淀生成
试写出反应的化学方程式
CuSO4 + 2NaOH ===== Cu(OH)2↓ + Na2SO4
(5)盐和盐的反应
氯化钡溶液与硫酸铜溶液反应实验
实验现象
有白色沉淀生成
试写出反应的化学方程式
CuSO4 + BaCl2 ===== BaSO4↓ + CuCl2
归纳: 复分解反应包括:
酸+碱 盐+水
酸+盐 新酸+新盐
碱+盐 新碱+新盐
盐+盐 新盐1+新盐2
酸+金属氧化物 盐+水
5.复分解反应的实质:
以盐酸和氢氧化钠反应为例
HCl + NaOH = NaCI + H2O
离子结合生成↓或↑或H2O的过程
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
二. 酸、碱、盐的溶解性(20℃)
酸
碱
红褐色沉淀
蓝色沉淀
碱
说明: “ 溶 ”表示那种物质可溶于水,“ 不 ” 表示不溶于水,“ 微 ”表示微溶于水,“ 挥 ”表示挥发性,“ — ”表示那种物质不存在或者遇到水就分解了.
酸碱盐的溶解性口诀
1.口诀一:钾、钠、铵盐,硝酸盐,都能溶解水中间。盐酸盐不溶银亚汞,硫酸盐不溶钡和铅,微溶有钙银。碳酸盐a多不溶,溶者只有钾钠铵。碳酸氢溶镁微溶,钾、钠、铵、钡碱都溶,氢氧化钙a是微溶。挥发者有氢氧铵,硝酸、氯化、碳酸氢。
2.口诀二:钾钠铵硝酸盐溶水快,硫酸盐除去钡铅钙。氯化物不溶氯化银,硝酸盐溶液都透明。口诀中未有皆下沉。
3.口诀三:钾钠铵盐硝酸盐,都可溶于水中间。氯化物除银亚汞,硫酸盐除钡钙铅。碳酸磷酸盐,只溶钾钠铵。
4.口诀四:钾钠铵硝皆可溶,盐酸盐不溶银亚汞。硫酸盐不溶钡和铅,碳磷酸盐多不溶。多数酸溶碱少溶,只有钾钠铵钡溶。
初中常见7大沉淀
白色沉淀:碳酸钙 CaCO3
碳酸钡 BaCO3
氢氧化镁 Mg(OH)2
硫酸钡 BaSO4
氯化银 AgCl
蓝色沉淀:氢氧化铜 Cu(OH)2
红褐色沉淀:氢氧化铁 Fe(OH)3
探究复分解反应发生的条件
现象
化学方程式
NaOH
+CuSO4
B aCl2
实验向两支分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液,观察现象并填写下表。
CuSO4+
CuSO4+2NaOH=
Na2SO4+Cu(OH)2 ↓
有蓝色沉淀生成
有白色沉淀生成
CuSO4+B aCl2=
BaSO4↓CuCi2
二.复分解反应发生的条件
2、分析归纳上述几个酸、碱、盐之间的复分解反应,它们的生成 物有什么特点?
生成物都含有气体或有水或有沉淀。
讨论
1、酸和碱作用生成盐和水的中和反应是否也属复分解反应?为什么?
属于复分解反应。因为“酸+碱→盐+水”符合复分解反应的概念,两种化合物相互交换成分,生成另外两种化合物。
Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 ===== Fe2(SO4)3 + 3H2O
Na2CO3 + 2HCl ===== 2NaCl + H2O + CO2↑
CaCO3 + 2HCl ===== CaCl2 + H2O + CO2↑
NaOH + HCl ===== NaCl + H2O
2NaOH + H2SO4 ===== Na2SO4 + 2H2O
CuSO4 + 2NaOH ===== Cu(OH)2↓ + Na2SO4
Na2CO3 +Ca(OH)2 ===== CaCO3 ↓ + 2NaOH
复分解反应
生成物中有沉淀或气体或水生成。
发生条件
归纳:复分解反应发生的条件
至少满足上述条件之一
稀硫酸
判断 依据
NaOH
NaCl
K2CO3
B a(NO3)2
复分解反应的条件:两种化合物互相交换成分,生成物中有沉淀、气体或水生成时,复分解反应才可以发生。
能
能
能
不能
有水生成
没有水,气体或沉淀生成
有气体和水生成
有沉淀生成
即时理解
第1组 第2组 第3组 第4组
H2SO4 NaOH Na2CO3 KNO3 CuSO4
H2SO4
NaOH
Na2CO3
KNO3
CuSO4
↑
-
-
-
-
-
-
-
-
-
-
-
-
-
↑
↓
↓
↓
↓
练一练:判断反应是否发生,并说明理由
√
√
√
√
√
√
√
经典例题
例1. 下列化学反应属于复分解反应的是( )
A. CH4+2O2 CO2+2H2O B. 3Fe+2O2 Fe3O4
C. NaOH+HCl===NaCl+H2O D. H2CO3===CO2↑+H2O
【解析】A、该反应的反应物中氧气是单质,不是两种化合物相互交换成分生成两种新的化合物的反应,不属于复分解反应,故A错误;B、该反应符合“多变一”的特征,属于化合反应,故B错误;C、该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应,故C正确;D、该反应符合“一变多”的特征,属于分解反应,故D错误。故答案为:C
C
B
例2.将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是( )
A. HNO3和FeCl3 B. NaOH和HCl
C. BaCl2和Na2SO4 D. KOH和CuSO4
【解析】A选项硝酸与氯化铁溶液混合,能得到黄色溶液;B选项氢氧化钠和盐酸反应生成氯化钠溶液无色;C选项氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,不符合题意;D选项氢氧化钾和硫酸铜溶液反应生成蓝色沉淀;故答案选择B。
C
例3.下列溶液混合后,不能发生复分解反应的一组是( )
A. HCl和NaOH B. Na2CO3和H2SO4
C. KNO3和NaCl D. NaOH和FeCl3
【解析】A、盐酸和氢氧化钠混合能反应生成水,复分解反应能够进行,故A不选;B、碳酸钠和硫酸混合能生成二氧化碳气体,复分解反应能够进行,故B不选;C、硝酸钾和氯化钠混合没有沉淀、气体或水生成,复分解反应不能进行,故C符合题意;D、氢氧化钠和氯化铁混合能生成氢氧化铁沉淀,复分解反应能够进行,故C不选;故选C。
例4.下列物质间发生的化学反应属于复分解反应的是( )
A. 镁条在空气中燃烧生成氧化镁
B. 锌粒和稀硫酸反应生成氢气
C. 氢氧化钠溶液和硫酸铜溶液混合生成氢氧化铜沉淀
D. 高温煅烧石灰石生成生石灰
【解析】A、镁条在空气中燃烧生成氧化镁,由两种物质生成一种物质,属于化合反应,故该项不符合题意;B、锌粒和稀硫酸反应生成硫酸锌和氢气,由一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应,故该项不符合题意;C、氢氧化钠溶液和硫酸铜溶液混合生成氢氧化铜沉淀和硫酸钠,由两种化合物相互交换成分形成另外两种化合物的反应,属于复分解反应,故该项符合题意;D、高温煅烧石灰石生成氧化钙和二氧化碳,由一种物质生成两种物质,属于分解反应,故该项不符合题意。故选C。
C
例5.下列物质之间的转化,经过一步反应不能实现的是( )
A.CuCl2→KCl B.KNO3→K2SO4
C.Fe(OH)3→Fe2(SO4)3 D.BaCl2→BaCO3
【解析】A、氯化铜与氢氧化钾溶液反应生成氢氧化铜沉淀和氯化钾,通过一步反应能实现;B、由KNO3转化为K2SO4,假设能反应,对应的是硝酸盐和钾盐,而硝酸盐和钾盐均是可溶性盐,不符合复分解反应的条件,通过一步反应不能实现;C、氢氧化铁与硫酸反应生成硫酸铁和水,通过一步反应能实现;D、氯化钡与碳酸钠溶液反应生成碳酸钡沉淀和氯化钠,转化能由一步反应实现。故选B。
B
例6.有一包白色粉末可能是CuSO4、CaCl2、Na2CO3、NaCl四种物质中的一种或几种组成,为确定该白色粉末的成分,进行了如下探究:
(1)取少量该白色粉末溶于水,得到无色溶液,说明一定不存在________,理由是________________。
(2)向该溶液中加入过量的稀HCl,产生大量的气泡,说明一定有________,一定没有________,理由是__________________。
(3)将(2)所得溶液蒸发后只得到NaCl一种物质,则原白色粉末________(填“一定”“一定不”或“不一定”)含有NaCl。理由是___________。
。
【答案】(1). CuSO4 CuSO4溶液呈蓝色 (2). Na2CO3 CaCl2 CaCl2和Na2CO3会发生化学反应生成难溶于水的CaCO3 (3). 不一定 ⑦. 步骤(2)中稀HCl与Na2CO3反应也会生成NaCl
【解析】(1)将该白色粉末溶于水,得到无色溶液,而无水硫酸铜溶于水变成蓝色,说明一定不存在CuSO4;(2)取上述所得无色透明溶液于另一试管中,向其中加入足量的稀盐酸,碳酸钠和盐酸反应会生成二氧化碳气体,所以观察到有气泡产生的现象,得出结论,白色粉末中一定含有Na2CO3,推出一定不含CaCl2,碳酸钠和氯化钙反应会生成碳酸钙沉淀和氯化钠,化学方程式是:Na2CO3+CaCl2=CaCO3↓+2NaCl;(3)将(2)所得溶液蒸发只得到NaCl一种物质,则原白色粉末不一定含有NaCl,理由是步骤(2)中稀HCl与Na2CO3也会反应生成NaCl。
2.学会了通过常见的酸碱盐溶解性表找出溶解规律,能判断常见物质的溶解性。
1. 通过探究,知道了什么是复分解反应,并能写出化学方程式。
3. 通过实验探究知道了复分解反应的条件,并能解决实际问题。
课堂小结
随堂练习
1.下列各组物质的溶液之间能发生复分解反应,且有沉淀生成的是( )
A.H2SO4、Na2CO3 B.NaCl、KNO3
C.NaOH、HCl D.FeCl3、NaOH
D
【解析】A中两物质反应有气体放出;B中两物质不反应;C中两物质反应但没有明显的现象;D中两物质可以反应得到Fe(OH)3红褐色沉淀。
2.向盛有少量碳酸钠溶液的试管中滴入澄清石灰水,对此反应的说法错误的是( )
A.反应会产生白色沉淀
B.化学方程式为Ca(OH)2+Na2CO3===CaCO3+2NaOH
C.两种化合物互相交换成分生成另两种化合物
D.属于复分解反应
【解析】在溶液中进行的反应,生成的碳酸钙是沉淀,应该加上沉淀符号。
B
3. 下列化学反应中属于复分解反应的是( )
A.Fe+CuSO4===Cu+FeSO4
B.CO2+Ca(OH)2===CaCO3↓+H2O
C.Fe2O3+3CO=====2Fe+3CO2
D.NaOH+HCl===NaCl+H2O
【解析】复分解反应要抓住两点:一是两种化合物生成两种新的化合物,二是一定要互相交换成分。B项虽然是两种化合物生成两种新的化合物,但没有交换成分。
D
【解析】分解反应的生成物中可能含有单质,也可能不含单质;置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,所以生成物中一定含单质;根据化合反应和复分解反应的特点可知,化合反应和复分解反应的生成物中一定不含单质。
D
4.在①分解反应、②化合反应、③置换反应、④复分解反应四种基本反应类型中,生成物中一定不含单质的是( )
A.①② B.②③ C.①③④ D.②④
【解析】根据复分解反应规律可判断X中有钙元素,而且X可溶,所以X可以为CaCl2、Ca(NO3)2、Ca(OH)2等可溶性含钙化合物。
C
5.对于化学反应X+Na2CO3 === 2Y+CaCO3↓的分析,错误的是( )
A.该反应属于复分解反应
B.Y中一定含有钠元素
C.X一定是熟石灰
D.X中阴离子的化合价是-1
6.下表是部分物质的溶解性表(室温),利用表中提供的信息回答下列问题。
(1)NaOH和BaCl2两种物质混合后________(填“能”或“不能”)发生反应,理由是________________________________________________。(2)利用表中阴离子和阳离子构成的物质,写出一个有BaSO4生成的化学方程式:_____________________________________________________
____________________。
OH- Cl- SO42-
Na+ 溶 溶 溶
Cu2+ 不 溶 溶
Ba2+ 溶 溶 不
【答案】(1)不能 不具备复分解反应发生的条件,没有水、气体或沉淀生成 (2)CuSO4+BaCl2===BaSO4↓+CuCl2(合理即可)
【解析】(1)根据溶解性表可知,NaOH、BaCl2、Ba(OH)2、NaCl都可溶,NaOH和BaCl2两种物质混合后没有沉淀、气体和水生成,不满足复分解反应的条件,不能发生反应。(2)Ba(OH)2或BaCl2都可以与可溶性硫酸盐反应生成硫酸钡。
化学就象你头顶上的果实,
只要肯稍作努力,成功的
甜蜜就属于你!
祝你成功!
See You
同课章节目录
