10.3常见的盐第4课时 盐的化学性质 复分解反应的应用课件(共40张PPT内嵌视频)-2024-2025学年人教版九年级化学下册
文档属性
| 名称 | 10.3常见的盐第4课时 盐的化学性质 复分解反应的应用课件(共40张PPT内嵌视频)-2024-2025学年人教版九年级化学下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-07 22:29:30 | ||
图片预览











文档简介
(共40张PPT)
课题3 常见的盐
人教版九年级化学下同步教学课件
第十单元 常见的酸、碱、盐
第4课时 盐的化学性质 复分解反应的应用
+
+
学习目标:
2.复习巩固复分解反应的相关知识。
1. 复习并归纳盐的化学性质。
3. 学会运用复分解反应处理部分离子共存与物质除杂等题目。
Na2CO3 + 2HCl 2NaCl + H2O + CO2↑
NaHCO3 + HCl NaCl + H2O + CO2↑
Na2CO3 + Ca(OH)2 2NaOH + CaCO3↓
H2CO3
由两种化合物互相交换成分,生成另外两种化合物的反应叫做复分解反应。
知识回顾:
复分解反应
特点:“互交换,价不变”。
表达式:AB+CD→AD+CB。(正价在前,负价在后)
实质:离子结合生成↓或↑或H2O的过程
+
+
四大基本反应类型的特点
化合反应
分解反应
置换反应
复分解反应
单换单
多变一
一变多
互交换
价不变
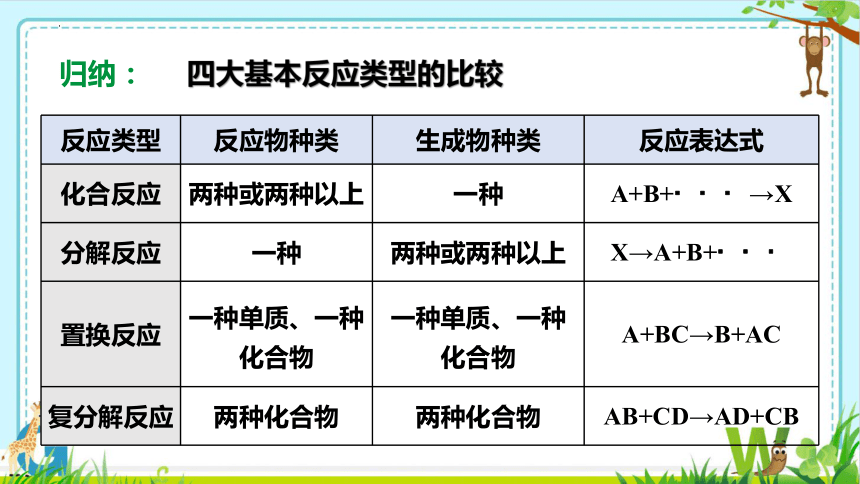
反应类型 反应物种类 生成物种类 反应表达式
化合反应 两种或两种以上 一种 A+B+ →X
分解反应 一种 两种或两种以上 X→A+B+
置换反应 一种单质、一种化合物 一种单质、一种化合物 A+BC→B+AC
复分解反应 两种化合物 两种化合物 AB+CD→AD+CB
归纳:
四大基本反应类型的比较
【实验】碳酸钠、碳酸氢钠分别与盐酸反应,是否都能产生CO2 ?
1. 与酸反应
一. 盐的化学性质
碳酸钠+盐酸 碳酸氢钠+盐酸
现象
分析
产生大量气泡,澄清石灰水变浑浊
有二氧化碳生成
产生大量气泡,澄清石灰水变浑浊
有二氧化碳生成
碳酸钠和稀盐酸反应的动画过程
实质:
旁观者:
Cl-和Na+
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
CO2
CO2
结论:
有CO2生成的复分解反应实质是 和H+反应
怎样检验这 些物质中含有碳酸根或者碳酸氢根?
即时理解
某物质
+稀盐酸
产生气体
变浑浊
CO2
CaCO3
(含碳酸根或碳酸氢根离子)
归纳:
碳酸根或碳酸氢根离子检验方法:
+澄清石灰水
【实验】硫酸铜溶液与氢氧化钠溶液的反应
实验现象
有少量蓝色絮状沉淀生成
试写出反应的化学方程式
CuSO4 + 2NaOH ===== Cu(OH)2↓ + Na2SO4
2.与碱溶液反应
【实验】向盛有少量碳酸钠溶液的试管中滴入澄清石灰水,观察现象。
现象: 。
分析: 。
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
试管里出现白色沉淀
碳酸钠与氢氧化钙反应,生成一种难溶物碳酸钙
这个原理常用作两种碱之间的相互转化。
3. 盐和盐的反应
氯化钡溶液与硫酸铜溶液反应实验
实验现象
有白色沉淀生成
试写出反应的化学方程式
CuSO4 + BaCl2 ===== BaSO4↓ + CuCl2
氯化钡与硫酸钠反应动画过程
实质:
旁观者:
Cl-和Na+
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
结论:
有BaSO4沉淀生成的复分解反应实质是Ba2+和 反应
盐的化学性质小结
盐
+
金属
新盐
酸
新盐
碱
新盐
盐
新盐
新金属
+
新酸
+
新碱
+
+
新盐
(强酸制弱酸)
(强碱制弱碱)
(1)盐溶液的颜色
①、铜盐(Cu 2+) 溶液: 蓝色
②、铁盐(Fe 3+ )溶液:黄色
③、亚铁盐(Fe 2+ )溶液:浅绿色
④、高锰酸钾溶液:紫红色
⑤、其它盐溶液一般:无色
二. 复分解反应的应用
1. 离子共存
白色沉淀:
CaCO3、BaCO3 、Ag2CO3
BaSO4、AgCl…(既不溶入水也不溶入酸)
Mg(OH)2、Al(OH)3、Zn(OH)2
蓝色沉淀:Cu(OH)2
红褐色沉淀:Fe(OH)3
(2)常见的沉淀颜色
H+
OH-
CO32-
NH4+
Ba2+
Ca2+
Mg2+
Cu2+
Al3+
Fe3+
Ag+
Cl-
Zn2+
(3)在同一溶液中不能大量共存,即结合产生沉淀、气体或水的离子
Fe2+
2. 物质除杂
(1)三原则:
①不引入新杂质;
②不减少被提纯物质的质量;
③杂质便于分离。
(2)三要领:
①根据物理性质或化学性质的差异;
②确定除杂质方法;
③选择适宜试剂。
(3)六种常用方法:
①化气法: 与杂质反应生成气体而除去.
例如:除NaCl中Na2CO3,可加适量稀HCl:
Na2CO3+ 2HCl=2NaCl+ CO2↑+ H2O
②沉淀法:将杂质转化为沉淀过滤除去。
例如:除去NaOH中的Na2CO3,可加适量的Ca(OH)2:Na2CO3+ Ca(OH)2==CaCO3↓+2NaOH
③置换法:将杂质通过置换反应而除去
例如:除FeSO4中的CuSO4,可加过量的铁粉,再过滤:CuSO4+Fe==Cu+FeSO4
④溶解法:将杂质溶于某种试剂而除去。
例如:除C粉中的CuO粉,可加适量稀硫酸,再过滤:
CuO+ H2SO4==CuSO4+ H2O
⑤加热法:杂质受热易分解,通过加热将杂质除去。
例如:除CaO中的CaCO3可加热:
CaCO3 CaO+ CO2↑
⑥转化法:将杂质通过化学反应转化为主要成分
例如:除CO2中的CO,可将气体通过灼热的CuO:CO+CuO Cu+CO2
经典例题
例1.将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是( )
A. HNO3和FeCl3 B. NaOH和HCl
C. BaCl2和Na2SO4 D. KOH和CuSO4
【解析】A选项硝酸与氯化铁溶液混合,能得到黄色溶液;
B选项氢氧化钠和盐酸反应生成氯化钠溶液无色;C选项氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,不符合题意;D选项氢氧化钾和硫酸铜溶液反应生成蓝色沉淀;故答案选择B。
B
C
例2.下列溶液混合后,不能发生复分解反应的一组是
( )
A. HCl和NaOH B. Na2CO3和H2SO4
C. KNO3和NaCl D. NaOH和FeCl3
【解析】A、盐酸和氢氧化钠混合能反应生成水,复分解反应能够进行,故A不选;B、碳酸钠和硫酸混合能生成二氧化碳气体,复分解反应能够进行,故B不选;C、硝酸钾和氯化钠混合没有沉淀、气体或水生成,复分解反应不能进行,故C符合题意;D、氢氧化钠和氯化铁混合能生成氢氧化铁沉淀,复分解反应能够进行,故C不选;故选C。
D
例3.下列除杂所选用试剂与操作方法均正确的是( )
【解析】除去杂质的原则是所加试剂只与杂质反应,且不生成新的杂质。A、水能与氧化钙反应,错误;B、氧化铜能与氢气反应,错误;C、有BaCl2溶液剩余,引入了杂质,错误;D、Na2CO3+2HCl==2NaCl+H2O+CO2↑,剩余的稀盐酸通过蒸发可除去,正确。故选D。
选项 物质(括号内为杂质) 除杂试剂 实验操作
A CaO(CaCO3) 水 溶解、过滤
B H2(CO) 灼热CuO 洗气
C NaCl(Na2SO4) 过量BaCl2溶液 过滤
D NaCl(Na2CO3) 足量稀盐酸 蒸发结晶
例4.下列各组离子在指定溶液中能大量共存的一组是( )
A. 在硝酸铵溶液中:Na+、Cu2+、OH﹣
B. 在稀盐酸中:Ba2+、CO32﹣、Zn2+
C. 在氯化钠溶液中:K+、Ca2+、NO3﹣
D. 在氢氧化钠溶液中:H+、Mg2+、Cl﹣
【解析】A、硝酸铵溶液中含有铵根离子和硝酸根离子,Cu2+、OH﹣两种离子能结合成氢氧化铜沉淀,OH﹣、铵根离子两种离子能结合成水和氨气,不能大量共存,故选项错误。B、稀盐酸中含有氢离子和氯离子,H+、CO32﹣两种离子能结合成水和二氧化碳,Ba2+、Zn2+与CO32﹣也不能共存,不能大量共存,故选项错误。C、氯化钠溶液中含有钠离子和氯离子,钠离子、氯离子、K+、Ca2+、NO3﹣五种离子间不能结合成沉淀、气体或水,能大量共存,故选项正确。D、氢氧化钠溶液中含有钠离子和氢氧根离子,H+、OH﹣两种离子能结合成水,Mg2+、OH﹣两种离子能结合成氢氧化镁沉淀,不能大量共存,故选项错误。
故选C。
C
例5.下列物质的溶液,不另加试剂就不能鉴别出来的一组是
( )
A. CuSO4、BaCl2、H2SO4 B. Na2CO3、Ca(NO3)2、HCl
C. Na2SO4、KNO3、HCl D. FeCl3、NaOH、 KMnO4
【解析】A、首先根据溶液颜色,判断出CuSO4(蓝色溶液),然后再利用CuSO4与其它的两种溶液反应,能形成白色沉淀的为BaCl2,可以鉴别出来,正确,B、Na2CO3能与Ca(NO3)2反应生成白色沉淀,且能与HCl反应有气泡产生,故可以鉴别出来,正确,C、Na2SO4、KNO3、HCl三种物质相互之间都不会反应,故无法鉴别出来,错误,D、直接根据溶液颜色,判断出FeCl3(黄色溶液),KMnO4(紫红色溶液),而NaOH溶液为无色,故可以鉴别出来,故选C
C
例6.有一包白色粉末可能是CuSO4、CaCl2、Na2CO3、NaCl四种物质中的一种或几种组成,为确定该白色粉末的成分,进行了如下探究:
(1)取少量该白色粉末溶于水,得到无色溶液,说明一定不存在________,理由是________________。
(2)向该溶液中加入过量的稀HCl,产生大量的气泡,说明一定有________,一定没有________,理由是__________________。
(3)将(2)所得溶液蒸发后只得到NaCl一种物质,则原白色粉末________(填“一定”“一定不”或“不一定”)含有NaCl。理由是___________。
【答案】 (1). CuSO4 CuSO4溶液呈蓝色 (2). Na2CO3 CaCl2 CaCl2和Na2CO3会发生化学反应生成难溶于水的CaCO3 (3). 不一定 步骤(2)中稀HCl与Na2CO3反应也会生成NaCl
【解析】(1)将该白色粉末溶于水,得到无色溶液,而无水硫酸铜溶于水变成蓝色,说明一定不存在CuSO4;(2)取上述所得无色透明溶液于另一试管中,向其中加入足量的稀盐酸,碳酸钠和盐酸反应会生成二氧化碳气体,所以观察到有气泡产生的现象,得出结论,白色粉末中一定含有Na2CO3,推出一定不含CaCl2,碳酸钠和氯化钙反应会生成碳酸钙沉淀和氯化钠,化学方程式是:Na2CO3+CaCl2=CaCO3↓+2NaCl;(3)将(2)所得溶液蒸发只得到NaCl一种物质,则原白色粉末不一定含有NaCl,理由是步骤(2)中稀HCl与Na2CO3也会反应生成NaCl。
2.复习巩固了复分解反应的相关知识。
1. 复习并归纳了盐的化学性质。
3. 学会运用复分解反应处理部分离子共存与物质除杂等题目。
课堂小结
随堂练习
1.下列各组离子在水中能大量共存的是( )
A. H+、Na+、Cl﹣、HCO3﹣
B. H+、K+、Cl﹣、OH﹣
C. Cu2+、Ba2+、Cl﹣、SO42﹣
D. K+、NH4+、Cl﹣、NO3﹣
D
【解析】A、H+、HCO3﹣会生成二氧化碳气体和水,不能共存,故A错误;B、H+、OH﹣两种离子能结合成水,不能大量共存,故B错误;C、Ba2+、SO42﹣两种离子能结合成硫酸钡沉淀,不能大量共存,故C错误;D、四种离子间不能结合成沉淀、气体或水,能大量共存,故D正确。故选D。
2.小金制作了一个如图甲所示的简易酸碱灭火器,并进行了如图乙所示的灭火操作,结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色;②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀生成。则残留液
中有大量的( )
A. 硫酸钠 B. 碳酸钠
C. 盐酸 D. 氯化钠
【解析】简易酸碱灭火器中碳酸钠溶液与一种常见的酸反应;结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色,石蕊溶液遇酸性溶液变红色,遇碱性溶液变蓝色,则说明残留液显酸性。②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀存在,说明此沉淀是氯化银或硫酸钡沉淀,由于反应物是一种酸,酸与碳酸钠溶液反应生成盐、水和二氧化碳,同时酸有剩余,则原酸溶液为硫酸,硫酸与碳酸钠溶液反应生成硫酸钠、水和二氧化碳,则残留液中有大量的硫酸钠、硫酸;故选A。
A
3.下列各组离子在酸性溶液中能大量共存的是( )
A. Ag+、Na+、Cl-、NO3- B. Na+、K+、OH-、SO42-
C. K+、Na+、CO32-、Cl- D. Ba2+、Mg2+、NO3-
【解析】A、Ag+离子和Cl-离子-反应会生成氯化银沉淀,不能大量共存,错误;B、在酸性溶液中存在着H+离子。H+离子与OH--离子反应生成水,不能大量共存,错误;C、在酸性溶液中存在着H+离子。H+离子与CO32-离子反应生成二氧化碳气体和水,不能大量共存,错误;D、四种离子在酸性条件下不发生任何反应,能大量共存,正确。故选D。
点睛:离子重新结合生成水或气体或沉淀时,就不能共存;本题还要注意题文明确指出了是酸性溶液中,即说明该溶液中含有氢离子。
D
【解析】A、氯化铜在碱性溶液中不能共存,错误;B、盐酸不能在碱性溶液中共存,错误;C、硫酸钾和氯化钡不能共存,错误;D、NaCl 、KOH 、KNO3可以在碱性溶液中共存,且都没有颜色,正确。故选D。
D
4.25℃时,下列物质在PH=12的溶液中能大量共存并形成无色溶液的是( )
A. CuCl2 NaCl Ba(NO3)2 B. CaCl2 KNO3 HCl
C. K2SO4 BaCl2 NaNO3 D. NaCl KOH KNO3
C
5.一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl-、OH-和SO42-离子的一种或几种。为确定溶液中可能存在的离子,进行下面实验。①经测定,溶液的PH=1;②取部分样品滴加NaOH溶液,有沉淀生成。继续滴加NaOH溶液至不再产生沉淀为止,过滤;③向实验②得到的滤液中继续滴加Na2CO3溶液,又观察到沉淀生成.分析实验得到的以下结论中,正确的是( )。
A. 溶液中一定含有H+、Ba2+、Cl-,一定不含有Na+、Fe3+、OH-、SO42-
B. 溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有Na+、OH-和SO42-
C. 溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有OH-、SO42-,可能含有Na+
D. 溶液中一定含有H+、Ba2+、Na+、Fe3+,一定不含有OH-、SO42-,可能含有Cl-
【解析】①经测定,溶液的pH=1,该溶液显酸性,一定含有H+、一定不含有OH﹣; ②取部分样品溶液滴加NaOH溶液,有沉淀生成.一定含Fe3+; ③向实验②得到的滤液中滴加Na2CO3溶液,又观察到沉淀生成,证明滤液中含有Ba2+,则一定不含有SO42-,溶液中阴阳离子平衡,所以一定含有Cl﹣。
综上所述,溶液中一定含有H+、Ba2+、Fe3+、Cl﹣,一定不含有OH﹣、SO42-,可能含有Na+。故选C.
6.应的实验,反应后都进行过滤得到无色滤液,他们对自己得到的无色滤液中溶质的成分进行探究。请你一同参与他们的探究活动。
【提出猜想】他们各自所得滤液中溶质的成分有如下几种可能:
A.NaOH B.Na2CO3、Ba(OH)2、NaOH
C.________________ D.Na2CO3和NaOH
【讨论交流】上述猜想中,肯定不成立的是B(填猜想序号),其理由是____________。
【实验探究】甲、乙两同学为了验证各自所得滤液的成分,分别进行了如下实验:
实验操作 实验现象 实验结论
甲同学 取少量滤液于试管中,加入足量的_____溶液 ________ 滤液中溶质的成分与猜想C对应
乙同学 取少量滤液于试管中,加入足量的Na2CO3溶液 无明显实验 现象 滤液中溶质的成分与猜想A 对应
【反思与评价】经过讨论,大家一致认为甲同学的实验结论是正确的,乙同学的实验结论不一定正确。请你帮乙同学设计实验,进一步确定乙同学得到的滤液中溶质的成分。
实验操作及实验现象 实验结论
__________ 滤液中溶质的成分与猜想_____对应
【答案】: 【提出猜想】 Ba(OH)2、NaOH 【讨论交流】Na2CO3和Ba(OH)2能发生反应 【实验探究】Na2CO3##碳酸钠 产生白色沉淀 【反思与评价】 加入Ba(OH)2溶液或Ca(OH)2溶液,无明显现象 A
【解析】根据碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,各自所得滤液中溶质的成分有如下几种可能:A.NaOH B.Na2CO3、Ba(OH)2、NaOH C.Ba(OH)2、NaOH; D.Na2CO3和NaOH;讨论交流:上述猜想中,肯定不成立的是B,其理由是Na2CO3和Ba(OH)2能发生反应; 实验探究:根据实验结论滤液中溶质的成分与猜想C对应,根据碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,出现白色沉淀,故取少量滤液于试管中,加入足量的碳酸钠溶液,产生白色沉淀,证明猜想C正确; 反思与评价:经过讨论,大家一致认为甲同学的实验结论是正确的,乙同学的实验结论不一定正确。 进一步确定乙同学得到的滤液中溶质的成分。具体操作为加入Ba(OH)2溶液或Ca(OH)2溶液,无明显现象,结论为猜想A对应。
化学就象你头顶上的果实,
只要肯稍作努力,成功的
甜蜜就属于你!
祝你成功!
See You
课题3 常见的盐
人教版九年级化学下同步教学课件
第十单元 常见的酸、碱、盐
第4课时 盐的化学性质 复分解反应的应用
+
+
学习目标:
2.复习巩固复分解反应的相关知识。
1. 复习并归纳盐的化学性质。
3. 学会运用复分解反应处理部分离子共存与物质除杂等题目。
Na2CO3 + 2HCl 2NaCl + H2O + CO2↑
NaHCO3 + HCl NaCl + H2O + CO2↑
Na2CO3 + Ca(OH)2 2NaOH + CaCO3↓
H2CO3
由两种化合物互相交换成分,生成另外两种化合物的反应叫做复分解反应。
知识回顾:
复分解反应
特点:“互交换,价不变”。
表达式:AB+CD→AD+CB。(正价在前,负价在后)
实质:离子结合生成↓或↑或H2O的过程
+
+
四大基本反应类型的特点
化合反应
分解反应
置换反应
复分解反应
单换单
多变一
一变多
互交换
价不变
反应类型 反应物种类 生成物种类 反应表达式
化合反应 两种或两种以上 一种 A+B+ →X
分解反应 一种 两种或两种以上 X→A+B+
置换反应 一种单质、一种化合物 一种单质、一种化合物 A+BC→B+AC
复分解反应 两种化合物 两种化合物 AB+CD→AD+CB
归纳:
四大基本反应类型的比较
【实验】碳酸钠、碳酸氢钠分别与盐酸反应,是否都能产生CO2 ?
1. 与酸反应
一. 盐的化学性质
碳酸钠+盐酸 碳酸氢钠+盐酸
现象
分析
产生大量气泡,澄清石灰水变浑浊
有二氧化碳生成
产生大量气泡,澄清石灰水变浑浊
有二氧化碳生成
碳酸钠和稀盐酸反应的动画过程
实质:
旁观者:
Cl-和Na+
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
CO2
CO2
结论:
有CO2生成的复分解反应实质是 和H+反应
怎样检验这 些物质中含有碳酸根或者碳酸氢根?
即时理解
某物质
+稀盐酸
产生气体
变浑浊
CO2
CaCO3
(含碳酸根或碳酸氢根离子)
归纳:
碳酸根或碳酸氢根离子检验方法:
+澄清石灰水
【实验】硫酸铜溶液与氢氧化钠溶液的反应
实验现象
有少量蓝色絮状沉淀生成
试写出反应的化学方程式
CuSO4 + 2NaOH ===== Cu(OH)2↓ + Na2SO4
2.与碱溶液反应
【实验】向盛有少量碳酸钠溶液的试管中滴入澄清石灰水,观察现象。
现象: 。
分析: 。
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
试管里出现白色沉淀
碳酸钠与氢氧化钙反应,生成一种难溶物碳酸钙
这个原理常用作两种碱之间的相互转化。
3. 盐和盐的反应
氯化钡溶液与硫酸铜溶液反应实验
实验现象
有白色沉淀生成
试写出反应的化学方程式
CuSO4 + BaCl2 ===== BaSO4↓ + CuCl2
氯化钡与硫酸钠反应动画过程
实质:
旁观者:
Cl-和Na+
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
结论:
有BaSO4沉淀生成的复分解反应实质是Ba2+和 反应
盐的化学性质小结
盐
+
金属
新盐
酸
新盐
碱
新盐
盐
新盐
新金属
+
新酸
+
新碱
+
+
新盐
(强酸制弱酸)
(强碱制弱碱)
(1)盐溶液的颜色
①、铜盐(Cu 2+) 溶液: 蓝色
②、铁盐(Fe 3+ )溶液:黄色
③、亚铁盐(Fe 2+ )溶液:浅绿色
④、高锰酸钾溶液:紫红色
⑤、其它盐溶液一般:无色
二. 复分解反应的应用
1. 离子共存
白色沉淀:
CaCO3、BaCO3 、Ag2CO3
BaSO4、AgCl…(既不溶入水也不溶入酸)
Mg(OH)2、Al(OH)3、Zn(OH)2
蓝色沉淀:Cu(OH)2
红褐色沉淀:Fe(OH)3
(2)常见的沉淀颜色
H+
OH-
CO32-
NH4+
Ba2+
Ca2+
Mg2+
Cu2+
Al3+
Fe3+
Ag+
Cl-
Zn2+
(3)在同一溶液中不能大量共存,即结合产生沉淀、气体或水的离子
Fe2+
2. 物质除杂
(1)三原则:
①不引入新杂质;
②不减少被提纯物质的质量;
③杂质便于分离。
(2)三要领:
①根据物理性质或化学性质的差异;
②确定除杂质方法;
③选择适宜试剂。
(3)六种常用方法:
①化气法: 与杂质反应生成气体而除去.
例如:除NaCl中Na2CO3,可加适量稀HCl:
Na2CO3+ 2HCl=2NaCl+ CO2↑+ H2O
②沉淀法:将杂质转化为沉淀过滤除去。
例如:除去NaOH中的Na2CO3,可加适量的Ca(OH)2:Na2CO3+ Ca(OH)2==CaCO3↓+2NaOH
③置换法:将杂质通过置换反应而除去
例如:除FeSO4中的CuSO4,可加过量的铁粉,再过滤:CuSO4+Fe==Cu+FeSO4
④溶解法:将杂质溶于某种试剂而除去。
例如:除C粉中的CuO粉,可加适量稀硫酸,再过滤:
CuO+ H2SO4==CuSO4+ H2O
⑤加热法:杂质受热易分解,通过加热将杂质除去。
例如:除CaO中的CaCO3可加热:
CaCO3 CaO+ CO2↑
⑥转化法:将杂质通过化学反应转化为主要成分
例如:除CO2中的CO,可将气体通过灼热的CuO:CO+CuO Cu+CO2
经典例题
例1.将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是( )
A. HNO3和FeCl3 B. NaOH和HCl
C. BaCl2和Na2SO4 D. KOH和CuSO4
【解析】A选项硝酸与氯化铁溶液混合,能得到黄色溶液;
B选项氢氧化钠和盐酸反应生成氯化钠溶液无色;C选项氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,不符合题意;D选项氢氧化钾和硫酸铜溶液反应生成蓝色沉淀;故答案选择B。
B
C
例2.下列溶液混合后,不能发生复分解反应的一组是
( )
A. HCl和NaOH B. Na2CO3和H2SO4
C. KNO3和NaCl D. NaOH和FeCl3
【解析】A、盐酸和氢氧化钠混合能反应生成水,复分解反应能够进行,故A不选;B、碳酸钠和硫酸混合能生成二氧化碳气体,复分解反应能够进行,故B不选;C、硝酸钾和氯化钠混合没有沉淀、气体或水生成,复分解反应不能进行,故C符合题意;D、氢氧化钠和氯化铁混合能生成氢氧化铁沉淀,复分解反应能够进行,故C不选;故选C。
D
例3.下列除杂所选用试剂与操作方法均正确的是( )
【解析】除去杂质的原则是所加试剂只与杂质反应,且不生成新的杂质。A、水能与氧化钙反应,错误;B、氧化铜能与氢气反应,错误;C、有BaCl2溶液剩余,引入了杂质,错误;D、Na2CO3+2HCl==2NaCl+H2O+CO2↑,剩余的稀盐酸通过蒸发可除去,正确。故选D。
选项 物质(括号内为杂质) 除杂试剂 实验操作
A CaO(CaCO3) 水 溶解、过滤
B H2(CO) 灼热CuO 洗气
C NaCl(Na2SO4) 过量BaCl2溶液 过滤
D NaCl(Na2CO3) 足量稀盐酸 蒸发结晶
例4.下列各组离子在指定溶液中能大量共存的一组是( )
A. 在硝酸铵溶液中:Na+、Cu2+、OH﹣
B. 在稀盐酸中:Ba2+、CO32﹣、Zn2+
C. 在氯化钠溶液中:K+、Ca2+、NO3﹣
D. 在氢氧化钠溶液中:H+、Mg2+、Cl﹣
【解析】A、硝酸铵溶液中含有铵根离子和硝酸根离子,Cu2+、OH﹣两种离子能结合成氢氧化铜沉淀,OH﹣、铵根离子两种离子能结合成水和氨气,不能大量共存,故选项错误。B、稀盐酸中含有氢离子和氯离子,H+、CO32﹣两种离子能结合成水和二氧化碳,Ba2+、Zn2+与CO32﹣也不能共存,不能大量共存,故选项错误。C、氯化钠溶液中含有钠离子和氯离子,钠离子、氯离子、K+、Ca2+、NO3﹣五种离子间不能结合成沉淀、气体或水,能大量共存,故选项正确。D、氢氧化钠溶液中含有钠离子和氢氧根离子,H+、OH﹣两种离子能结合成水,Mg2+、OH﹣两种离子能结合成氢氧化镁沉淀,不能大量共存,故选项错误。
故选C。
C
例5.下列物质的溶液,不另加试剂就不能鉴别出来的一组是
( )
A. CuSO4、BaCl2、H2SO4 B. Na2CO3、Ca(NO3)2、HCl
C. Na2SO4、KNO3、HCl D. FeCl3、NaOH、 KMnO4
【解析】A、首先根据溶液颜色,判断出CuSO4(蓝色溶液),然后再利用CuSO4与其它的两种溶液反应,能形成白色沉淀的为BaCl2,可以鉴别出来,正确,B、Na2CO3能与Ca(NO3)2反应生成白色沉淀,且能与HCl反应有气泡产生,故可以鉴别出来,正确,C、Na2SO4、KNO3、HCl三种物质相互之间都不会反应,故无法鉴别出来,错误,D、直接根据溶液颜色,判断出FeCl3(黄色溶液),KMnO4(紫红色溶液),而NaOH溶液为无色,故可以鉴别出来,故选C
C
例6.有一包白色粉末可能是CuSO4、CaCl2、Na2CO3、NaCl四种物质中的一种或几种组成,为确定该白色粉末的成分,进行了如下探究:
(1)取少量该白色粉末溶于水,得到无色溶液,说明一定不存在________,理由是________________。
(2)向该溶液中加入过量的稀HCl,产生大量的气泡,说明一定有________,一定没有________,理由是__________________。
(3)将(2)所得溶液蒸发后只得到NaCl一种物质,则原白色粉末________(填“一定”“一定不”或“不一定”)含有NaCl。理由是___________。
【答案】 (1). CuSO4 CuSO4溶液呈蓝色 (2). Na2CO3 CaCl2 CaCl2和Na2CO3会发生化学反应生成难溶于水的CaCO3 (3). 不一定 步骤(2)中稀HCl与Na2CO3反应也会生成NaCl
【解析】(1)将该白色粉末溶于水,得到无色溶液,而无水硫酸铜溶于水变成蓝色,说明一定不存在CuSO4;(2)取上述所得无色透明溶液于另一试管中,向其中加入足量的稀盐酸,碳酸钠和盐酸反应会生成二氧化碳气体,所以观察到有气泡产生的现象,得出结论,白色粉末中一定含有Na2CO3,推出一定不含CaCl2,碳酸钠和氯化钙反应会生成碳酸钙沉淀和氯化钠,化学方程式是:Na2CO3+CaCl2=CaCO3↓+2NaCl;(3)将(2)所得溶液蒸发只得到NaCl一种物质,则原白色粉末不一定含有NaCl,理由是步骤(2)中稀HCl与Na2CO3也会反应生成NaCl。
2.复习巩固了复分解反应的相关知识。
1. 复习并归纳了盐的化学性质。
3. 学会运用复分解反应处理部分离子共存与物质除杂等题目。
课堂小结
随堂练习
1.下列各组离子在水中能大量共存的是( )
A. H+、Na+、Cl﹣、HCO3﹣
B. H+、K+、Cl﹣、OH﹣
C. Cu2+、Ba2+、Cl﹣、SO42﹣
D. K+、NH4+、Cl﹣、NO3﹣
D
【解析】A、H+、HCO3﹣会生成二氧化碳气体和水,不能共存,故A错误;B、H+、OH﹣两种离子能结合成水,不能大量共存,故B错误;C、Ba2+、SO42﹣两种离子能结合成硫酸钡沉淀,不能大量共存,故C错误;D、四种离子间不能结合成沉淀、气体或水,能大量共存,故D正确。故选D。
2.小金制作了一个如图甲所示的简易酸碱灭火器,并进行了如图乙所示的灭火操作,结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色;②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀生成。则残留液
中有大量的( )
A. 硫酸钠 B. 碳酸钠
C. 盐酸 D. 氯化钠
【解析】简易酸碱灭火器中碳酸钠溶液与一种常见的酸反应;结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色,石蕊溶液遇酸性溶液变红色,遇碱性溶液变蓝色,则说明残留液显酸性。②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀存在,说明此沉淀是氯化银或硫酸钡沉淀,由于反应物是一种酸,酸与碳酸钠溶液反应生成盐、水和二氧化碳,同时酸有剩余,则原酸溶液为硫酸,硫酸与碳酸钠溶液反应生成硫酸钠、水和二氧化碳,则残留液中有大量的硫酸钠、硫酸;故选A。
A
3.下列各组离子在酸性溶液中能大量共存的是( )
A. Ag+、Na+、Cl-、NO3- B. Na+、K+、OH-、SO42-
C. K+、Na+、CO32-、Cl- D. Ba2+、Mg2+、NO3-
【解析】A、Ag+离子和Cl-离子-反应会生成氯化银沉淀,不能大量共存,错误;B、在酸性溶液中存在着H+离子。H+离子与OH--离子反应生成水,不能大量共存,错误;C、在酸性溶液中存在着H+离子。H+离子与CO32-离子反应生成二氧化碳气体和水,不能大量共存,错误;D、四种离子在酸性条件下不发生任何反应,能大量共存,正确。故选D。
点睛:离子重新结合生成水或气体或沉淀时,就不能共存;本题还要注意题文明确指出了是酸性溶液中,即说明该溶液中含有氢离子。
D
【解析】A、氯化铜在碱性溶液中不能共存,错误;B、盐酸不能在碱性溶液中共存,错误;C、硫酸钾和氯化钡不能共存,错误;D、NaCl 、KOH 、KNO3可以在碱性溶液中共存,且都没有颜色,正确。故选D。
D
4.25℃时,下列物质在PH=12的溶液中能大量共存并形成无色溶液的是( )
A. CuCl2 NaCl Ba(NO3)2 B. CaCl2 KNO3 HCl
C. K2SO4 BaCl2 NaNO3 D. NaCl KOH KNO3
C
5.一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl-、OH-和SO42-离子的一种或几种。为确定溶液中可能存在的离子,进行下面实验。①经测定,溶液的PH=1;②取部分样品滴加NaOH溶液,有沉淀生成。继续滴加NaOH溶液至不再产生沉淀为止,过滤;③向实验②得到的滤液中继续滴加Na2CO3溶液,又观察到沉淀生成.分析实验得到的以下结论中,正确的是( )。
A. 溶液中一定含有H+、Ba2+、Cl-,一定不含有Na+、Fe3+、OH-、SO42-
B. 溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有Na+、OH-和SO42-
C. 溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有OH-、SO42-,可能含有Na+
D. 溶液中一定含有H+、Ba2+、Na+、Fe3+,一定不含有OH-、SO42-,可能含有Cl-
【解析】①经测定,溶液的pH=1,该溶液显酸性,一定含有H+、一定不含有OH﹣; ②取部分样品溶液滴加NaOH溶液,有沉淀生成.一定含Fe3+; ③向实验②得到的滤液中滴加Na2CO3溶液,又观察到沉淀生成,证明滤液中含有Ba2+,则一定不含有SO42-,溶液中阴阳离子平衡,所以一定含有Cl﹣。
综上所述,溶液中一定含有H+、Ba2+、Fe3+、Cl﹣,一定不含有OH﹣、SO42-,可能含有Na+。故选C.
6.应的实验,反应后都进行过滤得到无色滤液,他们对自己得到的无色滤液中溶质的成分进行探究。请你一同参与他们的探究活动。
【提出猜想】他们各自所得滤液中溶质的成分有如下几种可能:
A.NaOH B.Na2CO3、Ba(OH)2、NaOH
C.________________ D.Na2CO3和NaOH
【讨论交流】上述猜想中,肯定不成立的是B(填猜想序号),其理由是____________。
【实验探究】甲、乙两同学为了验证各自所得滤液的成分,分别进行了如下实验:
实验操作 实验现象 实验结论
甲同学 取少量滤液于试管中,加入足量的_____溶液 ________ 滤液中溶质的成分与猜想C对应
乙同学 取少量滤液于试管中,加入足量的Na2CO3溶液 无明显实验 现象 滤液中溶质的成分与猜想A 对应
【反思与评价】经过讨论,大家一致认为甲同学的实验结论是正确的,乙同学的实验结论不一定正确。请你帮乙同学设计实验,进一步确定乙同学得到的滤液中溶质的成分。
实验操作及实验现象 实验结论
__________ 滤液中溶质的成分与猜想_____对应
【答案】: 【提出猜想】 Ba(OH)2、NaOH 【讨论交流】Na2CO3和Ba(OH)2能发生反应 【实验探究】Na2CO3##碳酸钠 产生白色沉淀 【反思与评价】 加入Ba(OH)2溶液或Ca(OH)2溶液,无明显现象 A
【解析】根据碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,各自所得滤液中溶质的成分有如下几种可能:A.NaOH B.Na2CO3、Ba(OH)2、NaOH C.Ba(OH)2、NaOH; D.Na2CO3和NaOH;讨论交流:上述猜想中,肯定不成立的是B,其理由是Na2CO3和Ba(OH)2能发生反应; 实验探究:根据实验结论滤液中溶质的成分与猜想C对应,根据碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,出现白色沉淀,故取少量滤液于试管中,加入足量的碳酸钠溶液,产生白色沉淀,证明猜想C正确; 反思与评价:经过讨论,大家一致认为甲同学的实验结论是正确的,乙同学的实验结论不一定正确。 进一步确定乙同学得到的滤液中溶质的成分。具体操作为加入Ba(OH)2溶液或Ca(OH)2溶液,无明显现象,结论为猜想A对应。
化学就象你头顶上的果实,
只要肯稍作努力,成功的
甜蜜就属于你!
祝你成功!
See You
同课章节目录
