化学人教版选修四《化学反应原理》第三章 电离平衡第二节 水的电离和溶液的PH 教学课件(共两课时)(33张)
文档属性
| 名称 | 化学人教版选修四《化学反应原理》第三章 电离平衡第二节 水的电离和溶液的PH 教学课件(共两课时)(33张) |  | |
| 格式 | zip | ||
| 文件大小 | 469.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-04-27 21:48:49 | ||
图片预览







文档简介
课件33张PPT。第三章 电离平衡
第二节 水的电离和溶液的PH (第1课时)思考:
如何用实验证明水是一种极弱的电解质?1.实验2.现象3.结论水是一种极弱的电解质4.原因实验测定(25℃时):C(H+)=C(OH-)=10-7mol/LKw =C(H+)·C(OH-)说明:1.常温(25℃ )Kw = 1× 10-14 2.稀溶液
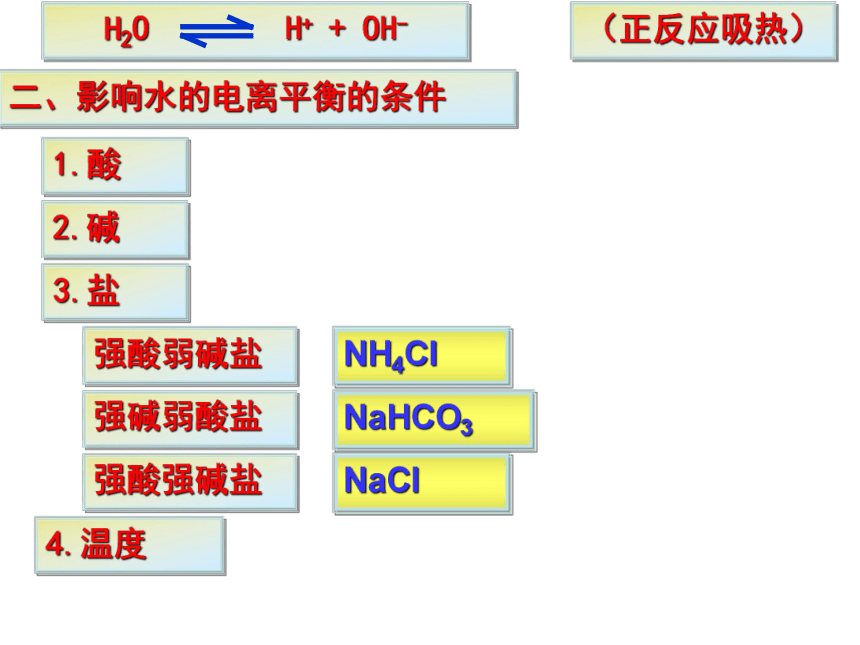
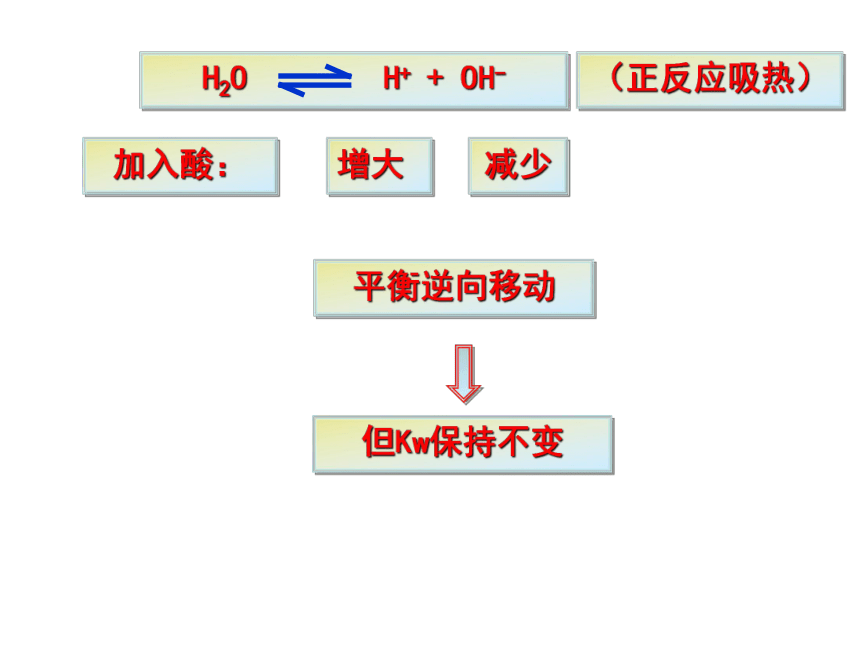
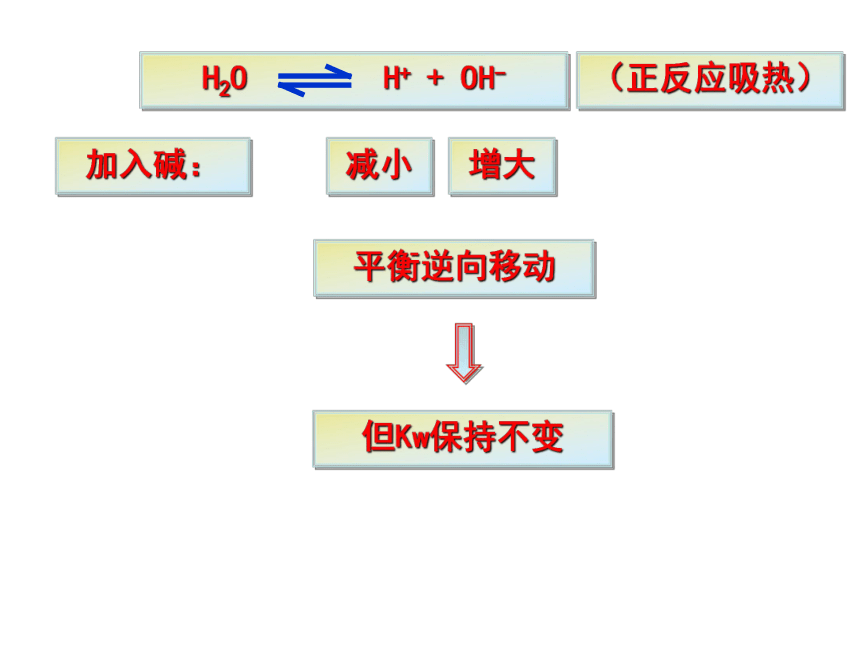
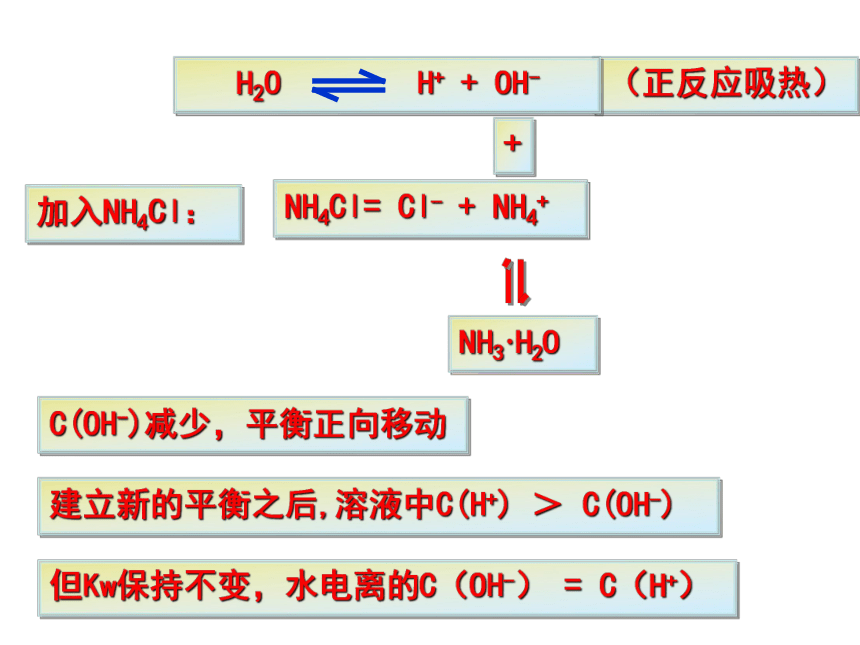
3.温度升高, Kw变大5.水的离子积(常数):定义:在一定温度下,溶液中氢离子与氢氧根离子浓度的乘积。强酸弱碱盐强碱弱酸盐强酸强碱盐二、影响水的电离平衡的条件1.酸2.碱3.盐4.温度(正反应吸热)NH4ClNaHCO3NaCl加入酸:增大减少平衡逆向移动但Kw保持不变(正反应吸热)加入碱:减小增大平衡逆向移动但Kw保持不变(正反应吸热)加入NH4Cl:NH4Cl= Cl- + NH4+ +NH3·H2OC(OH-)减少,平衡正向移动但Kw保持不变,水电离的C(OH-) = C(H+) 建立新的平衡之后,溶液中C(H+) > C(OH-)(正反应吸热)加入NaHCO3:NaHCO3 = HCO3- + Na+ +H2CO3C(H+)减少,平衡正向移动但Kw保持不变,水电离的C(OH-) =C(H+) 建立新的平衡之后,溶液中C(OH-) >C(H+)加入NaCl:NaCl = Cl- + Na+ Na+和Cl-不与水电离生成的H+ 和 OH-反应 所以,强酸强碱盐不影响水的电离平衡。
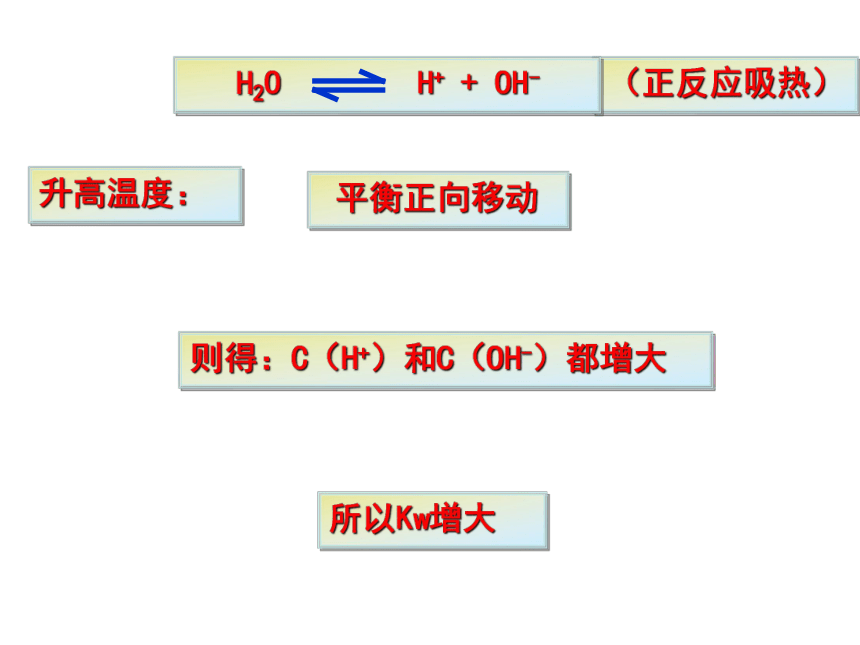
C(OH-) 和C(H+)不变,KW也不变。(正反应吸热)升高温度: 平衡正向移动则得:C(H+)和C(OH-)都增大所以Kw增大(正反应吸热)强酸弱碱盐强碱弱酸盐强酸强碱盐二、影响水的电离平衡的因素1、酸2、碱3、盐4、温度(正反应吸热)抑制水的电离,Kw保持不变促进水的电离,Kw保持不变不影响水的电离,Kw保持不变升高温度促进水的电离,Kw增大 注意:Kw是一个温度函数,只随温度的升高而增大三、溶液的酸、碱性跟C(H+)、C(OH-)的关系1.重要规律:电解质在一定温度时和稀溶液里C(H+)与C(OH-)的乘积仍是一个常数。经科学实验进一步证明C(稀) ≤1mol/L例:25℃时,Kw=1×10-14三、溶液的酸、碱性跟C(H+)、C(OH-)的关系2.关系(25℃):中性溶液:C(H+)=C(OH-)=1×10-7mol/L酸性溶液:C(H+)>C(OH-) C(H+)>1×10-7mol/L碱性溶液:C(H+)C(OH-) ;C(H+)越大酸性越强③碱性溶液:C(H+)第二节 水的电离和溶液的PH
(第2课时)三、溶液的酸碱性与PH的关系引言:溶液的酸碱性强弱,可以用溶液中氢离子浓度的大小来表示。例:C(H+)=1或2或3mol/L的酸性溶液。例:C(H+)=1×10-7或1.34×10-3mol/L的溶液。对溶液中氢离子极小的溶液,化学上常用PH值来表示溶液的酸碱性强弱。三、溶液的酸碱性与PH的关系1.溶液的PH值定义:溶液的酸碱性强弱用C(H+)的负对数来表示的值。数学表达式:PH=-lgC(H+)例:C(H+)=10-7mol/LPH=-lgC(H+)=-lg10-7=7例:C(H+)=10-5mol/LPH=-lgC(H+)=-lg10-=5例:C(H+)=10-9mol/LPH=-lgC(H+)=-lg10-9=9例:C(H+)=1mol/LPH=-lgC(H+)=-lg1=02.PH=-lgC(H+)的图象C(H+)PH1105+2+1-2-1+3-30y=lgx·····3.PH值的常用范围(25℃)10-14mol/L≤C(H+) ≤1mol/L10-14mol/L≤C(OH-) ≤1mol/L原因:为了简便,否则不简便4.溶液的酸、碱性和PH的关系(25℃)中性:C(H+)=C(OH-)=1×10-7mol/L酸性:C(H+)>C(OH-) C(H+)>1×10-7mol/L碱性:C(H+)74.溶液的酸、碱性和PH的关系(25℃)PH?→C(H+) ? →酸性?PH?→C(H+)?→酸性?思考:在100℃时,溶液PH=7,该溶液呈什么性?100 ℃ 时,→C(H+)·C(OH-)=10-12→中性时PH=6<7,故该溶液呈碱性。四、有关溶液PH的计算1.求强酸溶液的PH例1:求1×10-3mol/LHCl溶液的PH例2:求1×10-3mol/LH2SO4溶液的PH四、有关溶液PH的计算2.求强碱溶液的PH例1:求0.1mol/LNaOH溶液的PH例2:求0.1mol/LBa(OH)2溶液的PH四、有关溶液PH的计算3.求混合溶液的PH(1)求强酸与强酸混合溶液的PH例1:10mL0.1mol/LHCl与20mL0.2mol/LHCl混合,求该混合溶液的PH值。例2:将PH=1和PH=3的盐酸溶液等体积混合,求该混合溶液的PH值。四、有关溶液PH的计算3.求混合溶液的PH(2)求强碱与强碱混合溶液的PH例1:10mL0.1mol/LNaOH与20mL0.2mol/L Ba(OH)2混合,求该混合溶液的PH值。例2:将PH=11和PH=13的NaOH溶液等体积混合,求该混合溶液的PH值。四、有关溶液PH的计算3.求混合溶液的PH(3)求强酸与强碱混合溶液的PH例1:10mL0.1mol/LHCl与10mL0.2mol/LNaOH混合,求该混合溶液的PH值。例2:将PH=6的HCl和PH=10的NaOH溶液等体积混合,求该混合溶液的PH值。四、有关溶液PH的计算例:某盐酸溶液,欲PH值增1或减1,问C(H+)怎样变化?结论:强酸溶液,PH值每增加1个单位,C(H+)变为原浓度的1/10倍; PH值每减少1个单位,C(H+)变为原浓度的10倍5.强酸、强碱的稀释及过度稀释的PH计算例1.在10mL10-4mol/LHCl溶液中加水至100mL时,溶液的PH值是___________;若加水至105mL时,溶液的PH值____________________。例2.在10mLPH=10的NaOH溶液中加水至1000mL时,溶液的PH值是___________;若加水至106mL时,溶液的PH值____________________。5PH→7 但略小于78PH→7 但略大于7比较下列各组酸稀释后的PH大小:
1.PH均为1的盐酸和硫酸用蒸馏水稀释相同倍数,则前PH___后PH
2.浓度均为1mol/L的盐酸和硫酸用蒸馏水稀释相同倍数,则前PH____后PH
3.PH均为1的盐酸和醋酸用蒸馏水稀释相同倍数,则前PH___后PH
4.浓度均为1mol/L的盐酸和醋酸用蒸馏水稀释相同倍数,则前PH____后PH
第二节 水的电离和溶液的PH (第1课时)思考:
如何用实验证明水是一种极弱的电解质?1.实验2.现象3.结论水是一种极弱的电解质4.原因实验测定(25℃时):C(H+)=C(OH-)=10-7mol/LKw =C(H+)·C(OH-)说明:1.常温(25℃ )Kw = 1× 10-14 2.稀溶液
3.温度升高, Kw变大5.水的离子积(常数):定义:在一定温度下,溶液中氢离子与氢氧根离子浓度的乘积。强酸弱碱盐强碱弱酸盐强酸强碱盐二、影响水的电离平衡的条件1.酸2.碱3.盐4.温度(正反应吸热)NH4ClNaHCO3NaCl加入酸:增大减少平衡逆向移动但Kw保持不变(正反应吸热)加入碱:减小增大平衡逆向移动但Kw保持不变(正反应吸热)加入NH4Cl:NH4Cl= Cl- + NH4+ +NH3·H2OC(OH-)减少,平衡正向移动但Kw保持不变,水电离的C(OH-) = C(H+) 建立新的平衡之后,溶液中C(H+) > C(OH-)(正反应吸热)加入NaHCO3:NaHCO3 = HCO3- + Na+ +H2CO3C(H+)减少,平衡正向移动但Kw保持不变,水电离的C(OH-) =C(H+) 建立新的平衡之后,溶液中C(OH-) >C(H+)加入NaCl:NaCl = Cl- + Na+ Na+和Cl-不与水电离生成的H+ 和 OH-反应 所以,强酸强碱盐不影响水的电离平衡。
C(OH-) 和C(H+)不变,KW也不变。(正反应吸热)升高温度: 平衡正向移动则得:C(H+)和C(OH-)都增大所以Kw增大(正反应吸热)强酸弱碱盐强碱弱酸盐强酸强碱盐二、影响水的电离平衡的因素1、酸2、碱3、盐4、温度(正反应吸热)抑制水的电离,Kw保持不变促进水的电离,Kw保持不变不影响水的电离,Kw保持不变升高温度促进水的电离,Kw增大 注意:Kw是一个温度函数,只随温度的升高而增大三、溶液的酸、碱性跟C(H+)、C(OH-)的关系1.重要规律:电解质在一定温度时和稀溶液里C(H+)与C(OH-)的乘积仍是一个常数。经科学实验进一步证明C(稀) ≤1mol/L例:25℃时,Kw=1×10-14三、溶液的酸、碱性跟C(H+)、C(OH-)的关系2.关系(25℃):中性溶液:C(H+)=C(OH-)=1×10-7mol/L酸性溶液:C(H+)>C(OH-) C(H+)>1×10-7mol/L碱性溶液:C(H+)
1.PH均为1的盐酸和硫酸用蒸馏水稀释相同倍数,则前PH___后PH
2.浓度均为1mol/L的盐酸和硫酸用蒸馏水稀释相同倍数,则前PH____后PH
3.PH均为1的盐酸和醋酸用蒸馏水稀释相同倍数,则前PH___后PH
4.浓度均为1mol/L的盐酸和醋酸用蒸馏水稀释相同倍数,则前PH____后PH
