化学人教版选修3课件:2-2分子的立体构型(共23张PPT)
文档属性
| 名称 | 化学人教版选修3课件:2-2分子的立体构型(共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 607.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-04-27 21:49:36 | ||
图片预览






文档简介
课件23张PPT。分子的立体构型一、形形色色的分子共价键具有方向性,分子中原子之间存在一定的键角,这就导致了分子具有一定的几何特性,也就是“分子的立体构型”。三原子分子:
四原子分子:
五原子分子:直线形和V形
平面三角形和三角锥形
正四面体形化学式 结构式 分子的立体模型CO2
H2O
CH2O
NH3
CH4O=C=OO
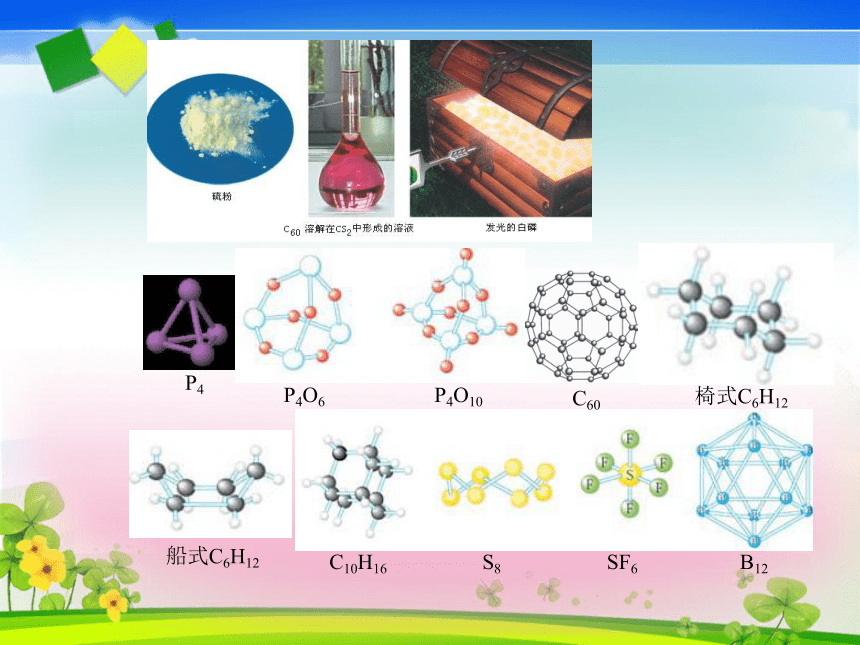
H H船式C6H12椅式C6H12C60P4O6 P4O10P4C10H16 S8 SF6 B12二、价层电子对互斥理论价层电子对互斥理论(VSEPR)认为,分子的立体构型是“价层电子对”相互排斥的结果。价层电子对是指中心原子上的电子对,包括σ键电子对和中心原子上的孤电子对。σ键电子对:
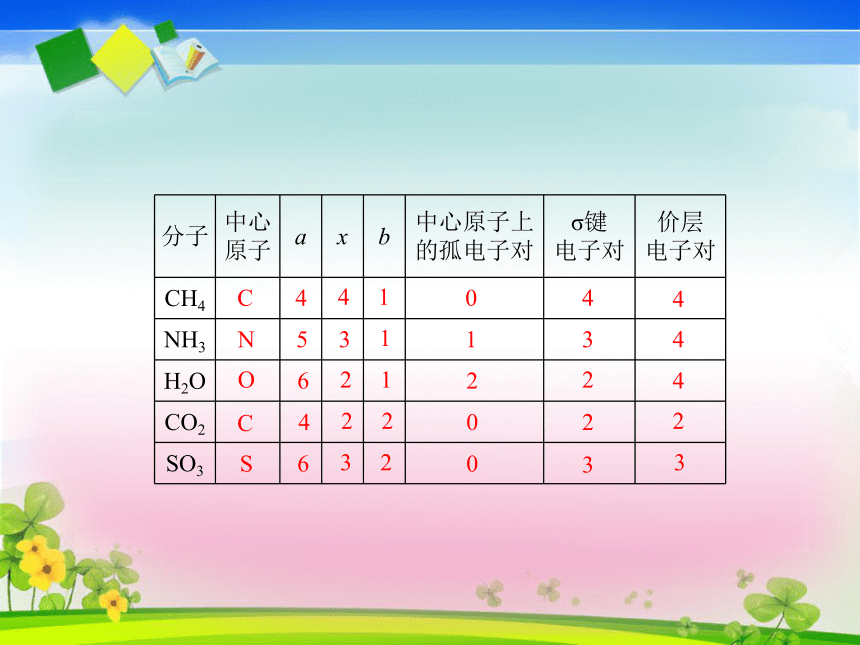
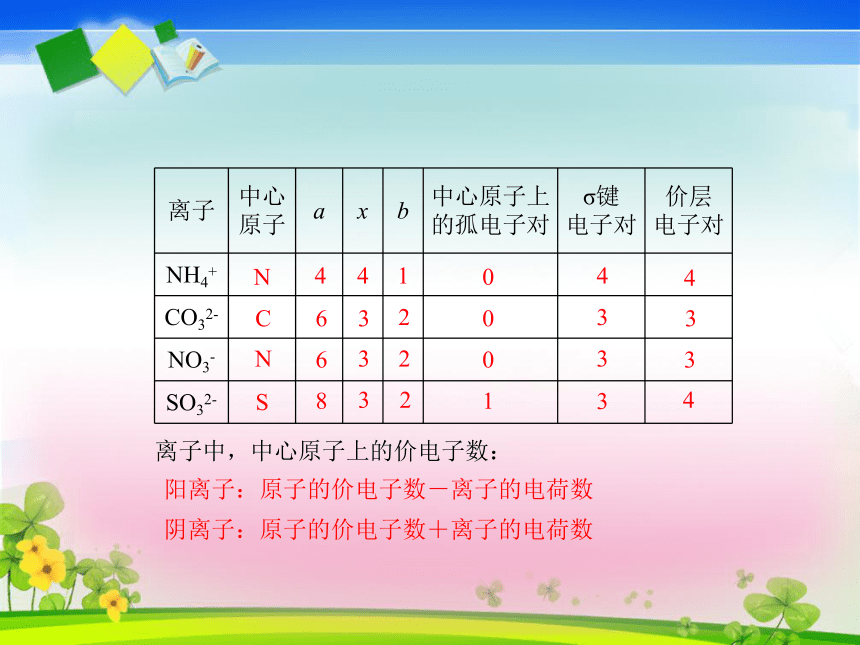
孤电子对:原子之间共用的一对电子原子中未与其它原子共用的一对电子O为中心原子,周围的四对电子为价层电子对;其中H与O共用的电子对为σ键电子对,未与其它原子共用的电子对为孤电子对。价层电子对排斥力大小:孤对电子对-孤对电子对>孤对电子对-σ键电子对>σ键电子对-σ键电子对a为中心原子的价电子数;x为中心原子结合的原子数;b为中心原子结合的原子最多能接受的电子数,即(8-该原子的价电子数)(H为2-1=1)σ键电子对=中心原子所连原子数OCN4CS41053116212422063204332244423NNC4S41063206320832143334334离子中,中心原子上的价电子数:阳离子:原子的价电子数-离子的电荷数阴离子:原子的价电子数+离子的电荷数略去VSEPR模型中的中心原子上的孤电子对,便可得到分子或离子的立体构型。平面三角形,电子对之间的夹角为120°直线形,电子对之间的夹角为180°正四面体形,电子对之间的夹角为109°28′价层电子对模型(VSEPR模型)名称:价层电子对数=2:
价层电子对数=3:
价层电子对数=4:σ键电子对和孤电子对之间的排斥力大小不同,所以VSEPR模型相同的分子或离子的立体构型中,键角的大小也不一定相同。VSEPR模型相同,分子或离子的立体构型不一定相同。VSEPR模型与价层电子对有关,分子或离子的立体构型与σ键电子对有关。VSEPR模型与立体构型203002143212直线形正四面体形直线形平面三角形平面三角形平面三角形V形正四面体形正四面体形正四面体形三角锥形V形180°小于120°120°小于109°28′109°28′222334234344直线形平面三角形平面三角形V形正四面
体形正四面体形正四面体形三角
锥形V形SO2正四面体形平面
三角形直线形CO2H2OSO3NH3CH4三、杂化轨道理论简介在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化。杂化以后的轨道称为杂化轨道。由1个s轨道和3个p轨道杂化成的轨道称为sp3杂化轨道。共4个轨道。由1个s轨道和2个p轨道杂化成的轨道称为sp2杂化轨道。共3个轨道。由1个s轨道和1个p轨道杂化成的轨道称为sp杂化轨道。共2 个轨道。杂化轨道与形成它的原子轨道的总数相同。杂化轨道与形成它的原子轨道形状不同,但成键能力强。杂化轨道只用于形成σ键或者容纳孤电子对,不能形成π键。sp3杂化轨道。轨道之间的夹角为109°28′sp2杂化轨道。轨道之间的夹角为120°未杂化的p轨道。用于形成π键。sp杂化轨道。轨道之间的夹角为180°未杂化的p轨道。用于形成π键。VSEPR模型与中心原子的杂化轨道类型2
2
23
3
40
1
20
1
02
3
43
4
4直线形
平面三角形
正四面体形直线形
V形
V形平面三角形
正四面体形
正四面体形平面三角形
三角锥形
正四面体形sp杂化
sp2杂化
sp3杂化sp2杂化
sp3杂化
sp3杂化杂化类型与价层电子对数相关。2
2
23
3
40
1
20
1
02
3
43
4
4直线形
平面三角形
正四面体形直线形
V形
V形平面三角形
正四面体形
正四面体形平面三角形
三角锥形
正四面体形sp杂化
sp2杂化
sp3杂化sp2杂化
sp3杂化
sp3杂化222334234344直线形平面三角形平面三角形V形正四面体形正四面体形正四面体形三角锥形V形直线形正四面体形平面三角形sp杂化
sp2杂化
sp3杂化sp2杂化
sp3杂化
sp3杂化4
3
23
20
0
01
23
4sp3杂化
sp2杂化
sp杂化sp3杂化
sp3杂化4
3
2四、配合物理论简介实验2-1上述实验中呈天蓝色的物质的溶液中含有水合铜离子:天蓝色天蓝色无色无色无色天蓝色将下表中的少量固体溶于足量的水,观察实验现象。[Cu(H2O)4]2+[Cu(H2O)4]2+的形成:Cu2+的原子轨道(部分):H2O的电子式:↑ ↑↓3d 4s 4p↑↓↑↓↑↓Cu2+存在空轨道,水分子中存在孤对电子;水分子中的孤对电子进入Cu2+的空轨道中;这类“电子对给予-接受键”称为配位键。提供空轨道的离子或原子称为中心离子或原子;提供孤对电子的分子或离子称为配体,配体的数目称为配位数。以配位键结合形成的化合物称为配位化合物,简称配合物。配位键的表示方法:其中A提供孤对电子,B提供空轨道A→B实验2-2向盛有硫酸铜溶液的试管中逐滴加入氨水,直至过量,再加入极性较小的溶剂(乙醇),观察并记录现象。生成蓝色沉淀Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+Cu(OH)2+4NH3·H2O=Cu(NH3)42++2OH-+4H2O深蓝色是由于存在[Cu(NH3)4]2+析出的深蓝色晶体为[Cu(NH3)4]SO4·H2OCu(NH3)42+的结构如下:沉淀溶解,得到深蓝色的透明溶液实验2-3向盛有氯化铁溶液的试管中滴加1滴硫氰化钾(KSCN)溶液,观察并记录现象。生成血红色溶液Fe3++3SCN-=[Fe(SCN)n]3-n血红色溶液是由于存在[Fe(SCN)n]3-n用于鉴定溶液中的Fe3+ 。配位键广泛存在于分子或离子中,如NH4+、H3O+、Ag(NH3)2OH(银氨溶液)、Na3AlF6(六氟合铝酸钠、冰晶石)、K3[Fe(CN)6](铁氰化钾、赤血盐)、H2SO4等。配位键的强度有大胡小,因而有的配合物很稳定,有的很不稳定。许多过渡金属离子对多种配体具有很强的结合力,因而,过渡金属配合物远比主族金属配合物多。
四原子分子:
五原子分子:直线形和V形
平面三角形和三角锥形
正四面体形化学式 结构式 分子的立体模型CO2
H2O
CH2O
NH3
CH4O=C=OO
H H船式C6H12椅式C6H12C60P4O6 P4O10P4C10H16 S8 SF6 B12二、价层电子对互斥理论价层电子对互斥理论(VSEPR)认为,分子的立体构型是“价层电子对”相互排斥的结果。价层电子对是指中心原子上的电子对,包括σ键电子对和中心原子上的孤电子对。σ键电子对:
孤电子对:原子之间共用的一对电子原子中未与其它原子共用的一对电子O为中心原子,周围的四对电子为价层电子对;其中H与O共用的电子对为σ键电子对,未与其它原子共用的电子对为孤电子对。价层电子对排斥力大小:孤对电子对-孤对电子对>孤对电子对-σ键电子对>σ键电子对-σ键电子对a为中心原子的价电子数;x为中心原子结合的原子数;b为中心原子结合的原子最多能接受的电子数,即(8-该原子的价电子数)(H为2-1=1)σ键电子对=中心原子所连原子数OCN4CS41053116212422063204332244423NNC4S41063206320832143334334离子中,中心原子上的价电子数:阳离子:原子的价电子数-离子的电荷数阴离子:原子的价电子数+离子的电荷数略去VSEPR模型中的中心原子上的孤电子对,便可得到分子或离子的立体构型。平面三角形,电子对之间的夹角为120°直线形,电子对之间的夹角为180°正四面体形,电子对之间的夹角为109°28′价层电子对模型(VSEPR模型)名称:价层电子对数=2:
价层电子对数=3:
价层电子对数=4:σ键电子对和孤电子对之间的排斥力大小不同,所以VSEPR模型相同的分子或离子的立体构型中,键角的大小也不一定相同。VSEPR模型相同,分子或离子的立体构型不一定相同。VSEPR模型与价层电子对有关,分子或离子的立体构型与σ键电子对有关。VSEPR模型与立体构型203002143212直线形正四面体形直线形平面三角形平面三角形平面三角形V形正四面体形正四面体形正四面体形三角锥形V形180°小于120°120°小于109°28′109°28′222334234344直线形平面三角形平面三角形V形正四面
体形正四面体形正四面体形三角
锥形V形SO2正四面体形平面
三角形直线形CO2H2OSO3NH3CH4三、杂化轨道理论简介在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化。杂化以后的轨道称为杂化轨道。由1个s轨道和3个p轨道杂化成的轨道称为sp3杂化轨道。共4个轨道。由1个s轨道和2个p轨道杂化成的轨道称为sp2杂化轨道。共3个轨道。由1个s轨道和1个p轨道杂化成的轨道称为sp杂化轨道。共2 个轨道。杂化轨道与形成它的原子轨道的总数相同。杂化轨道与形成它的原子轨道形状不同,但成键能力强。杂化轨道只用于形成σ键或者容纳孤电子对,不能形成π键。sp3杂化轨道。轨道之间的夹角为109°28′sp2杂化轨道。轨道之间的夹角为120°未杂化的p轨道。用于形成π键。sp杂化轨道。轨道之间的夹角为180°未杂化的p轨道。用于形成π键。VSEPR模型与中心原子的杂化轨道类型2
2
23
3
40
1
20
1
02
3
43
4
4直线形
平面三角形
正四面体形直线形
V形
V形平面三角形
正四面体形
正四面体形平面三角形
三角锥形
正四面体形sp杂化
sp2杂化
sp3杂化sp2杂化
sp3杂化
sp3杂化杂化类型与价层电子对数相关。2
2
23
3
40
1
20
1
02
3
43
4
4直线形
平面三角形
正四面体形直线形
V形
V形平面三角形
正四面体形
正四面体形平面三角形
三角锥形
正四面体形sp杂化
sp2杂化
sp3杂化sp2杂化
sp3杂化
sp3杂化222334234344直线形平面三角形平面三角形V形正四面体形正四面体形正四面体形三角锥形V形直线形正四面体形平面三角形sp杂化
sp2杂化
sp3杂化sp2杂化
sp3杂化
sp3杂化4
3
23
20
0
01
23
4sp3杂化
sp2杂化
sp杂化sp3杂化
sp3杂化4
3
2四、配合物理论简介实验2-1上述实验中呈天蓝色的物质的溶液中含有水合铜离子:天蓝色天蓝色无色无色无色天蓝色将下表中的少量固体溶于足量的水,观察实验现象。[Cu(H2O)4]2+[Cu(H2O)4]2+的形成:Cu2+的原子轨道(部分):H2O的电子式:↑ ↑↓3d 4s 4p↑↓↑↓↑↓Cu2+存在空轨道,水分子中存在孤对电子;水分子中的孤对电子进入Cu2+的空轨道中;这类“电子对给予-接受键”称为配位键。提供空轨道的离子或原子称为中心离子或原子;提供孤对电子的分子或离子称为配体,配体的数目称为配位数。以配位键结合形成的化合物称为配位化合物,简称配合物。配位键的表示方法:其中A提供孤对电子,B提供空轨道A→B实验2-2向盛有硫酸铜溶液的试管中逐滴加入氨水,直至过量,再加入极性较小的溶剂(乙醇),观察并记录现象。生成蓝色沉淀Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+Cu(OH)2+4NH3·H2O=Cu(NH3)42++2OH-+4H2O深蓝色是由于存在[Cu(NH3)4]2+析出的深蓝色晶体为[Cu(NH3)4]SO4·H2OCu(NH3)42+的结构如下:沉淀溶解,得到深蓝色的透明溶液实验2-3向盛有氯化铁溶液的试管中滴加1滴硫氰化钾(KSCN)溶液,观察并记录现象。生成血红色溶液Fe3++3SCN-=[Fe(SCN)n]3-n血红色溶液是由于存在[Fe(SCN)n]3-n用于鉴定溶液中的Fe3+ 。配位键广泛存在于分子或离子中,如NH4+、H3O+、Ag(NH3)2OH(银氨溶液)、Na3AlF6(六氟合铝酸钠、冰晶石)、K3[Fe(CN)6](铁氰化钾、赤血盐)、H2SO4等。配位键的强度有大胡小,因而有的配合物很稳定,有的很不稳定。许多过渡金属离子对多种配体具有很强的结合力,因而,过渡金属配合物远比主族金属配合物多。
