化学2.3化学平衡课件(71张幻灯片
文档属性
| 名称 | 化学2.3化学平衡课件(71张幻灯片 |

|
|
| 格式 | zip | ||
| 文件大小 | 500.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-04-27 00:00:00 | ||
图片预览











文档简介
课件71张PPT。化学反应原理第二章化学反应速率和化学平衡第三节 化学平衡思考:
20℃时,将一块质量为40 g 的NaCl晶体投入到100 g 水中,充分搅拌,至固体不再溶解为止,静置。经过相当长的时间后,发现NaCl晶体质量不再发生变化,但NaCl晶体的形状可能发生改变,为什么? 什么是饱和溶液? 在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。 饱和溶液中溶质的溶解过程完全停止了吗? 没有!以NaCl溶解于水为例,NaCl溶解的速率与溶解在水中的NaCl结晶析出晶体的速率相等。v溶解 > v结晶v溶解 < v结晶v溶解 = v结晶即:溶解速率 = 结晶速率
达到了溶解的平衡状态,一种动态平衡那么,可逆反应的情况又怎样呢?可逆反应正反应:从左向右进行的反应。
逆反应:从右向左进行的反应。 在同一条件下向正反应方向进行的同时又向逆反应方向进行的反应.
用 表示。 例: H2+I2 2HI可逆反应的特点:⑴同一条件下正逆反应同时进行
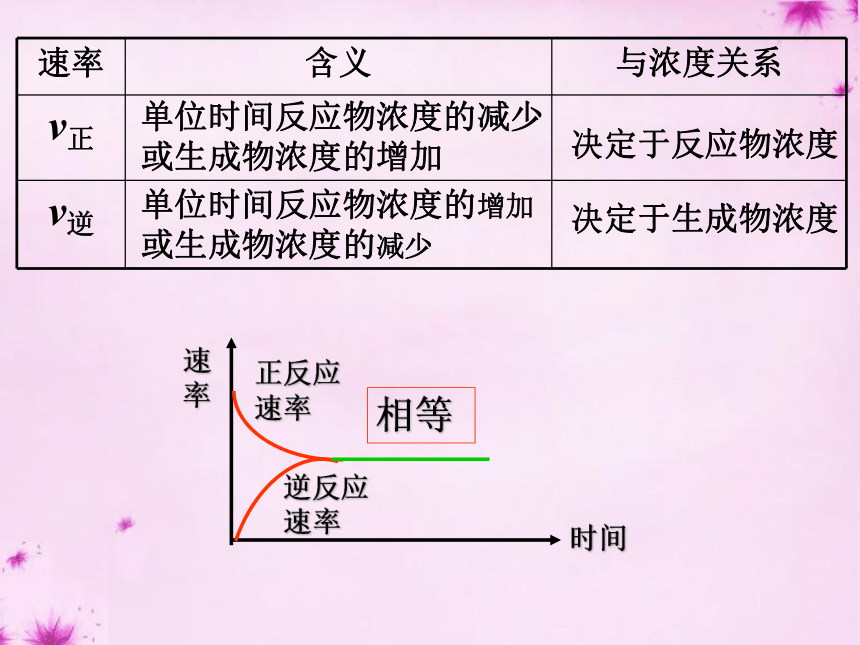
⑵可逆反应通常不能进行到底,反应物的转化率不能达到100%,反应体系中得到的总是反应物与生成物的混合物。单位时间反应物浓度的减少或生成物浓度的增加单位时间反应物浓度的增加或生成物浓度的减少
决定于生成物浓度决定于反应物浓度正反应速率逆反应速率相等时间速率1、定义化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。注意三点前提(适用范围):可逆反应内在本质:v(正)= v(逆) ≠0外在标志:反应混合物中各组分
的浓度保持不变如何判断可逆反应达到平衡状态?
或达到平衡的标志可逆反应2、化学平衡状态的特征(1)动:动态平衡,v(正)= v(逆) ≠0(2)等:(3)定:(5)逆:(4)变:v(正)= v(逆) 反应混合物中各组分的浓度保持不变条件改变,原平衡被破坏,在新的条件下建立新的平衡v正=v逆
1、同一物质
2、消耗=生成含量保持不变:
1、物质的量
2、物质的量浓度
3、体积分数1.不同物质
2.一正一逆
3.速率之比等于计量数之比 在500℃、钒触媒的作用下,某密闭容器中反应 2SO2 + O2 2SO3 △ H< 0 达到化学平衡状态时的标志是 ( )A SO2的消耗速率等于SO3的生成速率
B SO2的生成速率等于SO2的消耗速率
C SO2的消耗速率等于O2消耗速率的2倍
D SO3的生成速率等于O2生成速率的 2倍BD 在一定温度下,可逆反应A(g)+3B(g)
2C(g)达到平衡的标志是( )
A. C的生成速率与C的分解速率相等
B. 单位时间生成nmolA,同时生成3nmolB
C. 单位时间生成B的速率,与生成C的速率 相等
D. 单位时间生成nmolA,同时生成2nmolCAD 下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成AC百分含量质量分数:某一组分的质量总质量物质的量分数:某一组分的物质的量总物质的量体积分数:某气体组分的体积总体积=物质的量分数 下列说法中可以充分说明反应: P(g)+Q(g)
R(g)+S(g) , 在恒温恒容下已达平衡状态的是( )
(A) P、Q、R、S的浓度不再变化
(B) P、Q、R、S的分子数比为1:1:1:1
(C)反应容器内气体总物质的量不再变化
(D)混合气体的压强不再变化
(E)气体的平均分子量不再变化
(F)各组分的质量分数不再改变
(G)混合气体的密度不再变化AF对于不同类型的可逆反应,某一物理量不变是否可作为平衡已到达的标志,取决于该物理量在到达平衡前、后是否发生变化。若是则可;否则,不行。 下列说法中可以充分说明反应:
在恒温恒容下已达平衡状态的是( )
(A) P、Q、R、S的浓度不再变化
(B) P、Q、R、S的分子数比为2:1:1:1
(C)反应容器内气体总物质的量不再变化
(D)混合气体的压强不再变化
(E)气体的平均分子量不再变化
(F)各组分的质量分数不再改变
(G)混合气体的密度不再变化2P(g)+Q(g) R(g)+S(g)ACDEF 下列说法中可以充分说明反应:
A(s)+3B(g) 2C(g)+D(g) , 在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强不再改变
(B)气体的平均分子量不再改变
(C)各组分的质量分数不再改变
(D)混合气体的密度不再改变BCD 下列说法中可以充分说明反应: A(g)+3B(g) 2C(g)+D(g), 在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强不再改变
(B)气体的平均分子量不再改变
(C)各组分的质量分数不再改变
(D)混合气体的密度不再改变ABC 下列说法中可以充分说明反应: A(g)+3B(g) 2C(g)+2D(g),在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强不再改变
(B)气体的平均分子量不再改变
(C)各组分的质量分数不再改变
(D)混合气体的密度不再改变C 在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(s)+3B(g)
2C(g)+D(g)已达平衡状态的是(其中只有B气体有颜色) ( )
A.混合气体的压强 B.混合气体的密度
C.气体的平均分子量 D.气体的颜色BCDACDD在一定温度下的固定体积的密闭容器中,下列叙述不是可逆反应A(g)+3B(g) 2C(g)+2D(s)达到平衡的标志的是 ( )
①C的生成 速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB ③A、B、C的浓度不再变化
④A、B、C的百分含量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB
⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧
C.①③④⑦ D.②⑤⑥⑧ABC
在恒温下,固定容积的密闭容器中,有可逆反应2SO3(g) ???2SO2(g)+O2(g),可用来确定该反应已达到平衡状态的是( )
A.容器内压强不随时间改变而改变
B.SO3的消耗速率与SO2的生成速率相等
C.正反应生成SO2的速率与逆反应生成SO3的速率相等
D.容器内混合气体的密度不再改变
AC 在一定温度下, ??????????????????????????达到平衡的标志是( )
A.单位时间内生成nmol H2,同时生成nmol I2
B.容器内总压强不再变化
C.单位时间内生成2n molHI,同时生成n molH2
D.当 ??????????????时
C 下列说法中可以充分说明反应: P(g)+Q(g) R(g)+S(g) , 在恒温下已达平衡状态的是( )
A. 反应容器内压强不再变化 B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存 D. 反应容器内总物质的量不随时间变化而变化B复习:
1、可逆反应有哪些特点?
2、什么叫“反应向正反应方向进行”?
3、如何理解一个可逆反应中“v正>v逆”?
4、可逆反应进行方向与正逆反应速率有何联系?如何理解?定义:可逆反应中,旧化学平衡被破坏,新化学平衡建立过程,叫做化学平衡的移动。 v正≠ v逆v正=v逆≠0条件改变平衡1 不平衡 平衡2建立新平衡破坏旧平衡v正 = v逆≠0′′一定时间二、化学平衡的移动′′【思考与交流】有哪些条件能改变化学平衡呢?1、浓度对化学平衡的影响(P26)溶液橙色加深溶液黄色加深现象分析: Cr2O72- + H2O 2CrO42-+2H+
橙色 黄色增大c(H+)c(Cr2O72-)增大平衡逆向移动减小c(H+)平衡正向移动结论:增大生成物的浓度平衡向逆反应方向移动结论:减小生成物的浓度平衡向正反应方向移动溶液黄色加深c(CrO42-)增大溶液橙色加深实验探究(P27实验2-6)
FeCl3+3KSCN Fe(SCN)3+3KCl
现象:溶液变成红色(红色)A.加少量FeCl3的红色加深;B.加少量KSCN的红色也加深;(无色)(黄色)(无色)思考——加少量NaOH溶液颜色有何变化。有红褐色沉淀生成,溶液红色变浅
实验结论:在其他条件不变时,
增大反应物或减小生成物的浓度
化学平衡向正反应方向移动
减小反应物或增大生成物的浓度
化学平衡向逆反应方向移动向右移动向左移动原因分析:运用浓度对化学反应速率的影响以及化学平衡的建立等知识,解释浓度对化学平衡的影响t2v”正 = v”逆v’逆v,正t3平衡状态Ⅱ增大反应物浓度速率-时间关系图:原因分析:增加反应物的浓度, v正 > v逆,平衡向正反应方向移动; 当减小反应物的浓度时, 化学平衡将怎样移动?速率-时间关系图:讨论:减小反应物浓度平衡逆向移动v’逆> v’正结论: 减小反应物的浓度, v正 < v逆,平衡向逆反应方向移动;减小生成物浓度平衡正向移动v’正> v’逆v正增大生成物浓度平衡逆向移动v’逆> v’正图象连续?为什么?浓度对化学平衡移动的几个注意点①对平衡体系中的固态和纯液态物质,其浓度可看作
一个常数,增加或减小固态或液态纯净物的量并不
影响v正、v逆的大小,所以化学平衡不移动。②只要是增大浓度,不论增大的是反应物浓度,还是
生成物浓度,新平衡状态下的反应速率一定大于原
平衡状态;减小浓度,新平衡状态下的速率一定小
于原平衡状态。③反应物有两种或两种以上, 增加一种物质的浓度, 该
物质的平衡转化率降低, 而其他物质的转化率提高。④改变浓度后,速率-时间图象是连续的。⑤对于离子反应,只有改变实际参加反应的离子的浓
度才能改变平衡。应用:在工业生产中适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可以提高价格较高原料的转化率,以降低生产成本练习:可逆反应H2O(g) + C(s) CO(g) + H2(g)在一定条件下的恒容容器中达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?①增大水蒸气浓度 ②加入更多的碳 ③增加H2浓度①平衡正向移动,CO浓度增大②平衡不移动,CO浓度不变③平衡逆向移动,CO浓度减小小结:增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以v(正)仍等于v(逆),平衡不移动。已知在氨水中存在下列平衡:NH3 + H2O NH3· H2O NH4+ + OH- (1)向氨水中加入MgCl2固体,平衡向 移动,
OH-浓度 ,NH4+浓度 。(2)向氨水中加入浓盐酸,平衡向 移动,
此时溶液中浓度减小的粒子有 。(3)向氨水中加入少量NaOH固体,平衡向 .移动,此时发生的现象是 。正反应方向减小增大正反应方向OH-、NH3·H2O、NH3逆反应方向有气体放出课堂练习2、温度对化学平衡的影响P28实验探究(实验2-7)
2NO2(g) N2O4(g) △H=-56.9kJ/mol(红棕色)(无色)混合气体受热颜色变深;遇冷颜色变浅。现象:[讨论]A:混合气体受热颜色变深,说明① ;
② 。
B:混合气体遇冷颜色变浅,说明① ;
② 。NO2浓度增大 平衡向逆反应方向移动NO2浓度减小 平衡向正反应方向移动[结论]在其它条件不变的情况下:
A:温度升高,会使化学平衡向着吸热反应的方向移动;
B:温度降低,会使化学平衡向着放热反应的方向移动。[分析]A:混合物受热时,速率均增大,但v(吸)> v(放) ,故平衡
向吸热反应方向移动;
B:混合物遇冷,速率均减少,但v(吸)< v(放) ,故平衡
向放热反应方向移动;其他条件不变时,若正反应为放热反应,能否画出温度升高时的v-t图象?t2v”正 = v”逆v’逆v‘正升高温度(正反应是放热反应)速率-时间关系图:2NO2 N2O4注意:温度对平衡的影响,图像具有不连续性。为什么?温度对平衡影响:速率-时间关系图升温对吸热反应有利、降温对放热反应有利已知可逆反应2SO2+O2 2SO3的正反应为放热反应。升高温度产生的影响是( )
A、 v (正)增大, v (逆)减小
B、 v (正)、 v (逆)不同程度增大
C、 v (正)减小, v (逆)增大
D、 v (正)、 v (逆)同等程度增大
B练习已知高温下反应
(正反应为吸热反应)。要使混合气体颜色加深,可采取的方法是A、保持容积不变,加入HBr(g) B、降低温度C、升高温度D、保持容积不变,加入H2(g)( A C )2HBr(g) H2(g) + Br2(g)3、压强对化学平衡的影响:NH3%随着压强的增大而增大,即平衡向正反应的方向移动。实验
数据:解释:说明:增大压强,正逆反应速率均增大,但增大倍数不一样,平衡向着气体体积缩小的方向移动加压→体积缩小→浓度增大→正反应速率增大
逆反应速率增大→ v正> v逆→平衡向正反应方向移动。1)先决条件:2)结论: 对于反应前后气体体积发生变化的化学反应,在其它条件不变的情况下,增大压强(减小容器体积),会使化学平衡向着气体体积缩小的方向移动,减小压强(增大容器体积),会使化学平衡向着气体体积增大的方向移动。体积缩小:即气体分子数目减少
体积增大:即气体分子数目增多说明: v (mol·L-1·s-1)0t2v”正 = v”逆v’逆v‘正增大压强3)速率-时间关系图:注意:压强对平衡的影响,图像具有不连续性。为什么?速率-时间关系图:v’正= v’逆增大压强,正逆反应速率均增大,但增大倍数一样, v’正= v’逆,平衡不移动。t2规律:对于反应前后气体总体积相等的可逆反应,改变压强只改变化学反应速率,而对平衡无影响;增大压强,容器体积减小,浓度同等程度增大,颜色变深,但平衡不移动.压强对化学平衡的影响[注意] ①对于反应前后气体总体积相等的反应,改变压强对平衡无影响; ②平衡混合物都是固体或液体的,改变压强不能使平衡移动;
③压强的变化必须改变混合物浓度,才有可能使平衡移动。正向移动不移动逆向移动逆向移动不移动思考:对于反应②和⑤,增大压强(缩小容器体积)时,平衡没有移动,但正逆反应速率有无变化?如何变化?课堂练习压强对化学平衡的影响判断压强引起平衡移动的思路:
压强如何改变?压强变化是否引起浓度变化?
浓度改变则引起速率的变化
速率变化后,若导致v正 ≠ v逆时平衡移动
若v正 = v逆时,则平衡不移动不移动逆向移动 向平衡体系 3H2 (g) +N2 (g) 2NH3 (g)
恒容时,充入Ne ,则平衡__________;
恒压时,充入Ne ,则平衡__________。 压强对化学平衡的影响实验探究
2NO2(g) N2O4(g)
现象:(2体积,红棕色)(1体积,无色)A.加压混合气体颜色先深后浅;B.减压混合气体颜色先浅后深。压强对化学平衡的影响2NO2(g) N2O4(g)(2体积,红棕色)(1体积,无色)[讨论]
A:当加压气体体积缩小时,混合气体颜色先变深是由于① ,后又逐渐变浅是由于 ② ;
B:当减压气体体积增大时,混合气体颜色先变浅是由于① , 后又逐渐变深是由于 。 NO2浓度增大 NO2浓度减小 平衡向正反应方向移动平衡向逆反应方向移动一定量的混合气体在密闭容器中发生反应:
m A (g) + n B (g) p C (g)达到平衡后,温度不变,将气体体积缩小到原来
的1/2,达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是( )A、m + n > p B、A 的转化率降低
C、平衡向正反应方向移动 D、C的体积分数增加 B 课堂练习练习1.下列反应达到化学平衡时,增大压强,平衡是否移动?向哪个方向移动?移动的根本原因是什么?① 2NO(g) + O2(g) 2NO2 (g)
② CaCO3(s) CaO(s) + CO2 (g)
③ H2O(g) + C (s) CO(g) + H2(g)
④ H2O(g) + CO(g) CO2(g) + H2(g)
⑤ H2S(g) H2(g) + S(s)2.恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的是: A. a>b+c B. a<b+c C. a=b+c D. a=b=c A4、催化剂对化学平衡的影响催化剂同等程度地加快正、逆反应速率(v正= v逆);对化学平衡无影响。加催化剂(b)v逆v正′′催化剂能缩短平衡到达的时间向正反应方向移动向逆反应方向移动向体积缩小方向移动向体积增大方向移动向吸热方向移动向放热方向移动向减弱这种改变的方向移动反应物浓度减小反应物浓度增大体系压强减小体系压强增大体系温度减小体系温度增大减弱这种改变规
律改变一个条件[总结]改变反应条件时平衡移动的方向催化剂对化学平衡无影响,能缩短平衡到达的时间。平衡移动原理——勒夏特列原理 如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。注意:
①是“减弱”这种改变,不是“消除”这种改变
②只有单个条件改变,才能应用(多个条件改变就要具体问题具体分析)
③勒沙特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡等),未平衡状态不能用此来分析勒夏特列原理(红棕色)(无色)思考与交流[讨论] 试比较以下三种状态下的温度关系:
①改变温度前混合气体温度T1;
②改变温度后瞬时气体温度T2;
③改变温度达新平衡后混合气体温度T3。
升温: ;
降温: 。T2 > T3 > T1T1 > T3 > T22NO2(g) N2O4(g)(2体积,红棕色)(1体积,无色)思考与交流P2 > P3 > P1P1 > P3 > P2[讨论] 试比较以下三种状态下的压强关系:
①改变压强前混合气体压强p1;
②改变压强后瞬时气体压强p2;
③改变压强达新平衡后混合气体压强p3。
加压: ;
减压: 。课堂练习下列事实中不能用平衡移动原理解释的是
(A) 密闭、低温是存放氨水的必要条件 (B) 实验室用排饱和食盐水法收集氯气 (C) 硝酸工业生产中,使用过量空气以提高NH3的利用率
(D) 在FeSO4溶液中,加入铁粉以防止氧化D课堂练习已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
① 生成物的百分含量一定增加② 生成物的产量一定增加③ 反应物的转化率一定增大④ 反应物浓度一定降低⑤ 正反应速率一定大于逆反应速率⑥ 使用了合适的催化剂
A ① ② (B) ② ⑤ (C) ③ ⑤ (D) ④ ⑥
B
20℃时,将一块质量为40 g 的NaCl晶体投入到100 g 水中,充分搅拌,至固体不再溶解为止,静置。经过相当长的时间后,发现NaCl晶体质量不再发生变化,但NaCl晶体的形状可能发生改变,为什么? 什么是饱和溶液? 在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。 饱和溶液中溶质的溶解过程完全停止了吗? 没有!以NaCl溶解于水为例,NaCl溶解的速率与溶解在水中的NaCl结晶析出晶体的速率相等。v溶解 > v结晶v溶解 < v结晶v溶解 = v结晶即:溶解速率 = 结晶速率
达到了溶解的平衡状态,一种动态平衡那么,可逆反应的情况又怎样呢?可逆反应正反应:从左向右进行的反应。
逆反应:从右向左进行的反应。 在同一条件下向正反应方向进行的同时又向逆反应方向进行的反应.
用 表示。 例: H2+I2 2HI可逆反应的特点:⑴同一条件下正逆反应同时进行
⑵可逆反应通常不能进行到底,反应物的转化率不能达到100%,反应体系中得到的总是反应物与生成物的混合物。单位时间反应物浓度的减少或生成物浓度的增加单位时间反应物浓度的增加或生成物浓度的减少
决定于生成物浓度决定于反应物浓度正反应速率逆反应速率相等时间速率1、定义化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。注意三点前提(适用范围):可逆反应内在本质:v(正)= v(逆) ≠0外在标志:反应混合物中各组分
的浓度保持不变如何判断可逆反应达到平衡状态?
或达到平衡的标志可逆反应2、化学平衡状态的特征(1)动:动态平衡,v(正)= v(逆) ≠0(2)等:(3)定:(5)逆:(4)变:v(正)= v(逆) 反应混合物中各组分的浓度保持不变条件改变,原平衡被破坏,在新的条件下建立新的平衡v正=v逆
1、同一物质
2、消耗=生成含量保持不变:
1、物质的量
2、物质的量浓度
3、体积分数1.不同物质
2.一正一逆
3.速率之比等于计量数之比 在500℃、钒触媒的作用下,某密闭容器中反应 2SO2 + O2 2SO3 △ H< 0 达到化学平衡状态时的标志是 ( )A SO2的消耗速率等于SO3的生成速率
B SO2的生成速率等于SO2的消耗速率
C SO2的消耗速率等于O2消耗速率的2倍
D SO3的生成速率等于O2生成速率的 2倍BD 在一定温度下,可逆反应A(g)+3B(g)
2C(g)达到平衡的标志是( )
A. C的生成速率与C的分解速率相等
B. 单位时间生成nmolA,同时生成3nmolB
C. 单位时间生成B的速率,与生成C的速率 相等
D. 单位时间生成nmolA,同时生成2nmolCAD 下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成AC百分含量质量分数:某一组分的质量总质量物质的量分数:某一组分的物质的量总物质的量体积分数:某气体组分的体积总体积=物质的量分数 下列说法中可以充分说明反应: P(g)+Q(g)
R(g)+S(g) , 在恒温恒容下已达平衡状态的是( )
(A) P、Q、R、S的浓度不再变化
(B) P、Q、R、S的分子数比为1:1:1:1
(C)反应容器内气体总物质的量不再变化
(D)混合气体的压强不再变化
(E)气体的平均分子量不再变化
(F)各组分的质量分数不再改变
(G)混合气体的密度不再变化AF对于不同类型的可逆反应,某一物理量不变是否可作为平衡已到达的标志,取决于该物理量在到达平衡前、后是否发生变化。若是则可;否则,不行。 下列说法中可以充分说明反应:
在恒温恒容下已达平衡状态的是( )
(A) P、Q、R、S的浓度不再变化
(B) P、Q、R、S的分子数比为2:1:1:1
(C)反应容器内气体总物质的量不再变化
(D)混合气体的压强不再变化
(E)气体的平均分子量不再变化
(F)各组分的质量分数不再改变
(G)混合气体的密度不再变化2P(g)+Q(g) R(g)+S(g)ACDEF 下列说法中可以充分说明反应:
A(s)+3B(g) 2C(g)+D(g) , 在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强不再改变
(B)气体的平均分子量不再改变
(C)各组分的质量分数不再改变
(D)混合气体的密度不再改变BCD 下列说法中可以充分说明反应: A(g)+3B(g) 2C(g)+D(g), 在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强不再改变
(B)气体的平均分子量不再改变
(C)各组分的质量分数不再改变
(D)混合气体的密度不再改变ABC 下列说法中可以充分说明反应: A(g)+3B(g) 2C(g)+2D(g),在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强不再改变
(B)气体的平均分子量不再改变
(C)各组分的质量分数不再改变
(D)混合气体的密度不再改变C 在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(s)+3B(g)
2C(g)+D(g)已达平衡状态的是(其中只有B气体有颜色) ( )
A.混合气体的压强 B.混合气体的密度
C.气体的平均分子量 D.气体的颜色BCDACDD在一定温度下的固定体积的密闭容器中,下列叙述不是可逆反应A(g)+3B(g) 2C(g)+2D(s)达到平衡的标志的是 ( )
①C的生成 速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB ③A、B、C的浓度不再变化
④A、B、C的百分含量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB
⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧
C.①③④⑦ D.②⑤⑥⑧ABC
在恒温下,固定容积的密闭容器中,有可逆反应2SO3(g) ???2SO2(g)+O2(g),可用来确定该反应已达到平衡状态的是( )
A.容器内压强不随时间改变而改变
B.SO3的消耗速率与SO2的生成速率相等
C.正反应生成SO2的速率与逆反应生成SO3的速率相等
D.容器内混合气体的密度不再改变
AC 在一定温度下, ??????????????????????????达到平衡的标志是( )
A.单位时间内生成nmol H2,同时生成nmol I2
B.容器内总压强不再变化
C.单位时间内生成2n molHI,同时生成n molH2
D.当 ??????????????时
C 下列说法中可以充分说明反应: P(g)+Q(g) R(g)+S(g) , 在恒温下已达平衡状态的是( )
A. 反应容器内压强不再变化 B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存 D. 反应容器内总物质的量不随时间变化而变化B复习:
1、可逆反应有哪些特点?
2、什么叫“反应向正反应方向进行”?
3、如何理解一个可逆反应中“v正>v逆”?
4、可逆反应进行方向与正逆反应速率有何联系?如何理解?定义:可逆反应中,旧化学平衡被破坏,新化学平衡建立过程,叫做化学平衡的移动。 v正≠ v逆v正=v逆≠0条件改变平衡1 不平衡 平衡2建立新平衡破坏旧平衡v正 = v逆≠0′′一定时间二、化学平衡的移动′′【思考与交流】有哪些条件能改变化学平衡呢?1、浓度对化学平衡的影响(P26)溶液橙色加深溶液黄色加深现象分析: Cr2O72- + H2O 2CrO42-+2H+
橙色 黄色增大c(H+)c(Cr2O72-)增大平衡逆向移动减小c(H+)平衡正向移动结论:增大生成物的浓度平衡向逆反应方向移动结论:减小生成物的浓度平衡向正反应方向移动溶液黄色加深c(CrO42-)增大溶液橙色加深实验探究(P27实验2-6)
FeCl3+3KSCN Fe(SCN)3+3KCl
现象:溶液变成红色(红色)A.加少量FeCl3的红色加深;B.加少量KSCN的红色也加深;(无色)(黄色)(无色)思考——加少量NaOH溶液颜色有何变化。有红褐色沉淀生成,溶液红色变浅
实验结论:在其他条件不变时,
增大反应物或减小生成物的浓度
化学平衡向正反应方向移动
减小反应物或增大生成物的浓度
化学平衡向逆反应方向移动向右移动向左移动原因分析:运用浓度对化学反应速率的影响以及化学平衡的建立等知识,解释浓度对化学平衡的影响t2v”正 = v”逆v’逆v,正t3平衡状态Ⅱ增大反应物浓度速率-时间关系图:原因分析:增加反应物的浓度, v正 > v逆,平衡向正反应方向移动; 当减小反应物的浓度时, 化学平衡将怎样移动?速率-时间关系图:讨论:减小反应物浓度平衡逆向移动v’逆> v’正结论: 减小反应物的浓度, v正 < v逆,平衡向逆反应方向移动;减小生成物浓度平衡正向移动v’正> v’逆v正增大生成物浓度平衡逆向移动v’逆> v’正图象连续?为什么?浓度对化学平衡移动的几个注意点①对平衡体系中的固态和纯液态物质,其浓度可看作
一个常数,增加或减小固态或液态纯净物的量并不
影响v正、v逆的大小,所以化学平衡不移动。②只要是增大浓度,不论增大的是反应物浓度,还是
生成物浓度,新平衡状态下的反应速率一定大于原
平衡状态;减小浓度,新平衡状态下的速率一定小
于原平衡状态。③反应物有两种或两种以上, 增加一种物质的浓度, 该
物质的平衡转化率降低, 而其他物质的转化率提高。④改变浓度后,速率-时间图象是连续的。⑤对于离子反应,只有改变实际参加反应的离子的浓
度才能改变平衡。应用:在工业生产中适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可以提高价格较高原料的转化率,以降低生产成本练习:可逆反应H2O(g) + C(s) CO(g) + H2(g)在一定条件下的恒容容器中达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?①增大水蒸气浓度 ②加入更多的碳 ③增加H2浓度①平衡正向移动,CO浓度增大②平衡不移动,CO浓度不变③平衡逆向移动,CO浓度减小小结:增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以v(正)仍等于v(逆),平衡不移动。已知在氨水中存在下列平衡:NH3 + H2O NH3· H2O NH4+ + OH- (1)向氨水中加入MgCl2固体,平衡向 移动,
OH-浓度 ,NH4+浓度 。(2)向氨水中加入浓盐酸,平衡向 移动,
此时溶液中浓度减小的粒子有 。(3)向氨水中加入少量NaOH固体,平衡向 .移动,此时发生的现象是 。正反应方向减小增大正反应方向OH-、NH3·H2O、NH3逆反应方向有气体放出课堂练习2、温度对化学平衡的影响P28实验探究(实验2-7)
2NO2(g) N2O4(g) △H=-56.9kJ/mol(红棕色)(无色)混合气体受热颜色变深;遇冷颜色变浅。现象:[讨论]A:混合气体受热颜色变深,说明① ;
② 。
B:混合气体遇冷颜色变浅,说明① ;
② 。NO2浓度增大 平衡向逆反应方向移动NO2浓度减小 平衡向正反应方向移动[结论]在其它条件不变的情况下:
A:温度升高,会使化学平衡向着吸热反应的方向移动;
B:温度降低,会使化学平衡向着放热反应的方向移动。[分析]A:混合物受热时,速率均增大,但v(吸)> v(放) ,故平衡
向吸热反应方向移动;
B:混合物遇冷,速率均减少,但v(吸)< v(放) ,故平衡
向放热反应方向移动;其他条件不变时,若正反应为放热反应,能否画出温度升高时的v-t图象?t2v”正 = v”逆v’逆v‘正升高温度(正反应是放热反应)速率-时间关系图:2NO2 N2O4注意:温度对平衡的影响,图像具有不连续性。为什么?温度对平衡影响:速率-时间关系图升温对吸热反应有利、降温对放热反应有利已知可逆反应2SO2+O2 2SO3的正反应为放热反应。升高温度产生的影响是( )
A、 v (正)增大, v (逆)减小
B、 v (正)、 v (逆)不同程度增大
C、 v (正)减小, v (逆)增大
D、 v (正)、 v (逆)同等程度增大
B练习已知高温下反应
(正反应为吸热反应)。要使混合气体颜色加深,可采取的方法是A、保持容积不变,加入HBr(g) B、降低温度C、升高温度D、保持容积不变,加入H2(g)( A C )2HBr(g) H2(g) + Br2(g)3、压强对化学平衡的影响:NH3%随着压强的增大而增大,即平衡向正反应的方向移动。实验
数据:解释:说明:增大压强,正逆反应速率均增大,但增大倍数不一样,平衡向着气体体积缩小的方向移动加压→体积缩小→浓度增大→正反应速率增大
逆反应速率增大→ v正> v逆→平衡向正反应方向移动。1)先决条件:2)结论: 对于反应前后气体体积发生变化的化学反应,在其它条件不变的情况下,增大压强(减小容器体积),会使化学平衡向着气体体积缩小的方向移动,减小压强(增大容器体积),会使化学平衡向着气体体积增大的方向移动。体积缩小:即气体分子数目减少
体积增大:即气体分子数目增多说明: v (mol·L-1·s-1)0t2v”正 = v”逆v’逆v‘正增大压强3)速率-时间关系图:注意:压强对平衡的影响,图像具有不连续性。为什么?速率-时间关系图:v’正= v’逆增大压强,正逆反应速率均增大,但增大倍数一样, v’正= v’逆,平衡不移动。t2规律:对于反应前后气体总体积相等的可逆反应,改变压强只改变化学反应速率,而对平衡无影响;增大压强,容器体积减小,浓度同等程度增大,颜色变深,但平衡不移动.压强对化学平衡的影响[注意] ①对于反应前后气体总体积相等的反应,改变压强对平衡无影响; ②平衡混合物都是固体或液体的,改变压强不能使平衡移动;
③压强的变化必须改变混合物浓度,才有可能使平衡移动。正向移动不移动逆向移动逆向移动不移动思考:对于反应②和⑤,增大压强(缩小容器体积)时,平衡没有移动,但正逆反应速率有无变化?如何变化?课堂练习压强对化学平衡的影响判断压强引起平衡移动的思路:
压强如何改变?压强变化是否引起浓度变化?
浓度改变则引起速率的变化
速率变化后,若导致v正 ≠ v逆时平衡移动
若v正 = v逆时,则平衡不移动不移动逆向移动 向平衡体系 3H2 (g) +N2 (g) 2NH3 (g)
恒容时,充入Ne ,则平衡__________;
恒压时,充入Ne ,则平衡__________。 压强对化学平衡的影响实验探究
2NO2(g) N2O4(g)
现象:(2体积,红棕色)(1体积,无色)A.加压混合气体颜色先深后浅;B.减压混合气体颜色先浅后深。压强对化学平衡的影响2NO2(g) N2O4(g)(2体积,红棕色)(1体积,无色)[讨论]
A:当加压气体体积缩小时,混合气体颜色先变深是由于① ,后又逐渐变浅是由于 ② ;
B:当减压气体体积增大时,混合气体颜色先变浅是由于① , 后又逐渐变深是由于 。 NO2浓度增大 NO2浓度减小 平衡向正反应方向移动平衡向逆反应方向移动一定量的混合气体在密闭容器中发生反应:
m A (g) + n B (g) p C (g)达到平衡后,温度不变,将气体体积缩小到原来
的1/2,达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是( )A、m + n > p B、A 的转化率降低
C、平衡向正反应方向移动 D、C的体积分数增加 B 课堂练习练习1.下列反应达到化学平衡时,增大压强,平衡是否移动?向哪个方向移动?移动的根本原因是什么?① 2NO(g) + O2(g) 2NO2 (g)
② CaCO3(s) CaO(s) + CO2 (g)
③ H2O(g) + C (s) CO(g) + H2(g)
④ H2O(g) + CO(g) CO2(g) + H2(g)
⑤ H2S(g) H2(g) + S(s)2.恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的是: A. a>b+c B. a<b+c C. a=b+c D. a=b=c A4、催化剂对化学平衡的影响催化剂同等程度地加快正、逆反应速率(v正= v逆);对化学平衡无影响。加催化剂(b)v逆v正′′催化剂能缩短平衡到达的时间向正反应方向移动向逆反应方向移动向体积缩小方向移动向体积增大方向移动向吸热方向移动向放热方向移动向减弱这种改变的方向移动反应物浓度减小反应物浓度增大体系压强减小体系压强增大体系温度减小体系温度增大减弱这种改变规
律改变一个条件[总结]改变反应条件时平衡移动的方向催化剂对化学平衡无影响,能缩短平衡到达的时间。平衡移动原理——勒夏特列原理 如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。注意:
①是“减弱”这种改变,不是“消除”这种改变
②只有单个条件改变,才能应用(多个条件改变就要具体问题具体分析)
③勒沙特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡等),未平衡状态不能用此来分析勒夏特列原理(红棕色)(无色)思考与交流[讨论] 试比较以下三种状态下的温度关系:
①改变温度前混合气体温度T1;
②改变温度后瞬时气体温度T2;
③改变温度达新平衡后混合气体温度T3。
升温: ;
降温: 。T2 > T3 > T1T1 > T3 > T22NO2(g) N2O4(g)(2体积,红棕色)(1体积,无色)思考与交流P2 > P3 > P1P1 > P3 > P2[讨论] 试比较以下三种状态下的压强关系:
①改变压强前混合气体压强p1;
②改变压强后瞬时气体压强p2;
③改变压强达新平衡后混合气体压强p3。
加压: ;
减压: 。课堂练习下列事实中不能用平衡移动原理解释的是
(A) 密闭、低温是存放氨水的必要条件 (B) 实验室用排饱和食盐水法收集氯气 (C) 硝酸工业生产中,使用过量空气以提高NH3的利用率
(D) 在FeSO4溶液中,加入铁粉以防止氧化D课堂练习已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
① 生成物的百分含量一定增加② 生成物的产量一定增加③ 反应物的转化率一定增大④ 反应物浓度一定降低⑤ 正反应速率一定大于逆反应速率⑥ 使用了合适的催化剂
A ① ② (B) ② ⑤ (C) ③ ⑤ (D) ④ ⑥
B
