化学1.3化学反应热的计算课件(35张幻灯片)
文档属性
| 名称 | 化学1.3化学反应热的计算课件(35张幻灯片) |  | |
| 格式 | zip | ||
| 文件大小 | 830.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-04-27 21:53:08 | ||
图片预览










文档简介
课件35张PPT。化学反应热的计算1、已知:H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ/mol
则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为( )A.+184.6 kJ/mol B.-92.3 kJ/mol
C.-369.2 kJ/mol D.+92.3 kJ/mol复习:D2、甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下1g甲硅烷自燃放出44.6kJ热量,其热化学方程式为:
_____________________________________________ SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-1427.2kJ/mol规律: “正逆”反应的反应热效应数值相等,符号相反3、已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,计算下列反应中放出的热量。
(1)用20g NaOH 配成稀溶液跟足量稀盐酸反应,放出热量为 kJ。
(2)用0.1molBa(OH)2配成稀溶液跟足量稀硝酸反应,放出热量为 kJ。
(3)用1mol醋酸稀溶液和足量NaOH溶液反应,放出的热量 (大于、小于、等于)57.3kJ。
(4)100ml 0.1mol/L的Ba(OH)2溶液与100ml 0.1mol/L的H2SO4溶液反应,放出的热量是否为1.146kJ?为什么?28.6511.46小于◆能否根据式子:CH4(g)+O2(g)= CO2(g)+H2O(l) ΔH=-445.15kJ/mol认为甲烷的燃烧热是445.15kJ/mol? 例:0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中完全燃烧,生成固态B2O3和液态水,放出649.5kJ热量,则表示乙硼烷燃烧热的热化学方程式为
。 B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=-2165kJ/mol ① H2(g)+1/2O2(g)==H2O(g) △H1=-241.8kJ/mol
那么,H2的燃烧热△H究竟是多少?还差什么条件?
已知: ② H2O(g)==H2O(l) △H2=-44kJ/mol
求 ③ H2(g)+1/2O2(g)==H2O(l) △H3=?
用图示求解过程。
①+②=③ △H3=△H1+△H2=-285.8kJ/mol判断下列数据△H1表示燃烧热吗?思考:如何测出该反应的反应热:
① C(s)+1/2O2(g)==CO(g) ΔH1=?如果已知:
②CO(g)+1/2O2(g)== CO2(g) ΔH2=-283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3=-393.5kJ/mol
你能求出ΔH1吗?不能很好的控制反应的程度,故不能直接通过实验测得△H1① + ② = ③ ,
则 ΔH1 + ΔH2 =ΔH3
所以,ΔH1=ΔH3-ΔH2 =-393.5kJ/mol+283.0kJ/mol
=-110.5kJ/mol由上两例你能得出什么结论?影响反应热的因素1、与温度、压强有关
2、与物质的状态有关
3、与反应物的用量有关
4、与反应条件(途径)无关
——盖斯定律 定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的
途径无关。
盖斯定律的本质:方程式按一
定系数比加和时其反应热也按
该系数比加和。 1、盖斯定律一、盖斯定律AB请思考:由起点A到终点B有多少条途径?
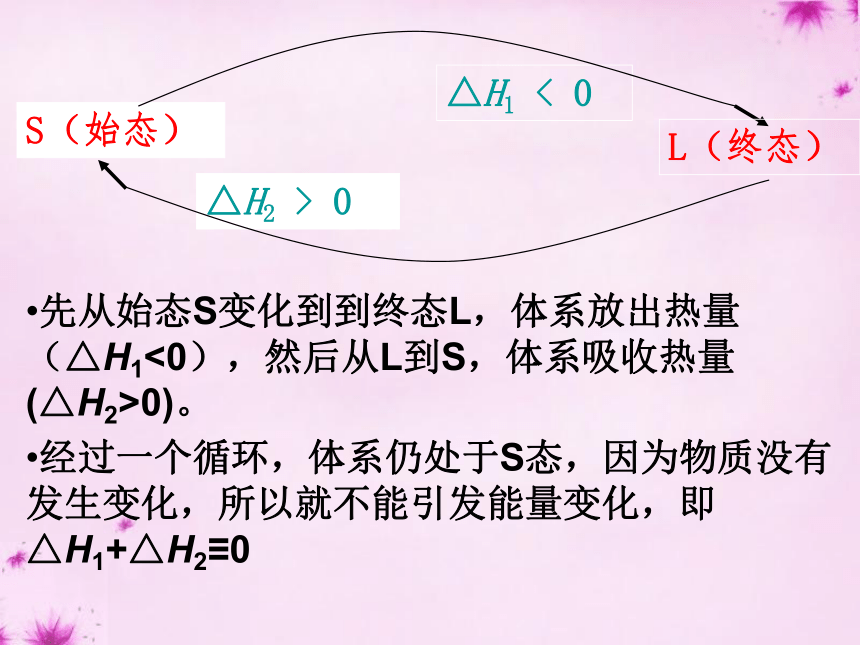
从不同途径由A点到B点的位移有什么关系?登山的高度与上山的途径无关,只与起点和终点的相对高度有关如何理解盖斯定律?△H2 > 0△H1 < 0S(始态)L(终态)先从始态S变化到到终态L,体系放出热量(△H1<0),然后从L到S,体系吸收热量(△H2>0)。
经过一个循环,体系仍处于S态,因为物质没有发生变化,所以就不能引发能量变化,即△H1+△H2≡0
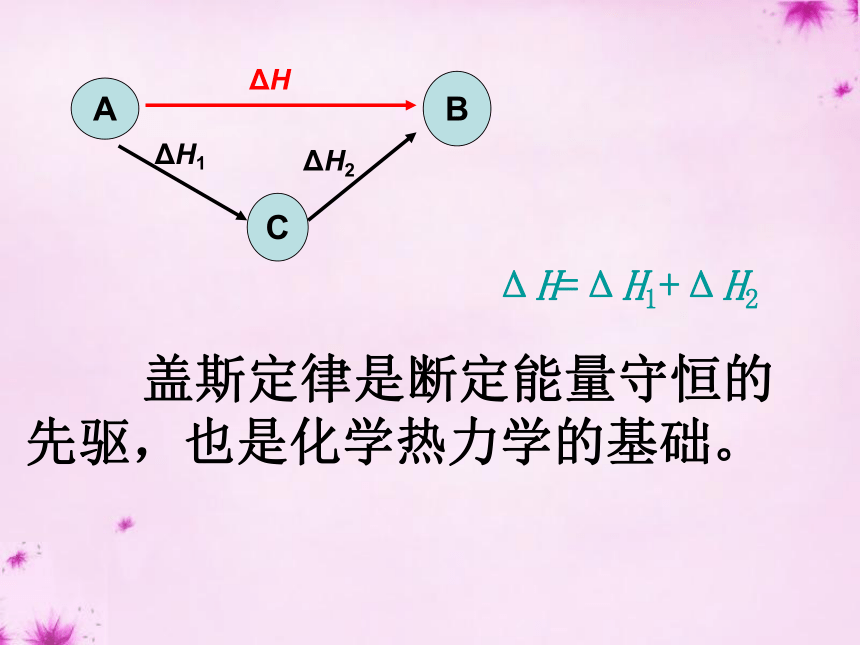
ΔH=ΔH1+ΔH2BΔHACΔH1ΔH2 盖斯定律是断定能量守恒的先驱,也是化学热力学的基础。 2、盖斯定律在科学研究中的重要意义有些反应进行得很慢
有些反应不容易直接发生
有些反应的产品不纯(有副反应发生)
这些都给测量反应热造成了困难
利用盖斯定律可以间接地把它们的反应热计算出来 有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。3、盖斯定律的应用关键:目标方程式的“四则运算式”的导出。方法:写出目标方程式确定“过渡物质”(要消去的物质)
然后用消元法逐一消去“过渡物质”,导出“四则运算式”。例1:已知下列各反应的焓变
①Ca(s)+C(s,石墨)+3/2O2(g)=CaCO3(s)
△H = -1206.8 kJ/mol
②Ca(s)+1/2O2(g)=CaO(s)
△H = -635.1 kJ/mol
③C(s,石墨)+O2(g)=CO2(g)
△H = -393.5 kJ/mol
试求④CaCO3(s)=CaO(s)+CO2(g)的焓变△H=+178.2 kJ/mol④=②+③-①例2:按照盖斯定律,结合下述反应方程式回答问题,已知:
①NH3(g)+HCl(g)=NH4Cl(s) △H1=-176kJ/mol
②NH3(g)+H2O(l)=NH3· H2O(aq) △H2=-35.1kJ/mol
③HCl(g) +H2O(l)=HCl(aq) △H3=-72.3kJ/mol
④NH3(aq)+ HCl(aq)=NH4Cl(aq) △H4=-52.3kJ/mol
⑤NH4Cl(s)+2H2O(l)= NH4Cl(aq) △H5=?
则第⑤个方程式中的反应热△H是________。
根据盖斯定律和上述反应方程式得:
⑤=④+③+②-①,
即△H5 = +16.3kJ/mol例3:写出石墨变成金刚石的热化学方程式 (25℃,101kPa时)石墨能直接变成金刚石吗?查燃烧热表知:
①C(石墨,s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)=CO2(g) △H2=-395.0kJ/mol所以, ①- ②得:
C(石墨,s)=C(金刚石,s) △H=+1.5kJ/mol 观察该热化学方程式,回答:金刚石能自动变成石墨吗?需要什么条件?若金刚石、石墨共1mol混合在氧气中燃烧,产热QKJ,则两者的物质的量之比为:例4:同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:①P4(白磷、 s)+5O2(g)=P4O10(s)△H1=-2983.2 kJ/mol②P(红磷、 s)+5/4O2(g)=1/4P4O10(s) △H2= -738.5 kJ/mol试写出白磷转化为红磷的热化学方程式 。 P4(白磷、s)=4 P(红磷、s) △ H =-29.2kJ/mol①-4×②:你知道神六的火箭燃料是什么吗?例5:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
①N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
②N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)= 3N2(g)+4H2O(l) △H=-1135.2kJ/mol 2 × ②-①:应用盖斯定律进行简单计算,关键在于设计反应过程,同时注意:
⑴ 当反应式乘以或除以某数时,△H也应乘以或除以某数。
⑵ 反应式进行加减运算时,△H也同样要进行加减运算,且要带“+”、“-”符号,即把△H看作一个整体进行运算。
⑶ 通过盖斯定律计算比较反应热的大小时,同样要把△H看作一个整体。
⑷ 在设计的反应过程中常会遇到同一物质固、液、气三态的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
⑸ 当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。已知
① CO(g)+1/2O2(g)=CO2(g) ΔH1= -283.0 kJ/mol
② H2(g)+1/2O2(g)=H2O(l) ΔH2= -285.8 kJ/mol ③C2H5OH(l)+ 3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370 kJ/mol 试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH?【解】:根据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热效应都是相同的。下面就看看反应④能不能由①②③三个反应通过加减乘除组合而成,也就是说,看看反应④能不能分成①②③几步完成。
①×2 + ②×4 - ③ = ④ 所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3 ????? =-283.2 kJ/mol ×2 -285.8 kJ/mol ×4 +1370 kJ/mol
=-339.6kJ/mol 练习题型一:有关热化学反应方程式的的含义及书写
1. 已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
2、有关反应热的计算
(1)盖斯定律及其应用
(2) 根据一定量的物质参加反应放出的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。Q=n×△H
(3)利用键能计算反应热
题型二:燃烧热、中和热的判断、求算及测量二、反应的计算课本P12 例1:【解一】钠与氯气起反应的热化学方程式如下:Na(s) + 1/2Cl2(g)== NaCl (s) △H 则:△H=23g/mol×(-17.87kJ)÷ 1.0g
=-411kJ/mol注意热化学方程式正确书写,特别注意有关单位的正确书写。由:Q=n×△H
-17.87kJ = 1.0g /(23g/mol) ×△H课本P12 例1:【解二】设生成1molNaCl放热量为QNa(s) + 1/2Cl2(g)== NaCl (s)答:由钠和氯气反应生成1mol的反应热为-411kJ/mol23gQ1g17.87kJ则:Q=23g×17.87kJ÷ 1.0g
=411kJ1.已知: C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
H2(g)+1/2O2(g)=H2O(g) ΔH= -241.8 kJ/mol
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为
A. 2:3.25 B. 12:3.25
C. 1:1 D. 393.5:241.8B变式练习 2.已知胆矾溶于水时溶液温度降低,
胆矾分解的热化学方程式为:
CuSO4?5H2O(s)==CuSO4(s)+5H2O(l)
△H=+Q1kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液
时放热Q2kJ,则( )
A.Q1>Q2 B.Q1=Q2
C. Q1A
设计合理的反应过程,注意反应热的正、负号!
盖斯定律的灵活应用变式练习 3 在 101 kPa时,1mol CH4 完全燃烧生成CO2和液态H2O,放出 890 kJ的热量,CH4 的燃烧热为多少? 1000 L CH4(标准状况)燃烧后所产生的热量为多少?【解】根据题意,在 101 kPa时,1mol CH4 完全燃烧的热化学方程式为:
CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH=-890 kJ/mol
即CH4 的燃烧热为 890 kJ/mol。
由:Q=n×△H
1000 L CH4 (标准状况)完全燃烧放出的热量为:
Q= V (CH4) / V m ×△H
=1000L / (22.4L·mol-1)×(—890 kJ/mol )
=44.6 mol×(-890 kJ/mol)=—3.97×104kJ
答:CH4的燃烧热为 890 kJ/mol,1000 L CH4(标准状况)完全燃烧产生的热量为3.97×104kJ。4? 葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:C6H12O6(s)+6O2(g)= 6CO2(g)+6H2O(l) ΔH=-2 800 kJ/mol 葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算 100 g葡萄糖在人体中完全氧化时所产生的热量。【解】?由:
Q=n×△H
= m(C6H12O6 )/M(C6H12O6 ) ×△H
=100g/180g·mol-1 ×(-2800 kJ/mol)
=-1560 kJ
答:100g葡萄糖在人体中完全氧化时产生1560 kJ的热量。已知:
2N2H4(g)+2NO2(g)= 3N2(g)+4H2O(l) △H=-1135.2kJ/mol
则16g肼完全反应放出的热量为: 。 巩固练习 1.1 g炭与适量水蒸气反应生成一氧化碳和氢气,需吸收10.94 kJ的热量,相应的热化学方程式为 ( )
A.C+H2O=CO+H2 ΔH=+10.9 kJ/ mol
B.C(s)+H2O(g)=CO(g)+H2(g)
ΔH=+10.94 kJ/ mol
C.C(s)+H2O(g)=CO(g)+H2(g)
ΔH=+131.28 kJ/ mol
D.1/2C(s)+ 1/2H2O(g)= 1/2CO(g)+ 1/2H2(g )
ΔH=+65.64 kJ/ mol
CD2.已知1mol白磷转化成1mol红磷,放出18.39 kJ热量,又知:P4(白,s)+5O2 = 2P2O5(s) ΔH1,4P(红,s)+5O2 = 2P2O5 (s)ΔH2
则ΔH1和ΔH2的关系正确的是( )
A.ΔH1>ΔH2 B.ΔH1<ΔH2
C.ΔH1=ΔH2 D.无法确定B3、 今有如下三个热化学方程式:
H2(g)+1/2O2(g)=H2O(g) ΔH=a kJ/ mol
H2(g)+1/2O2(g)=H2O(l) ΔH=b kJ/ mol
2H2(g)+ O2(g)=2H2O(l) ΔH=c kJ/ mol
关于它们的下列表述正确的是 ( )
A.它们都是吸热反应
B.a、b和c均为正值
C.a=b D.2b=cD4.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)=CO2(g) △H=-393.51kJ·mol-1
C(金刚石)+O2(g)=CO2(g) △H=-395.41kJ·mol-1
据此判断,下列说法中正确的是( )
A、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高A思考:为什么在热化学反应方程式中通常可不表明反应条件?正逆反应的反应热效应数值相等,符号相反。 “+”不能省去。5.已知石墨的燃烧热:△H=-393.5kJ/mol
(1)写出石墨的完全燃烧的热化学方程式
(2)二氧化碳转化为石墨和氧气的热化学方程式①C(石墨,s)+O2(g)=CO2(g) △H =-393.5kJ/mol
②CO2(g)=C(石墨,s)+O2(g) △H =+393.5kJ/mol盖斯定律:不管化学反应是一步完成或分几步完成,其反应热是相同.换句话说, 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关.
因为有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难.此时如果应用盖斯定律,就可以间接地把它们的反应热计算出来.
则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为( )A.+184.6 kJ/mol B.-92.3 kJ/mol
C.-369.2 kJ/mol D.+92.3 kJ/mol复习:D2、甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下1g甲硅烷自燃放出44.6kJ热量,其热化学方程式为:
_____________________________________________ SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-1427.2kJ/mol规律: “正逆”反应的反应热效应数值相等,符号相反3、已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,计算下列反应中放出的热量。
(1)用20g NaOH 配成稀溶液跟足量稀盐酸反应,放出热量为 kJ。
(2)用0.1molBa(OH)2配成稀溶液跟足量稀硝酸反应,放出热量为 kJ。
(3)用1mol醋酸稀溶液和足量NaOH溶液反应,放出的热量 (大于、小于、等于)57.3kJ。
(4)100ml 0.1mol/L的Ba(OH)2溶液与100ml 0.1mol/L的H2SO4溶液反应,放出的热量是否为1.146kJ?为什么?28.6511.46小于◆能否根据式子:CH4(g)+O2(g)= CO2(g)+H2O(l) ΔH=-445.15kJ/mol认为甲烷的燃烧热是445.15kJ/mol? 例:0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中完全燃烧,生成固态B2O3和液态水,放出649.5kJ热量,则表示乙硼烷燃烧热的热化学方程式为
。 B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=-2165kJ/mol ① H2(g)+1/2O2(g)==H2O(g) △H1=-241.8kJ/mol
那么,H2的燃烧热△H究竟是多少?还差什么条件?
已知: ② H2O(g)==H2O(l) △H2=-44kJ/mol
求 ③ H2(g)+1/2O2(g)==H2O(l) △H3=?
用图示求解过程。
①+②=③ △H3=△H1+△H2=-285.8kJ/mol判断下列数据△H1表示燃烧热吗?思考:如何测出该反应的反应热:
① C(s)+1/2O2(g)==CO(g) ΔH1=?如果已知:
②CO(g)+1/2O2(g)== CO2(g) ΔH2=-283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3=-393.5kJ/mol
你能求出ΔH1吗?不能很好的控制反应的程度,故不能直接通过实验测得△H1① + ② = ③ ,
则 ΔH1 + ΔH2 =ΔH3
所以,ΔH1=ΔH3-ΔH2 =-393.5kJ/mol+283.0kJ/mol
=-110.5kJ/mol由上两例你能得出什么结论?影响反应热的因素1、与温度、压强有关
2、与物质的状态有关
3、与反应物的用量有关
4、与反应条件(途径)无关
——盖斯定律 定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的
途径无关。
盖斯定律的本质:方程式按一
定系数比加和时其反应热也按
该系数比加和。 1、盖斯定律一、盖斯定律AB请思考:由起点A到终点B有多少条途径?
从不同途径由A点到B点的位移有什么关系?登山的高度与上山的途径无关,只与起点和终点的相对高度有关如何理解盖斯定律?△H2 > 0△H1 < 0S(始态)L(终态)先从始态S变化到到终态L,体系放出热量(△H1<0),然后从L到S,体系吸收热量(△H2>0)。
经过一个循环,体系仍处于S态,因为物质没有发生变化,所以就不能引发能量变化,即△H1+△H2≡0
ΔH=ΔH1+ΔH2BΔHACΔH1ΔH2 盖斯定律是断定能量守恒的先驱,也是化学热力学的基础。 2、盖斯定律在科学研究中的重要意义有些反应进行得很慢
有些反应不容易直接发生
有些反应的产品不纯(有副反应发生)
这些都给测量反应热造成了困难
利用盖斯定律可以间接地把它们的反应热计算出来 有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。3、盖斯定律的应用关键:目标方程式的“四则运算式”的导出。方法:写出目标方程式确定“过渡物质”(要消去的物质)
然后用消元法逐一消去“过渡物质”,导出“四则运算式”。例1:已知下列各反应的焓变
①Ca(s)+C(s,石墨)+3/2O2(g)=CaCO3(s)
△H = -1206.8 kJ/mol
②Ca(s)+1/2O2(g)=CaO(s)
△H = -635.1 kJ/mol
③C(s,石墨)+O2(g)=CO2(g)
△H = -393.5 kJ/mol
试求④CaCO3(s)=CaO(s)+CO2(g)的焓变△H=+178.2 kJ/mol④=②+③-①例2:按照盖斯定律,结合下述反应方程式回答问题,已知:
①NH3(g)+HCl(g)=NH4Cl(s) △H1=-176kJ/mol
②NH3(g)+H2O(l)=NH3· H2O(aq) △H2=-35.1kJ/mol
③HCl(g) +H2O(l)=HCl(aq) △H3=-72.3kJ/mol
④NH3(aq)+ HCl(aq)=NH4Cl(aq) △H4=-52.3kJ/mol
⑤NH4Cl(s)+2H2O(l)= NH4Cl(aq) △H5=?
则第⑤个方程式中的反应热△H是________。
根据盖斯定律和上述反应方程式得:
⑤=④+③+②-①,
即△H5 = +16.3kJ/mol例3:写出石墨变成金刚石的热化学方程式 (25℃,101kPa时)石墨能直接变成金刚石吗?查燃烧热表知:
①C(石墨,s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)=CO2(g) △H2=-395.0kJ/mol所以, ①- ②得:
C(石墨,s)=C(金刚石,s) △H=+1.5kJ/mol 观察该热化学方程式,回答:金刚石能自动变成石墨吗?需要什么条件?若金刚石、石墨共1mol混合在氧气中燃烧,产热QKJ,则两者的物质的量之比为:例4:同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:①P4(白磷、 s)+5O2(g)=P4O10(s)△H1=-2983.2 kJ/mol②P(红磷、 s)+5/4O2(g)=1/4P4O10(s) △H2= -738.5 kJ/mol试写出白磷转化为红磷的热化学方程式 。 P4(白磷、s)=4 P(红磷、s) △ H =-29.2kJ/mol①-4×②:你知道神六的火箭燃料是什么吗?例5:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
①N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
②N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)= 3N2(g)+4H2O(l) △H=-1135.2kJ/mol 2 × ②-①:应用盖斯定律进行简单计算,关键在于设计反应过程,同时注意:
⑴ 当反应式乘以或除以某数时,△H也应乘以或除以某数。
⑵ 反应式进行加减运算时,△H也同样要进行加减运算,且要带“+”、“-”符号,即把△H看作一个整体进行运算。
⑶ 通过盖斯定律计算比较反应热的大小时,同样要把△H看作一个整体。
⑷ 在设计的反应过程中常会遇到同一物质固、液、气三态的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
⑸ 当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。已知
① CO(g)+1/2O2(g)=CO2(g) ΔH1= -283.0 kJ/mol
② H2(g)+1/2O2(g)=H2O(l) ΔH2= -285.8 kJ/mol ③C2H5OH(l)+ 3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370 kJ/mol 试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH?【解】:根据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热效应都是相同的。下面就看看反应④能不能由①②③三个反应通过加减乘除组合而成,也就是说,看看反应④能不能分成①②③几步完成。
①×2 + ②×4 - ③ = ④ 所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3 ????? =-283.2 kJ/mol ×2 -285.8 kJ/mol ×4 +1370 kJ/mol
=-339.6kJ/mol 练习题型一:有关热化学反应方程式的的含义及书写
1. 已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
2、有关反应热的计算
(1)盖斯定律及其应用
(2) 根据一定量的物质参加反应放出的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。Q=n×△H
(3)利用键能计算反应热
题型二:燃烧热、中和热的判断、求算及测量二、反应的计算课本P12 例1:【解一】钠与氯气起反应的热化学方程式如下:Na(s) + 1/2Cl2(g)== NaCl (s) △H 则:△H=23g/mol×(-17.87kJ)÷ 1.0g
=-411kJ/mol注意热化学方程式正确书写,特别注意有关单位的正确书写。由:Q=n×△H
-17.87kJ = 1.0g /(23g/mol) ×△H课本P12 例1:【解二】设生成1molNaCl放热量为QNa(s) + 1/2Cl2(g)== NaCl (s)答:由钠和氯气反应生成1mol的反应热为-411kJ/mol23gQ1g17.87kJ则:Q=23g×17.87kJ÷ 1.0g
=411kJ1.已知: C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
H2(g)+1/2O2(g)=H2O(g) ΔH= -241.8 kJ/mol
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为
A. 2:3.25 B. 12:3.25
C. 1:1 D. 393.5:241.8B变式练习 2.已知胆矾溶于水时溶液温度降低,
胆矾分解的热化学方程式为:
CuSO4?5H2O(s)==CuSO4(s)+5H2O(l)
△H=+Q1kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液
时放热Q2kJ,则( )
A.Q1>Q2 B.Q1=Q2
C. Q1
设计合理的反应过程,注意反应热的正、负号!
盖斯定律的灵活应用变式练习 3 在 101 kPa时,1mol CH4 完全燃烧生成CO2和液态H2O,放出 890 kJ的热量,CH4 的燃烧热为多少? 1000 L CH4(标准状况)燃烧后所产生的热量为多少?【解】根据题意,在 101 kPa时,1mol CH4 完全燃烧的热化学方程式为:
CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH=-890 kJ/mol
即CH4 的燃烧热为 890 kJ/mol。
由:Q=n×△H
1000 L CH4 (标准状况)完全燃烧放出的热量为:
Q= V (CH4) / V m ×△H
=1000L / (22.4L·mol-1)×(—890 kJ/mol )
=44.6 mol×(-890 kJ/mol)=—3.97×104kJ
答:CH4的燃烧热为 890 kJ/mol,1000 L CH4(标准状况)完全燃烧产生的热量为3.97×104kJ。4? 葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:C6H12O6(s)+6O2(g)= 6CO2(g)+6H2O(l) ΔH=-2 800 kJ/mol 葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算 100 g葡萄糖在人体中完全氧化时所产生的热量。【解】?由:
Q=n×△H
= m(C6H12O6 )/M(C6H12O6 ) ×△H
=100g/180g·mol-1 ×(-2800 kJ/mol)
=-1560 kJ
答:100g葡萄糖在人体中完全氧化时产生1560 kJ的热量。已知:
2N2H4(g)+2NO2(g)= 3N2(g)+4H2O(l) △H=-1135.2kJ/mol
则16g肼完全反应放出的热量为: 。 巩固练习 1.1 g炭与适量水蒸气反应生成一氧化碳和氢气,需吸收10.94 kJ的热量,相应的热化学方程式为 ( )
A.C+H2O=CO+H2 ΔH=+10.9 kJ/ mol
B.C(s)+H2O(g)=CO(g)+H2(g)
ΔH=+10.94 kJ/ mol
C.C(s)+H2O(g)=CO(g)+H2(g)
ΔH=+131.28 kJ/ mol
D.1/2C(s)+ 1/2H2O(g)= 1/2CO(g)+ 1/2H2(g )
ΔH=+65.64 kJ/ mol
CD2.已知1mol白磷转化成1mol红磷,放出18.39 kJ热量,又知:P4(白,s)+5O2 = 2P2O5(s) ΔH1,4P(红,s)+5O2 = 2P2O5 (s)ΔH2
则ΔH1和ΔH2的关系正确的是( )
A.ΔH1>ΔH2 B.ΔH1<ΔH2
C.ΔH1=ΔH2 D.无法确定B3、 今有如下三个热化学方程式:
H2(g)+1/2O2(g)=H2O(g) ΔH=a kJ/ mol
H2(g)+1/2O2(g)=H2O(l) ΔH=b kJ/ mol
2H2(g)+ O2(g)=2H2O(l) ΔH=c kJ/ mol
关于它们的下列表述正确的是 ( )
A.它们都是吸热反应
B.a、b和c均为正值
C.a=b D.2b=cD4.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)=CO2(g) △H=-393.51kJ·mol-1
C(金刚石)+O2(g)=CO2(g) △H=-395.41kJ·mol-1
据此判断,下列说法中正确的是( )
A、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高A思考:为什么在热化学反应方程式中通常可不表明反应条件?正逆反应的反应热效应数值相等,符号相反。 “+”不能省去。5.已知石墨的燃烧热:△H=-393.5kJ/mol
(1)写出石墨的完全燃烧的热化学方程式
(2)二氧化碳转化为石墨和氧气的热化学方程式①C(石墨,s)+O2(g)=CO2(g) △H =-393.5kJ/mol
②CO2(g)=C(石墨,s)+O2(g) △H =+393.5kJ/mol盖斯定律:不管化学反应是一步完成或分几步完成,其反应热是相同.换句话说, 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关.
因为有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难.此时如果应用盖斯定律,就可以间接地把它们的反应热计算出来.
