2025版新教材高考化学第二轮复习专题练--专题七 化学反应的热效应(含答案)
文档属性
| 名称 | 2025版新教材高考化学第二轮复习专题练--专题七 化学反应的热效应(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-09 21:21:33 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025版新教材高考化学第二轮复习
专题七 化学反应的热效应
五年高考
考点1 化学反应中的能量变化
1.(2024广东,15,4分)对反应S(g) T(g)(I为中间产物),相同条件下:①加入催化剂,反应达到平衡所需时间大幅缩短;②提高反应温度,c平(S)/c平(T)增大,c平(S)/c平(I)减小。基于以上事实,可能的反应历程示意图(—为无催化剂, 为有催化剂)为 ( )
2.(2024安徽,10,3分)某温度下,在密闭容器中充入一定量的X(g),发生下列反应:X(g) Y(g)(ΔH1<0),Y(g) Z(g)(ΔH2<0),测得各气体浓度与反应时间的关系如图所示。下列反应进程示意图符合题意的是 ( )
3.(2023北京,13,3分)一种分解氯化铵实现产物分离的物质转化关系如下,其中b、d代表MgO或Mg(OH)Cl中的一种。下列说法正确的是 ( )
A.a、c分别是HCl、NH3
B.d既可以是MgO,也可以是Mg(OH)Cl
C.已知MgCl2为副产物,则通入水蒸气可减少MgCl2的产生
D.等压条件下,反应①、②的反应热之和,小于氯化铵直接分解的反应热
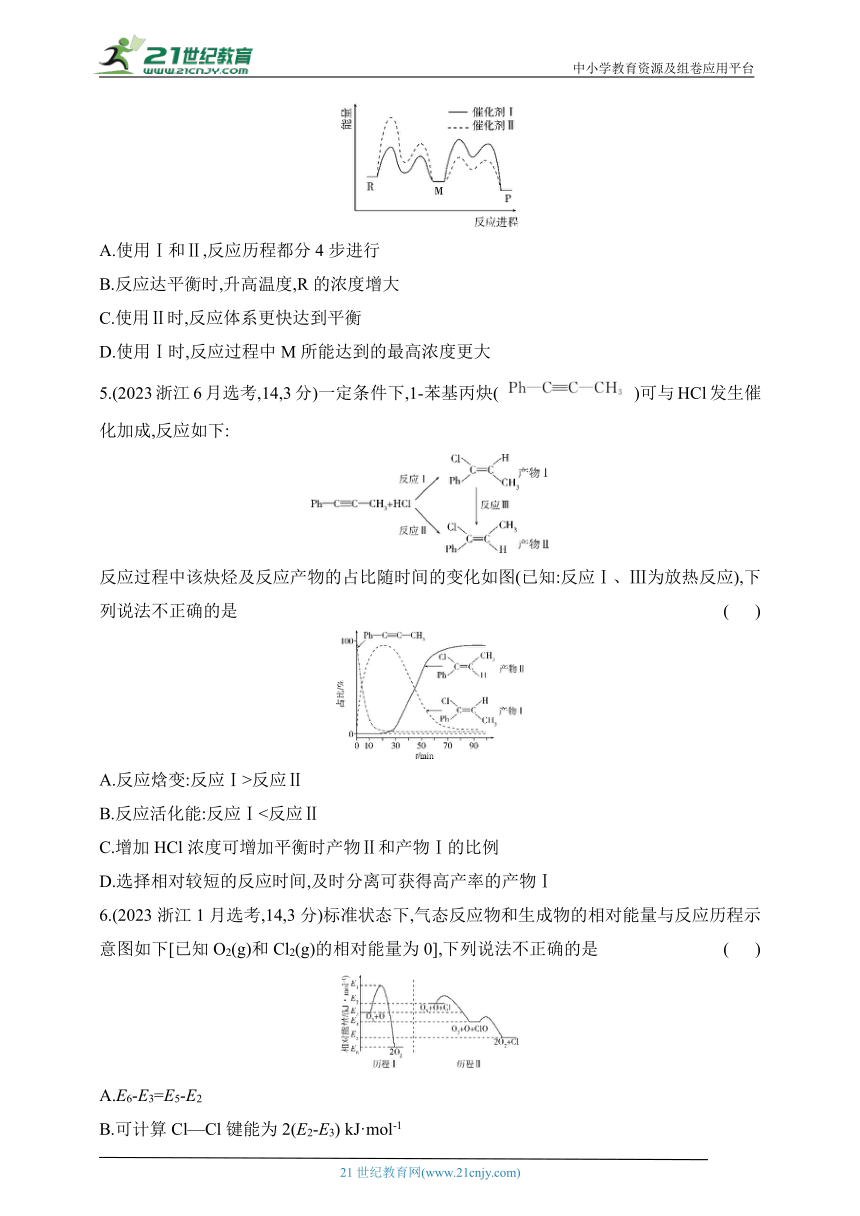
4.(2023广东,15,4分)催化剂Ⅰ和Ⅱ均能催化反应R(g) P(g)。反应历程(如图)中,M为中间产物。其他条件相同时,下列说法不正确的是 ( )
A.使用Ⅰ和Ⅱ,反应历程都分4步进行
B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡
D.使用Ⅰ时,反应过程中M所能达到的最高浓度更大
5.(2023浙江6月选考,14,3分)一定条件下,1-苯基丙炔()可与HCl发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应),下列说法不正确的是 ( )
A.反应焓变:反应Ⅰ>反应Ⅱ
B.反应活化能:反应Ⅰ<反应Ⅱ
C.增加HCl浓度可增加平衡时产物Ⅱ和产物Ⅰ的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
6.(2023浙江1月选考,14,3分)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是 ( )
A.E6-E3=E5-E2
B.可计算Cl—Cl键能为2(E2-E3) kJ·mol-1
C.相同条件下,O3的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:ClO(g)+O(g) O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1
7.(2021山东,14,4分)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为:
+OH- +CH3O-
能量变化如图所示。已知为快速平衡,下列说法正确的是 ( )
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在COH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
考点2 热化学方程式的书写 盖斯定律的应用
8.(2023海南,7,2分)各相关物质的燃烧热数据如下表。下列热化学方程式正确的是 ( )
物质 C2H6(g) C2H4(g) H2(g)
ΔH/(kJ· mol-1) -1 559.8 -1 411 -285.8
A.C2H4(g)+3O2(g) 2CO2(g)+2H2O(g) ΔH=-1 411 kJ·mol-1
B.C2H6(g) C2H4(g)+H2(g) ΔH=-137 kJ·mol-1
C.H2O(l) O2(g)+H2(g) ΔH=+285.8 kJ·mol-1
D.C2H6(g)+O2(g) 2CO2(g)+3H2O(l) ΔH=-1 559.8 kJ·mol-1
9.(2022重庆,13,3分)“千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究(NH4)2SO4的离子键强弱,设计如图所示的循环过程,可得ΔH4/(kJ·mol-1)为 ( )
A.+533 B.+686 C.+838 D.+1 143
10.(2021浙江1月选考,20,2分)已知共价键的键能与热化学方程式信息如下表:
共价键 H—H H—O
键能/(kJ·mol-1) 436 463
热化学方程式 2H2(g)+O2(g) 2H2O(g) ΔH=-482 kJ·mol-1
则2O(g) O2(g)的ΔH为 ( )
A.428 kJ·mol-1 B.-428 kJ·mol-1
C.498 kJ·mol-1 D.-498 kJ·mol-1
11.(2021北京,14,3分)丙烷经催化脱氢可制丙烯:C3H8 C3H6+H2。600 ℃,将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如图。
已知:①C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2 220 kJ·mol-1
②C3H6(g)+O2(g) 3CO2(g)+3H2O(l) ΔH=-2 058 kJ·mol-1
③H2(g)+O2(g) H2O(l) ΔH=-286 kJ·mol-1
下列说法不正确的是 ( )
A.C3H8(g) C3H6(g)+H2(g)
ΔH=+124 kJ·mol-1
B.c(H2)和c(C3H6)变化差异的原因:CO2+H2 CO+H2O
C.其他条件不变,投料比c(C3H8)/c(CO2)越大,C3H8转化率越大
D.若体系只有C3H6、CO、H2 和H2O生成,则初始物质浓度c0与流出物质浓度c之间一定存在:3c0(C3H8)+c0(CO2)=c(CO)+c(CO2)+3c(C3H8)+3c(C3H6)
12.(2023新课标,29,节选)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据图1数据计算反应N2(g)+H2(g) NH3(g)的ΔH= kJ·mol-1。
研究表明,合成氨反应在Fe催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的N2)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)
为 (填步骤前的标号),理由是 。
合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4。已知α-Fe属于立方晶系,晶胞参数a=287 pm,密度为7.8 g·cm-3。则α-Fe晶胞中含有Fe的原子数
为 (列出计算式,阿伏加德罗常数的值为NA)。
13.(2023广东,17,14分)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cρV总·ΔT计算获得。
(1)盐酸浓度的测定:移取20.00 mL待测液,加入指示剂,用0.500 0 mol·L-1 NaOH溶液滴定至终点,消耗NaOH溶液22.00 mL。
①上述滴定操作用到的仪器有 。
②该盐酸浓度为 mol·L-1。
(2)热量的测定:取上述NaOH溶液和盐酸各50 mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为 J(c和ρ分别取4.18 J·g-1·℃-1和1.0 g·mL-1,忽略水以外各物质吸收的热量,下同)。
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4(aq) FeSO4(aq)+Cu(s)的焓变ΔH(忽略温度对焓变的影响,下同)。实验结果见下表。
序号 反应试剂 体系温度/℃
反应前 反应后
ⅰ 0.20 mol·L-1 CuSO4溶液100 mL 1.20 g Fe粉 a b
ⅱ 0.56 g Fe粉 a c
①温度:b > c(填“>”“<”或“=”)。
②ΔH= (选择表中一组数据计算)。结果表明,该方法可行。
(4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+Fe2(SO4)3(aq) 3FeSO4(aq)的焓变。
查阅资料 配制Fe2(SO4)3溶液时需加入酸。加酸的目的是 。
提出猜想 Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想 用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和 (用离子方程式表示)。
实验小结 猜想成立,不能直接测反应A的焓变。
教师指导 鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计 乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为 。
(5)化学能可转化为热能,写出其在生产或生活中的一种应用 。
三年模拟
题型强化练
题型 反应历程图像分析
1.(2024甘肃兰州一模,11)乙烯在酸催化下水合制乙醇的反应机理、能量与反应进程的关系如下图所示。
下列叙述正确的是 ( )
A.第①、②、③步反应都是放热反应
B.第①步反应只断裂了化学键
C.总反应速率由第①步反应决定
D.中间体CH3CH2H2更稳定
2.(2024湖南怀化二模,9)一种利用H2和O2直接合成H2O2的反应历程如下图所示(NA为阿伏加德罗常数的值)。下列说法中错误的是(D)
A.总反应的原子利用率理论上可达100%
B.步骤2中,若1 mol O2完全反应,则理论上转移电子数目为2NA
C.降低了反应的活化能,加快了反应速率
D.和中Pd的化合价不相同
3.(2024山东德州三模,11)在浓硫酸作用下,苯与浓硝酸发生反应的反应历程如图所示。下列说法错误的是 ( )
A.生成中间体时碳的杂化方式未发生改变
B.生成中间体的反应为决速步骤
C.产物1为加成反应的产物
D.动力学和热力学优势产物均为产物2
4.(2024江西赣州一模,11)在催化剂CuMn2O4表面进行的NH3选择性催化还原NO的反应机理如下图所示(NH3吸附在催化剂表面可表示为*NH3,Ea表示活化能)。
下列有关说法正确的是 ( )
A.温度越高,反应速率越快
B.NH3比NO更易被催化剂CuMn2O4吸附
C.反应过程中有非极性键的断裂与极性键的形成
D.决定总反应速率的基元反应可表示为*NH3 *NH2+H
综合拔高练
建议用时:20分钟
1.(2024湖北武汉4月调研,8)晶格能是反映离子晶体稳定性的物理量,其定义为气态离子形成1 mol离子晶体释放的能量。TlF(s)生成TlF3(s)的Born-Haber循环如下图所示。
下列说法错误的是 ( )
A.离子晶体稳定性:TlFB.Tl的第三电离能为4 849 kJ·mol-1
C.断裂1 mol F—F键消耗158 kJ的能量
D.TlF(s)+F2(g) TlF3(s) ΔH=-297 kJ·mol-1
2.(2024江西九江十校第二次联考,14)已知反应2N2O(g) 2N2(g)+O2(g)的势能曲线示意图如下(…表示吸附作用,A表示催化剂,TS表示过渡态)。
下列有关说法正确的是 ( )
A.过程Ⅰ、Ⅱ、Ⅲ中都有N2生成
B.若在任意温度下均能自发进行,则反应为吸热反应
C.该反应中只有两种物质能够吸附N2O分子
D.过程Ⅲ中最大势能能垒为37.49 kcal·mol-1
3.(2024福建厦门二模,10)CH4干法重整中镍基催化剂活性会因积炭反应而降低,同时存在的消炭反应则使积炭量减少,其中涉及的相关数据如表。催化剂表面发生的不同积炭反应在不同温度下的质量增量如图。下列说法错误的是 ( )
基元反应 RhNi Rh6Ni
Ea正/kJ· mol-1 Ea逆/kJ· mol-1 Ea正/kJ· mol-1 Ea逆/kJ· mol-1
积炭:C* +C* 65.5 136.8 103.1 109.8
消炭:C* +O* CO* 139.7 326.6 117.5 51.0
吸附在催化剂表面上的物种用*标注
A.一氧化碳歧化反应是放热反应
B.甲烷裂解是镍基催化剂表面积碳的主要来源
C.C*+C* 的焓变为-71.3 kJ·mol-1
D.由上表判断,催化剂Rh6Ni劣于RhNi
4.(2024陕西西安一模,11)丙烯与HBr发生加成反应的机理及反应体系中的能量变化如图所示,下列说法错误的是 ( )
A.反应2放出热量更多
B.相同条件下反应2的速率比反应1大
C.对于反应1和反应2,第Ⅰ步都是反应的决速步骤
D.曲线a表示的是反应2的能量变化图
5.(2024福建福州4月末质检,7)实验室以苯甲醛为原料合成苯甲酸苯甲酯的反应机理如图(已知RO-极易结合H+转化为ROH)。下列说法正确的是 ( )
A.该反应的催化剂为苯甲醇,能降低反应的焓变
B.久置的苯甲醛中含有少量苯甲酸,能加快该历程反应速率
C.合成苯甲酸苯甲酯总反应方程式为2 +H2O
D.与酯化反应相比,该反应的原子利用率高
6.(2024天津和平一模,9)据文献报道,金红石Ti3+L3表面催化氮气固定机理如下图所示。下列叙述错误的是 ( )
A.催化剂可以提高固氮速率的原因是改变该反应的ΔH
B.该催化固氮总反应为3H2+N2 2NH3
C.[]是反应中间体
D.整个催化过程中存在N—Ti键的断裂和生成
7.(2024广东四校联考,19,节选)直接将CO2转化为有机物并非植物的“专利”,科学家通过多种途径实现了CO2合成甲醛,总反应为CO2(g)+2H2(g) HCHO(g)+H2O(g) ΔH。转化步骤如图所示:
(2)已知2H2(g)+O2(g) 2H2O(g) ΔH4,则总反应的ΔH= (用图中焓变以及ΔH4表示)。
8.(2024北京人大附中模拟,15,节选)(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
Ⅰ.
Ⅱ.N2(g)+O2(g)2NO(g) ΔH1
2CO(g)+O2(g) 2CO2(g) ΔH2=-565 kJ·mol-1
①ΔH1= 。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式: 。
专题七 化学反应的热效应
五年高考
考点1 化学反应中的能量变化
1.(2024广东,15,4分)对反应S(g) T(g)(I为中间产物),相同条件下:①加入催化剂,反应达到平衡所需时间大幅缩短;②提高反应温度,c平(S)/c平(T)增大,c平(S)/c平(I)减小。基于以上事实,可能的反应历程示意图(—为无催化剂, 为有催化剂)为 (A)
2.(2024安徽,10,3分)某温度下,在密闭容器中充入一定量的X(g),发生下列反应:X(g) Y(g)(ΔH1<0),Y(g) Z(g)(ΔH2<0),测得各气体浓度与反应时间的关系如图所示。下列反应进程示意图符合题意的是 (B)
3.(2023北京,13,3分)一种分解氯化铵实现产物分离的物质转化关系如下,其中b、d代表MgO或Mg(OH)Cl中的一种。下列说法正确的是 (C)
A.a、c分别是HCl、NH3
B.d既可以是MgO,也可以是Mg(OH)Cl
C.已知MgCl2为副产物,则通入水蒸气可减少MgCl2的产生
D.等压条件下,反应①、②的反应热之和,小于氯化铵直接分解的反应热
4.(2023广东,15,4分)催化剂Ⅰ和Ⅱ均能催化反应R(g) P(g)。反应历程(如图)中,M为中间产物。其他条件相同时,下列说法不正确的是 (C)
A.使用Ⅰ和Ⅱ,反应历程都分4步进行
B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡
D.使用Ⅰ时,反应过程中M所能达到的最高浓度更大
5.(2023浙江6月选考,14,3分)一定条件下,1-苯基丙炔()可与HCl发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应),下列说法不正确的是 (C)
A.反应焓变:反应Ⅰ>反应Ⅱ
B.反应活化能:反应Ⅰ<反应Ⅱ
C.增加HCl浓度可增加平衡时产物Ⅱ和产物Ⅰ的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
6.(2023浙江1月选考,14,3分)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是 (C)
A.E6-E3=E5-E2
B.可计算Cl—Cl键能为2(E2-E3) kJ·mol-1
C.相同条件下,O3的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:ClO(g)+O(g) O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1
7.(2021山东,14,4分)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为:
+OH- +CH3O-
能量变化如图所示。已知为快速平衡,下列说法正确的是 (B)
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在COH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
考点2 热化学方程式的书写 盖斯定律的应用
8.(2023海南,7,2分)各相关物质的燃烧热数据如下表。下列热化学方程式正确的是 (D)
物质 C2H6(g) C2H4(g) H2(g)
ΔH/(kJ· mol-1) -1 559.8 -1 411 -285.8
A.C2H4(g)+3O2(g) 2CO2(g)+2H2O(g) ΔH=-1 411 kJ·mol-1
B.C2H6(g) C2H4(g)+H2(g) ΔH=-137 kJ·mol-1
C.H2O(l) O2(g)+H2(g) ΔH=+285.8 kJ·mol-1
D.C2H6(g)+O2(g) 2CO2(g)+3H2O(l) ΔH=-1 559.8 kJ·mol-1
9.(2022重庆,13,3分)“千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究(NH4)2SO4的离子键强弱,设计如图所示的循环过程,可得ΔH4/(kJ·mol-1)为 (C)
A.+533 B.+686 C.+838 D.+1 143
10.(2021浙江1月选考,20,2分)已知共价键的键能与热化学方程式信息如下表:
共价键 H—H H—O
键能/(kJ·mol-1) 436 463
热化学方程式 2H2(g)+O2(g) 2H2O(g) ΔH=-482 kJ·mol-1
则2O(g) O2(g)的ΔH为 (D)
A.428 kJ·mol-1 B.-428 kJ·mol-1
C.498 kJ·mol-1 D.-498 kJ·mol-1
11.(2021北京,14,3分)丙烷经催化脱氢可制丙烯:C3H8 C3H6+H2。600 ℃,将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如图。
已知:①C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2 220 kJ·mol-1
②C3H6(g)+O2(g) 3CO2(g)+3H2O(l) ΔH=-2 058 kJ·mol-1
③H2(g)+O2(g) H2O(l) ΔH=-286 kJ·mol-1
下列说法不正确的是 (C)
A.C3H8(g) C3H6(g)+H2(g)
ΔH=+124 kJ·mol-1
B.c(H2)和c(C3H6)变化差异的原因:CO2+H2 CO+H2O
C.其他条件不变,投料比c(C3H8)/c(CO2)越大,C3H8转化率越大
D.若体系只有C3H6、CO、H2 和H2O生成,则初始物质浓度c0与流出物质浓度c之间一定存在:3c0(C3H8)+c0(CO2)=c(CO)+c(CO2)+3c(C3H8)+3c(C3H6)
12.(2023新课标,29,节选)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据图1数据计算反应N2(g)+H2(g) NH3(g)的ΔH= -45 kJ·mol-1。
(2)研究表明,合成氨反应在Fe催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的N2)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为 (ⅱ) (填步骤前的标号),理由是 N2分子中键能很高,解离为N原子所需能量最多 。
(3)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4。已知α-Fe属于立方晶系,晶胞参数a=287 pm,密度为7.8 g·cm-3。则α-Fe晶胞中含有Fe的原子数为 (列出计算式,阿伏加德罗常数的值为NA)。
13.(2023广东,17,14分)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cρV总·ΔT计算获得。
(1)盐酸浓度的测定:移取20.00 mL待测液,加入指示剂,用0.500 0 mol·L-1 NaOH溶液滴定至终点,消耗NaOH溶液22.00 mL。
①上述滴定操作用到的仪器有 AD 。
②该盐酸浓度为 0.550 0 mol·L-1。
(2)热量的测定:取上述NaOH溶液和盐酸各50 mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为 418(T1-T0) J(c和ρ分别取4.18 J·g-1·℃-1和1.0 g·mL-1,忽略水以外各物质吸收的热量,下同)。
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4(aq) FeSO4(aq)+Cu(s)的焓变ΔH(忽略温度对焓变的影响,下同)。实验结果见下表。
序号 反应试剂 体系温度/℃
反应前 反应后
ⅰ 0.20 mol·L-1 CuSO4溶液100 mL 1.20 g Fe粉 a b
ⅱ 0.56 g Fe粉 a c
①温度:b > c(填“>”“<”或“=”)。
②ΔH= -20.9(b-a)kJ·mol-1[或-41.8(c-a)kJ·mol-1] (选择表中一组数据计算)。结果表明,该方法可行。
(4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+Fe2(SO4)3(aq) 3FeSO4(aq)的焓变。
查阅资料 配制Fe2(SO4)3溶液时需加入酸。加酸的目的是 抑制Fe3+的水解 。
提出猜想 Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想 用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和 Fe+2H+ Fe2++H2↑ (用离子方程式表示)。
实验小结 猜想成立,不能直接测反应A的焓变。
教师指导 鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计 乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为 将一定量的Cu粉加入一定浓度的Fe2(SO4)3溶液中反应,测量反应的热量变化,计算得到反应Cu(s)+Fe2(SO4)3(aq) CuSO4(aq)+2FeSO4(aq)的焓变ΔH1;根据(3)中实验计算得到反应Fe(s)+CuSO4(aq) FeSO4(aq)+Cu(s)的焓变ΔH2;根据盖斯定律计算得到反应Fe(s)+Fe2(SO4)3(aq) 3FeSO4(aq)的焓变为ΔH1+ΔH2 。
(5)化学能可转化为热能,写出其在生产或生活中的一种应用 燃料燃烧、铝热反应焊接铁轨等 。
三年模拟
题型强化练
题型 反应历程图像分析
1.(2024甘肃兰州一模,11)乙烯在酸催化下水合制乙醇的反应机理、能量与反应进程的关系如下图所示。
下列叙述正确的是 (C)
A.第①、②、③步反应都是放热反应
B.第①步反应只断裂了化学键
C.总反应速率由第①步反应决定
D.中间体CH3CH2H2更稳定
2.(2024湖南怀化二模,9)一种利用H2和O2直接合成H2O2的反应历程如下图所示(NA为阿伏加德罗常数的值)。下列说法中错误的是(D)
A.总反应的原子利用率理论上可达100%
B.步骤2中,若1 mol O2完全反应,则理论上转移电子数目为2NA
C.降低了反应的活化能,加快了反应速率
D.和中Pd的化合价不相同
3.(2024山东德州三模,11)在浓硫酸作用下,苯与浓硝酸发生反应的反应历程如图所示。下列说法错误的是 (A)
A.生成中间体时碳的杂化方式未发生改变
B.生成中间体的反应为决速步骤
C.产物1为加成反应的产物
D.动力学和热力学优势产物均为产物2
4.(2024江西赣州一模,11)在催化剂CuMn2O4表面进行的NH3选择性催化还原NO的反应机理如下图所示(NH3吸附在催化剂表面可表示为*NH3,Ea表示活化能)。
下列有关说法正确的是 (D)
A.温度越高,反应速率越快
B.NH3比NO更易被催化剂CuMn2O4吸附
C.反应过程中有非极性键的断裂与极性键的形成
D.决定总反应速率的基元反应可表示为*NH3 *NH2+H
综合拔高练
建议用时:20分钟
1.(2024湖北武汉4月调研,8)晶格能是反映离子晶体稳定性的物理量,其定义为气态离子形成1 mol离子晶体释放的能量。TlF(s)生成TlF3(s)的Born-Haber循环如下图所示。
下列说法错误的是 (B)
A.离子晶体稳定性:TlFB.Tl的第三电离能为4 849 kJ·mol-1
C.断裂1 mol F—F键消耗158 kJ的能量
D.TlF(s)+F2(g) TlF3(s) ΔH=-297 kJ·mol-1
2.(2024江西九江十校第二次联考,14)已知反应2N2O(g) 2N2(g)+O2(g)的势能曲线示意图如下(…表示吸附作用,A表示催化剂,TS表示过渡态)。
下列有关说法正确的是 (A)
A.过程Ⅰ、Ⅱ、Ⅲ中都有N2生成
B.若在任意温度下均能自发进行,则反应为吸热反应
C.该反应中只有两种物质能够吸附N2O分子
D.过程Ⅲ中最大势能能垒为37.49 kcal·mol-1
3.(2024福建厦门二模,10)CH4干法重整中镍基催化剂活性会因积炭反应而降低,同时存在的消炭反应则使积炭量减少,其中涉及的相关数据如表。催化剂表面发生的不同积炭反应在不同温度下的质量增量如图。下列说法错误的是 (D)
基元反应 RhNi Rh6Ni
Ea正/kJ· mol-1 Ea逆/kJ· mol-1 Ea正/kJ· mol-1 Ea逆/kJ· mol-1
积炭:C* +C* 65.5 136.8 103.1 109.8
消炭:C* +O* CO* 139.7 326.6 117.5 51.0
吸附在催化剂表面上的物种用*标注
A.一氧化碳歧化反应是放热反应
B.甲烷裂解是镍基催化剂表面积碳的主要来源
C.C*+C* 的焓变为-71.3 kJ·mol-1
D.由上表判断,催化剂Rh6Ni劣于RhNi
4.(2024陕西西安一模,11)丙烯与HBr发生加成反应的机理及反应体系中的能量变化如图所示,下列说法错误的是 (D)
A.反应2放出热量更多
B.相同条件下反应2的速率比反应1大
C.对于反应1和反应2,第Ⅰ步都是反应的决速步骤
D.曲线a表示的是反应2的能量变化图
5.(2024福建福州4月末质检,7)实验室以苯甲醛为原料合成苯甲酸苯甲酯的反应机理如图(已知RO-极易结合H+转化为ROH)。下列说法正确的是 (D)
A.该反应的催化剂为苯甲醇,能降低反应的焓变
B.久置的苯甲醛中含有少量苯甲酸,能加快该历程反应速率
C.合成苯甲酸苯甲酯总反应方程式为2 +H2O
D.与酯化反应相比,该反应的原子利用率高
6.(2024天津和平一模,9)据文献报道,金红石Ti3+L3表面催化氮气固定机理如下图所示。下列叙述错误的是 (A)
A.催化剂可以提高固氮速率的原因是改变该反应的ΔH
B.该催化固氮总反应为3H2+N2 2NH3
C.[]是反应中间体
D.整个催化过程中存在N—Ti键的断裂和生成
7.(2024广东四校联考,19,节选)直接将CO2转化为有机物并非植物的“专利”,科学家通过多种途径实现了CO2合成甲醛,总反应为CO2(g)+2H2(g) HCHO(g)+H2O(g) ΔH。转化步骤如图所示:
(2)已知2H2(g)+O2(g) 2H2O(g) ΔH4,则总反应的ΔH= (2ΔH1+2ΔH2+ΔH3-ΔH4) (用图中焓变以及ΔH4表示)。
8.(2024北京人大附中模拟,15,节选)(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
Ⅰ.
Ⅱ.N2(g)+O2(g)2NO(g) ΔH1
2CO(g)+O2(g) 2CO2(g) ΔH2=-565 kJ·mol-1
①ΔH1= +183 kJ·mol-1 。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式: 2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=-748 kJ·mol-1 。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025版新教材高考化学第二轮复习
专题七 化学反应的热效应
五年高考
考点1 化学反应中的能量变化
1.(2024广东,15,4分)对反应S(g) T(g)(I为中间产物),相同条件下:①加入催化剂,反应达到平衡所需时间大幅缩短;②提高反应温度,c平(S)/c平(T)增大,c平(S)/c平(I)减小。基于以上事实,可能的反应历程示意图(—为无催化剂, 为有催化剂)为 ( )
2.(2024安徽,10,3分)某温度下,在密闭容器中充入一定量的X(g),发生下列反应:X(g) Y(g)(ΔH1<0),Y(g) Z(g)(ΔH2<0),测得各气体浓度与反应时间的关系如图所示。下列反应进程示意图符合题意的是 ( )
3.(2023北京,13,3分)一种分解氯化铵实现产物分离的物质转化关系如下,其中b、d代表MgO或Mg(OH)Cl中的一种。下列说法正确的是 ( )
A.a、c分别是HCl、NH3
B.d既可以是MgO,也可以是Mg(OH)Cl
C.已知MgCl2为副产物,则通入水蒸气可减少MgCl2的产生
D.等压条件下,反应①、②的反应热之和,小于氯化铵直接分解的反应热
4.(2023广东,15,4分)催化剂Ⅰ和Ⅱ均能催化反应R(g) P(g)。反应历程(如图)中,M为中间产物。其他条件相同时,下列说法不正确的是 ( )
A.使用Ⅰ和Ⅱ,反应历程都分4步进行
B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡
D.使用Ⅰ时,反应过程中M所能达到的最高浓度更大
5.(2023浙江6月选考,14,3分)一定条件下,1-苯基丙炔()可与HCl发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应),下列说法不正确的是 ( )
A.反应焓变:反应Ⅰ>反应Ⅱ
B.反应活化能:反应Ⅰ<反应Ⅱ
C.增加HCl浓度可增加平衡时产物Ⅱ和产物Ⅰ的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
6.(2023浙江1月选考,14,3分)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是 ( )
A.E6-E3=E5-E2
B.可计算Cl—Cl键能为2(E2-E3) kJ·mol-1
C.相同条件下,O3的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:ClO(g)+O(g) O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1
7.(2021山东,14,4分)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为:
+OH- +CH3O-
能量变化如图所示。已知为快速平衡,下列说法正确的是 ( )
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在COH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
考点2 热化学方程式的书写 盖斯定律的应用
8.(2023海南,7,2分)各相关物质的燃烧热数据如下表。下列热化学方程式正确的是 ( )
物质 C2H6(g) C2H4(g) H2(g)
ΔH/(kJ· mol-1) -1 559.8 -1 411 -285.8
A.C2H4(g)+3O2(g) 2CO2(g)+2H2O(g) ΔH=-1 411 kJ·mol-1
B.C2H6(g) C2H4(g)+H2(g) ΔH=-137 kJ·mol-1
C.H2O(l) O2(g)+H2(g) ΔH=+285.8 kJ·mol-1
D.C2H6(g)+O2(g) 2CO2(g)+3H2O(l) ΔH=-1 559.8 kJ·mol-1
9.(2022重庆,13,3分)“千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究(NH4)2SO4的离子键强弱,设计如图所示的循环过程,可得ΔH4/(kJ·mol-1)为 ( )
A.+533 B.+686 C.+838 D.+1 143
10.(2021浙江1月选考,20,2分)已知共价键的键能与热化学方程式信息如下表:
共价键 H—H H—O
键能/(kJ·mol-1) 436 463
热化学方程式 2H2(g)+O2(g) 2H2O(g) ΔH=-482 kJ·mol-1
则2O(g) O2(g)的ΔH为 ( )
A.428 kJ·mol-1 B.-428 kJ·mol-1
C.498 kJ·mol-1 D.-498 kJ·mol-1
11.(2021北京,14,3分)丙烷经催化脱氢可制丙烯:C3H8 C3H6+H2。600 ℃,将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如图。
已知:①C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2 220 kJ·mol-1
②C3H6(g)+O2(g) 3CO2(g)+3H2O(l) ΔH=-2 058 kJ·mol-1
③H2(g)+O2(g) H2O(l) ΔH=-286 kJ·mol-1
下列说法不正确的是 ( )
A.C3H8(g) C3H6(g)+H2(g)
ΔH=+124 kJ·mol-1
B.c(H2)和c(C3H6)变化差异的原因:CO2+H2 CO+H2O
C.其他条件不变,投料比c(C3H8)/c(CO2)越大,C3H8转化率越大
D.若体系只有C3H6、CO、H2 和H2O生成,则初始物质浓度c0与流出物质浓度c之间一定存在:3c0(C3H8)+c0(CO2)=c(CO)+c(CO2)+3c(C3H8)+3c(C3H6)
12.(2023新课标,29,节选)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据图1数据计算反应N2(g)+H2(g) NH3(g)的ΔH= kJ·mol-1。
研究表明,合成氨反应在Fe催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的N2)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)
为 (填步骤前的标号),理由是 。
合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4。已知α-Fe属于立方晶系,晶胞参数a=287 pm,密度为7.8 g·cm-3。则α-Fe晶胞中含有Fe的原子数
为 (列出计算式,阿伏加德罗常数的值为NA)。
13.(2023广东,17,14分)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cρV总·ΔT计算获得。
(1)盐酸浓度的测定:移取20.00 mL待测液,加入指示剂,用0.500 0 mol·L-1 NaOH溶液滴定至终点,消耗NaOH溶液22.00 mL。
①上述滴定操作用到的仪器有 。
②该盐酸浓度为 mol·L-1。
(2)热量的测定:取上述NaOH溶液和盐酸各50 mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为 J(c和ρ分别取4.18 J·g-1·℃-1和1.0 g·mL-1,忽略水以外各物质吸收的热量,下同)。
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4(aq) FeSO4(aq)+Cu(s)的焓变ΔH(忽略温度对焓变的影响,下同)。实验结果见下表。
序号 反应试剂 体系温度/℃
反应前 反应后
ⅰ 0.20 mol·L-1 CuSO4溶液100 mL 1.20 g Fe粉 a b
ⅱ 0.56 g Fe粉 a c
①温度:b > c(填“>”“<”或“=”)。
②ΔH= (选择表中一组数据计算)。结果表明,该方法可行。
(4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+Fe2(SO4)3(aq) 3FeSO4(aq)的焓变。
查阅资料 配制Fe2(SO4)3溶液时需加入酸。加酸的目的是 。
提出猜想 Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想 用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和 (用离子方程式表示)。
实验小结 猜想成立,不能直接测反应A的焓变。
教师指导 鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计 乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为 。
(5)化学能可转化为热能,写出其在生产或生活中的一种应用 。
三年模拟
题型强化练
题型 反应历程图像分析
1.(2024甘肃兰州一模,11)乙烯在酸催化下水合制乙醇的反应机理、能量与反应进程的关系如下图所示。
下列叙述正确的是 ( )
A.第①、②、③步反应都是放热反应
B.第①步反应只断裂了化学键
C.总反应速率由第①步反应决定
D.中间体CH3CH2H2更稳定
2.(2024湖南怀化二模,9)一种利用H2和O2直接合成H2O2的反应历程如下图所示(NA为阿伏加德罗常数的值)。下列说法中错误的是(D)
A.总反应的原子利用率理论上可达100%
B.步骤2中,若1 mol O2完全反应,则理论上转移电子数目为2NA
C.降低了反应的活化能,加快了反应速率
D.和中Pd的化合价不相同
3.(2024山东德州三模,11)在浓硫酸作用下,苯与浓硝酸发生反应的反应历程如图所示。下列说法错误的是 ( )
A.生成中间体时碳的杂化方式未发生改变
B.生成中间体的反应为决速步骤
C.产物1为加成反应的产物
D.动力学和热力学优势产物均为产物2
4.(2024江西赣州一模,11)在催化剂CuMn2O4表面进行的NH3选择性催化还原NO的反应机理如下图所示(NH3吸附在催化剂表面可表示为*NH3,Ea表示活化能)。
下列有关说法正确的是 ( )
A.温度越高,反应速率越快
B.NH3比NO更易被催化剂CuMn2O4吸附
C.反应过程中有非极性键的断裂与极性键的形成
D.决定总反应速率的基元反应可表示为*NH3 *NH2+H
综合拔高练
建议用时:20分钟
1.(2024湖北武汉4月调研,8)晶格能是反映离子晶体稳定性的物理量,其定义为气态离子形成1 mol离子晶体释放的能量。TlF(s)生成TlF3(s)的Born-Haber循环如下图所示。
下列说法错误的是 ( )
A.离子晶体稳定性:TlF
C.断裂1 mol F—F键消耗158 kJ的能量
D.TlF(s)+F2(g) TlF3(s) ΔH=-297 kJ·mol-1
2.(2024江西九江十校第二次联考,14)已知反应2N2O(g) 2N2(g)+O2(g)的势能曲线示意图如下(…表示吸附作用,A表示催化剂,TS表示过渡态)。
下列有关说法正确的是 ( )
A.过程Ⅰ、Ⅱ、Ⅲ中都有N2生成
B.若在任意温度下均能自发进行,则反应为吸热反应
C.该反应中只有两种物质能够吸附N2O分子
D.过程Ⅲ中最大势能能垒为37.49 kcal·mol-1
3.(2024福建厦门二模,10)CH4干法重整中镍基催化剂活性会因积炭反应而降低,同时存在的消炭反应则使积炭量减少,其中涉及的相关数据如表。催化剂表面发生的不同积炭反应在不同温度下的质量增量如图。下列说法错误的是 ( )
基元反应 RhNi Rh6Ni
Ea正/kJ· mol-1 Ea逆/kJ· mol-1 Ea正/kJ· mol-1 Ea逆/kJ· mol-1
积炭:C* +C* 65.5 136.8 103.1 109.8
消炭:C* +O* CO* 139.7 326.6 117.5 51.0
吸附在催化剂表面上的物种用*标注
A.一氧化碳歧化反应是放热反应
B.甲烷裂解是镍基催化剂表面积碳的主要来源
C.C*+C* 的焓变为-71.3 kJ·mol-1
D.由上表判断,催化剂Rh6Ni劣于RhNi
4.(2024陕西西安一模,11)丙烯与HBr发生加成反应的机理及反应体系中的能量变化如图所示,下列说法错误的是 ( )
A.反应2放出热量更多
B.相同条件下反应2的速率比反应1大
C.对于反应1和反应2,第Ⅰ步都是反应的决速步骤
D.曲线a表示的是反应2的能量变化图
5.(2024福建福州4月末质检,7)实验室以苯甲醛为原料合成苯甲酸苯甲酯的反应机理如图(已知RO-极易结合H+转化为ROH)。下列说法正确的是 ( )
A.该反应的催化剂为苯甲醇,能降低反应的焓变
B.久置的苯甲醛中含有少量苯甲酸,能加快该历程反应速率
C.合成苯甲酸苯甲酯总反应方程式为2 +H2O
D.与酯化反应相比,该反应的原子利用率高
6.(2024天津和平一模,9)据文献报道,金红石Ti3+L3表面催化氮气固定机理如下图所示。下列叙述错误的是 ( )
A.催化剂可以提高固氮速率的原因是改变该反应的ΔH
B.该催化固氮总反应为3H2+N2 2NH3
C.[]是反应中间体
D.整个催化过程中存在N—Ti键的断裂和生成
7.(2024广东四校联考,19,节选)直接将CO2转化为有机物并非植物的“专利”,科学家通过多种途径实现了CO2合成甲醛,总反应为CO2(g)+2H2(g) HCHO(g)+H2O(g) ΔH。转化步骤如图所示:
(2)已知2H2(g)+O2(g) 2H2O(g) ΔH4,则总反应的ΔH= (用图中焓变以及ΔH4表示)。
8.(2024北京人大附中模拟,15,节选)(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
Ⅰ.
Ⅱ.N2(g)+O2(g)2NO(g) ΔH1
2CO(g)+O2(g) 2CO2(g) ΔH2=-565 kJ·mol-1
①ΔH1= 。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式: 。
专题七 化学反应的热效应
五年高考
考点1 化学反应中的能量变化
1.(2024广东,15,4分)对反应S(g) T(g)(I为中间产物),相同条件下:①加入催化剂,反应达到平衡所需时间大幅缩短;②提高反应温度,c平(S)/c平(T)增大,c平(S)/c平(I)减小。基于以上事实,可能的反应历程示意图(—为无催化剂, 为有催化剂)为 (A)
2.(2024安徽,10,3分)某温度下,在密闭容器中充入一定量的X(g),发生下列反应:X(g) Y(g)(ΔH1<0),Y(g) Z(g)(ΔH2<0),测得各气体浓度与反应时间的关系如图所示。下列反应进程示意图符合题意的是 (B)
3.(2023北京,13,3分)一种分解氯化铵实现产物分离的物质转化关系如下,其中b、d代表MgO或Mg(OH)Cl中的一种。下列说法正确的是 (C)
A.a、c分别是HCl、NH3
B.d既可以是MgO,也可以是Mg(OH)Cl
C.已知MgCl2为副产物,则通入水蒸气可减少MgCl2的产生
D.等压条件下,反应①、②的反应热之和,小于氯化铵直接分解的反应热
4.(2023广东,15,4分)催化剂Ⅰ和Ⅱ均能催化反应R(g) P(g)。反应历程(如图)中,M为中间产物。其他条件相同时,下列说法不正确的是 (C)
A.使用Ⅰ和Ⅱ,反应历程都分4步进行
B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡
D.使用Ⅰ时,反应过程中M所能达到的最高浓度更大
5.(2023浙江6月选考,14,3分)一定条件下,1-苯基丙炔()可与HCl发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应),下列说法不正确的是 (C)
A.反应焓变:反应Ⅰ>反应Ⅱ
B.反应活化能:反应Ⅰ<反应Ⅱ
C.增加HCl浓度可增加平衡时产物Ⅱ和产物Ⅰ的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
6.(2023浙江1月选考,14,3分)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是 (C)
A.E6-E3=E5-E2
B.可计算Cl—Cl键能为2(E2-E3) kJ·mol-1
C.相同条件下,O3的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:ClO(g)+O(g) O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1
7.(2021山东,14,4分)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为:
+OH- +CH3O-
能量变化如图所示。已知为快速平衡,下列说法正确的是 (B)
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在COH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
考点2 热化学方程式的书写 盖斯定律的应用
8.(2023海南,7,2分)各相关物质的燃烧热数据如下表。下列热化学方程式正确的是 (D)
物质 C2H6(g) C2H4(g) H2(g)
ΔH/(kJ· mol-1) -1 559.8 -1 411 -285.8
A.C2H4(g)+3O2(g) 2CO2(g)+2H2O(g) ΔH=-1 411 kJ·mol-1
B.C2H6(g) C2H4(g)+H2(g) ΔH=-137 kJ·mol-1
C.H2O(l) O2(g)+H2(g) ΔH=+285.8 kJ·mol-1
D.C2H6(g)+O2(g) 2CO2(g)+3H2O(l) ΔH=-1 559.8 kJ·mol-1
9.(2022重庆,13,3分)“千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究(NH4)2SO4的离子键强弱,设计如图所示的循环过程,可得ΔH4/(kJ·mol-1)为 (C)
A.+533 B.+686 C.+838 D.+1 143
10.(2021浙江1月选考,20,2分)已知共价键的键能与热化学方程式信息如下表:
共价键 H—H H—O
键能/(kJ·mol-1) 436 463
热化学方程式 2H2(g)+O2(g) 2H2O(g) ΔH=-482 kJ·mol-1
则2O(g) O2(g)的ΔH为 (D)
A.428 kJ·mol-1 B.-428 kJ·mol-1
C.498 kJ·mol-1 D.-498 kJ·mol-1
11.(2021北京,14,3分)丙烷经催化脱氢可制丙烯:C3H8 C3H6+H2。600 ℃,将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如图。
已知:①C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2 220 kJ·mol-1
②C3H6(g)+O2(g) 3CO2(g)+3H2O(l) ΔH=-2 058 kJ·mol-1
③H2(g)+O2(g) H2O(l) ΔH=-286 kJ·mol-1
下列说法不正确的是 (C)
A.C3H8(g) C3H6(g)+H2(g)
ΔH=+124 kJ·mol-1
B.c(H2)和c(C3H6)变化差异的原因:CO2+H2 CO+H2O
C.其他条件不变,投料比c(C3H8)/c(CO2)越大,C3H8转化率越大
D.若体系只有C3H6、CO、H2 和H2O生成,则初始物质浓度c0与流出物质浓度c之间一定存在:3c0(C3H8)+c0(CO2)=c(CO)+c(CO2)+3c(C3H8)+3c(C3H6)
12.(2023新课标,29,节选)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据图1数据计算反应N2(g)+H2(g) NH3(g)的ΔH= -45 kJ·mol-1。
(2)研究表明,合成氨反应在Fe催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的N2)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为 (ⅱ) (填步骤前的标号),理由是 N2分子中键能很高,解离为N原子所需能量最多 。
(3)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4。已知α-Fe属于立方晶系,晶胞参数a=287 pm,密度为7.8 g·cm-3。则α-Fe晶胞中含有Fe的原子数为 (列出计算式,阿伏加德罗常数的值为NA)。
13.(2023广东,17,14分)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cρV总·ΔT计算获得。
(1)盐酸浓度的测定:移取20.00 mL待测液,加入指示剂,用0.500 0 mol·L-1 NaOH溶液滴定至终点,消耗NaOH溶液22.00 mL。
①上述滴定操作用到的仪器有 AD 。
②该盐酸浓度为 0.550 0 mol·L-1。
(2)热量的测定:取上述NaOH溶液和盐酸各50 mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为 418(T1-T0) J(c和ρ分别取4.18 J·g-1·℃-1和1.0 g·mL-1,忽略水以外各物质吸收的热量,下同)。
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4(aq) FeSO4(aq)+Cu(s)的焓变ΔH(忽略温度对焓变的影响,下同)。实验结果见下表。
序号 反应试剂 体系温度/℃
反应前 反应后
ⅰ 0.20 mol·L-1 CuSO4溶液100 mL 1.20 g Fe粉 a b
ⅱ 0.56 g Fe粉 a c
①温度:b > c(填“>”“<”或“=”)。
②ΔH= -20.9(b-a)kJ·mol-1[或-41.8(c-a)kJ·mol-1] (选择表中一组数据计算)。结果表明,该方法可行。
(4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+Fe2(SO4)3(aq) 3FeSO4(aq)的焓变。
查阅资料 配制Fe2(SO4)3溶液时需加入酸。加酸的目的是 抑制Fe3+的水解 。
提出猜想 Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想 用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和 Fe+2H+ Fe2++H2↑ (用离子方程式表示)。
实验小结 猜想成立,不能直接测反应A的焓变。
教师指导 鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计 乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为 将一定量的Cu粉加入一定浓度的Fe2(SO4)3溶液中反应,测量反应的热量变化,计算得到反应Cu(s)+Fe2(SO4)3(aq) CuSO4(aq)+2FeSO4(aq)的焓变ΔH1;根据(3)中实验计算得到反应Fe(s)+CuSO4(aq) FeSO4(aq)+Cu(s)的焓变ΔH2;根据盖斯定律计算得到反应Fe(s)+Fe2(SO4)3(aq) 3FeSO4(aq)的焓变为ΔH1+ΔH2 。
(5)化学能可转化为热能,写出其在生产或生活中的一种应用 燃料燃烧、铝热反应焊接铁轨等 。
三年模拟
题型强化练
题型 反应历程图像分析
1.(2024甘肃兰州一模,11)乙烯在酸催化下水合制乙醇的反应机理、能量与反应进程的关系如下图所示。
下列叙述正确的是 (C)
A.第①、②、③步反应都是放热反应
B.第①步反应只断裂了化学键
C.总反应速率由第①步反应决定
D.中间体CH3CH2H2更稳定
2.(2024湖南怀化二模,9)一种利用H2和O2直接合成H2O2的反应历程如下图所示(NA为阿伏加德罗常数的值)。下列说法中错误的是(D)
A.总反应的原子利用率理论上可达100%
B.步骤2中,若1 mol O2完全反应,则理论上转移电子数目为2NA
C.降低了反应的活化能,加快了反应速率
D.和中Pd的化合价不相同
3.(2024山东德州三模,11)在浓硫酸作用下,苯与浓硝酸发生反应的反应历程如图所示。下列说法错误的是 (A)
A.生成中间体时碳的杂化方式未发生改变
B.生成中间体的反应为决速步骤
C.产物1为加成反应的产物
D.动力学和热力学优势产物均为产物2
4.(2024江西赣州一模,11)在催化剂CuMn2O4表面进行的NH3选择性催化还原NO的反应机理如下图所示(NH3吸附在催化剂表面可表示为*NH3,Ea表示活化能)。
下列有关说法正确的是 (D)
A.温度越高,反应速率越快
B.NH3比NO更易被催化剂CuMn2O4吸附
C.反应过程中有非极性键的断裂与极性键的形成
D.决定总反应速率的基元反应可表示为*NH3 *NH2+H
综合拔高练
建议用时:20分钟
1.(2024湖北武汉4月调研,8)晶格能是反映离子晶体稳定性的物理量,其定义为气态离子形成1 mol离子晶体释放的能量。TlF(s)生成TlF3(s)的Born-Haber循环如下图所示。
下列说法错误的是 (B)
A.离子晶体稳定性:TlF
C.断裂1 mol F—F键消耗158 kJ的能量
D.TlF(s)+F2(g) TlF3(s) ΔH=-297 kJ·mol-1
2.(2024江西九江十校第二次联考,14)已知反应2N2O(g) 2N2(g)+O2(g)的势能曲线示意图如下(…表示吸附作用,A表示催化剂,TS表示过渡态)。
下列有关说法正确的是 (A)
A.过程Ⅰ、Ⅱ、Ⅲ中都有N2生成
B.若在任意温度下均能自发进行,则反应为吸热反应
C.该反应中只有两种物质能够吸附N2O分子
D.过程Ⅲ中最大势能能垒为37.49 kcal·mol-1
3.(2024福建厦门二模,10)CH4干法重整中镍基催化剂活性会因积炭反应而降低,同时存在的消炭反应则使积炭量减少,其中涉及的相关数据如表。催化剂表面发生的不同积炭反应在不同温度下的质量增量如图。下列说法错误的是 (D)
基元反应 RhNi Rh6Ni
Ea正/kJ· mol-1 Ea逆/kJ· mol-1 Ea正/kJ· mol-1 Ea逆/kJ· mol-1
积炭:C* +C* 65.5 136.8 103.1 109.8
消炭:C* +O* CO* 139.7 326.6 117.5 51.0
吸附在催化剂表面上的物种用*标注
A.一氧化碳歧化反应是放热反应
B.甲烷裂解是镍基催化剂表面积碳的主要来源
C.C*+C* 的焓变为-71.3 kJ·mol-1
D.由上表判断,催化剂Rh6Ni劣于RhNi
4.(2024陕西西安一模,11)丙烯与HBr发生加成反应的机理及反应体系中的能量变化如图所示,下列说法错误的是 (D)
A.反应2放出热量更多
B.相同条件下反应2的速率比反应1大
C.对于反应1和反应2,第Ⅰ步都是反应的决速步骤
D.曲线a表示的是反应2的能量变化图
5.(2024福建福州4月末质检,7)实验室以苯甲醛为原料合成苯甲酸苯甲酯的反应机理如图(已知RO-极易结合H+转化为ROH)。下列说法正确的是 (D)
A.该反应的催化剂为苯甲醇,能降低反应的焓变
B.久置的苯甲醛中含有少量苯甲酸,能加快该历程反应速率
C.合成苯甲酸苯甲酯总反应方程式为2 +H2O
D.与酯化反应相比,该反应的原子利用率高
6.(2024天津和平一模,9)据文献报道,金红石Ti3+L3表面催化氮气固定机理如下图所示。下列叙述错误的是 (A)
A.催化剂可以提高固氮速率的原因是改变该反应的ΔH
B.该催化固氮总反应为3H2+N2 2NH3
C.[]是反应中间体
D.整个催化过程中存在N—Ti键的断裂和生成
7.(2024广东四校联考,19,节选)直接将CO2转化为有机物并非植物的“专利”,科学家通过多种途径实现了CO2合成甲醛,总反应为CO2(g)+2H2(g) HCHO(g)+H2O(g) ΔH。转化步骤如图所示:
(2)已知2H2(g)+O2(g) 2H2O(g) ΔH4,则总反应的ΔH= (2ΔH1+2ΔH2+ΔH3-ΔH4) (用图中焓变以及ΔH4表示)。
8.(2024北京人大附中模拟,15,节选)(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
Ⅰ.
Ⅱ.N2(g)+O2(g)2NO(g) ΔH1
2CO(g)+O2(g) 2CO2(g) ΔH2=-565 kJ·mol-1
①ΔH1= +183 kJ·mol-1 。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式: 2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=-748 kJ·mol-1 。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
