2025版新教材高考化学第二轮复习专题练--专题十 弱电解质的电离平衡和溶液的酸碱性(含答案)
文档属性
| 名称 | 2025版新教材高考化学第二轮复习专题练--专题十 弱电解质的电离平衡和溶液的酸碱性(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-09 21:23:19 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025版新教材高考化学第二轮复习
专题十 弱电解质的电离平衡和溶液的酸碱性
五年高考
考点1 弱电解质的电离平衡
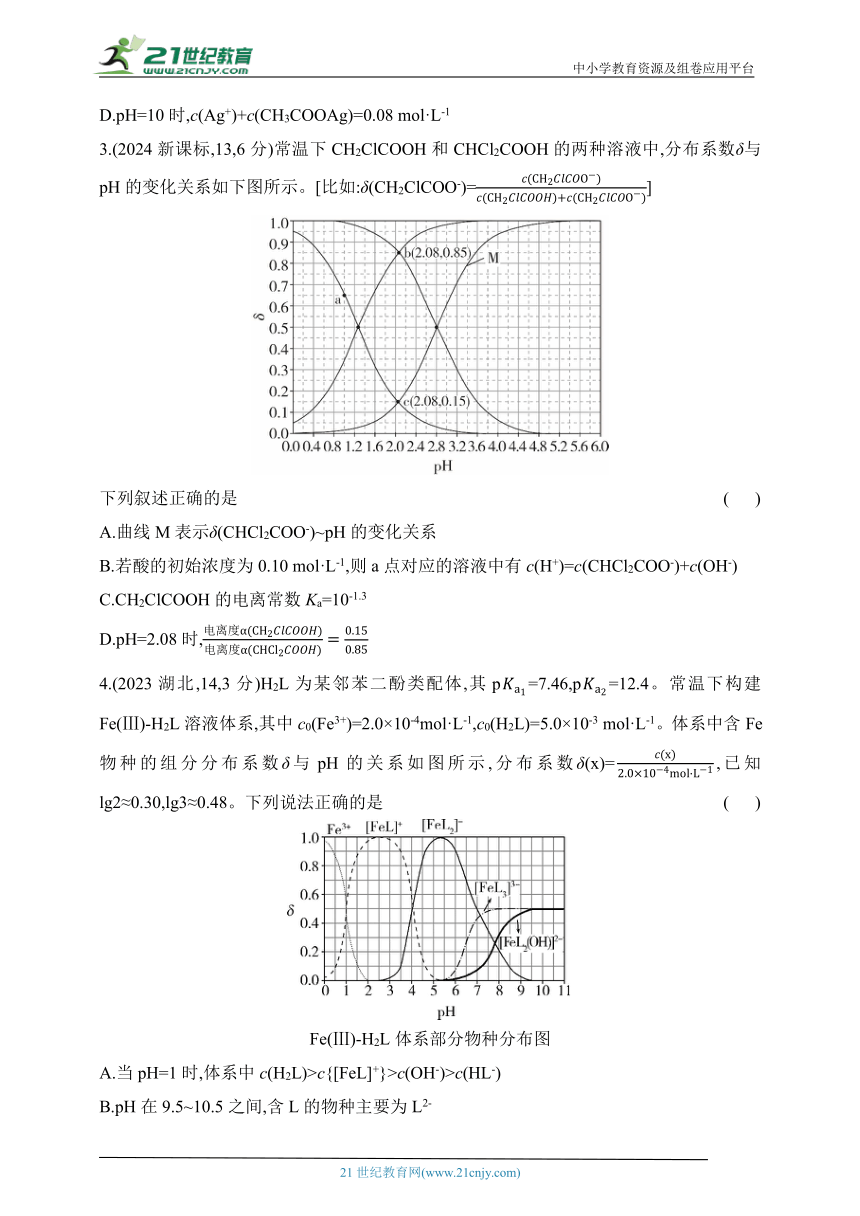
1.(2024贵州,12,3分)硼砂[Na2B4O5(OH)4·8H2O]水溶液常用于pH计的校准。硼砂水解生成等物质的量的B(OH)3(硼酸)和Na[B(OH)4](硼酸钠)。
已知:①25 ℃时,硼酸显酸性的原理
B(OH)3+2H2O H3O++
Ka=5.8×10-10;
②lg≈0.38。
下列说法正确的是 ( )
A.硼砂稀溶液中c(Na+)=c[B(OH)3]
B.硼酸水溶液中的H+主要来自水的电离
C.25 ℃时,0.01 mol·L-1硼酸水溶液的pH≈6.38
D.等浓度等体积的B(OH)3和Na[B(OH)4]溶液混合后,溶液显酸性
2.(2024山东,10,2分)常温下Ag(Ⅰ)-CH3COOH水溶液体系中存在反应:Ag++CH3COO- CH3COOAg(aq),平衡常数为K。已知初始浓度c0(Ag+)=c0(CH3COOH)=0.08 mol·L-1,所有含碳物种的摩尔分数与pH变化关系如图所示(忽略溶液体积变化)。
下列说法正确的是 ( )
A.线Ⅱ表示CH3COOH的变化情况
B.CH3COOH的电离平衡常数Ka=10-n
C.pH=n时,c(Ag+)= mol·L-1
D.pH=10时,c(Ag+)+c(CH3COOAg)=0.08 mol·L-1
3.(2024新课标,13,6分)常温下CH2ClCOOH和CHCl2COOH的两种溶液中,分布系数δ与pH的变化关系如下图所示。[比如:δ(CH2ClCOO-)=]
下列叙述正确的是 ( )
A.曲线M表示δ(CHCl2COO-)~pH的变化关系
B.若酸的初始浓度为0.10 mol·L-1,则a点对应的溶液中有c(H+)=c(CHCl2COO-)+c(OH-)
C.CH2ClCOOH的电离常数Ka=10-1.3
D.pH=2.08时,
4.(2023湖北,14,3分)H2L为某邻苯二酚类配体,其p=7.46,p=12.4。常温下构建Fe(Ⅲ)-H2L溶液体系,其中c0(Fe3+)=2.0×10-4mol·L-1,c0(H2L)=5.0×10-3 mol·L-1。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数δ(x)=,已知lg2≈0.30,lg3≈0.48。下列说法正确的是 ( )
Fe(Ⅲ)-H2L体系部分物种分布图
A.当pH=1时,体系中c(H2L)>c{[FeL]+}>c(OH-)>c(HL-)
B.pH在9.5~10.5之间,含L的物种主要为L2-
C.L2-+[FeL]+ [FeL2]-的平衡常数的lgK约为14
D.当pH=10时,参与配位的c(L2-)≈1.0×10-3 mol·L-1
5.(2022福建,5,4分)探究醋酸浓度与电离度(α)关系的步骤如下。与相关步骤对应的操作或叙述正确的是 ( )
步骤 操作或叙述
A Ⅰ.用NaOH标准溶液标定醋酸溶液浓度 滴定时应始终注视滴定管中的液面
B Ⅱ.用标定后的溶液配制不同浓度的醋酸溶液 应使用干燥的容量瓶
C Ⅲ.测定步骤Ⅱ中所得溶液的pH 应在相同温度下测定
D Ⅳ.计算不同浓度溶液中醋酸的电离度 计算式为 α=×100%
6.(2022浙江1月选考,17,2分)已知25 ℃时二元酸H2A的=1.3×10-7,=7.1×10-15。下列说法正确的是 ( )
A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者
B.向0.1 mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%
C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)
D.取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
7.(2021湖北,14,3分,改编)常温下,已知H3PO3溶液中含磷物种的浓度之和为0.1 mol·L-1,溶液中各含磷物种的pc-pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法正确的是 ( )
A.曲线①表示pc(H3PO3)随pOH的变化
B.H3PO3为三元酸且具有还原性
C.pH=4的溶液中:c(H2P)<0.1 mol·L-1-2c(HP)
D.H3PO3+HP的平衡常数K>1.0×105
8.(2021浙江6月选考,19,2分)某同学拟用pH计测定溶液pH以探究某酸HR是否为弱电解质。下列说法正确的是 ( )
A.25 ℃时,若测得0.01 mol·L-1 NaR溶液pH=7,则HR是弱酸
B.25 ℃时,若测得0.01 mol·L-1 HR溶液pH>2且pH<7,则HR是弱酸
C.25 ℃时,若测得HR溶液pH=a,取该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得pH=b,b-a<1,则HR是弱酸
D.25 ℃时,若测得NaR溶液pH=a,取该溶液10.0 mL,升温至50 ℃,测得pH=b,a>b,则HR是弱酸
9.(2020北京,11,3分)室温下,对于1 L 0.1 mol·L-1醋酸溶液,下列判断正确的是 ( )
A.该溶液中CH3COO-数目为6.02×1022
B.加入少量CH3COONa固体后,溶液的pH降低
C.滴加NaOH溶液过程中,n(CH3COO-)与n(CH3COOH)之和始终为0.1 mol
D.与Na2CO3溶液反应的离子方程式为C+2H+ H2O+CO2↑
10.(2022天津,16,14分)天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物Fe3+L(L为配体)溶于弱碱性的海水中,制成吸收液,将气体H2S转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①H2S的吸收氧化;②Fe3+L的再生。反应原理如下:
①H2S(g)+2Fe3+L(aq)+2OH-(aq) S(s)+2Fe2+L(aq)+2H2O(l) ΔH=-a kJ·mol-1(a>0)
②4Fe2+L(aq)+O2(g)+2H2O(l) 4Fe3+L(aq)+4OH-(aq) ΔH=-b kJ·mol-1(b>0)
回答下列问题:
(1)该工艺的总反应方程式为 。1 mol H2S(g)发生该反应的热量变化为 ,Fe3+L在总反应中的作用是 。
(2)研究不同配体与Fe3+所形成的配合物(A、B、C)对H2S吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入H2S,测得单位体积吸收液中H2S吸收转化率[α(H2S)]随时间变化的曲线如图1所示。以α(H2S)由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是 (填“A”“B”或“C”)。
图1
(3)H2S的电离方程式为 。25 ℃时,H2S溶液中H2S、HS-、S2-在含硫粒子总浓度中所占分数δ随溶液pH的变化关系如图2。由图2计算,H2S的= ,= 。再生反应在常温下进行,Fe2+L解离出的Fe2+易与溶液中的S2-形成沉淀。若溶液中的c(Fe2+)=1.0×10-5 mol·L-1,c(H2S)=6.0×10-9 mol·L-1,为避免有FeS沉淀生成,应控制溶液pH不大于 (已知25 ℃时,FeS的Ksp为6.0×10-18)。
图2
11.(2024广东,19,14分)酸在多种反应中具有广泛应用,其性能通常与酸的强度密切相关。
(1)酸催化下NaNO2与NH4Cl混合溶液的反应(反应a),可用于石油开采中油路解堵。
①基态N原子价层电子的轨道表示式为 。
②反应a:N(aq)+N(aq) N2(g)+2H2O(l)
已知:
则反应a的ΔH= 。
③某小组研究了3种酸对反应a的催化作用。在相同条件下,向反应体系中滴加等物质的量的少量酸,测得体系的温度T随时间t的变化如图。据图可知,在该过程中, 。
A.催化剂酸性增强,可增大反应焓变
B.催化剂酸性增强,有利于提高反应速率
C.催化剂分子中含H越多,越有利于加速反应
D.反应速率并不始终随着反应物浓度下降而减小
(2)在非水溶剂中,将CO2转化为化合物ⅱ(一种重要的电子化学品)的催化机理示意图如图所示,其中的催化剂有 和 。
(3)在非水溶剂中研究弱酸的电离平衡具有重要科学价值。一定温度下,某研究组通过分光光度法测定了两种一元弱酸HX(X为A或B)在某非水溶剂中的Ka。
a.选择合适的指示剂HIn,Ka(HIn)=3.6×10-20;其钾盐为KIn。
b.向KIn溶液中加入HX,发生反应:In-+HX X-+HIn。KIn起始的物质的量为n0(KIn),加入HX的物质的量为n(HX),平衡时,测得c平(In-)/c平(HIn)随n(HX)/n0(KIn)的变化曲线如图。
已知:该溶剂本身不电离,钾盐在该溶剂中完全电离。
①计算Ka(HA)(写出计算过程,结果保留两位有效数字)。
②在该溶剂中,Ka(HB) Ka(HA);Ka(HB) Ka(HIn)(填“>”“<”或“=”)。
考点2 溶液的酸碱性 酸碱中和滴定
12.(2024湖南,13,3分)常温下Ka(HCOOH)=1.8×10-4,向20 mL 0.10 mol·L-1 NaOH溶液中缓慢滴入相同浓度的HCOOH溶液,混合溶液中某两种离子的浓度随加入HCOOH溶液体积的变化关系如图所示,下列说法错误的是 ( )
A.水的电离程度:MB.M点:2c(OH-)=c(Na+)+c(H+)
C.当V(HCOOH)=10 mL时,c(OH-)=c(H+)+2c(HCOOH)+c(HCOO-)
D.N点:c(Na+)>c(HCOO-)>c(OH-)>c(H+)>c(HCOOH)
13.(2023湖南,12,3分)常温下,用浓度为0.020 0 mol·L-1的NaOH标准溶液滴定浓度均为0.020 0 mol·L-1的HCl和CH3COOH的混合溶液,滴定过程中溶液的pH随η[η=]的变化曲线如图所示。
下列说法错误的是 ( )
A.Ka(CH3COOH)约为10-4.76
B.点a:c(Na+)=c(Cl-)=c(CH3COO-)+c(CH3COOH)
C.点b:c(CH3COOH)D.水的电离程度:a14.(2022湖北,12,3分)根据酸碱质子理论,给出质子(H+)的物质是酸,给出质子的能力越强,酸性越强。已知:
N2+N2H4
N2H4+CH3COOH N2+CH3COO-
下列酸性强弱顺序正确的是 ( )
A.N2
B.N2
C.NH3>N2H4>CH3COO-
D.CH3COOH>N2
15.(2022山东,6,2分)实验室用基准Na2CO3配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定Na2CO3标准溶液。下列说法错误的是 ( )
A.可用量筒量取25.00 mL Na2CO3标准溶液置于锥形瓶中
B.应选用配有塑料塞的容量瓶配制Na2CO3标准溶液
C.应选用烧杯而非称量纸称量Na2CO3固体
D.达到滴定终点时溶液显橙色
16.(2022河北,9,3分)某水样中含一定浓度的C和其他不与酸碱反应的离子。取10.00 mL水样,用0.010 00 mol·L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。
下列说法正确的是 ( )
A.该水样中c(C)=0.01 mol·L-1
B.a点处c(H2CO3)+c(H+)=c(OH-)
C.当V(HCl)≤20.00 mL时,溶液中c(HC)基本保持不变
D.曲线上任意一点存在c(C)+c(HC)+c(H2CO3)=0.03 mol·L-1
17.(2021浙江1月选考,17,2分)25 ℃时,下列说法正确的是 ( )
A.NaHA溶液呈酸性,可以推测H2A为强酸
B.可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐
C.0.010 mol·L-1、0.10 mol·L-1的醋酸溶液的电离度分别为α1、α2,则α1<α2
D.100 mL pH=10.00的Na2CO3溶液中水电离出H+的物质的量为1.0×10-5 mol
三年模拟
题型强化练
题型 中和滴定原理的迁移应用
1.(2024湖南长郡中学期末适应考,12)莫尔法测定生理盐水浓度的过程如下:移取10.00 mL稀释后的生理盐水置于250 mL锥形瓶中,加入3滴K2CrO4溶液作指示剂,用0.100 0 mol·L-1 AgNO3标准溶液滴定至终点。重复3次,消耗标准溶液的体积平均为V mL,然后计算出NaCl的浓度。已知:Ksp(AgCl)=1.77×10―10;Ksp(Ag2CrO4)=1.12×10-12;Ag2CrO4为砖红色沉淀。下列关于本实验的说法正确的是 ( )
A.可用酸式滴定管盛装AgNO3标准溶液
B.该稀释后的生理盐水浓度为0.1V mol·L-1
C.实验中若用生理盐水润洗锥形瓶将导致测定结果偏低
D.在相同浓度的KCl和K2CrO4混合溶液中滴入AgNO3溶液,先出现砖红色沉淀
2.(2024福建厦门双十中学模拟,10)电位滴定是利用溶液电位突变指示终点的滴定法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。常温下,用x mol·L-1盐酸标准溶液测定y mL某Na2CO3样品溶液中NaHCO3的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说法正确的是( )
(注:—表示电极电位曲线图; 表示电极电压曲线图)
A.该滴定过程需要加入酸碱指示剂
B.a点溶液中:c(OH-)+2c(C)=c(H+)+c(H2CO3)
C.b到c过程中存在c(Na+)>c(Cl-),水的电离程度:bD.y mL该Na2CO3样品溶液中含有NaHCO3的质量为0.084x g
3.(2024北京西城一模,14)利用碘量法测定某纯净水样中溶解O2的含量,实验如下(加入的试剂已除去O2)。
步骤1 水样中O2的固定:用250 mL的水瓶盛满水样,加入1.0 mL 2 mol/L MnSO4溶液,再加入含9 mol/L NaOH溶液和1.8 mol/L KI溶液的混合液2.0 mL,部分水样溢出,立即盖好瓶盖,翻转摇匀,生成白色沉淀Mn(OH)2,随即有棕色沉淀MnO(OH)2生成。
步骤2 生成I2:当水样中的沉淀沉降到距瓶口三分之一以下时,缓缓加入适量稀H2SO4至液面下,部分溶液溢出,立即盖好瓶盖,翻转摇动,至沉淀完全溶解,得到黄色溶液。
步骤3 测定及计算:用碘量法测出步骤2中生成的I2为b mol,进而计算出该纯净水样中溶解O2的含量。
已知:O2直接氧化I-的反应速率很慢。
下列说法不正确的是 ( )
A.步骤1中,用注射器加入试剂时应将细长针头插到液面下一定距离
B.步骤2中,生成I2的反应:MnO(OH)2+4H++2I- Mn2++I2+3H2O
C.步骤2中,部分溶液溢出不影响测定该纯净水样中溶解O2的含量
D.步骤3中,经计算,该纯净水样中含有O2的浓度为 g/L
4.(2024河北唐山一模,15,节选)已知三氯化六氨合钴[Co(NH3)6]Cl3为橙黄色晶体,易溶于热水,在冷水中微溶,可在氯化铵和氨水的混合溶液中、在活性炭作催化剂条件下,利用H2O2溶液氧化CoCl2制备。
Ⅱ.测定产品纯度,实验如下:
①称取a g产品溶于足量稀硝酸中,并用蒸馏水稀释,置于锥形瓶中,加入过量V1 mL c1 mol·L-1 AgNO3溶液,并加3 mL的硝基苯用力振荡。
②向锥形瓶中滴入3滴Fe(NO3)3溶液为指示剂,用c2 mol·L-1 KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时用去V2 mL KSCN溶液。[已知:Ksp(AgCl)=1.8×10-10,Ksp(AgSCN)=1.0×10-12]
回答下列问题:
(1)产品的质量分数为 。(列出计算式)
(2)加入硝基苯的目的是 。
5.(2024湖南雅礼中学第八次月考,16,节选)高纯二氧化锗的含量采用碘酸钾滴定法进行测定。称取a g高纯二氧化锗样品,加入氢氧化钠溶液在电炉中溶解,冷却至20 ℃以下,然后用次磷酸与过量氢氧化钠溶液反应得到的次磷酸钠(NaH2PO2)将其还原为Ge2+,以淀粉为指示剂,用b mol/L的碘酸钾标准溶液滴定,消耗碘酸钾标准溶液的体积为V mL。(20 ℃以下,次磷酸钠不会被碘酸钾和碘氧化)
资料:3Ge2++I+5I-+6H+ 3I2+3H2O。
①次磷酸钠(NaH2PO2)为 (填“正盐”或“酸式盐”)。
②上述滴定终点的判断方法为 。
③此样品中二氧化锗的质量分数是 (用表达式表示)。
6.(2024陕西西安一中二模,26,节选)(6)用Na2H2Y溶液测定饮用水的总硬度。取饮用水样品250 mL,加入掩蔽剂排除干扰,调节pH等预处理后,用0.010 0 mol·L-1 Na2H2Y标准溶液进行测定。测定中涉及的反应有:M2++HIn2-(蓝色) MIn-(酒红色)+H+、MIn-(酒红色)+H2Y2- MY2-+HIn2-(蓝色)+H+、M2++H2Y2- MY2-+2H+[M2+代表Mg2+、Ca2+;铬黑T(HIn2-)为指示剂]。
①达到滴定终点的现象是 。
②平行实验三次,滴定终点时共消耗Na2H2Y溶液的平均体积为20.00 mL,则该饮用水的硬
度= 度(水硬度的表示方法是将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1 L水中含有10 mg CaO称为1度)。
综合拔高练
建议用时:45分钟
1.(2024湖北4月调研,12)已知溶剂分子结合H+的能力会影响酸给出H+的能力,某温度下部分酸在冰醋酸中的pKa如下表所示。下列说法错误的是 ( )
分子式 HClO4 H2SO4 HCl HNO3
pKa=-lgKa 4.87 7.24(一级) 8.9 9.4
A.HClO4在冰醋酸中的电离方程式:HClO4+CH3COOH Cl
B.在冰醋酸中酸性:HClO4>H2SO4>HCl>HNO3
C.结合H+的能力:H2O>CH3COOH
D.相同温度下醋酸在液氨中的pKa大于其在水中的pKa
2.(2024江苏苏锡常镇四市二模,12)实验室用如下方案测定Na2CO3和NaHCO3混合物的组成:称取一定质量样品溶解于锥形瓶中,加入2滴指示剂M,用标准盐酸滴定至终点时消耗盐酸V1 mL;向锥形瓶中再加入2滴指示剂N,继续用标准盐酸滴定至终点,又消耗盐酸V2 mL。下列说法正确的是 ( )
A.指示剂M、N可依次选用甲基橙、酚酞
B.样品溶解后的溶液中:2c(Na+)=3c(C)+3c(HC)+3c(H2CO3)
C.滴定至第一次终点时的溶液中:c(H+)+c(Na+)=c(OH-)+c(HC)+2c(C)
D.样品中Na2CO3和NaHCO3物质的量之比为
3.(2024安徽江淮十校第三次联考,15)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验。
实验Ⅰ:往20 mL 0.1 mol/L NaHC2O4溶液中滴加0.1 mol/L NaOH溶液。
实验Ⅱ:往20 mL 0.1 mol/L NaHC2O4溶液中滴加0.1 mol/L CaCl2溶液。
已知:H2C2O4的电离常数=5.4×10-2,=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计。下列说法错误的是 ( )
A.实验Ⅰ可选用酚酞作指示剂,指示反应终点
B.实验Ⅰ中V(NaOH)=10 mL时,溶液显酸性
C.实验Ⅱ中在初始阶段发生的反应是2HC2+Ca2+ CaC2O4↓+H2C2O4
D.实验Ⅱ中V(CaCl2)=80 mL时,溶液中c(C2)=4.0×10-7 mol/L
4.(2024江西赣州二模,14)赣南脐橙富含柠檬酸(用H3R表示)。常温下,用0.1 mol·L-1 NaOH溶液滴定20.00 mL 0.1 mol·L-1 H3R溶液,滴定曲线如图所示。下列说法正确的是 ( )
(已知:常温下柠檬酸的电离常数:=1.0×10-3.1,=1.0×10-4.8,=1.0×10-6.4)
A.a点溶液中:c(H3R)+c(H+)=c(HR2-)+2c(R3-)+c(OH-)
B.反应H3R+HR2- 2H2R-的平衡常数K=10-1.7
C.b点溶液中,c(Na+)>c(HR2-)>c(H2R-)>c(R3-)
D.常温下,Na2HR溶液加水稀释过程中,增大
5.(2024吉林白山一模,15)常温下,向20 mL 0.2 mol·L-1一元弱碱ROH溶液中逐滴加入0.1 mol·L-1盐酸,溶液的M值[M=lg]随加入盐酸体积的变化曲线如图所示。已知a点溶液pH=9.8。下列说法中错误的是 ( )
A.Kb(ROH)=1×10-4.2
B.b点时,c(R+)>c(Cl-)>c(ROH)>c(OH-)>c(H+)
C.c点时,c(Cl-)=c(R+)+c(ROH)
D.a、b、c、d四点中,水的电离程度最小的是d点
6.(2024九省联考江西卷,12)马来酸依那普利(记为X,摩尔质量为M g/mol)是一种心血管疾病防治药物,结构如下所示:
通常使用以下两种方法滴定分析样品中X的质量分数w:
方法一:将m g样品溶于有机溶剂中,以c1 mol/L的HClO4溶液滴定,终点消耗V1 mL HClO4溶液,计量关系为n(X)∶n(HClO4)=1∶1;
方法二:将m g样品溶于水中,以c2 mol/L的NaOH溶液滴定,终点消耗V2 mL NaOH溶液,计量关系为n(X)∶n(NaOH)=1∶3。
下列说法正确的是 ( )
A.方法一滴定终点时,pH=7
B.方法一w=×100%
C.方法二滴定终点时,pH=7
D.方法二w=×100%
7.(2024山东济宁一模)阅读下列材料,回答(1)~(2)题。
氧泡泡是一种多功能新型漂白剂,其有效成分是过碳酸钠(xNa2CO3·yH2O2)。
Ⅰ.以芒硝(Na2SO4·10H2O)、H2O2等为原料制备过碳酸钠的工艺流程如图所示:
Ⅱ.测定过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
①用电子天平称取两份质量均为m g的样品。
②将一份置于锥形瓶中,加水溶解,加催化剂使H2O2充分快速分解(催化剂不参与其他反应),然后加酚酞作指示剂,用0.050 0 mol·L-1 H2SO4溶液滴定至终点,消耗硫酸V1 mL。
③将另一份置于碘量瓶中,加入50 mL蒸馏水,并立即加入6 mL 2.0 mol·L-1 H3PO4溶液,再加入过量KI固体,摇匀后于暗处放置10 min,加入适量指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V2 mL。(已知:2Na2S2O3+I2 Na2S4O6+2NaI)
(1)关于过碳酸钠制备的流程,下列说法错误的是 ( )
A.步骤1中2 mol芒硝参与反应时,消耗1 mol Na2Cr2O7
B.滤渣的主要成分为CaSO4
C.步骤2的化学方程式为2Na2CrO4+2CO2+H2O Na2Cr2O7+2NaHCO3↓
D.稳定剂的作用是阻止微量杂质金属离子的催化作用,减少H2O2的分解
(2)测定过碳酸钠化学式的步骤中,下列说法错误的是 ( )
A.步骤③样品溶于水酸化后放置一段时间,然后再加入过量KI固体,导致x∶y偏大
B.该过碳酸钠样品中x∶y=V1∶V2
C.该样品的纯度为%
D.步骤②中滴定前滴定管尖嘴处有气泡,滴定后无气泡,导致x∶y偏大
8.(2024福建泉州一模,10)硼酸(H3BO3)在水溶液中存在电离平衡:H3BO3+H2O [B(OH)4]-+H+ K=10-9.34。用0.01 mol/L NaOH溶液分别滴定体积均为20 mL的0.01 mol/L硼酸溶液、0.01 mol/L硼酸和甘露醇混合溶液,滴定过程中硼酸溶液pH、混合溶液的随加入的NaOH溶液体积的变化如图。
已知:+2 +4H2O
下列说法错误的是 ( )
A.加入甘露醇促进硼酸电离平衡正向移动
B.溶液中c(H+):M点>N点
C.P点:c(H3BO3)=c{[B(OH)4]-}>c(OH-)>c(H+)
D.W点:c(Na+)+c(H+)+c(H3BO3)-c(OH-)=0.01 mol/L
9.(2024安徽安庆二模,12)某温度下,改变0.1 mol/L K2Cr2O7溶液的pH,各种含铬元素粒子的浓度变化如图所示(已知H2CrO4是二元弱酸,其电离常数为)。下列有关说法错误的是 ( )
A.该温度下的KW=1×10-14
B.该温度下(H2CrO4)的数量级为10-1
C.该温度下反应Cr2+2H+的平衡常数为5.1×10-15.2
D.B点溶液中:c(K+)≤2c(Cr2)+3c(Cr)
10.(2024广东湛江一模,17)Na2S2O3标准溶液是氧化还原反应中常用的还原性标定试剂,但配制时使用的Na2S2O3·5H2O固体中通常含有一些杂质,且易风化和潮解。Na2S2O3溶液也容易被O2氧化。因此在实际操作中,Na2S2O3标准溶液配制好后常用K2Cr2O7进行标定。但又由于K2Cr2O7与Na2S2O3反应的产物有很多种,不能按确定的反应式进行,故无法通过氧化还原滴定法确定浓度。操作中一般先用K2Cr2O7与过量的KI反应,定量生成的I2再用Na2S2O3滴定,发生反应的离子方程式为Cr2。我们将这种Na2S2O3与I2联用的方法称为碘量法,碘量法是分析化学中常用的分析方法,常用于一些无法直接滴定的反应的物质的间接滴定。
已知:K2Cr2O7与KI的反应需要一定的时间才能进行得比较完全,故需放置约5 min。
(1)Na2S2O3标准溶液的配制。
①配制480 mL 0.1 mol/L的Na2S2O3标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、 。
②将下述实验步骤A到F按实验过程先后次序排列 。
(2)Na2S2O3标准溶液的标定:取20.00 mL 0.017 mol/L K2Cr2O7溶液于250 mL锥形瓶中,加入5 mL 6 mol/L HCl溶液,再加入10 mL 100 g/L KI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用Na2S2O3溶液滴定至浅黄色后加入2 mL淀粉指示剂,继续滴定至终点,平行测定3次,计算Na2S2O3标准溶液的浓度。
①用 量取20.00 mL 0.017 mol/L K2Cr2O7溶液。
②加入KI摇匀后用牛皮纸扎紧瓶口的目的是 。
③如何判定滴定结束 。
④列式并计算Na2S2O3标准溶液的浓度。
K2Cr2O7溶液 KI溶液 V(Na2S2O3)/mL c(Na2S2O3)/(mol/L)
20.00 mL 0.017 mol/L 10 mL 100 g/L 20.35
20.45
20.40
21.20
(3)借鉴(2)的方法,用碘量法测定KMnO4溶液的物质的量浓度:量取25.00 mL待测液于250 mL锥形瓶中,加入2 mol/L H2SO4溶液25 mL,再加入10% KI溶液10 mL,然后用已知浓度的Na2S2O3溶液滴定到淡黄色,加0.5%的淀粉溶液3 mL,用Na2S2O3溶液继续滴定至终点。
①滴定时需加入硫酸。能否用盐酸代替硫酸,为什么 。
②写出KMnO4溶液与KI反应的离子方程式: 。
(4)借鉴(3)的方法,某小组用碘量法测量磷酸铁锂溶液中Fe3+的物质的量浓度。
提出问题:Fe3+与I-是可逆反应,Fe3+的存在是否会影响滴定
实验验证:①在磷酸铁锂溶液中加入过量的KI,静置一段时间后,加入KSCN,观察到溶液颜色变红;请写出Fe3+与I-反应的离子方程式: 。
②取标准量的磷酸铁锂溶液,分成两组,其中一组加入过量的KI溶液,另一组加入等量的水。再分别使用Na2S2O3溶液进行标定,发现消耗的Na2S2O3溶液体积相同。
实验小结:Fe3+ 滴定(填“影响”或“不影响”)。
专题十 弱电解质的电离平衡和溶液的酸碱性
五年高考
考点1 弱电解质的电离平衡
1.(2024贵州,12,3分)硼砂[Na2B4O5(OH)4·8H2O]水溶液常用于pH计的校准。硼砂水解生成等物质的量的B(OH)3(硼酸)和Na[B(OH)4](硼酸钠)。
已知:①25 ℃时,硼酸显酸性的原理
B(OH)3+2H2O H3O++
Ka=5.8×10-10;
②lg≈0.38。
下列说法正确的是 (B)
A.硼砂稀溶液中c(Na+)=c[B(OH)3]
B.硼酸水溶液中的H+主要来自水的电离
C.25 ℃时,0.01 mol·L-1硼酸水溶液的pH≈6.38
D.等浓度等体积的B(OH)3和Na[B(OH)4]溶液混合后,溶液显酸性
2.(2024山东,10,2分)常温下Ag(Ⅰ)-CH3COOH水溶液体系中存在反应:Ag++CH3COO- CH3COOAg(aq),平衡常数为K。已知初始浓度c0(Ag+)=c0(CH3COOH)=0.08 mol·L-1,所有含碳物种的摩尔分数与pH变化关系如图所示(忽略溶液体积变化)。
下列说法正确的是 (C)
A.线Ⅱ表示CH3COOH的变化情况
B.CH3COOH的电离平衡常数Ka=10-n
C.pH=n时,c(Ag+)= mol·L-1
D.pH=10时,c(Ag+)+c(CH3COOAg)=0.08 mol·L-1
3.(2024新课标,13,6分)常温下CH2ClCOOH和CHCl2COOH的两种溶液中,分布系数δ与pH的变化关系如下图所示。[比如:δ(CH2ClCOO-)=]
下列叙述正确的是 (D)
A.曲线M表示δ(CHCl2COO-)~pH的变化关系
B.若酸的初始浓度为0.10 mol·L-1,则a点对应的溶液中有c(H+)=c(CHCl2COO-)+c(OH-)
C.CH2ClCOOH的电离常数Ka=10-1.3
D.pH=2.08时,
4.(2023湖北,14,3分)H2L为某邻苯二酚类配体,其p=7.46,p=12.4。常温下构建Fe(Ⅲ)-H2L溶液体系,其中c0(Fe3+)=2.0×10-4mol·L-1,c0(H2L)=5.0×10-3 mol·L-1。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数δ(x)=,已知lg2≈0.30,lg3≈0.48。下列说法正确的是 (C)
Fe(Ⅲ)-H2L体系部分物种分布图
A.当pH=1时,体系中c(H2L)>c{[FeL]+}>c(OH-)>c(HL-)
B.pH在9.5~10.5之间,含L的物种主要为L2-
C.L2-+[FeL]+ [FeL2]-的平衡常数的lgK约为14
D.当pH=10时,参与配位的c(L2-)≈1.0×10-3 mol·L-1
5.(2022福建,5,4分)探究醋酸浓度与电离度(α)关系的步骤如下。与相关步骤对应的操作或叙述正确的是 (C)
步骤 操作或叙述
A Ⅰ.用NaOH标准溶液标定醋酸溶液浓度 滴定时应始终注视滴定管中的液面
B Ⅱ.用标定后的溶液配制不同浓度的醋酸溶液 应使用干燥的容量瓶
C Ⅲ.测定步骤Ⅱ中所得溶液的pH 应在相同温度下测定
D Ⅳ.计算不同浓度溶液中醋酸的电离度 计算式为 α=×100%
6.(2022浙江1月选考,17,2分)已知25 ℃时二元酸H2A的=1.3×10-7,=7.1×10-15。下列说法正确的是 (B)
A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者
B.向0.1 mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%
C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)
D.取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
7.(2021湖北,14,3分,改编)常温下,已知H3PO3溶液中含磷物种的浓度之和为0.1 mol·L-1,溶液中各含磷物种的pc-pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法正确的是 (D)
A.曲线①表示pc(H3PO3)随pOH的变化
B.H3PO3为三元酸且具有还原性
C.pH=4的溶液中:c(H2P)<0.1 mol·L-1-2c(HP)
D.H3PO3+HP的平衡常数K>1.0×105
8.(2021浙江6月选考,19,2分)某同学拟用pH计测定溶液pH以探究某酸HR是否为弱电解质。下列说法正确的是 (B)
A.25 ℃时,若测得0.01 mol·L-1 NaR溶液pH=7,则HR是弱酸
B.25 ℃时,若测得0.01 mol·L-1 HR溶液pH>2且pH<7,则HR是弱酸
C.25 ℃时,若测得HR溶液pH=a,取该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得pH=b,b-a<1,则HR是弱酸
D.25 ℃时,若测得NaR溶液pH=a,取该溶液10.0 mL,升温至50 ℃,测得pH=b,a>b,则HR是弱酸
9.(2020北京,11,3分)室温下,对于1 L 0.1 mol·L-1醋酸溶液,下列判断正确的是 (C)
A.该溶液中CH3COO-数目为6.02×1022
B.加入少量CH3COONa固体后,溶液的pH降低
C.滴加NaOH溶液过程中,n(CH3COO-)与n(CH3COOH)之和始终为0.1 mol
D.与Na2CO3溶液反应的离子方程式为C+2H+ H2O+CO2↑
10.(2022天津,16,14分)天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物Fe3+L(L为配体)溶于弱碱性的海水中,制成吸收液,将气体H2S转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①H2S的吸收氧化;②Fe3+L的再生。反应原理如下:
①H2S(g)+2Fe3+L(aq)+2OH-(aq) S(s)+2Fe2+L(aq)+2H2O(l) ΔH=-a kJ·mol-1(a>0)
②4Fe2+L(aq)+O2(g)+2H2O(l) 4Fe3+L(aq)+4OH-(aq) ΔH=-b kJ·mol-1(b>0)
回答下列问题:
(1)该工艺的总反应方程式为 2H2S+O2 2H2O+2S↓[或2H2S(g)+O2(g) 2H2O(l)+2S(s)] 。1 mol H2S(g)发生该反应的热量变化为 放出(a+) kJ热量 ,Fe3+L在总反应中的作用是 作催化剂(或降低反应活化能) 。
(2)研究不同配体与Fe3+所形成的配合物(A、B、C)对H2S吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入H2S,测得单位体积吸收液中H2S吸收转化率[α(H2S)]随时间变化的曲线如图1所示。以α(H2S)由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是 A (填“A”“B”或“C”)。
图1
(3)H2S的电离方程式为 H2S+H2O H3O++HS-(或H2S H++HS-,同时写出第二步电离也可) 。25 ℃时,H2S溶液中H2S、HS-、S2-在含硫粒子总浓度中所占分数δ随溶液pH的变化关系如图2。由图2计算,H2S的= 1.0×10-7 ,= 1.0×10-13 。再生反应在常温下进行,Fe2+L解离出的Fe2+易与溶液中的S2-形成沉淀。若溶液中的c(Fe2+)=1.0×10-5 mol·L-1,c(H2S)=6.0×10-9 mol·L-1,为避免有FeS沉淀生成,应控制溶液pH不大于 8 (已知25 ℃时,FeS的Ksp为6.0×10-18)。
图2
11.(2024广东,19,14分)酸在多种反应中具有广泛应用,其性能通常与酸的强度密切相关。
(1)酸催化下NaNO2与NH4Cl混合溶液的反应(反应a),可用于石油开采中油路解堵。
①基态N原子价层电子的轨道表示式为
②反应a:N(aq)+N(aq) N2(g)+2H2O(l)
已知:
则反应a的ΔH= ΔH1-ΔH2-ΔH3+ΔH4 。
③某小组研究了3种酸对反应a的催化作用。在相同条件下,向反应体系中滴加等物质的量的少量酸,测得体系的温度T随时间t的变化如图。据图可知,在该过程中, BD 。
A.催化剂酸性增强,可增大反应焓变
B.催化剂酸性增强,有利于提高反应速率
C.催化剂分子中含H越多,越有利于加速反应
D.反应速率并不始终随着反应物浓度下降而减小
(2)在非水溶剂中,将CO2转化为化合物ⅱ(一种重要的电子化学品)的催化机理示意图如图所示,其中的催化剂有 AcOH 和 KI 。
(3)在非水溶剂中研究弱酸的电离平衡具有重要科学价值。一定温度下,某研究组通过分光光度法测定了两种一元弱酸HX(X为A或B)在某非水溶剂中的Ka。
a.选择合适的指示剂HIn,Ka(HIn)=3.6×10-20;其钾盐为KIn。
b.向KIn溶液中加入HX,发生反应:In-+HX X-+HIn。KIn起始的物质的量为n0(KIn),加入HX的物质的量为n(HX),平衡时,测得c平(In-)/c平(HIn)随n(HX)/n0(KIn)的变化曲线如图。
已知:该溶剂本身不电离,钾盐在该溶剂中完全电离。
①计算Ka(HA)(写出计算过程,结果保留两位有效数字)。
答案 根据=1.0时,=3.0,设n(HA)=n0(KIn)=1 mol,列三段式:
In-+HA A-+HIn
起始/mol 1 1 0 0
转化/mol 0.25 0.25 0.25 0.25
平衡/mol 0.75 0.75 0.25 0.25
K=,Ka(HA)=Ka(HIn)×=4.0×10-21
②在该溶剂中,Ka(HB) > Ka(HA);Ka(HB) > Ka(HIn)(填“>”“<”或“=”)。
考点2 溶液的酸碱性 酸碱中和滴定
12.(2024湖南,13,3分)常温下Ka(HCOOH)=1.8×10-4,向20 mL 0.10 mol·L-1 NaOH溶液中缓慢滴入相同浓度的HCOOH溶液,混合溶液中某两种离子的浓度随加入HCOOH溶液体积的变化关系如图所示,下列说法错误的是 (D)
A.水的电离程度:MB.M点:2c(OH-)=c(Na+)+c(H+)
C.当V(HCOOH)=10 mL时,c(OH-)=c(H+)+2c(HCOOH)+c(HCOO-)
D.N点:c(Na+)>c(HCOO-)>c(OH-)>c(H+)>c(HCOOH)
13.(2023湖南,12,3分)常温下,用浓度为0.020 0 mol·L-1的NaOH标准溶液滴定浓度均为0.020 0 mol·L-1的HCl和CH3COOH的混合溶液,滴定过程中溶液的pH随η[η=]的变化曲线如图所示。
下列说法错误的是 (D)
A.Ka(CH3COOH)约为10-4.76
B.点a:c(Na+)=c(Cl-)=c(CH3COO-)+c(CH3COOH)
C.点b:c(CH3COOH)D.水的电离程度:a14.(2022湖北,12,3分)根据酸碱质子理论,给出质子(H+)的物质是酸,给出质子的能力越强,酸性越强。已知:
N2+N2H4
N2H4+CH3COOH N2+CH3COO-
下列酸性强弱顺序正确的是 (D)
A.N2
B.N2
C.NH3>N2H4>CH3COO-
D.CH3COOH>N2
15.(2022山东,6,2分)实验室用基准Na2CO3配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定Na2CO3标准溶液。下列说法错误的是 (A)
A.可用量筒量取25.00 mL Na2CO3标准溶液置于锥形瓶中
B.应选用配有塑料塞的容量瓶配制Na2CO3标准溶液
C.应选用烧杯而非称量纸称量Na2CO3固体
D.达到滴定终点时溶液显橙色
16.(2022河北,9,3分)某水样中含一定浓度的C和其他不与酸碱反应的离子。取10.00 mL水样,用0.010 00 mol·L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。
下列说法正确的是 (C)
A.该水样中c(C)=0.01 mol·L-1
B.a点处c(H2CO3)+c(H+)=c(OH-)
C.当V(HCl)≤20.00 mL时,溶液中c(HC)基本保持不变
D.曲线上任意一点存在c(C)+c(HC)+c(H2CO3)=0.03 mol·L-1
17.(2021浙江1月选考,17,2分)25 ℃时,下列说法正确的是 (D)
A.NaHA溶液呈酸性,可以推测H2A为强酸
B.可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐
C.0.010 mol·L-1、0.10 mol·L-1的醋酸溶液的电离度分别为α1、α2,则α1<α2
D.100 mL pH=10.00的Na2CO3溶液中水电离出H+的物质的量为1.0×10-5 mol
三年模拟
题型强化练
题型 中和滴定原理的迁移应用
1.(2024湖南长郡中学期末适应考,12)莫尔法测定生理盐水浓度的过程如下:移取10.00 mL稀释后的生理盐水置于250 mL锥形瓶中,加入3滴K2CrO4溶液作指示剂,用0.100 0 mol·L-1 AgNO3标准溶液滴定至终点。重复3次,消耗标准溶液的体积平均为V mL,然后计算出NaCl的浓度。已知:Ksp(AgCl)=1.77×10―10;Ksp(Ag2CrO4)=1.12×10-12;Ag2CrO4为砖红色沉淀。下列关于本实验的说法正确的是 (A)
A.可用酸式滴定管盛装AgNO3标准溶液
B.该稀释后的生理盐水浓度为0.1V mol·L-1
C.实验中若用生理盐水润洗锥形瓶将导致测定结果偏低
D.在相同浓度的KCl和K2CrO4混合溶液中滴入AgNO3溶液,先出现砖红色沉淀
2.(2024福建厦门双十中学模拟,10)电位滴定是利用溶液电位突变指示终点的滴定法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。常温下,用x mol·L-1盐酸标准溶液测定y mL某Na2CO3样品溶液中NaHCO3的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说法正确的是(D)
(注:—表示电极电位曲线图; 表示电极电压曲线图)
A.该滴定过程需要加入酸碱指示剂
B.a点溶液中:c(OH-)+2c(C)=c(H+)+c(H2CO3)
C.b到c过程中存在c(Na+)>c(Cl-),水的电离程度:bD.y mL该Na2CO3样品溶液中含有NaHCO3的质量为0.084x g
3.(2024北京西城一模,14)利用碘量法测定某纯净水样中溶解O2的含量,实验如下(加入的试剂已除去O2)。
步骤1 水样中O2的固定:用250 mL的水瓶盛满水样,加入1.0 mL 2 mol/L MnSO4溶液,再加入含9 mol/L NaOH溶液和1.8 mol/L KI溶液的混合液2.0 mL,部分水样溢出,立即盖好瓶盖,翻转摇匀,生成白色沉淀Mn(OH)2,随即有棕色沉淀MnO(OH)2生成。
步骤2 生成I2:当水样中的沉淀沉降到距瓶口三分之一以下时,缓缓加入适量稀H2SO4至液面下,部分溶液溢出,立即盖好瓶盖,翻转摇动,至沉淀完全溶解,得到黄色溶液。
步骤3 测定及计算:用碘量法测出步骤2中生成的I2为b mol,进而计算出该纯净水样中溶解O2的含量。
已知:O2直接氧化I-的反应速率很慢。
下列说法不正确的是 (D)
A.步骤1中,用注射器加入试剂时应将细长针头插到液面下一定距离
B.步骤2中,生成I2的反应:MnO(OH)2+4H++2I- Mn2++I2+3H2O
C.步骤2中,部分溶液溢出不影响测定该纯净水样中溶解O2的含量
D.步骤3中,经计算,该纯净水样中含有O2的浓度为 g/L
4.(2024河北唐山一模,15,节选)已知三氯化六氨合钴[Co(NH3)6]Cl3为橙黄色晶体,易溶于热水,在冷水中微溶,可在氯化铵和氨水的混合溶液中、在活性炭作催化剂条件下,利用H2O2溶液氧化CoCl2制备。
Ⅱ.测定产品纯度,实验如下:
①称取a g产品溶于足量稀硝酸中,并用蒸馏水稀释,置于锥形瓶中,加入过量V1 mL c1 mol·L-1 AgNO3溶液,并加3 mL的硝基苯用力振荡。
②向锥形瓶中滴入3滴Fe(NO3)3溶液为指示剂,用c2 mol·L-1 KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时用去V2 mL KSCN溶液。[已知:Ksp(AgCl)=1.8×10-10,Ksp(AgSCN)=1.0×10-12]
回答下列问题:
(1)产品的质量分数为 ×100% 。(列出计算式)
(2)加入硝基苯的目的是 使生成的AgCl沉淀被硝基苯覆盖,防止AgCl转化为AgSCN沉淀 。
5.(2024湖南雅礼中学第八次月考,16,节选)高纯二氧化锗的含量采用碘酸钾滴定法进行测定。称取a g高纯二氧化锗样品,加入氢氧化钠溶液在电炉中溶解,冷却至20 ℃以下,然后用次磷酸与过量氢氧化钠溶液反应得到的次磷酸钠(NaH2PO2)将其还原为Ge2+,以淀粉为指示剂,用b mol/L的碘酸钾标准溶液滴定,消耗碘酸钾标准溶液的体积为V mL。(20 ℃以下,次磷酸钠不会被碘酸钾和碘氧化)
资料:3Ge2++I+5I-+6H+ 3I2+3H2O。
①次磷酸钠(NaH2PO2)为 正盐 (填“正盐”或“酸式盐”)。
②上述滴定终点的判断方法为 当滴加最后半滴标准溶液,溶液由无色变为蓝色,且30秒内不变色即可认为达滴定终点 。
③此样品中二氧化锗的质量分数是 ×100% (用表达式表示)。
6.(2024陕西西安一中二模,26,节选)(6)用Na2H2Y溶液测定饮用水的总硬度。取饮用水样品250 mL,加入掩蔽剂排除干扰,调节pH等预处理后,用0.010 0 mol·L-1 Na2H2Y标准溶液进行测定。测定中涉及的反应有:M2++HIn2-(蓝色) MIn-(酒红色)+H+、MIn-(酒红色)+H2Y2- MY2-+HIn2-(蓝色)+H+、M2++H2Y2- MY2-+2H+[M2+代表Mg2+、Ca2+;铬黑T(HIn2-)为指示剂]。
①达到滴定终点的现象是 当滴入最后半滴Na2H2Y溶液,溶液由酒红色变为蓝色,且半分钟内不恢复原色 。
②平行实验三次,滴定终点时共消耗Na2H2Y溶液的平均体积为20.00 mL,则该饮用水的硬度= 4.48 度(水硬度的表示方法是将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1 L水中含有10 mg CaO称为1度)。
综合拔高练
建议用时:45分钟
1.(2024湖北4月调研,12)已知溶剂分子结合H+的能力会影响酸给出H+的能力,某温度下部分酸在冰醋酸中的pKa如下表所示。下列说法错误的是 (D)
分子式 HClO4 H2SO4 HCl HNO3
pKa=-lgKa 4.87 7.24(一级) 8.9 9.4
A.HClO4在冰醋酸中的电离方程式:HClO4+CH3COOH Cl
B.在冰醋酸中酸性:HClO4>H2SO4>HCl>HNO3
C.结合H+的能力:H2O>CH3COOH
D.相同温度下醋酸在液氨中的pKa大于其在水中的pKa
2.(2024江苏苏锡常镇四市二模,12)实验室用如下方案测定Na2CO3和NaHCO3混合物的组成:称取一定质量样品溶解于锥形瓶中,加入2滴指示剂M,用标准盐酸滴定至终点时消耗盐酸V1 mL;向锥形瓶中再加入2滴指示剂N,继续用标准盐酸滴定至终点,又消耗盐酸V2 mL。下列说法正确的是 (D)
A.指示剂M、N可依次选用甲基橙、酚酞
B.样品溶解后的溶液中:2c(Na+)=3c(C)+3c(HC)+3c(H2CO3)
C.滴定至第一次终点时的溶液中:c(H+)+c(Na+)=c(OH-)+c(HC)+2c(C)
D.样品中Na2CO3和NaHCO3物质的量之比为
3.(2024安徽江淮十校第三次联考,15)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验。
实验Ⅰ:往20 mL 0.1 mol/L NaHC2O4溶液中滴加0.1 mol/L NaOH溶液。
实验Ⅱ:往20 mL 0.1 mol/L NaHC2O4溶液中滴加0.1 mol/L CaCl2溶液。
已知:H2C2O4的电离常数=5.4×10-2,=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计。下列说法错误的是 (D)
A.实验Ⅰ可选用酚酞作指示剂,指示反应终点
B.实验Ⅰ中V(NaOH)=10 mL时,溶液显酸性
C.实验Ⅱ中在初始阶段发生的反应是2HC2+Ca2+ CaC2O4↓+H2C2O4
D.实验Ⅱ中V(CaCl2)=80 mL时,溶液中c(C2)=4.0×10-7 mol/L
4.(2024江西赣州二模,14)赣南脐橙富含柠檬酸(用H3R表示)。常温下,用0.1 mol·L-1 NaOH溶液滴定20.00 mL 0.1 mol·L-1 H3R溶液,滴定曲线如图所示。下列说法正确的是 (A)
(已知:常温下柠檬酸的电离常数:=1.0×10-3.1,=1.0×10-4.8,=1.0×10-6.4)
A.a点溶液中:c(H3R)+c(H+)=c(HR2-)+2c(R3-)+c(OH-)
B.反应H3R+HR2- 2H2R-的平衡常数K=10-1.7
C.b点溶液中,c(Na+)>c(HR2-)>c(H2R-)>c(R3-)
D.常温下,Na2HR溶液加水稀释过程中,增大
5.(2024吉林白山一模,15)常温下,向20 mL 0.2 mol·L-1一元弱碱ROH溶液中逐滴加入0.1 mol·L-1盐酸,溶液的M值[M=lg]随加入盐酸体积的变化曲线如图所示。已知a点溶液pH=9.8。下列说法中错误的是 (D)
A.Kb(ROH)=1×10-4.2
B.b点时,c(R+)>c(Cl-)>c(ROH)>c(OH-)>c(H+)
C.c点时,c(Cl-)=c(R+)+c(ROH)
D.a、b、c、d四点中,水的电离程度最小的是d点
6.(2024九省联考江西卷,12)马来酸依那普利(记为X,摩尔质量为M g/mol)是一种心血管疾病防治药物,结构如下所示:
通常使用以下两种方法滴定分析样品中X的质量分数w:
方法一:将m g样品溶于有机溶剂中,以c1 mol/L的HClO4溶液滴定,终点消耗V1 mL HClO4溶液,计量关系为n(X)∶n(HClO4)=1∶1;
方法二:将m g样品溶于水中,以c2 mol/L的NaOH溶液滴定,终点消耗V2 mL NaOH溶液,计量关系为n(X)∶n(NaOH)=1∶3。
下列说法正确的是 (B)
A.方法一滴定终点时,pH=7
B.方法一w=×100%
C.方法二滴定终点时,pH=7
D.方法二w=×100%
7.(2024山东济宁一模)阅读下列材料,回答(1)~(2)题。
氧泡泡是一种多功能新型漂白剂,其有效成分是过碳酸钠(xNa2CO3·yH2O2)。
Ⅰ.以芒硝(Na2SO4·10H2O)、H2O2等为原料制备过碳酸钠的工艺流程如图所示:
Ⅱ.测定过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
①用电子天平称取两份质量均为m g的样品。
②将一份置于锥形瓶中,加水溶解,加催化剂使H2O2充分快速分解(催化剂不参与其他反应),然后加酚酞作指示剂,用0.050 0 mol·L-1 H2SO4溶液滴定至终点,消耗硫酸V1 mL。
③将另一份置于碘量瓶中,加入50 mL蒸馏水,并立即加入6 mL 2.0 mol·L-1 H3PO4溶液,再加入过量KI固体,摇匀后于暗处放置10 min,加入适量指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V2 mL。(已知:2Na2S2O3+I2 Na2S4O6+2NaI)
(1)关于过碳酸钠制备的流程,下列说法错误的是 (A)
A.步骤1中2 mol芒硝参与反应时,消耗1 mol Na2Cr2O7
B.滤渣的主要成分为CaSO4
C.步骤2的化学方程式为2Na2CrO4+2CO2+H2O Na2Cr2O7+2NaHCO3↓
D.稳定剂的作用是阻止微量杂质金属离子的催化作用,减少H2O2的分解
(2)测定过碳酸钠化学式的步骤中,下列说法错误的是 (B)
A.步骤③样品溶于水酸化后放置一段时间,然后再加入过量KI固体,导致x∶y偏大
B.该过碳酸钠样品中x∶y=V1∶V2
C.该样品的纯度为%
D.步骤②中滴定前滴定管尖嘴处有气泡,滴定后无气泡,导致x∶y偏大
8.(2024福建泉州一模,10)硼酸(H3BO3)在水溶液中存在电离平衡:H3BO3+H2O [B(OH)4]-+H+ K=10-9.34。用0.01 mol/L NaOH溶液分别滴定体积均为20 mL的0.01 mol/L硼酸溶液、0.01 mol/L硼酸和甘露醇混合溶液,滴定过程中硼酸溶液pH、混合溶液的随加入的NaOH溶液体积的变化如图。
已知:+2 +4H2O
下列说法错误的是 ()
A.加入甘露醇促进硼酸电离平衡正向移动
B.溶液中c(H+):M点>N点
C.P点:c(H3BO3)=c{[B(OH)4]-}>c(OH-)>c(H+)
D.W点:c(Na+)+c(H+)+c(H3BO3)-c(OH-)=0.01 mol/L
9.(2024安徽安庆二模,12)某温度下,改变0.1 mol/L K2Cr2O7溶液的pH,各种含铬元素粒子的浓度变化如图所示(已知H2CrO4是二元弱酸,其电离常数为)。下列有关说法错误的是 (D)
A.该温度下的KW=1×10-14
B.该温度下(H2CrO4)的数量级为10-1
C.该温度下反应Cr2+2H+的平衡常数为5.1×10-15.2
D.B点溶液中:c(K+)≤2c(Cr2)+3c(Cr)
10.(2024广东湛江一模,17)Na2S2O3标准溶液是氧化还原反应中常用的还原性标定试剂,但配制时使用的Na2S2O3·5H2O固体中通常含有一些杂质,且易风化和潮解。Na2S2O3溶液也容易被O2氧化。因此在实际操作中,Na2S2O3标准溶液配制好后常用K2Cr2O7进行标定。但又由于K2Cr2O7与Na2S2O3反应的产物有很多种,不能按确定的反应式进行,故无法通过氧化还原滴定法确定浓度。操作中一般先用K2Cr2O7与过量的KI反应,定量生成的I2再用Na2S2O3滴定,发生反应的离子方程式为Cr2。我们将这种Na2S2O3与I2联用的方法称为碘量法,碘量法是分析化学中常用的分析方法,常用于一些无法直接滴定的反应的物质的间接滴定。
已知:K2Cr2O7与KI的反应需要一定的时间才能进行得比较完全,故需放置约5 min。
(1)Na2S2O3标准溶液的配制。
①配制480 mL 0.1 mol/L的Na2S2O3标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、 500 mL容量瓶 。
②将下述实验步骤A到F按实验过程先后次序排列 CBDFAE 。
(2)Na2S2O3标准溶液的标定:取20.00 mL 0.017 mol/L K2Cr2O7溶液于250 mL锥形瓶中,加入5 mL 6 mol/L HCl溶液,再加入10 mL 100 g/L KI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用Na2S2O3溶液滴定至浅黄色后加入2 mL淀粉指示剂,继续滴定至终点,平行测定3次,计算Na2S2O3标准溶液的浓度。
①用 酸式滴定管 量取20.00 mL 0.017 mol/L K2Cr2O7溶液。
②加入KI摇匀后用牛皮纸扎紧瓶口的目的是 防止空气中氧气氧化I- 。
③如何判定滴定结束 当滴入最后半滴Na2S2O3溶液,溶液蓝色褪去,且30 s内不恢复蓝色 。
④列式并计算Na2S2O3标准溶液的浓度。
K2Cr2O7溶液 KI溶液 V(Na2S2O3)/mL c(Na2S2O3)/(mol/L)
20.00 mL 0.017 mol/L 10 mL 100 g/L 20.35
20.45
20.40
21.20
答案 =0.100 mol·L-1
(3)借鉴(2)的方法,用碘量法测定KMnO4溶液的物质的量浓度:量取25.00 mL待测液于250 mL锥形瓶中,加入2 mol/L H2SO4溶液25 mL,再加入10% KI溶液10 mL,然后用已知浓度的Na2S2O3溶液滴定到淡黄色,加0.5%的淀粉溶液3 mL,用Na2S2O3溶液继续滴定至终点。
①滴定时需加入硫酸。能否用盐酸代替硫酸,为什么 不能,KMnO4会与HCl发生反应生成Cl2 。
②写出KMnO4溶液与KI反应的离子方程式: 2Mn+10I-+16H+ 2Mn2++5I2+8H2O 。
(4)借鉴(3)的方法,某小组用碘量法测量磷酸铁锂溶液中Fe3+的物质的量浓度。
提出问题:Fe3+与I-是可逆反应,Fe3+的存在是否会影响滴定
实验验证:①在磷酸铁锂溶液中加入过量的KI,静置一段时间后,加入KSCN,观察到溶液颜色变红;请写出Fe3+与I-反应的离子方程式: 2Fe3++2I- 2Fe2++I2 。
②取标准量的磷酸铁锂溶液,分成两组,其中一组加入过量的KI溶液,另一组加入等量的水。再分别使用Na2S2O3溶液进行标定,发现消耗的Na2S2O3溶液体积相同。
实验小结:Fe3+ 不影响 滴定(填“影响”或“不影响”)。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025版新教材高考化学第二轮复习
专题十 弱电解质的电离平衡和溶液的酸碱性
五年高考
考点1 弱电解质的电离平衡
1.(2024贵州,12,3分)硼砂[Na2B4O5(OH)4·8H2O]水溶液常用于pH计的校准。硼砂水解生成等物质的量的B(OH)3(硼酸)和Na[B(OH)4](硼酸钠)。
已知:①25 ℃时,硼酸显酸性的原理
B(OH)3+2H2O H3O++
Ka=5.8×10-10;
②lg≈0.38。
下列说法正确的是 ( )
A.硼砂稀溶液中c(Na+)=c[B(OH)3]
B.硼酸水溶液中的H+主要来自水的电离
C.25 ℃时,0.01 mol·L-1硼酸水溶液的pH≈6.38
D.等浓度等体积的B(OH)3和Na[B(OH)4]溶液混合后,溶液显酸性
2.(2024山东,10,2分)常温下Ag(Ⅰ)-CH3COOH水溶液体系中存在反应:Ag++CH3COO- CH3COOAg(aq),平衡常数为K。已知初始浓度c0(Ag+)=c0(CH3COOH)=0.08 mol·L-1,所有含碳物种的摩尔分数与pH变化关系如图所示(忽略溶液体积变化)。
下列说法正确的是 ( )
A.线Ⅱ表示CH3COOH的变化情况
B.CH3COOH的电离平衡常数Ka=10-n
C.pH=n时,c(Ag+)= mol·L-1
D.pH=10时,c(Ag+)+c(CH3COOAg)=0.08 mol·L-1
3.(2024新课标,13,6分)常温下CH2ClCOOH和CHCl2COOH的两种溶液中,分布系数δ与pH的变化关系如下图所示。[比如:δ(CH2ClCOO-)=]
下列叙述正确的是 ( )
A.曲线M表示δ(CHCl2COO-)~pH的变化关系
B.若酸的初始浓度为0.10 mol·L-1,则a点对应的溶液中有c(H+)=c(CHCl2COO-)+c(OH-)
C.CH2ClCOOH的电离常数Ka=10-1.3
D.pH=2.08时,
4.(2023湖北,14,3分)H2L为某邻苯二酚类配体,其p=7.46,p=12.4。常温下构建Fe(Ⅲ)-H2L溶液体系,其中c0(Fe3+)=2.0×10-4mol·L-1,c0(H2L)=5.0×10-3 mol·L-1。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数δ(x)=,已知lg2≈0.30,lg3≈0.48。下列说法正确的是 ( )
Fe(Ⅲ)-H2L体系部分物种分布图
A.当pH=1时,体系中c(H2L)>c{[FeL]+}>c(OH-)>c(HL-)
B.pH在9.5~10.5之间,含L的物种主要为L2-
C.L2-+[FeL]+ [FeL2]-的平衡常数的lgK约为14
D.当pH=10时,参与配位的c(L2-)≈1.0×10-3 mol·L-1
5.(2022福建,5,4分)探究醋酸浓度与电离度(α)关系的步骤如下。与相关步骤对应的操作或叙述正确的是 ( )
步骤 操作或叙述
A Ⅰ.用NaOH标准溶液标定醋酸溶液浓度 滴定时应始终注视滴定管中的液面
B Ⅱ.用标定后的溶液配制不同浓度的醋酸溶液 应使用干燥的容量瓶
C Ⅲ.测定步骤Ⅱ中所得溶液的pH 应在相同温度下测定
D Ⅳ.计算不同浓度溶液中醋酸的电离度 计算式为 α=×100%
6.(2022浙江1月选考,17,2分)已知25 ℃时二元酸H2A的=1.3×10-7,=7.1×10-15。下列说法正确的是 ( )
A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者
B.向0.1 mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%
C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)
D.取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
7.(2021湖北,14,3分,改编)常温下,已知H3PO3溶液中含磷物种的浓度之和为0.1 mol·L-1,溶液中各含磷物种的pc-pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法正确的是 ( )
A.曲线①表示pc(H3PO3)随pOH的变化
B.H3PO3为三元酸且具有还原性
C.pH=4的溶液中:c(H2P)<0.1 mol·L-1-2c(HP)
D.H3PO3+HP的平衡常数K>1.0×105
8.(2021浙江6月选考,19,2分)某同学拟用pH计测定溶液pH以探究某酸HR是否为弱电解质。下列说法正确的是 ( )
A.25 ℃时,若测得0.01 mol·L-1 NaR溶液pH=7,则HR是弱酸
B.25 ℃时,若测得0.01 mol·L-1 HR溶液pH>2且pH<7,则HR是弱酸
C.25 ℃时,若测得HR溶液pH=a,取该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得pH=b,b-a<1,则HR是弱酸
D.25 ℃时,若测得NaR溶液pH=a,取该溶液10.0 mL,升温至50 ℃,测得pH=b,a>b,则HR是弱酸
9.(2020北京,11,3分)室温下,对于1 L 0.1 mol·L-1醋酸溶液,下列判断正确的是 ( )
A.该溶液中CH3COO-数目为6.02×1022
B.加入少量CH3COONa固体后,溶液的pH降低
C.滴加NaOH溶液过程中,n(CH3COO-)与n(CH3COOH)之和始终为0.1 mol
D.与Na2CO3溶液反应的离子方程式为C+2H+ H2O+CO2↑
10.(2022天津,16,14分)天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物Fe3+L(L为配体)溶于弱碱性的海水中,制成吸收液,将气体H2S转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①H2S的吸收氧化;②Fe3+L的再生。反应原理如下:
①H2S(g)+2Fe3+L(aq)+2OH-(aq) S(s)+2Fe2+L(aq)+2H2O(l) ΔH=-a kJ·mol-1(a>0)
②4Fe2+L(aq)+O2(g)+2H2O(l) 4Fe3+L(aq)+4OH-(aq) ΔH=-b kJ·mol-1(b>0)
回答下列问题:
(1)该工艺的总反应方程式为 。1 mol H2S(g)发生该反应的热量变化为 ,Fe3+L在总反应中的作用是 。
(2)研究不同配体与Fe3+所形成的配合物(A、B、C)对H2S吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入H2S,测得单位体积吸收液中H2S吸收转化率[α(H2S)]随时间变化的曲线如图1所示。以α(H2S)由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是 (填“A”“B”或“C”)。
图1
(3)H2S的电离方程式为 。25 ℃时,H2S溶液中H2S、HS-、S2-在含硫粒子总浓度中所占分数δ随溶液pH的变化关系如图2。由图2计算,H2S的= ,= 。再生反应在常温下进行,Fe2+L解离出的Fe2+易与溶液中的S2-形成沉淀。若溶液中的c(Fe2+)=1.0×10-5 mol·L-1,c(H2S)=6.0×10-9 mol·L-1,为避免有FeS沉淀生成,应控制溶液pH不大于 (已知25 ℃时,FeS的Ksp为6.0×10-18)。
图2
11.(2024广东,19,14分)酸在多种反应中具有广泛应用,其性能通常与酸的强度密切相关。
(1)酸催化下NaNO2与NH4Cl混合溶液的反应(反应a),可用于石油开采中油路解堵。
①基态N原子价层电子的轨道表示式为 。
②反应a:N(aq)+N(aq) N2(g)+2H2O(l)
已知:
则反应a的ΔH= 。
③某小组研究了3种酸对反应a的催化作用。在相同条件下,向反应体系中滴加等物质的量的少量酸,测得体系的温度T随时间t的变化如图。据图可知,在该过程中, 。
A.催化剂酸性增强,可增大反应焓变
B.催化剂酸性增强,有利于提高反应速率
C.催化剂分子中含H越多,越有利于加速反应
D.反应速率并不始终随着反应物浓度下降而减小
(2)在非水溶剂中,将CO2转化为化合物ⅱ(一种重要的电子化学品)的催化机理示意图如图所示,其中的催化剂有 和 。
(3)在非水溶剂中研究弱酸的电离平衡具有重要科学价值。一定温度下,某研究组通过分光光度法测定了两种一元弱酸HX(X为A或B)在某非水溶剂中的Ka。
a.选择合适的指示剂HIn,Ka(HIn)=3.6×10-20;其钾盐为KIn。
b.向KIn溶液中加入HX,发生反应:In-+HX X-+HIn。KIn起始的物质的量为n0(KIn),加入HX的物质的量为n(HX),平衡时,测得c平(In-)/c平(HIn)随n(HX)/n0(KIn)的变化曲线如图。
已知:该溶剂本身不电离,钾盐在该溶剂中完全电离。
①计算Ka(HA)(写出计算过程,结果保留两位有效数字)。
②在该溶剂中,Ka(HB) Ka(HA);Ka(HB) Ka(HIn)(填“>”“<”或“=”)。
考点2 溶液的酸碱性 酸碱中和滴定
12.(2024湖南,13,3分)常温下Ka(HCOOH)=1.8×10-4,向20 mL 0.10 mol·L-1 NaOH溶液中缓慢滴入相同浓度的HCOOH溶液,混合溶液中某两种离子的浓度随加入HCOOH溶液体积的变化关系如图所示,下列说法错误的是 ( )
A.水的电离程度:M
C.当V(HCOOH)=10 mL时,c(OH-)=c(H+)+2c(HCOOH)+c(HCOO-)
D.N点:c(Na+)>c(HCOO-)>c(OH-)>c(H+)>c(HCOOH)
13.(2023湖南,12,3分)常温下,用浓度为0.020 0 mol·L-1的NaOH标准溶液滴定浓度均为0.020 0 mol·L-1的HCl和CH3COOH的混合溶液,滴定过程中溶液的pH随η[η=]的变化曲线如图所示。
下列说法错误的是 ( )
A.Ka(CH3COOH)约为10-4.76
B.点a:c(Na+)=c(Cl-)=c(CH3COO-)+c(CH3COOH)
C.点b:c(CH3COOH)
N2+N2H4
N2H4+CH3COOH N2+CH3COO-
下列酸性强弱顺序正确的是 ( )
A.N2
B.N2
C.NH3>N2H4>CH3COO-
D.CH3COOH>N2
15.(2022山东,6,2分)实验室用基准Na2CO3配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定Na2CO3标准溶液。下列说法错误的是 ( )
A.可用量筒量取25.00 mL Na2CO3标准溶液置于锥形瓶中
B.应选用配有塑料塞的容量瓶配制Na2CO3标准溶液
C.应选用烧杯而非称量纸称量Na2CO3固体
D.达到滴定终点时溶液显橙色
16.(2022河北,9,3分)某水样中含一定浓度的C和其他不与酸碱反应的离子。取10.00 mL水样,用0.010 00 mol·L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。
下列说法正确的是 ( )
A.该水样中c(C)=0.01 mol·L-1
B.a点处c(H2CO3)+c(H+)=c(OH-)
C.当V(HCl)≤20.00 mL时,溶液中c(HC)基本保持不变
D.曲线上任意一点存在c(C)+c(HC)+c(H2CO3)=0.03 mol·L-1
17.(2021浙江1月选考,17,2分)25 ℃时,下列说法正确的是 ( )
A.NaHA溶液呈酸性,可以推测H2A为强酸
B.可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐
C.0.010 mol·L-1、0.10 mol·L-1的醋酸溶液的电离度分别为α1、α2,则α1<α2
D.100 mL pH=10.00的Na2CO3溶液中水电离出H+的物质的量为1.0×10-5 mol
三年模拟
题型强化练
题型 中和滴定原理的迁移应用
1.(2024湖南长郡中学期末适应考,12)莫尔法测定生理盐水浓度的过程如下:移取10.00 mL稀释后的生理盐水置于250 mL锥形瓶中,加入3滴K2CrO4溶液作指示剂,用0.100 0 mol·L-1 AgNO3标准溶液滴定至终点。重复3次,消耗标准溶液的体积平均为V mL,然后计算出NaCl的浓度。已知:Ksp(AgCl)=1.77×10―10;Ksp(Ag2CrO4)=1.12×10-12;Ag2CrO4为砖红色沉淀。下列关于本实验的说法正确的是 ( )
A.可用酸式滴定管盛装AgNO3标准溶液
B.该稀释后的生理盐水浓度为0.1V mol·L-1
C.实验中若用生理盐水润洗锥形瓶将导致测定结果偏低
D.在相同浓度的KCl和K2CrO4混合溶液中滴入AgNO3溶液,先出现砖红色沉淀
2.(2024福建厦门双十中学模拟,10)电位滴定是利用溶液电位突变指示终点的滴定法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。常温下,用x mol·L-1盐酸标准溶液测定y mL某Na2CO3样品溶液中NaHCO3的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说法正确的是( )
(注:—表示电极电位曲线图; 表示电极电压曲线图)
A.该滴定过程需要加入酸碱指示剂
B.a点溶液中:c(OH-)+2c(C)=c(H+)+c(H2CO3)
C.b到c过程中存在c(Na+)>c(Cl-),水的电离程度:b
3.(2024北京西城一模,14)利用碘量法测定某纯净水样中溶解O2的含量,实验如下(加入的试剂已除去O2)。
步骤1 水样中O2的固定:用250 mL的水瓶盛满水样,加入1.0 mL 2 mol/L MnSO4溶液,再加入含9 mol/L NaOH溶液和1.8 mol/L KI溶液的混合液2.0 mL,部分水样溢出,立即盖好瓶盖,翻转摇匀,生成白色沉淀Mn(OH)2,随即有棕色沉淀MnO(OH)2生成。
步骤2 生成I2:当水样中的沉淀沉降到距瓶口三分之一以下时,缓缓加入适量稀H2SO4至液面下,部分溶液溢出,立即盖好瓶盖,翻转摇动,至沉淀完全溶解,得到黄色溶液。
步骤3 测定及计算:用碘量法测出步骤2中生成的I2为b mol,进而计算出该纯净水样中溶解O2的含量。
已知:O2直接氧化I-的反应速率很慢。
下列说法不正确的是 ( )
A.步骤1中,用注射器加入试剂时应将细长针头插到液面下一定距离
B.步骤2中,生成I2的反应:MnO(OH)2+4H++2I- Mn2++I2+3H2O
C.步骤2中,部分溶液溢出不影响测定该纯净水样中溶解O2的含量
D.步骤3中,经计算,该纯净水样中含有O2的浓度为 g/L
4.(2024河北唐山一模,15,节选)已知三氯化六氨合钴[Co(NH3)6]Cl3为橙黄色晶体,易溶于热水,在冷水中微溶,可在氯化铵和氨水的混合溶液中、在活性炭作催化剂条件下,利用H2O2溶液氧化CoCl2制备。
Ⅱ.测定产品纯度,实验如下:
①称取a g产品溶于足量稀硝酸中,并用蒸馏水稀释,置于锥形瓶中,加入过量V1 mL c1 mol·L-1 AgNO3溶液,并加3 mL的硝基苯用力振荡。
②向锥形瓶中滴入3滴Fe(NO3)3溶液为指示剂,用c2 mol·L-1 KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时用去V2 mL KSCN溶液。[已知:Ksp(AgCl)=1.8×10-10,Ksp(AgSCN)=1.0×10-12]
回答下列问题:
(1)产品的质量分数为 。(列出计算式)
(2)加入硝基苯的目的是 。
5.(2024湖南雅礼中学第八次月考,16,节选)高纯二氧化锗的含量采用碘酸钾滴定法进行测定。称取a g高纯二氧化锗样品,加入氢氧化钠溶液在电炉中溶解,冷却至20 ℃以下,然后用次磷酸与过量氢氧化钠溶液反应得到的次磷酸钠(NaH2PO2)将其还原为Ge2+,以淀粉为指示剂,用b mol/L的碘酸钾标准溶液滴定,消耗碘酸钾标准溶液的体积为V mL。(20 ℃以下,次磷酸钠不会被碘酸钾和碘氧化)
资料:3Ge2++I+5I-+6H+ 3I2+3H2O。
①次磷酸钠(NaH2PO2)为 (填“正盐”或“酸式盐”)。
②上述滴定终点的判断方法为 。
③此样品中二氧化锗的质量分数是 (用表达式表示)。
6.(2024陕西西安一中二模,26,节选)(6)用Na2H2Y溶液测定饮用水的总硬度。取饮用水样品250 mL,加入掩蔽剂排除干扰,调节pH等预处理后,用0.010 0 mol·L-1 Na2H2Y标准溶液进行测定。测定中涉及的反应有:M2++HIn2-(蓝色) MIn-(酒红色)+H+、MIn-(酒红色)+H2Y2- MY2-+HIn2-(蓝色)+H+、M2++H2Y2- MY2-+2H+[M2+代表Mg2+、Ca2+;铬黑T(HIn2-)为指示剂]。
①达到滴定终点的现象是 。
②平行实验三次,滴定终点时共消耗Na2H2Y溶液的平均体积为20.00 mL,则该饮用水的硬
度= 度(水硬度的表示方法是将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1 L水中含有10 mg CaO称为1度)。
综合拔高练
建议用时:45分钟
1.(2024湖北4月调研,12)已知溶剂分子结合H+的能力会影响酸给出H+的能力,某温度下部分酸在冰醋酸中的pKa如下表所示。下列说法错误的是 ( )
分子式 HClO4 H2SO4 HCl HNO3
pKa=-lgKa 4.87 7.24(一级) 8.9 9.4
A.HClO4在冰醋酸中的电离方程式:HClO4+CH3COOH Cl
B.在冰醋酸中酸性:HClO4>H2SO4>HCl>HNO3
C.结合H+的能力:H2O>CH3COOH
D.相同温度下醋酸在液氨中的pKa大于其在水中的pKa
2.(2024江苏苏锡常镇四市二模,12)实验室用如下方案测定Na2CO3和NaHCO3混合物的组成:称取一定质量样品溶解于锥形瓶中,加入2滴指示剂M,用标准盐酸滴定至终点时消耗盐酸V1 mL;向锥形瓶中再加入2滴指示剂N,继续用标准盐酸滴定至终点,又消耗盐酸V2 mL。下列说法正确的是 ( )
A.指示剂M、N可依次选用甲基橙、酚酞
B.样品溶解后的溶液中:2c(Na+)=3c(C)+3c(HC)+3c(H2CO3)
C.滴定至第一次终点时的溶液中:c(H+)+c(Na+)=c(OH-)+c(HC)+2c(C)
D.样品中Na2CO3和NaHCO3物质的量之比为
3.(2024安徽江淮十校第三次联考,15)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验。
实验Ⅰ:往20 mL 0.1 mol/L NaHC2O4溶液中滴加0.1 mol/L NaOH溶液。
实验Ⅱ:往20 mL 0.1 mol/L NaHC2O4溶液中滴加0.1 mol/L CaCl2溶液。
已知:H2C2O4的电离常数=5.4×10-2,=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计。下列说法错误的是 ( )
A.实验Ⅰ可选用酚酞作指示剂,指示反应终点
B.实验Ⅰ中V(NaOH)=10 mL时,溶液显酸性
C.实验Ⅱ中在初始阶段发生的反应是2HC2+Ca2+ CaC2O4↓+H2C2O4
D.实验Ⅱ中V(CaCl2)=80 mL时,溶液中c(C2)=4.0×10-7 mol/L
4.(2024江西赣州二模,14)赣南脐橙富含柠檬酸(用H3R表示)。常温下,用0.1 mol·L-1 NaOH溶液滴定20.00 mL 0.1 mol·L-1 H3R溶液,滴定曲线如图所示。下列说法正确的是 ( )
(已知:常温下柠檬酸的电离常数:=1.0×10-3.1,=1.0×10-4.8,=1.0×10-6.4)
A.a点溶液中:c(H3R)+c(H+)=c(HR2-)+2c(R3-)+c(OH-)
B.反应H3R+HR2- 2H2R-的平衡常数K=10-1.7
C.b点溶液中,c(Na+)>c(HR2-)>c(H2R-)>c(R3-)
D.常温下,Na2HR溶液加水稀释过程中,增大
5.(2024吉林白山一模,15)常温下,向20 mL 0.2 mol·L-1一元弱碱ROH溶液中逐滴加入0.1 mol·L-1盐酸,溶液的M值[M=lg]随加入盐酸体积的变化曲线如图所示。已知a点溶液pH=9.8。下列说法中错误的是 ( )
A.Kb(ROH)=1×10-4.2
B.b点时,c(R+)>c(Cl-)>c(ROH)>c(OH-)>c(H+)
C.c点时,c(Cl-)=c(R+)+c(ROH)
D.a、b、c、d四点中,水的电离程度最小的是d点
6.(2024九省联考江西卷,12)马来酸依那普利(记为X,摩尔质量为M g/mol)是一种心血管疾病防治药物,结构如下所示:
通常使用以下两种方法滴定分析样品中X的质量分数w:
方法一:将m g样品溶于有机溶剂中,以c1 mol/L的HClO4溶液滴定,终点消耗V1 mL HClO4溶液,计量关系为n(X)∶n(HClO4)=1∶1;
方法二:将m g样品溶于水中,以c2 mol/L的NaOH溶液滴定,终点消耗V2 mL NaOH溶液,计量关系为n(X)∶n(NaOH)=1∶3。
下列说法正确的是 ( )
A.方法一滴定终点时,pH=7
B.方法一w=×100%
C.方法二滴定终点时,pH=7
D.方法二w=×100%
7.(2024山东济宁一模)阅读下列材料,回答(1)~(2)题。
氧泡泡是一种多功能新型漂白剂,其有效成分是过碳酸钠(xNa2CO3·yH2O2)。
Ⅰ.以芒硝(Na2SO4·10H2O)、H2O2等为原料制备过碳酸钠的工艺流程如图所示:
Ⅱ.测定过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
①用电子天平称取两份质量均为m g的样品。
②将一份置于锥形瓶中,加水溶解,加催化剂使H2O2充分快速分解(催化剂不参与其他反应),然后加酚酞作指示剂,用0.050 0 mol·L-1 H2SO4溶液滴定至终点,消耗硫酸V1 mL。
③将另一份置于碘量瓶中,加入50 mL蒸馏水,并立即加入6 mL 2.0 mol·L-1 H3PO4溶液,再加入过量KI固体,摇匀后于暗处放置10 min,加入适量指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V2 mL。(已知:2Na2S2O3+I2 Na2S4O6+2NaI)
(1)关于过碳酸钠制备的流程,下列说法错误的是 ( )
A.步骤1中2 mol芒硝参与反应时,消耗1 mol Na2Cr2O7
B.滤渣的主要成分为CaSO4
C.步骤2的化学方程式为2Na2CrO4+2CO2+H2O Na2Cr2O7+2NaHCO3↓
D.稳定剂的作用是阻止微量杂质金属离子的催化作用,减少H2O2的分解
(2)测定过碳酸钠化学式的步骤中,下列说法错误的是 ( )
A.步骤③样品溶于水酸化后放置一段时间,然后再加入过量KI固体,导致x∶y偏大
B.该过碳酸钠样品中x∶y=V1∶V2
C.该样品的纯度为%
D.步骤②中滴定前滴定管尖嘴处有气泡,滴定后无气泡,导致x∶y偏大
8.(2024福建泉州一模,10)硼酸(H3BO3)在水溶液中存在电离平衡:H3BO3+H2O [B(OH)4]-+H+ K=10-9.34。用0.01 mol/L NaOH溶液分别滴定体积均为20 mL的0.01 mol/L硼酸溶液、0.01 mol/L硼酸和甘露醇混合溶液,滴定过程中硼酸溶液pH、混合溶液的随加入的NaOH溶液体积的变化如图。
已知:+2 +4H2O
下列说法错误的是 ( )
A.加入甘露醇促进硼酸电离平衡正向移动
B.溶液中c(H+):M点>N点
C.P点:c(H3BO3)=c{[B(OH)4]-}>c(OH-)>c(H+)
D.W点:c(Na+)+c(H+)+c(H3BO3)-c(OH-)=0.01 mol/L
9.(2024安徽安庆二模,12)某温度下,改变0.1 mol/L K2Cr2O7溶液的pH,各种含铬元素粒子的浓度变化如图所示(已知H2CrO4是二元弱酸,其电离常数为)。下列有关说法错误的是 ( )
A.该温度下的KW=1×10-14
B.该温度下(H2CrO4)的数量级为10-1
C.该温度下反应Cr2+2H+的平衡常数为5.1×10-15.2
D.B点溶液中:c(K+)≤2c(Cr2)+3c(Cr)
10.(2024广东湛江一模,17)Na2S2O3标准溶液是氧化还原反应中常用的还原性标定试剂,但配制时使用的Na2S2O3·5H2O固体中通常含有一些杂质,且易风化和潮解。Na2S2O3溶液也容易被O2氧化。因此在实际操作中,Na2S2O3标准溶液配制好后常用K2Cr2O7进行标定。但又由于K2Cr2O7与Na2S2O3反应的产物有很多种,不能按确定的反应式进行,故无法通过氧化还原滴定法确定浓度。操作中一般先用K2Cr2O7与过量的KI反应,定量生成的I2再用Na2S2O3滴定,发生反应的离子方程式为Cr2。我们将这种Na2S2O3与I2联用的方法称为碘量法,碘量法是分析化学中常用的分析方法,常用于一些无法直接滴定的反应的物质的间接滴定。
已知:K2Cr2O7与KI的反应需要一定的时间才能进行得比较完全,故需放置约5 min。
(1)Na2S2O3标准溶液的配制。
①配制480 mL 0.1 mol/L的Na2S2O3标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、 。
②将下述实验步骤A到F按实验过程先后次序排列 。
(2)Na2S2O3标准溶液的标定:取20.00 mL 0.017 mol/L K2Cr2O7溶液于250 mL锥形瓶中,加入5 mL 6 mol/L HCl溶液,再加入10 mL 100 g/L KI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用Na2S2O3溶液滴定至浅黄色后加入2 mL淀粉指示剂,继续滴定至终点,平行测定3次,计算Na2S2O3标准溶液的浓度。
①用 量取20.00 mL 0.017 mol/L K2Cr2O7溶液。
②加入KI摇匀后用牛皮纸扎紧瓶口的目的是 。
③如何判定滴定结束 。
④列式并计算Na2S2O3标准溶液的浓度。
K2Cr2O7溶液 KI溶液 V(Na2S2O3)/mL c(Na2S2O3)/(mol/L)
20.00 mL 0.017 mol/L 10 mL 100 g/L 20.35
20.45
20.40
21.20
(3)借鉴(2)的方法,用碘量法测定KMnO4溶液的物质的量浓度:量取25.00 mL待测液于250 mL锥形瓶中,加入2 mol/L H2SO4溶液25 mL,再加入10% KI溶液10 mL,然后用已知浓度的Na2S2O3溶液滴定到淡黄色,加0.5%的淀粉溶液3 mL,用Na2S2O3溶液继续滴定至终点。
①滴定时需加入硫酸。能否用盐酸代替硫酸,为什么 。
②写出KMnO4溶液与KI反应的离子方程式: 。
(4)借鉴(3)的方法,某小组用碘量法测量磷酸铁锂溶液中Fe3+的物质的量浓度。
提出问题:Fe3+与I-是可逆反应,Fe3+的存在是否会影响滴定
实验验证:①在磷酸铁锂溶液中加入过量的KI,静置一段时间后,加入KSCN,观察到溶液颜色变红;请写出Fe3+与I-反应的离子方程式: 。
②取标准量的磷酸铁锂溶液,分成两组,其中一组加入过量的KI溶液,另一组加入等量的水。再分别使用Na2S2O3溶液进行标定,发现消耗的Na2S2O3溶液体积相同。
实验小结:Fe3+ 滴定(填“影响”或“不影响”)。
专题十 弱电解质的电离平衡和溶液的酸碱性
五年高考
考点1 弱电解质的电离平衡
1.(2024贵州,12,3分)硼砂[Na2B4O5(OH)4·8H2O]水溶液常用于pH计的校准。硼砂水解生成等物质的量的B(OH)3(硼酸)和Na[B(OH)4](硼酸钠)。
已知:①25 ℃时,硼酸显酸性的原理
B(OH)3+2H2O H3O++
Ka=5.8×10-10;
②lg≈0.38。
下列说法正确的是 (B)
A.硼砂稀溶液中c(Na+)=c[B(OH)3]
B.硼酸水溶液中的H+主要来自水的电离
C.25 ℃时,0.01 mol·L-1硼酸水溶液的pH≈6.38
D.等浓度等体积的B(OH)3和Na[B(OH)4]溶液混合后,溶液显酸性
2.(2024山东,10,2分)常温下Ag(Ⅰ)-CH3COOH水溶液体系中存在反应:Ag++CH3COO- CH3COOAg(aq),平衡常数为K。已知初始浓度c0(Ag+)=c0(CH3COOH)=0.08 mol·L-1,所有含碳物种的摩尔分数与pH变化关系如图所示(忽略溶液体积变化)。
下列说法正确的是 (C)
A.线Ⅱ表示CH3COOH的变化情况
B.CH3COOH的电离平衡常数Ka=10-n
C.pH=n时,c(Ag+)= mol·L-1
D.pH=10时,c(Ag+)+c(CH3COOAg)=0.08 mol·L-1
3.(2024新课标,13,6分)常温下CH2ClCOOH和CHCl2COOH的两种溶液中,分布系数δ与pH的变化关系如下图所示。[比如:δ(CH2ClCOO-)=]
下列叙述正确的是 (D)
A.曲线M表示δ(CHCl2COO-)~pH的变化关系
B.若酸的初始浓度为0.10 mol·L-1,则a点对应的溶液中有c(H+)=c(CHCl2COO-)+c(OH-)
C.CH2ClCOOH的电离常数Ka=10-1.3
D.pH=2.08时,
4.(2023湖北,14,3分)H2L为某邻苯二酚类配体,其p=7.46,p=12.4。常温下构建Fe(Ⅲ)-H2L溶液体系,其中c0(Fe3+)=2.0×10-4mol·L-1,c0(H2L)=5.0×10-3 mol·L-1。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数δ(x)=,已知lg2≈0.30,lg3≈0.48。下列说法正确的是 (C)
Fe(Ⅲ)-H2L体系部分物种分布图
A.当pH=1时,体系中c(H2L)>c{[FeL]+}>c(OH-)>c(HL-)
B.pH在9.5~10.5之间,含L的物种主要为L2-
C.L2-+[FeL]+ [FeL2]-的平衡常数的lgK约为14
D.当pH=10时,参与配位的c(L2-)≈1.0×10-3 mol·L-1
5.(2022福建,5,4分)探究醋酸浓度与电离度(α)关系的步骤如下。与相关步骤对应的操作或叙述正确的是 (C)
步骤 操作或叙述
A Ⅰ.用NaOH标准溶液标定醋酸溶液浓度 滴定时应始终注视滴定管中的液面
B Ⅱ.用标定后的溶液配制不同浓度的醋酸溶液 应使用干燥的容量瓶
C Ⅲ.测定步骤Ⅱ中所得溶液的pH 应在相同温度下测定
D Ⅳ.计算不同浓度溶液中醋酸的电离度 计算式为 α=×100%
6.(2022浙江1月选考,17,2分)已知25 ℃时二元酸H2A的=1.3×10-7,=7.1×10-15。下列说法正确的是 (B)
A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者
B.向0.1 mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%
C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)
D.取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
7.(2021湖北,14,3分,改编)常温下,已知H3PO3溶液中含磷物种的浓度之和为0.1 mol·L-1,溶液中各含磷物种的pc-pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法正确的是 (D)
A.曲线①表示pc(H3PO3)随pOH的变化
B.H3PO3为三元酸且具有还原性
C.pH=4的溶液中:c(H2P)<0.1 mol·L-1-2c(HP)
D.H3PO3+HP的平衡常数K>1.0×105
8.(2021浙江6月选考,19,2分)某同学拟用pH计测定溶液pH以探究某酸HR是否为弱电解质。下列说法正确的是 (B)
A.25 ℃时,若测得0.01 mol·L-1 NaR溶液pH=7,则HR是弱酸
B.25 ℃时,若测得0.01 mol·L-1 HR溶液pH>2且pH<7,则HR是弱酸
C.25 ℃时,若测得HR溶液pH=a,取该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得pH=b,b-a<1,则HR是弱酸
D.25 ℃时,若测得NaR溶液pH=a,取该溶液10.0 mL,升温至50 ℃,测得pH=b,a>b,则HR是弱酸
9.(2020北京,11,3分)室温下,对于1 L 0.1 mol·L-1醋酸溶液,下列判断正确的是 (C)
A.该溶液中CH3COO-数目为6.02×1022
B.加入少量CH3COONa固体后,溶液的pH降低
C.滴加NaOH溶液过程中,n(CH3COO-)与n(CH3COOH)之和始终为0.1 mol
D.与Na2CO3溶液反应的离子方程式为C+2H+ H2O+CO2↑
10.(2022天津,16,14分)天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物Fe3+L(L为配体)溶于弱碱性的海水中,制成吸收液,将气体H2S转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①H2S的吸收氧化;②Fe3+L的再生。反应原理如下:
①H2S(g)+2Fe3+L(aq)+2OH-(aq) S(s)+2Fe2+L(aq)+2H2O(l) ΔH=-a kJ·mol-1(a>0)
②4Fe2+L(aq)+O2(g)+2H2O(l) 4Fe3+L(aq)+4OH-(aq) ΔH=-b kJ·mol-1(b>0)
回答下列问题:
(1)该工艺的总反应方程式为 2H2S+O2 2H2O+2S↓[或2H2S(g)+O2(g) 2H2O(l)+2S(s)] 。1 mol H2S(g)发生该反应的热量变化为 放出(a+) kJ热量 ,Fe3+L在总反应中的作用是 作催化剂(或降低反应活化能) 。
(2)研究不同配体与Fe3+所形成的配合物(A、B、C)对H2S吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入H2S,测得单位体积吸收液中H2S吸收转化率[α(H2S)]随时间变化的曲线如图1所示。以α(H2S)由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是 A (填“A”“B”或“C”)。
图1
(3)H2S的电离方程式为 H2S+H2O H3O++HS-(或H2S H++HS-,同时写出第二步电离也可) 。25 ℃时,H2S溶液中H2S、HS-、S2-在含硫粒子总浓度中所占分数δ随溶液pH的变化关系如图2。由图2计算,H2S的= 1.0×10-7 ,= 1.0×10-13 。再生反应在常温下进行,Fe2+L解离出的Fe2+易与溶液中的S2-形成沉淀。若溶液中的c(Fe2+)=1.0×10-5 mol·L-1,c(H2S)=6.0×10-9 mol·L-1,为避免有FeS沉淀生成,应控制溶液pH不大于 8 (已知25 ℃时,FeS的Ksp为6.0×10-18)。
图2
11.(2024广东,19,14分)酸在多种反应中具有广泛应用,其性能通常与酸的强度密切相关。
(1)酸催化下NaNO2与NH4Cl混合溶液的反应(反应a),可用于石油开采中油路解堵。
①基态N原子价层电子的轨道表示式为
②反应a:N(aq)+N(aq) N2(g)+2H2O(l)
已知:
则反应a的ΔH= ΔH1-ΔH2-ΔH3+ΔH4 。
③某小组研究了3种酸对反应a的催化作用。在相同条件下,向反应体系中滴加等物质的量的少量酸,测得体系的温度T随时间t的变化如图。据图可知,在该过程中, BD 。
A.催化剂酸性增强,可增大反应焓变
B.催化剂酸性增强,有利于提高反应速率
C.催化剂分子中含H越多,越有利于加速反应
D.反应速率并不始终随着反应物浓度下降而减小
(2)在非水溶剂中,将CO2转化为化合物ⅱ(一种重要的电子化学品)的催化机理示意图如图所示,其中的催化剂有 AcOH 和 KI 。
(3)在非水溶剂中研究弱酸的电离平衡具有重要科学价值。一定温度下,某研究组通过分光光度法测定了两种一元弱酸HX(X为A或B)在某非水溶剂中的Ka。
a.选择合适的指示剂HIn,Ka(HIn)=3.6×10-20;其钾盐为KIn。
b.向KIn溶液中加入HX,发生反应:In-+HX X-+HIn。KIn起始的物质的量为n0(KIn),加入HX的物质的量为n(HX),平衡时,测得c平(In-)/c平(HIn)随n(HX)/n0(KIn)的变化曲线如图。
已知:该溶剂本身不电离,钾盐在该溶剂中完全电离。
①计算Ka(HA)(写出计算过程,结果保留两位有效数字)。
答案 根据=1.0时,=3.0,设n(HA)=n0(KIn)=1 mol,列三段式:
In-+HA A-+HIn
起始/mol 1 1 0 0
转化/mol 0.25 0.25 0.25 0.25
平衡/mol 0.75 0.75 0.25 0.25
K=,Ka(HA)=Ka(HIn)×=4.0×10-21
②在该溶剂中,Ka(HB) > Ka(HA);Ka(HB) > Ka(HIn)(填“>”“<”或“=”)。
考点2 溶液的酸碱性 酸碱中和滴定
12.(2024湖南,13,3分)常温下Ka(HCOOH)=1.8×10-4,向20 mL 0.10 mol·L-1 NaOH溶液中缓慢滴入相同浓度的HCOOH溶液,混合溶液中某两种离子的浓度随加入HCOOH溶液体积的变化关系如图所示,下列说法错误的是 (D)
A.水的电离程度:M
C.当V(HCOOH)=10 mL时,c(OH-)=c(H+)+2c(HCOOH)+c(HCOO-)
D.N点:c(Na+)>c(HCOO-)>c(OH-)>c(H+)>c(HCOOH)
13.(2023湖南,12,3分)常温下,用浓度为0.020 0 mol·L-1的NaOH标准溶液滴定浓度均为0.020 0 mol·L-1的HCl和CH3COOH的混合溶液,滴定过程中溶液的pH随η[η=]的变化曲线如图所示。
下列说法错误的是 (D)
A.Ka(CH3COOH)约为10-4.76
B.点a:c(Na+)=c(Cl-)=c(CH3COO-)+c(CH3COOH)
C.点b:c(CH3COOH)
N2+N2H4
N2H4+CH3COOH N2+CH3COO-
下列酸性强弱顺序正确的是 (D)
A.N2
B.N2
C.NH3>N2H4>CH3COO-
D.CH3COOH>N2
15.(2022山东,6,2分)实验室用基准Na2CO3配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定Na2CO3标准溶液。下列说法错误的是 (A)
A.可用量筒量取25.00 mL Na2CO3标准溶液置于锥形瓶中
B.应选用配有塑料塞的容量瓶配制Na2CO3标准溶液
C.应选用烧杯而非称量纸称量Na2CO3固体
D.达到滴定终点时溶液显橙色
16.(2022河北,9,3分)某水样中含一定浓度的C和其他不与酸碱反应的离子。取10.00 mL水样,用0.010 00 mol·L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。
下列说法正确的是 (C)
A.该水样中c(C)=0.01 mol·L-1
B.a点处c(H2CO3)+c(H+)=c(OH-)
C.当V(HCl)≤20.00 mL时,溶液中c(HC)基本保持不变
D.曲线上任意一点存在c(C)+c(HC)+c(H2CO3)=0.03 mol·L-1
17.(2021浙江1月选考,17,2分)25 ℃时,下列说法正确的是 (D)
A.NaHA溶液呈酸性,可以推测H2A为强酸
B.可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐
C.0.010 mol·L-1、0.10 mol·L-1的醋酸溶液的电离度分别为α1、α2,则α1<α2
D.100 mL pH=10.00的Na2CO3溶液中水电离出H+的物质的量为1.0×10-5 mol
三年模拟
题型强化练
题型 中和滴定原理的迁移应用
1.(2024湖南长郡中学期末适应考,12)莫尔法测定生理盐水浓度的过程如下:移取10.00 mL稀释后的生理盐水置于250 mL锥形瓶中,加入3滴K2CrO4溶液作指示剂,用0.100 0 mol·L-1 AgNO3标准溶液滴定至终点。重复3次,消耗标准溶液的体积平均为V mL,然后计算出NaCl的浓度。已知:Ksp(AgCl)=1.77×10―10;Ksp(Ag2CrO4)=1.12×10-12;Ag2CrO4为砖红色沉淀。下列关于本实验的说法正确的是 (A)
A.可用酸式滴定管盛装AgNO3标准溶液
B.该稀释后的生理盐水浓度为0.1V mol·L-1
C.实验中若用生理盐水润洗锥形瓶将导致测定结果偏低
D.在相同浓度的KCl和K2CrO4混合溶液中滴入AgNO3溶液,先出现砖红色沉淀
2.(2024福建厦门双十中学模拟,10)电位滴定是利用溶液电位突变指示终点的滴定法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。常温下,用x mol·L-1盐酸标准溶液测定y mL某Na2CO3样品溶液中NaHCO3的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说法正确的是(D)
(注:—表示电极电位曲线图; 表示电极电压曲线图)
A.该滴定过程需要加入酸碱指示剂
B.a点溶液中:c(OH-)+2c(C)=c(H+)+c(H2CO3)
C.b到c过程中存在c(Na+)>c(Cl-),水的电离程度:b
3.(2024北京西城一模,14)利用碘量法测定某纯净水样中溶解O2的含量,实验如下(加入的试剂已除去O2)。
步骤1 水样中O2的固定:用250 mL的水瓶盛满水样,加入1.0 mL 2 mol/L MnSO4溶液,再加入含9 mol/L NaOH溶液和1.8 mol/L KI溶液的混合液2.0 mL,部分水样溢出,立即盖好瓶盖,翻转摇匀,生成白色沉淀Mn(OH)2,随即有棕色沉淀MnO(OH)2生成。
步骤2 生成I2:当水样中的沉淀沉降到距瓶口三分之一以下时,缓缓加入适量稀H2SO4至液面下,部分溶液溢出,立即盖好瓶盖,翻转摇动,至沉淀完全溶解,得到黄色溶液。
步骤3 测定及计算:用碘量法测出步骤2中生成的I2为b mol,进而计算出该纯净水样中溶解O2的含量。
已知:O2直接氧化I-的反应速率很慢。
下列说法不正确的是 (D)
A.步骤1中,用注射器加入试剂时应将细长针头插到液面下一定距离
B.步骤2中,生成I2的反应:MnO(OH)2+4H++2I- Mn2++I2+3H2O
C.步骤2中,部分溶液溢出不影响测定该纯净水样中溶解O2的含量
D.步骤3中,经计算,该纯净水样中含有O2的浓度为 g/L
4.(2024河北唐山一模,15,节选)已知三氯化六氨合钴[Co(NH3)6]Cl3为橙黄色晶体,易溶于热水,在冷水中微溶,可在氯化铵和氨水的混合溶液中、在活性炭作催化剂条件下,利用H2O2溶液氧化CoCl2制备。
Ⅱ.测定产品纯度,实验如下:
①称取a g产品溶于足量稀硝酸中,并用蒸馏水稀释,置于锥形瓶中,加入过量V1 mL c1 mol·L-1 AgNO3溶液,并加3 mL的硝基苯用力振荡。
②向锥形瓶中滴入3滴Fe(NO3)3溶液为指示剂,用c2 mol·L-1 KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时用去V2 mL KSCN溶液。[已知:Ksp(AgCl)=1.8×10-10,Ksp(AgSCN)=1.0×10-12]
回答下列问题:
(1)产品的质量分数为 ×100% 。(列出计算式)
(2)加入硝基苯的目的是 使生成的AgCl沉淀被硝基苯覆盖,防止AgCl转化为AgSCN沉淀 。
5.(2024湖南雅礼中学第八次月考,16,节选)高纯二氧化锗的含量采用碘酸钾滴定法进行测定。称取a g高纯二氧化锗样品,加入氢氧化钠溶液在电炉中溶解,冷却至20 ℃以下,然后用次磷酸与过量氢氧化钠溶液反应得到的次磷酸钠(NaH2PO2)将其还原为Ge2+,以淀粉为指示剂,用b mol/L的碘酸钾标准溶液滴定,消耗碘酸钾标准溶液的体积为V mL。(20 ℃以下,次磷酸钠不会被碘酸钾和碘氧化)
资料:3Ge2++I+5I-+6H+ 3I2+3H2O。
①次磷酸钠(NaH2PO2)为 正盐 (填“正盐”或“酸式盐”)。
②上述滴定终点的判断方法为 当滴加最后半滴标准溶液,溶液由无色变为蓝色,且30秒内不变色即可认为达滴定终点 。
③此样品中二氧化锗的质量分数是 ×100% (用表达式表示)。
6.(2024陕西西安一中二模,26,节选)(6)用Na2H2Y溶液测定饮用水的总硬度。取饮用水样品250 mL,加入掩蔽剂排除干扰,调节pH等预处理后,用0.010 0 mol·L-1 Na2H2Y标准溶液进行测定。测定中涉及的反应有:M2++HIn2-(蓝色) MIn-(酒红色)+H+、MIn-(酒红色)+H2Y2- MY2-+HIn2-(蓝色)+H+、M2++H2Y2- MY2-+2H+[M2+代表Mg2+、Ca2+;铬黑T(HIn2-)为指示剂]。
①达到滴定终点的现象是 当滴入最后半滴Na2H2Y溶液,溶液由酒红色变为蓝色,且半分钟内不恢复原色 。
②平行实验三次,滴定终点时共消耗Na2H2Y溶液的平均体积为20.00 mL,则该饮用水的硬度= 4.48 度(水硬度的表示方法是将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1 L水中含有10 mg CaO称为1度)。
综合拔高练
建议用时:45分钟
1.(2024湖北4月调研,12)已知溶剂分子结合H+的能力会影响酸给出H+的能力,某温度下部分酸在冰醋酸中的pKa如下表所示。下列说法错误的是 (D)
分子式 HClO4 H2SO4 HCl HNO3
pKa=-lgKa 4.87 7.24(一级) 8.9 9.4
A.HClO4在冰醋酸中的电离方程式:HClO4+CH3COOH Cl
B.在冰醋酸中酸性:HClO4>H2SO4>HCl>HNO3
C.结合H+的能力:H2O>CH3COOH
D.相同温度下醋酸在液氨中的pKa大于其在水中的pKa
2.(2024江苏苏锡常镇四市二模,12)实验室用如下方案测定Na2CO3和NaHCO3混合物的组成:称取一定质量样品溶解于锥形瓶中,加入2滴指示剂M,用标准盐酸滴定至终点时消耗盐酸V1 mL;向锥形瓶中再加入2滴指示剂N,继续用标准盐酸滴定至终点,又消耗盐酸V2 mL。下列说法正确的是 (D)
A.指示剂M、N可依次选用甲基橙、酚酞
B.样品溶解后的溶液中:2c(Na+)=3c(C)+3c(HC)+3c(H2CO3)
C.滴定至第一次终点时的溶液中:c(H+)+c(Na+)=c(OH-)+c(HC)+2c(C)
D.样品中Na2CO3和NaHCO3物质的量之比为
3.(2024安徽江淮十校第三次联考,15)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验。
实验Ⅰ:往20 mL 0.1 mol/L NaHC2O4溶液中滴加0.1 mol/L NaOH溶液。
实验Ⅱ:往20 mL 0.1 mol/L NaHC2O4溶液中滴加0.1 mol/L CaCl2溶液。
已知:H2C2O4的电离常数=5.4×10-2,=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计。下列说法错误的是 (D)
A.实验Ⅰ可选用酚酞作指示剂,指示反应终点
B.实验Ⅰ中V(NaOH)=10 mL时,溶液显酸性
C.实验Ⅱ中在初始阶段发生的反应是2HC2+Ca2+ CaC2O4↓+H2C2O4
D.实验Ⅱ中V(CaCl2)=80 mL时,溶液中c(C2)=4.0×10-7 mol/L
4.(2024江西赣州二模,14)赣南脐橙富含柠檬酸(用H3R表示)。常温下,用0.1 mol·L-1 NaOH溶液滴定20.00 mL 0.1 mol·L-1 H3R溶液,滴定曲线如图所示。下列说法正确的是 (A)
(已知:常温下柠檬酸的电离常数:=1.0×10-3.1,=1.0×10-4.8,=1.0×10-6.4)
A.a点溶液中:c(H3R)+c(H+)=c(HR2-)+2c(R3-)+c(OH-)
B.反应H3R+HR2- 2H2R-的平衡常数K=10-1.7
C.b点溶液中,c(Na+)>c(HR2-)>c(H2R-)>c(R3-)
D.常温下,Na2HR溶液加水稀释过程中,增大
5.(2024吉林白山一模,15)常温下,向20 mL 0.2 mol·L-1一元弱碱ROH溶液中逐滴加入0.1 mol·L-1盐酸,溶液的M值[M=lg]随加入盐酸体积的变化曲线如图所示。已知a点溶液pH=9.8。下列说法中错误的是 (D)
A.Kb(ROH)=1×10-4.2
B.b点时,c(R+)>c(Cl-)>c(ROH)>c(OH-)>c(H+)
C.c点时,c(Cl-)=c(R+)+c(ROH)
D.a、b、c、d四点中,水的电离程度最小的是d点
6.(2024九省联考江西卷,12)马来酸依那普利(记为X,摩尔质量为M g/mol)是一种心血管疾病防治药物,结构如下所示:
通常使用以下两种方法滴定分析样品中X的质量分数w:
方法一:将m g样品溶于有机溶剂中,以c1 mol/L的HClO4溶液滴定,终点消耗V1 mL HClO4溶液,计量关系为n(X)∶n(HClO4)=1∶1;
方法二:将m g样品溶于水中,以c2 mol/L的NaOH溶液滴定,终点消耗V2 mL NaOH溶液,计量关系为n(X)∶n(NaOH)=1∶3。
下列说法正确的是 (B)
A.方法一滴定终点时,pH=7
B.方法一w=×100%
C.方法二滴定终点时,pH=7
D.方法二w=×100%
7.(2024山东济宁一模)阅读下列材料,回答(1)~(2)题。
氧泡泡是一种多功能新型漂白剂,其有效成分是过碳酸钠(xNa2CO3·yH2O2)。
Ⅰ.以芒硝(Na2SO4·10H2O)、H2O2等为原料制备过碳酸钠的工艺流程如图所示:
Ⅱ.测定过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
①用电子天平称取两份质量均为m g的样品。
②将一份置于锥形瓶中,加水溶解,加催化剂使H2O2充分快速分解(催化剂不参与其他反应),然后加酚酞作指示剂,用0.050 0 mol·L-1 H2SO4溶液滴定至终点,消耗硫酸V1 mL。
③将另一份置于碘量瓶中,加入50 mL蒸馏水,并立即加入6 mL 2.0 mol·L-1 H3PO4溶液,再加入过量KI固体,摇匀后于暗处放置10 min,加入适量指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V2 mL。(已知:2Na2S2O3+I2 Na2S4O6+2NaI)
(1)关于过碳酸钠制备的流程,下列说法错误的是 (A)
A.步骤1中2 mol芒硝参与反应时,消耗1 mol Na2Cr2O7
B.滤渣的主要成分为CaSO4
C.步骤2的化学方程式为2Na2CrO4+2CO2+H2O Na2Cr2O7+2NaHCO3↓
D.稳定剂的作用是阻止微量杂质金属离子的催化作用,减少H2O2的分解
(2)测定过碳酸钠化学式的步骤中,下列说法错误的是 (B)
A.步骤③样品溶于水酸化后放置一段时间,然后再加入过量KI固体,导致x∶y偏大
B.该过碳酸钠样品中x∶y=V1∶V2
C.该样品的纯度为%
D.步骤②中滴定前滴定管尖嘴处有气泡,滴定后无气泡,导致x∶y偏大
8.(2024福建泉州一模,10)硼酸(H3BO3)在水溶液中存在电离平衡:H3BO3+H2O [B(OH)4]-+H+ K=10-9.34。用0.01 mol/L NaOH溶液分别滴定体积均为20 mL的0.01 mol/L硼酸溶液、0.01 mol/L硼酸和甘露醇混合溶液,滴定过程中硼酸溶液pH、混合溶液的随加入的NaOH溶液体积的变化如图。
已知:+2 +4H2O
下列说法错误的是 ()
A.加入甘露醇促进硼酸电离平衡正向移动
B.溶液中c(H+):M点>N点
C.P点:c(H3BO3)=c{[B(OH)4]-}>c(OH-)>c(H+)
D.W点:c(Na+)+c(H+)+c(H3BO3)-c(OH-)=0.01 mol/L
9.(2024安徽安庆二模,12)某温度下,改变0.1 mol/L K2Cr2O7溶液的pH,各种含铬元素粒子的浓度变化如图所示(已知H2CrO4是二元弱酸,其电离常数为)。下列有关说法错误的是 (D)
A.该温度下的KW=1×10-14
B.该温度下(H2CrO4)的数量级为10-1
C.该温度下反应Cr2+2H+的平衡常数为5.1×10-15.2
D.B点溶液中:c(K+)≤2c(Cr2)+3c(Cr)
10.(2024广东湛江一模,17)Na2S2O3标准溶液是氧化还原反应中常用的还原性标定试剂,但配制时使用的Na2S2O3·5H2O固体中通常含有一些杂质,且易风化和潮解。Na2S2O3溶液也容易被O2氧化。因此在实际操作中,Na2S2O3标准溶液配制好后常用K2Cr2O7进行标定。但又由于K2Cr2O7与Na2S2O3反应的产物有很多种,不能按确定的反应式进行,故无法通过氧化还原滴定法确定浓度。操作中一般先用K2Cr2O7与过量的KI反应,定量生成的I2再用Na2S2O3滴定,发生反应的离子方程式为Cr2。我们将这种Na2S2O3与I2联用的方法称为碘量法,碘量法是分析化学中常用的分析方法,常用于一些无法直接滴定的反应的物质的间接滴定。
已知:K2Cr2O7与KI的反应需要一定的时间才能进行得比较完全,故需放置约5 min。
(1)Na2S2O3标准溶液的配制。
①配制480 mL 0.1 mol/L的Na2S2O3标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、 500 mL容量瓶 。
②将下述实验步骤A到F按实验过程先后次序排列 CBDFAE 。
(2)Na2S2O3标准溶液的标定:取20.00 mL 0.017 mol/L K2Cr2O7溶液于250 mL锥形瓶中,加入5 mL 6 mol/L HCl溶液,再加入10 mL 100 g/L KI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用Na2S2O3溶液滴定至浅黄色后加入2 mL淀粉指示剂,继续滴定至终点,平行测定3次,计算Na2S2O3标准溶液的浓度。
①用 酸式滴定管 量取20.00 mL 0.017 mol/L K2Cr2O7溶液。
②加入KI摇匀后用牛皮纸扎紧瓶口的目的是 防止空气中氧气氧化I- 。
③如何判定滴定结束 当滴入最后半滴Na2S2O3溶液,溶液蓝色褪去,且30 s内不恢复蓝色 。
④列式并计算Na2S2O3标准溶液的浓度。
K2Cr2O7溶液 KI溶液 V(Na2S2O3)/mL c(Na2S2O3)/(mol/L)
20.00 mL 0.017 mol/L 10 mL 100 g/L 20.35
20.45
20.40
21.20
答案 =0.100 mol·L-1
(3)借鉴(2)的方法,用碘量法测定KMnO4溶液的物质的量浓度:量取25.00 mL待测液于250 mL锥形瓶中,加入2 mol/L H2SO4溶液25 mL,再加入10% KI溶液10 mL,然后用已知浓度的Na2S2O3溶液滴定到淡黄色,加0.5%的淀粉溶液3 mL,用Na2S2O3溶液继续滴定至终点。
①滴定时需加入硫酸。能否用盐酸代替硫酸,为什么 不能,KMnO4会与HCl发生反应生成Cl2 。
②写出KMnO4溶液与KI反应的离子方程式: 2Mn+10I-+16H+ 2Mn2++5I2+8H2O 。
(4)借鉴(3)的方法,某小组用碘量法测量磷酸铁锂溶液中Fe3+的物质的量浓度。
提出问题:Fe3+与I-是可逆反应,Fe3+的存在是否会影响滴定
实验验证:①在磷酸铁锂溶液中加入过量的KI,静置一段时间后,加入KSCN,观察到溶液颜色变红;请写出Fe3+与I-反应的离子方程式: 2Fe3++2I- 2Fe2++I2 。
②取标准量的磷酸铁锂溶液,分成两组,其中一组加入过量的KI溶液,另一组加入等量的水。再分别使用Na2S2O3溶液进行标定,发现消耗的Na2S2O3溶液体积相同。
实验小结:Fe3+ 不影响 滴定(填“影响”或“不影响”)。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
