2025版新教材高考化学第二轮复习专题练--专题十一 盐类水解和沉淀溶解平衡(含答案)
文档属性
| 名称 | 2025版新教材高考化学第二轮复习专题练--专题十一 盐类水解和沉淀溶解平衡(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-09 21:24:46 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025版新教材高考化学第二轮复习
专题十一 盐类水解和沉淀溶解平衡
五年高考
考点1 盐类水解
1.(2024安徽,13,3分)环境保护工程师研究利用Na2S、FeS和H2S处理水样中的Cd2+。
已知25 ℃时,H2S饱和溶液浓度约为0.1 mol·L-1,(H2S)=10-6.97,(H2S)=10-12.90,Ksp(FeS)=10-17.20,Ksp(CdS)=10-26.10。
下列说法错误的是 ( )
A.Na2S溶液中:c(H+)+c(Na+)=c(OH-)+c(HS-)+2c(S2-)
B.0.01 mol·L-1 Na2S溶液中:c(Na+)>c(S2-)>c(OH-)>c(HS-)
C.向c(Cd2+)=0.01 mol·L-1的溶液中加入FeS,可使c(Cd2+)<10-8 mol·L-1
D.向c(Cd2+)=0.01 mol·L-1的溶液中通入H2S气体至饱和,所得溶液中:c(H+)>c(Cd2+)
2.(2023北京,3,3分)下列过程与水解反应无关的是 ( )
A.热的纯碱溶液去除油脂
B.重油在高温、高压和催化剂作用下转化为小分子烃
C.蛋白质在酶的作用下转化为氨基酸
D.向沸水中滴入饱和FeCl3溶液制备Fe(OH)3胶体
3.(2023重庆,11,3分)(NH4)2SO4溶解度随温度变化的曲线如图所示,关于各点对应的溶液,下列说法正确的是 ( )
A.M点KW等于N点KW
B.M点pH大于N点pH
C.N点降温过程中有2个平衡发生移动
D.P点c(H+)+c(N)+c(NH3·H2O)=c(OH-)+2c(S)
4.(2023海南,14,4分)25 ℃下,Na2CO3水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是 ( )
A.c(Na2CO3)=0.6 mol·L-1时,溶液中c(OH-)<0.01 mol·L-1
B.Na2CO3水解程度随其浓度增大而减小
C.在水中H2CO3的<4×10-11
D.0.2 mol·L-1的Na2CO3溶液和0.3 mol·L-1的NaHCO3溶液等体积混合,得到的溶液中c(OH-)<2×10-4 mol·L-1
5.(2023福建,10,4分)25 ℃时,某二元酸(H2A)的=10-4.37。1.0 mol·L-1 NaHA溶液稀释过程中δ(H2A)、δ(HA-)、δ(A2-)与pc(Na+)的关系如图所示。已知pc(Na+)=-lgc(Na+),HA-的分布系数δ(HA-)=。下列说法错误的是 ( )
A.曲线n为δ(HA-)的变化曲线
B.a点:pH=4.37
C.b点:2c(H2A)+c(HA-)=c(Na+)
D.c点:c(Na+)+c(H+)=3c(HA-)+c(OH-)
6.(2023江苏,12,3分)室温下,用含少量Mg2+的MnSO4溶液制备MnCO3的过程如图所示。已知Ksp(MgF2)=5.2×10-11,Ka(HF)=6.3×10-4。下列说法正确的是 ( )
A.0.1 mol·L-1 NaF溶液中:c(F-)=c(Na+)+c(H+)
B.“除镁”得到的上层清液中:c(Mg2+)=
C.0.1 mol·L-1 NaHCO3溶液中:c(C)=c(H+)+c(H2CO3)-c(OH-)
D.“沉锰”后的滤液中:c(Na+)+c(H+)=c(OH-)+c(HC)+2c(C)
7.(2023浙江6月选考,15,3分)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验:
实验Ⅰ:往20 mL 0.1 mol·L-1 NaHC2O4溶液中滴加0.1 mol·L-1 NaOH溶液。
实验Ⅱ:往20 mL 0.10 mol·L-1 NaHC2O4溶液中滴加0.10 mol·L-1 CaCl2溶液。
[已知:H2C2O4的电离常数=5.4×10-2,=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计],下列说法正确的是 ( )
A.实验Ⅰ可选用甲基橙作指示剂,指示反应终点
B.实验Ⅰ中V(NaOH)=10 mL时,存在c(C2)C.实验Ⅱ中发生反应HC2+Ca2+ CaC2O4↓+H+
D.实验Ⅱ中V(CaCl2)=80 mL时,溶液中c(C2)=4.0×10-8 mol·L-1
8.(双选)(2022海南,13,4分)NaClO溶液具有漂白能力。已知25 ℃时,Ka(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是 ( )
A.0.01 mol·L-1溶液中,c(ClO-)<0.01 mol·L-1
B.长期露置在空气中,释放Cl2,漂白能力减弱
C.通入过量SO2,反应的离子方程式为SO2+ClO-+H2O HS+HClO
D.25 ℃,pH=7.0的NaClO和HClO的混合溶液中,c(HClO)>c(ClO-)=c(Na+)
9.(2022辽宁,15,3分)甘氨酸(NH2CH2COOH)是人体必需氨基酸之一。在25 ℃时,NCH2COO-和NH2CH2COO-的分布分数[如δ(A2-)=]与溶液pH关系如图。下列说法错误的是 ( )
A.甘氨酸具有两性
B.曲线c代表NH2CH2COO-
C.NCH2COOH+OH-的平衡常数K=10-11.65
D.c2(NCH2COO-)10.(2022浙江1月选考,23,2分)某同学在两个相同的特制容器中分别加入20 mL 0.4 mol·L-1 Na2CO3溶液和40 mL 0.2 mol·L-1 NaHCO3溶液,再分别用0.4 mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如下曲线:
下列说法正确的是 ( )
A.图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸
B.当滴加盐酸的体积为V1 mL时(a点、b点),所发生的反应用离子方程式表示为:HC+H+ CO2↑+H2O
C.根据pH-V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点
D.Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(C)=c(OH-)-c(H+)
11.(2021重庆,14,3分)下列叙述正确的是 ( )
A.向氨水中加入醋酸使溶液呈酸性,则c(N)>c(CH3COO-)
B.向NH4Cl溶液中加入少量Al2(SO4)3固体,则水的电离程度减小
C.向Na2CO3溶液中滴加盐酸至c(Na+)=2c(Cl-),则c(HC)>c(H2CO3)
D.向0.2 mol/L磷酸中加水至原体积的两倍,则c(H+)>0.1 mol/L
12.(2021广东,8,2分)鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl表示)。已知GHCl水溶液呈酸性,下列叙述正确的是 ( )
A.0.001 mol/L GHCl水溶液加水稀释,pH升高
B.0.001 mol/L GHCl水溶液的pH=3
C.GHCl在水中的电离方程式为:GHCl G+HCl
D.GHCl水溶液中:c(OH-)+c(Cl-)=c(GH+)+c(G)
13.(2021河北,6,3分)BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
下列说法错误的是 ( )
A.酸浸工序中分次加入稀HNO3可降低反应剧烈程度
B.转化工序中加入稀HCl可抑制生成BiONO3
C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度
D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成
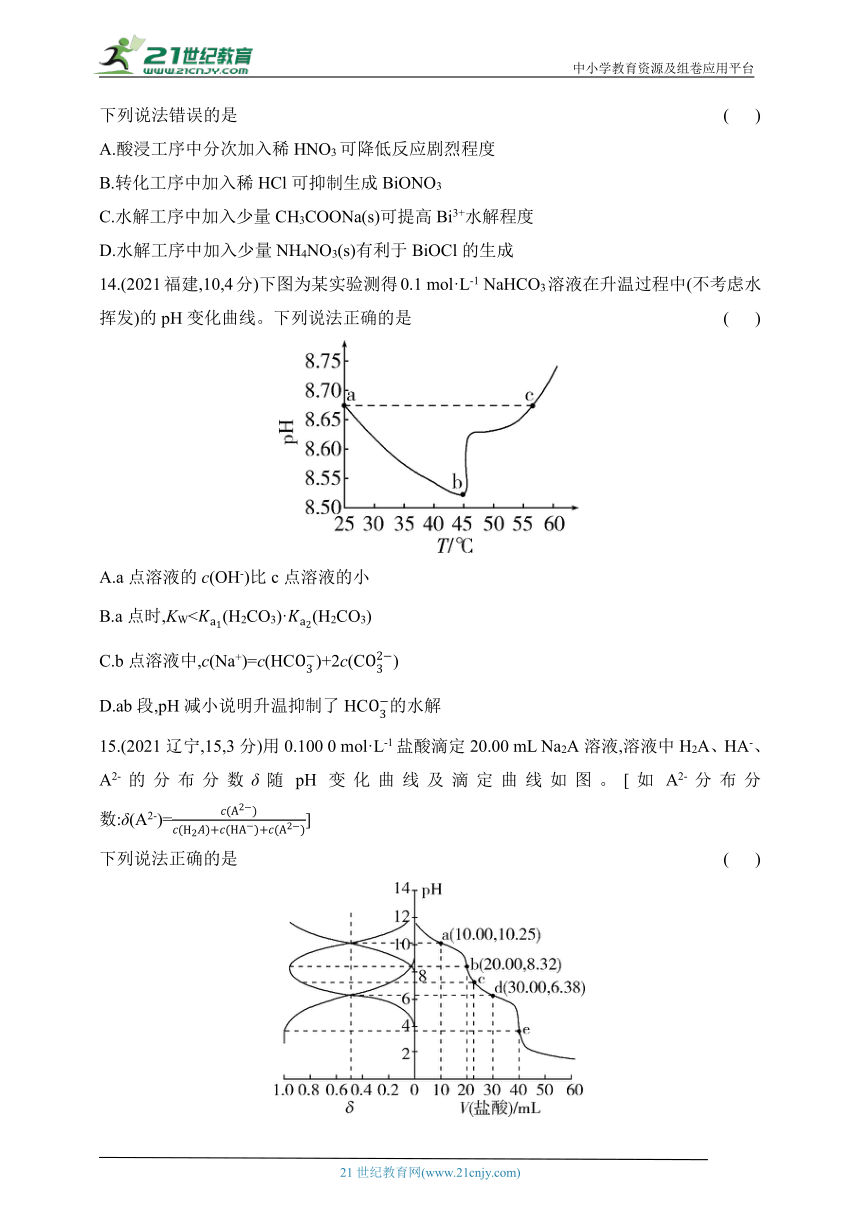
14.(2021福建,10,4分)下图为某实验测得0.1 mol·L-1 NaHCO3溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法正确的是 ( )
A.a点溶液的c(OH-)比c点溶液的小
B.a点时,KW<(H2CO3)·(H2CO3)
C.b点溶液中,c(Na+)=c(HC)+2c(C)
D.ab段,pH减小说明升温抑制了HC的水解
15.(2021辽宁,15,3分)用0.100 0 mol·L-1盐酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-的分布分数δ随pH变化曲线及滴定曲线如图。[如A2-分布分数:δ(A2-)=]
下列说法正确的是 ( )
A.H2A的为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选酚酞作指示剂
D.c(Na2A)=0.200 0 mol·L-1
16.(2021湖南,9,3分)常温下,用0.100 0 mol·L-1的盐酸分别滴定20.00 mL浓度均为0.100 0 mol·L-1的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是 ( )
A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)
C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)
D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-)
17.(2020海南,12,4分)某弱酸HA溶液中主要成分的分布分数随pH的变化如图所示。下列说法错误的是 ( )
A.该酸-lgKa≈4.7
B.NaA的水解平衡常数Kh=
C.当该溶液的pH=7.0时,c(HA)D.某c(HA)∶c(A-)=4∶1的缓冲溶液,pH≈4
18.(2020天津,7,3分)常温下,下列有关电解质溶液的说法错误的是 ( )
A.相同浓度的HCOONa和NaF两溶液,前者的pH较大,则Ka(HCOOH)>Ka(HF)
B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则Ksp(FeS)>Ksp(CuS)
D.在1 mol·L-1 Na2S溶液中,c(S2-)+c(HS-)+c(H2S)=1 mol·L-1
考点2 沉淀溶解平衡
19.(2024黑、吉、辽,15,3分)25 ℃下,AgCl、AgBr和Ag2CrO4的沉淀溶解平衡曲线如下图所示。某实验小组以K2CrO4为指示剂,用AgNO3标准溶液分别滴定含Cl-水样、含Br-水样。
已知:①Ag2CrO4为砖红色沉淀;
②相同条件下AgCl溶解度大于AgBr;
③25 ℃时,p(H2CrO4)=0.7,p(H2CrO4)=6.5。
下列说法错误的是 ( )
A.曲线②为AgCl沉淀溶解平衡曲线
B.反应Ag2CrO4+H+ 2Ag++HCr的平衡常数K=10-5.2
C.滴定Cl-时,理论上混合液中指示剂浓度不宜超过10-2.0 mol·L-1
D.滴定Br-达终点时,溶液中=10-0.5
20.(2024江西,13,3分)废弃电池中锰可通过浸取回收。某温度下,MnSO4在不同浓度的KOH水溶液中,Mn(Ⅱ)的分布系数δ与pH的关系如图。下列说法正确的是 ( )
已知:δ(MnOH+)=
;Mn(OH)2难溶于水,具有两性。
A.曲线z为δ(MnOH+)
B.O点,c(H+)=×10-10.3 mol·L-1
C.P点,c(Mn2+)D.Q点,c(S)=2c(MnOH+)+2c(Mn)
21.(2024全国甲,13,6分)将0.10 mmol Ag2CrO4配制成1.0 mL悬浊液,向其中滴加0.10 mol·L-1的NaCl溶液。lg [cM/(mol·L-1)](M代表Ag+、Cl-或Cr)随加入NaCl溶液体积(V)的变化关系如图所示。
下列叙述正确的是 ( )
A.交点a处:c(Na+)=2c(Cl-)
B.=10-2.21
C.V≤2.0 mL时不变
D.y1=-7.82,y2=-lg34
22.(2023河北,14,3分)某温度下,两种难溶盐AgxX、AgyY的饱和溶液中-lg c(Xx-)或-lg c(Yy-)与-lg c(Ag+)的关系如图所示。下列说法错误的是 ( )
A.x∶y=3∶1
B.若混合溶液中各离子浓度如J点所示,加入AgNO3(s),则平衡时变小
C.向AgxX固体中加入NayY溶液,可发生AgxX→AgyY的转化
D.若混合溶液中各离子起始浓度如T点所示,待平衡时c(Xx-)+c(Yy-)<2c(Ag+)
23.(2023北京,14,3分)利用平衡移动原理,分析一定温度下Mg2+在不同pH的Na2CO3体系中的可能产物。
已知:①图1中曲线表示Na2CO3体系中各含碳粒子的物质的量分数与pH的关系。
②图2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=Ksp[Mg(OH)2];曲线Ⅱ的离子浓度关系符合c(Mg2+)·c(C)=Ksp(MgCO3)[注:起始c(Na2CO3)=0.1 mol·L-1,不同pH下c(C)由图1得到]。
下列说法不正确的是 ( )
A.由图1,pH=10.25,c(HC)=c(C)
B.由图2,初始状态pH=11、lg[c(Mg2+)]=-6,无沉淀生成
C.由图2,初始状态pH=9、lg[c(Mg2+)]=-2,平衡后溶液中存在c(H2CO3)+c(HC)+c(C)=0.1 mol·L-1
D.由图1和图2,初始状态pH=8、lg[c(Mg2+)]=-1,发生反应:Mg2++2HC MgCO3↓+CO2↑+H2O
24.(2023全国乙,13,6分)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是 ( )
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)=c(Cr),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl- 2AgCl+Cr的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
25.(2023新课标,13,6分)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3 [Ag(NH3)]+和NH3+[Ag(NH3)]+ [Ag(NH3)2]+。lg[c(M)/(mol·L-1)]与lg[c(NH3)/(mol·L-1)]的关系如下图所示{其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+}。
下列说法错误的是 ( )
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线
B.AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-9.75
C.反应[Ag(NH3)]++NH3 [Ag(NH3)2]+的平衡常数K的值为103.81
D.c(NH3)=0.01 mol·L-1时,溶液中c{[Ag(NH3)2]+}>c{[Ag(NH3)]+}>c(Ag+)
26.(2023辽宁,15,3分)某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol·L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lg c关系如图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol·L-1。已知Ksp(NiS)>Ksp(CdS),下列说法正确的是 ( )
A.Ksp(CdS)=10-18.4
B.③为pH与-lg c(HS-)的关系曲线
C.Ka1(H2S)=10-8.1
D.Ka2(H2S)=10-14.7
27.(双选)(2023山东,15,4分)在含HgI2(s)的溶液中,一定c(I-)范围内,存在平衡关系:HgI2(s) HgI2(aq);HgI2(aq) Hg2++2I-;HgI2(aq) HgI++I-;HgI2(aq)+I- Hg;HgI2(aq)+2I- Hg,平衡常数依次为K0、K1、K2、K3、K4。已知lgc(Hg2+)、lgc(HgI+)、lgc(Hg)、lgc(Hg)随lgc(I-)的变化关系如图所示。下列说法错误的是 ( )
A.线L表示lgc(Hg)的变化情况
B.随c(I-)增大,c[HgI2(aq)]先增大后减小
C.a=lg
D.溶液中I元素与Hg元素的物质的量之比始终为2∶1
28.(2022重庆,11,3分)某小组模拟成垢—除垢过程如下。
100 mL 0.1 mol·L-1 CaCl2水溶液
……
忽略体积变化,且步骤②中反应完全。下列说法正确的是 ( )
A.经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-)
B.经过步骤②,溶液中c(Na+)=4c(S)
C.经过步骤②,溶液中c(Cl-)=c(C)+c(HC)+c(H2CO3)
D.经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)
29.(双选)(2022海南,14,4分)某元素M的氢氧化物M(OH)2(s)在水中的溶解反应为:
M(OH)2(s) M2+(aq)+2OH-(aq)
M(OH)2(s)+2OH-(aq) M(OH(aq)
25 ℃,-lgc与pH的关系如图所示,c为M2+或M(OH 浓度的值。下列说法错误的是 ( )
A.曲线①代表-lgc(M2+)与pH的关系
B.M(OH)2的Ksp约为1×10-10
C.向c(M2+)=0.1 mol·L-1的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以M(OH)2(s)存在
D.向c[M(OH]=0.1 mol·L-1的溶液中加入等体积0.4 mol·L-1的HCl溶液后,体系中元素M主要以M2+存在
30.(2022福建,7,3分)锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有Fe3+、Al3+、Fe2+和Mg2+杂质离子,可在0~14范围内调节pH对其净化(即相关离子浓度c<10-5 mol·L-1)。25 ℃时,lgc与pH关系见如图[碱性过强时Fe(OH)3和Fe(OH)2会部分溶解]。下列说法正确的是 ( )
A.Mg2+可被净化的pH区间最大
B.加入适量H2O2,可进一步提升净化程度
C.净化的先后顺序:Mg2+、Fe2+、Fe3+、Al3+
D.Ksp[Fe(OH)3]31.(2022山东,14,4分)工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究。现有含SrCO3(s)的0.1 mol·L-1、1.0 mol·L-1 Na2CO3溶液,含SrSO4(s)的0.1 mol·L-1、1.0 mol·L-1 Na2SO4溶液。在一定pH范围内,四种溶液中lg[c(Sr2+)/mol·L-1]随pH的变化关系如图所示。下列说法错误的是 ( )
A.反应SrSO4(s)+C SrCO3(s)+S
B.a=-6.5
C.曲线④代表含SrCO3(s)的1.0 mol·L-1 Na2CO3溶液的变化曲线
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
三年模拟
题型强化练
题型 溶液中离子平衡图像分析
1.(2024安徽合肥三模,13)25 ℃,取浓度均为0.1 mol·L-1的ROH溶液和HX溶液各20 mL,分别用0.1 mol·L-1的盐酸、0.1 mol·L-1的NaOH溶液进行滴定。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法正确的是 ( )
A.HX为弱酸,ROH为强碱
B.曲线ⅡV=10 mL时溶液中:c(OH-)-c(H+)=c(HX)-c(X-)
C.滴定前,ROH溶液中:c(ROH)>c(OH-)>c(R+)>c(H+)
D.滴定至V=40 mL的过程中,两种溶液中由水电离出的c(H+)·c(OH-)始终保持不变
2.(2024东北三省一模,15)菠萝“扎嘴”的原因之一是菠萝中含有一种难溶于水的草酸钙针晶。常温下,草酸钙在不同pH体系中lgc(M)与pH的关系如图所示(M代表H2C2O4、HC2、Ca2+),已知Ksp(CaC2O4)=10-8.62、Ksp[Ca(OH)2]=10-5.6。下列有关说法正确的是 ( )
A.(H2C2O4)的数量级为10-4
B.溶液pH=7时,c(HC2)+2c(C2)=2c(Ca2+)
C.pH>12时,曲线①呈上升趋势的原因是部分CaC2O4转化为Ca(OH)2
D.A点时,体系中c(Ca2+)>c(H2C2O4)=c(HC2)>c(C2)>c(H+)>c(OH-)
3.(2024广东湛江二模,16)常温下,等浓度的氨水和醋酸溶液互相滴定过程中,溶液中pH与pX[pX=-lg]的关系如图所示。下列说法错误的是 ( )
A.常温下,Ka(CH3COOH)=1×10-4.76
B.水的电离程度:fC.曲线Ⅱ代表氨水滴定CH3COOH溶液
D.g点c(CH3COO-)=c(N)>c(CH3COOH)=c(NH3·H2O)
4.(2024湖北武汉4月调研,15)为测定[Ag(CN)n]1-n中Ag+的配位数n,将浓度均为0.01 mol·L-1的AgNO3和KCN溶液按不同体积比混合,其用量和溶液浑浊度的关系如下图所示。已知:Ksp(AgCN)=1.6×10-14。下列说法错误的是 ( )
A.b点对应的V[AgNO3(aq)]= mL
B.[Ag(CN)n]1-n中Ag+配位数n=2
C.当V[KCN(aq)]=4 mL时,c(CN-)≈8.0×10-12 mol·L-1
D.当V[KCN(aq)]=6 mL时,n(AgCN)≈4.0×10-5 mol
5.(2024福建泉州三模,10)常温下,用浓度均为0.10 mol·L-1的HCl和CH3COOH溶液进行实验:①各取10 mL,混合后滴加一定浓度的KOH溶液。测得溶液的电导率随KOH溶液体积的变化如图1所示;②各取10 mL,分别滴加上述KOH溶液。测得溶液的电导率随KOH溶液体积的变化如图2所示。下列说法正确的是 ( )
图1图2
A.a点溶液:pH=1
B.水的电离程度:bC.c(Cl-)+c(CH3COO-)+c(OH-):a>c>d
D.由图2可知等浓度时的电导率:Cl->CH3COO-
6.(2024山东临沂二模,15,改编)常温下,用盐酸调节草酸钡(用BaR表示)浊液的pH,测得溶液中-lgc(X)[X为R2-、]随-lgc(Ba2+)的变化关系如图所示。下列说法错误的是 ( )
A.曲线L2表示-lgc(Ba2+)与-lg[]变化曲线
B.Ksp(BaR)=10-6.8
C.a点溶液中:c(Ba2+)=c(Cl-)+c(OH-)+c(R2-)
D.b点溶液中:
lgc(R2-)=
7.(2024山东青岛二模,15)弱酸H2A在有机相和水相中存在平衡:H2A(环己烷) H2A(aq),平衡常数为Kd。25 ℃时,向V mL 0.1 mol·L-1 H2A环己烷溶液中加入V mL水进行萃取,用NaOH(s)或HCl(g)调节水溶液pH。测得水溶液中H2A、HA-、A2-浓度、环己烷中H2A的浓度[c环己烷(H2A)]与水相萃取率α[α=1-]随pH的变化关系如图所示。下列说法正确的是 ( )
已知:①H2A在环己烷中不电离;②忽略溶液体积变化;③lg2=0.3。
A.Kd=0.2
B.pH=6时,95%<α<96%
C.若调节水溶液pH=3,应加NaOH固体调节
D.若加水体积为2V mL,则交点N会由pH=4.6移至pH=4.3
综合拔高练
建议用时:30分钟
1.(2024北京东城二模,3)下列关于浓度均为0.1 mol·L-1的Na2CO3溶液和NaHCO3溶液的说法不正确的是 ( )
A.溶液pH:Na2CO3>NaHCO3
B.两种溶液中粒子种类不相同
C.均能与Ca(OH)2反应产生沉淀
D.溶液中均存在:c(H+)+c(Na+)=c(HC)+2c(C)+c(OH-)
2.(2024天津十二校一模,12)常温下,将SO2通入NaOH溶液中,得到一组c(H2SO3)+c(HS)+c(S)=0.100 mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH变化的关系曲线如下图所示。
下列有关说法错误的是 ( )
A.H2SO3的=10-1.9
B.在c(Na+)=0.100 mol·L-1的溶液中c(H+)+c(S)=c(OH-)+c(H2SO3)
C.在c(S)=c(HS)的溶液中c(H+)+c(Na+)+c(H2SO3)=0.100+c(OH-)+c(HS)
D.pH=1.9的溶液中:c(HS)>c(Na+)
3.(2024湖北八市3月联考,15)室温下,向10 mL 0.05 mol·L-1的NaHCO3溶液中滴加0.05 mol·L-1的盐酸(或0.05 mol·L-1 NaOH溶液),溶液的pH随加入酸(或碱)体积的变化如图所示。下列说法正确的是 ( )
A.根据题中信息不能判断NaHCO3溶液中HC的水解程度与电离程度的大小
B.a→n→m过程中:c(HC)+2c(C)+c(OH-)逐渐减小
C.a→b→c过程中:c(Na+)D.m点的[c(Na+)+c(H+)]小于c点的[c(Na+)+c(H+)]
4.(2024湖南雅礼中学4月测试,13)常温下,现有0.1 mol·L-1的NH4HCO3溶液,pH=7.8。已知含氮或含碳各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示,下列说法错误的是 ( )
A.常温下,Kb(NH3·H2O)>(H2CO3)
B.向pH=7.8的上述溶液中逐滴滴加NaOH溶液时,N浓度都逐渐减小
C.NH4HCO3溶液中存在下列守恒关系:c(N)+c(NH3·H2O)=c(HC)+c(C)+c(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HC)>c(N)>c(NH3·H2O)>c(C)
5.(2024北京朝阳二模,10)粗盐中的杂质离子主要有S、Ca2+、Mg2+,采用如下方法得到精制盐水,进而制取精盐(部分流程略)。
已知:ⅰ.
物质 BaSO4 BaCO3 CaCO3 Mg(OH)2
Ksp(25 ℃) 1.1×10-10 2.6×10-9 3.4×10-9 5.6×10-12
ⅱ.粗盐水中c(S)>c(Ca2+)
下列说法不合理的是 ( )
A.常温下,过程Ⅰ中当溶液pH=11时,Mg2+已沉淀完全
B.过程Ⅱ中加入足量的BaCO3,盐水b中的阴离子仅含有Cl-、OH-
C.过程Ⅱ中若改为先加BaCl2溶液、过滤后再加Na2CO3溶液也能达到除杂目的
D.过程Ⅲ中滴加盐酸调节pH时,应调至溶液呈中性或微酸性
6.(2024广东梅州二模,15)常温下,用一定浓度NaOH溶液滴定某一元酸HA溶液。滴定过程中溶液pH和导电能力的变化如下图所示。下列说法正确的是 ( )
A.HA为一元强酸
B.a点对应的溶液中:c(A-)=c(Na+)=c(H+)=c(OH-)
C.根据溶液pH和导电能力的变化可判断V2>V3
D.a、b、c三点对应的溶液中b点水的电离程度最大
7.(2024黑龙江哈三中一模,15)MB是一种难溶盐,H2B是一种二元弱酸(=1.3×10-7,=2.6×10-15),难挥发;M2+不发生水解。室温下,将MB溶于一定浓度的一元强酸HA溶液中,直到不再溶解,所得溶液中c2(H+)与c2(M2+)有如图所示的线性关系(已知:=2.6,忽略溶液体积变化)。下列说法错误的是 ( )
A.在图示实线对应的pH范围内,溶液中c(M2+)≈c(H2B)
B.Ksp(MB)≈2.0×10-24
C.溶液中存在c(HB-)+c(H+)+2c(H2B)=c(A-)+c(OH-)
D.将0.02 mol MB溶于1.0 L HA溶液中,所需HA的最低浓度为0.26 mol·L-1
8.(2024九省联考吉林、黑龙江卷,15)室温下,向c(Al3+)、c(Zn2+)均为0.1 mol·L-1的混合溶液中持续通入H2S气体,始终保持H2S饱和(H2S的物质的量浓度为0.1 mol·L-1),通过调节pH使Al3+、Zn2+分别沉淀,溶液中-lgc与pH的关系如下图所示。其中,c表示Al3+、Zn2+、OH-和S2-的物质的量浓度的数值,Ksp[Zn(OH)2]=1.2×10-17。下列说法错误的是 ( )
A.①代表-lgc(S2-)与pH的关系曲线
B.pH逐渐增大时,溶液中优先析出的沉淀为ZnS
C.Al(OH)3的Ksp=10-32.8
D.Zn2+(aq)+H2S(g) ZnS(s)+2H+(aq)的平衡常数K=10-0.4
9.(2024河北石家庄一模,14)氧化铅(PbO)在不同pH的水溶液体系中存在以下溶解平衡:
①PbO(s)+2H+(aq) Pb2+(aq)+H2O(l) K1
②PbO(s)+H+(aq) Pb(OH)+(aq) K2
③PbO(s)+H2O(l) Pb(OH)2(aq) K3
④PbO(s)+2H2O(l) Pb(OH(aq)+H+(aq) K4
lgc(X)[X为Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH]随pH变化的关系如图所示。下列说法错误的是 ( )
A.c表示lg[Pb(OH)+]与pH的关系
B.K3的数量级为10-5
C.随pH增大,溶液中所有含铅微粒的总浓度c总(Pb)逐渐降低
D.2Pb(OH)2(aq) Pb(OH)+(aq)+Pb(OH(aq)的K=
10.(2024甘肃兰州一模,14)1922年范斯莱克(Vanslyke)提出用缓冲容量β来描述缓冲溶液缓冲能力大小,β越大,缓冲能力越大。下图是常温下CH3COOH和CH3COONa组成的缓冲溶液的β-pH关系图,其中A、B两条曲线分别对应c总=c(CH3COOH)+c(CH3COO-)=0.1 mol/L和c总=c(CH3COOH)+c(CH3COO-)=0.2 mol/L。已知常温下,Ka(CH3COOH)=10-4.76,下列说法不正确的是 ( )
A.向pH=4.76的上述缓冲溶液中加入少量NaOH溶液,水的电离程度会增大
B.A曲线上任意一点的溶液中均存在c(Na+)+c(CH3COOH)+c(H+)=0.1+c(OH-)
C.B曲线代表的溶液缓冲能力最大时,溶液中c(Na+)>c(CH3COOH)
D.pH=4时,A、B曲线所代表的溶液中相等
11.(2024河北邢台二模,14)常温下,将一定浓度的氨水逐滴加入25 mL 0.12 mol·L-1 AgNO3溶液中,该过程中溶液AG[AG=lg]与加入氨水的体积V的关系如图所示。已知e点对应的溶液迅速由浑浊变澄清,且此时溶液中的c(Ag+)与c(NH3)均约为2×10-3 mol·L-1。下列叙述错误的是( )
A.a点对应溶液中由水电离出的c(H+)=10-5 mol·L-1
B.b点对应溶液中:c(Ag+)+c{[Ag(NH3)2]+}C.由e点可知,反应Ag++2NH3 [Ag(NH3)2]+的平衡常数约为1.25×107
D.最好选择d-e段溶液与葡萄糖等含有醛基的有机物发生银镜反应
专题十一 盐类水解和沉淀溶解平衡
五年高考
考点1 盐类水解
1.(2024安徽,13,3分)环境保护工程师研究利用Na2S、FeS和H2S处理水样中的Cd2+。
已知25 ℃时,H2S饱和溶液浓度约为0.1 mol·L-1,(H2S)=10-6.97,(H2S)=10-12.90,Ksp(FeS)=10-17.20,Ksp(CdS)=10-26.10。
下列说法错误的是 (B)
A.Na2S溶液中:c(H+)+c(Na+)=c(OH-)+c(HS-)+2c(S2-)
B.0.01 mol·L-1 Na2S溶液中:c(Na+)>c(S2-)>c(OH-)>c(HS-)
C.向c(Cd2+)=0.01 mol·L-1的溶液中加入FeS,可使c(Cd2+)<10-8 mol·L-1
D.向c(Cd2+)=0.01 mol·L-1的溶液中通入H2S气体至饱和,所得溶液中:c(H+)>c(Cd2+)
2.(2023北京,3,3分)下列过程与水解反应无关的是 (B)
A.热的纯碱溶液去除油脂
B.重油在高温、高压和催化剂作用下转化为小分子烃
C.蛋白质在酶的作用下转化为氨基酸
D.向沸水中滴入饱和FeCl3溶液制备Fe(OH)3胶体
3.(2023重庆,11,3分)(NH4)2SO4溶解度随温度变化的曲线如图所示,关于各点对应的溶液,下列说法正确的是 (B)
A.M点KW等于N点KW
B.M点pH大于N点pH
C.N点降温过程中有2个平衡发生移动
D.P点c(H+)+c(N)+c(NH3·H2O)=c(OH-)+2c(S)
4.(2023海南,14,4分)25 ℃下,Na2CO3水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是 (B)
A.c(Na2CO3)=0.6 mol·L-1时,溶液中c(OH-)<0.01 mol·L-1
B.Na2CO3水解程度随其浓度增大而减小
C.在水中H2CO3的<4×10-11
D.0.2 mol·L-1的Na2CO3溶液和0.3 mol·L-1的NaHCO3溶液等体积混合,得到的溶液中c(OH-)<2×10-4 mol·L-1
5.(2023福建,10,4分)25 ℃时,某二元酸(H2A)的=10-4.37。1.0 mol·L-1 NaHA溶液稀释过程中δ(H2A)、δ(HA-)、δ(A2-)与pc(Na+)的关系如图所示。已知pc(Na+)=-lgc(Na+),HA-的分布系数δ(HA-)=。下列说法错误的是 (B)
A.曲线n为δ(HA-)的变化曲线
B.a点:pH=4.37
C.b点:2c(H2A)+c(HA-)=c(Na+)
D.c点:c(Na+)+c(H+)=3c(HA-)+c(OH-)
6.(2023江苏,12,3分)室温下,用含少量Mg2+的MnSO4溶液制备MnCO3的过程如图所示。已知Ksp(MgF2)=5.2×10-11,Ka(HF)=6.3×10-4。下列说法正确的是 (C)
A.0.1 mol·L-1 NaF溶液中:c(F-)=c(Na+)+c(H+)
B.“除镁”得到的上层清液中:c(Mg2+)=
C.0.1 mol·L-1 NaHCO3溶液中:c(C)=c(H+)+c(H2CO3)-c(OH-)
D.“沉锰”后的滤液中:c(Na+)+c(H+)=c(OH-)+c(HC)+2c(C)
7.(2023浙江6月选考,15,3分)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验:
实验Ⅰ:往20 mL 0.1 mol·L-1 NaHC2O4溶液中滴加0.1 mol·L-1 NaOH溶液。
实验Ⅱ:往20 mL 0.10 mol·L-1 NaHC2O4溶液中滴加0.10 mol·L-1 CaCl2溶液。
[已知:H2C2O4的电离常数=5.4×10-2,=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计],下列说法正确的是 (D)
A.实验Ⅰ可选用甲基橙作指示剂,指示反应终点
B.实验Ⅰ中V(NaOH)=10 mL时,存在c(C2)C.实验Ⅱ中发生反应HC2+Ca2+ CaC2O4↓+H+
D.实验Ⅱ中V(CaCl2)=80 mL时,溶液中c(C2)=4.0×10-8 mol·L-1
8.(双选)(2022海南,13,4分)NaClO溶液具有漂白能力。已知25 ℃时,Ka(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是 (AD)
A.0.01 mol·L-1溶液中,c(ClO-)<0.01 mol·L-1
B.长期露置在空气中,释放Cl2,漂白能力减弱
C.通入过量SO2,反应的离子方程式为SO2+ClO-+H2O HS+HClO
D.25 ℃,pH=7.0的NaClO和HClO的混合溶液中,c(HClO)>c(ClO-)=c(Na+)
9.(2022辽宁,15,3分)甘氨酸(NH2CH2COOH)是人体必需氨基酸之一。在25 ℃时,NCH2COO-和NH2CH2COO-的分布分数[如δ(A2-)=]与溶液pH关系如图。下列说法错误的是 (D)
A.甘氨酸具有两性
B.曲线c代表NH2CH2COO-
C.NCH2COOH+OH-的平衡常数K=10-11.65
D.c2(NCH2COO-)10.(2022浙江1月选考,23,2分)某同学在两个相同的特制容器中分别加入20 mL 0.4 mol·L-1 Na2CO3溶液和40 mL 0.2 mol·L-1 NaHCO3溶液,再分别用0.4 mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如下曲线:
下列说法正确的是 (C)
A.图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸
B.当滴加盐酸的体积为V1 mL时(a点、b点),所发生的反应用离子方程式表示为:HC+H+ CO2↑+H2O
C.根据pH-V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点
D.Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(C)=c(OH-)-c(H+)
11.(2021重庆,14,3分)下列叙述正确的是 (C)
A.向氨水中加入醋酸使溶液呈酸性,则c(N)>c(CH3COO-)
B.向NH4Cl溶液中加入少量Al2(SO4)3固体,则水的电离程度减小
C.向Na2CO3溶液中滴加盐酸至c(Na+)=2c(Cl-),则c(HC)>c(H2CO3)
D.向0.2 mol/L磷酸中加水至原体积的两倍,则c(H+)>0.1 mol/L
12.(2021广东,8,2分)鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl表示)。已知GHCl水溶液呈酸性,下列叙述正确的是 (A)
A.0.001 mol/L GHCl水溶液加水稀释,pH升高
B.0.001 mol/L GHCl水溶液的pH=3
C.GHCl在水中的电离方程式为:GHCl G+HCl
D.GHCl水溶液中:c(OH-)+c(Cl-)=c(GH+)+c(G)
13.(2021河北,6,3分)BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
下列说法错误的是 (D)
A.酸浸工序中分次加入稀HNO3可降低反应剧烈程度
B.转化工序中加入稀HCl可抑制生成BiONO3
C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度
D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成
14.(2021福建,10,4分)下图为某实验测得0.1 mol·L-1 NaHCO3溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法正确的是 (A)
A.a点溶液的c(OH-)比c点溶液的小
B.a点时,KW<(H2CO3)·(H2CO3)
C.b点溶液中,c(Na+)=c(HC)+2c(C)
D.ab段,pH减小说明升温抑制了HC的水解
15.(2021辽宁,15,3分)用0.100 0 mol·L-1盐酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-的分布分数δ随pH变化曲线及滴定曲线如图。[如A2-分布分数:δ(A2-)=]
下列说法正确的是 (C)
A.H2A的为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选酚酞作指示剂
D.c(Na2A)=0.200 0 mol·L-1
16.(2021湖南,9,3分)常温下,用0.100 0 mol·L-1的盐酸分别滴定20.00 mL浓度均为0.100 0 mol·L-1的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是 (C)
A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)
C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)
D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-)
17.(2020海南,12,4分)某弱酸HA溶液中主要成分的分布分数随pH的变化如图所示。下列说法错误的是 (B)
A.该酸-lgKa≈4.7
B.NaA的水解平衡常数Kh=
C.当该溶液的pH=7.0时,c(HA)D.某c(HA)∶c(A-)=4∶1的缓冲溶液,pH≈4
18.(2020天津,7,3分)常温下,下列有关电解质溶液的说法错误的是 (A)
A.相同浓度的HCOONa和NaF两溶液,前者的pH较大,则Ka(HCOOH)>Ka(HF)
B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则Ksp(FeS)>Ksp(CuS)
D.在1 mol·L-1 Na2S溶液中,c(S2-)+c(HS-)+c(H2S)=1 mol·L-1
考点2 沉淀溶解平衡
19.(2024黑、吉、辽,15,3分)25 ℃下,AgCl、AgBr和Ag2CrO4的沉淀溶解平衡曲线如下图所示。某实验小组以K2CrO4为指示剂,用AgNO3标准溶液分别滴定含Cl-水样、含Br-水样。
已知:①Ag2CrO4为砖红色沉淀;
②相同条件下AgCl溶解度大于AgBr;
③25 ℃时,p(H2CrO4)=0.7,p(H2CrO4)=6.5。
下列说法错误的是 (D)
A.曲线②为AgCl沉淀溶解平衡曲线
B.反应Ag2CrO4+H+ 2Ag++HCr的平衡常数K=10-5.2
C.滴定Cl-时,理论上混合液中指示剂浓度不宜超过10-2.0 mol·L-1
D.滴定Br-达终点时,溶液中=10-0.5
20.(2024江西,13,3分)废弃电池中锰可通过浸取回收。某温度下,MnSO4在不同浓度的KOH水溶液中,Mn(Ⅱ)的分布系数δ与pH的关系如图。下列说法正确的是 (C)
已知:δ(MnOH+)=
;Mn(OH)2难溶于水,具有两性。
A.曲线z为δ(MnOH+)
B.O点,c(H+)=×10-10.3 mol·L-1
C.P点,c(Mn2+)D.Q点,c(S)=2c(MnOH+)+2c(Mn)
21.(2024全国甲,13,6分)将0.10 mmol Ag2CrO4配制成1.0 mL悬浊液,向其中滴加0.10 mol·L-1的NaCl溶液。lg [cM/(mol·L-1)](M代表Ag+、Cl-或Cr)随加入NaCl溶液体积(V)的变化关系如图所示。
下列叙述正确的是 (D)
A.交点a处:c(Na+)=2c(Cl-)
B.=10-2.21
C.V≤2.0 mL时不变
D.y1=-7.82,y2=-lg34
22.(2023河北,14,3分)某温度下,两种难溶盐AgxX、AgyY的饱和溶液中-lg c(Xx-)或-lg c(Yy-)与-lg c(Ag+)的关系如图所示。下列说法错误的是 (D)
A.x∶y=3∶1
B.若混合溶液中各离子浓度如J点所示,加入AgNO3(s),则平衡时变小
C.向AgxX固体中加入NayY溶液,可发生AgxX→AgyY的转化
D.若混合溶液中各离子起始浓度如T点所示,待平衡时c(Xx-)+c(Yy-)<2c(Ag+)
23.(2023北京,14,3分)利用平衡移动原理,分析一定温度下Mg2+在不同pH的Na2CO3体系中的可能产物。
已知:①图1中曲线表示Na2CO3体系中各含碳粒子的物质的量分数与pH的关系。
②图2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=Ksp[Mg(OH)2];曲线Ⅱ的离子浓度关系符合c(Mg2+)·c(C)=Ksp(MgCO3)[注:起始c(Na2CO3)=0.1 mol·L-1,不同pH下c(C)由图1得到]。
下列说法不正确的是 (C)
A.由图1,pH=10.25,c(HC)=c(C)
B.由图2,初始状态pH=11、lg[c(Mg2+)]=-6,无沉淀生成
C.由图2,初始状态pH=9、lg[c(Mg2+)]=-2,平衡后溶液中存在c(H2CO3)+c(HC)+c(C)=0.1 mol·L-1
D.由图1和图2,初始状态pH=8、lg[c(Mg2+)]=-1,发生反应:Mg2++2HC MgCO3↓+CO2↑+H2O
24.(2023全国乙,13,6分)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是 (C)
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)=c(Cr),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl- 2AgCl+Cr的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
25.(2023新课标,13,6分)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3 [Ag(NH3)]+和NH3+[Ag(NH3)]+ [Ag(NH3)2]+。lg[c(M)/(mol·L-1)]与lg[c(NH3)/(mol·L-1)]的关系如下图所示{其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+}。
下列说法错误的是 (A)
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线
B.AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-9.75
C.反应[Ag(NH3)]++NH3 [Ag(NH3)2]+的平衡常数K的值为103.81
D.c(NH3)=0.01 mol·L-1时,溶液中c{[Ag(NH3)2]+}>c{[Ag(NH3)]+}>c(Ag+)
26.(2023辽宁,15,3分)某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol·L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lg c关系如图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol·L-1。已知Ksp(NiS)>Ksp(CdS),下列说法正确的是 (D)
A.Ksp(CdS)=10-18.4
B.③为pH与-lg c(HS-)的关系曲线
C.Ka1(H2S)=10-8.1
D.Ka2(H2S)=10-14.7
27.(双选)(2023山东,15,4分)在含HgI2(s)的溶液中,一定c(I-)范围内,存在平衡关系:HgI2(s) HgI2(aq);HgI2(aq) Hg2++2I-;HgI2(aq) HgI++I-;HgI2(aq)+I- Hg;HgI2(aq)+2I- Hg,平衡常数依次为K0、K1、K2、K3、K4。已知lgc(Hg2+)、lgc(HgI+)、lgc(Hg)、lgc(Hg)随lgc(I-)的变化关系如图所示。下列说法错误的是 (BD)
A.线L表示lgc(Hg)的变化情况
B.随c(I-)增大,c[HgI2(aq)]先增大后减小
C.a=lg
D.溶液中I元素与Hg元素的物质的量之比始终为2∶1
28.(2022重庆,11,3分)某小组模拟成垢—除垢过程如下。
100 mL 0.1 mol·L-1 CaCl2水溶液
……
忽略体积变化,且步骤②中反应完全。下列说法正确的是 (D)
A.经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-)
B.经过步骤②,溶液中c(Na+)=4c(S)
C.经过步骤②,溶液中c(Cl-)=c(C)+c(HC)+c(H2CO3)
D.经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)
29.(双选)(2022海南,14,4分)某元素M的氢氧化物M(OH)2(s)在水中的溶解反应为:
M(OH)2(s) M2+(aq)+2OH-(aq)
M(OH)2(s)+2OH-(aq) M(OH(aq)
25 ℃,-lgc与pH的关系如图所示,c为M2+或M(OH 浓度的值。下列说法错误的是 (BD)
A.曲线①代表-lgc(M2+)与pH的关系
B.M(OH)2的Ksp约为1×10-10
C.向c(M2+)=0.1 mol·L-1的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以M(OH)2(s)存在
D.向c[M(OH]=0.1 mol·L-1的溶液中加入等体积0.4 mol·L-1的HCl溶液后,体系中元素M主要以M2+存在
30.(2022福建,7,3分)锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有Fe3+、Al3+、Fe2+和Mg2+杂质离子,可在0~14范围内调节pH对其净化(即相关离子浓度c<10-5 mol·L-1)。25 ℃时,lgc与pH关系见如图[碱性过强时Fe(OH)3和Fe(OH)2会部分溶解]。下列说法正确的是 (B)
A.Mg2+可被净化的pH区间最大
B.加入适量H2O2,可进一步提升净化程度
C.净化的先后顺序:Mg2+、Fe2+、Fe3+、Al3+
D.Ksp[Fe(OH)3]31.(2022山东,14,4分)工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究。现有含SrCO3(s)的0.1 mol·L-1、1.0 mol·L-1 Na2CO3溶液,含SrSO4(s)的0.1 mol·L-1、1.0 mol·L-1 Na2SO4溶液。在一定pH范围内,四种溶液中lg[c(Sr2+)/mol·L-1]随pH的变化关系如图所示。下列说法错误的是 (D)
A.反应SrSO4(s)+C SrCO3(s)+S
B.a=-6.5
C.曲线④代表含SrCO3(s)的1.0 mol·L-1 Na2CO3溶液的变化曲线
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
三年模拟
题型强化练
题型 溶液中离子平衡图像分析
1.(2024安徽合肥三模,13)25 ℃,取浓度均为0.1 mol·L-1的ROH溶液和HX溶液各20 mL,分别用0.1 mol·L-1的盐酸、0.1 mol·L-1的NaOH溶液进行滴定。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法正确的是 (C)
A.HX为弱酸,ROH为强碱
B.曲线ⅡV=10 mL时溶液中:c(OH-)-c(H+)=c(HX)-c(X-)
C.滴定前,ROH溶液中:c(ROH)>c(OH-)>c(R+)>c(H+)
D.滴定至V=40 mL的过程中,两种溶液中由水电离出的c(H+)·c(OH-)始终保持不变
2.(2024东北三省一模,15)菠萝“扎嘴”的原因之一是菠萝中含有一种难溶于水的草酸钙针晶。常温下,草酸钙在不同pH体系中lgc(M)与pH的关系如图所示(M代表H2C2O4、HC2、Ca2+),已知Ksp(CaC2O4)=10-8.62、Ksp[Ca(OH)2]=10-5.6。下列有关说法正确的是 (B)
A.(H2C2O4)的数量级为10-4
B.溶液pH=7时,c(HC2)+2c(C2)=2c(Ca2+)
C.pH>12时,曲线①呈上升趋势的原因是部分CaC2O4转化为Ca(OH)2
D.A点时,体系中c(Ca2+)>c(H2C2O4)=c(HC2)>c(C2)>c(H+)>c(OH-)
3.(2024广东湛江二模,16)常温下,等浓度的氨水和醋酸溶液互相滴定过程中,溶液中pH与pX[pX=-lg]的关系如图所示。下列说法错误的是 (B)
A.常温下,Ka(CH3COOH)=1×10-4.76
B.水的电离程度:fC.曲线Ⅱ代表氨水滴定CH3COOH溶液
D.g点c(CH3COO-)=c(N)>c(CH3COOH)=c(NH3·H2O)
4.(2024湖北武汉4月调研,15)为测定[Ag(CN)n]1-n中Ag+的配位数n,将浓度均为0.01 mol·L-1的AgNO3和KCN溶液按不同体积比混合,其用量和溶液浑浊度的关系如下图所示。已知:Ksp(AgCN)=1.6×10-14。下列说法错误的是 (D)
A.b点对应的V[AgNO3(aq)]= mL
B.[Ag(CN)n]1-n中Ag+配位数n=2
C.当V[KCN(aq)]=4 mL时,c(CN-)≈8.0×10-12 mol·L-1
D.当V[KCN(aq)]=6 mL时,n(AgCN)≈4.0×10-5 mol
5.(2024福建泉州三模,10)常温下,用浓度均为0.10 mol·L-1的HCl和CH3COOH溶液进行实验:①各取10 mL,混合后滴加一定浓度的KOH溶液。测得溶液的电导率随KOH溶液体积的变化如图1所示;②各取10 mL,分别滴加上述KOH溶液。测得溶液的电导率随KOH溶液体积的变化如图2所示。下列说法正确的是 (D)
图1图2
A.a点溶液:pH=1
B.水的电离程度:bC.c(Cl-)+c(CH3COO-)+c(OH-):a>c>d
D.由图2可知等浓度时的电导率:Cl->CH3COO-
6.(2024山东临沂二模,15,改编)常温下,用盐酸调节草酸钡(用BaR表示)浊液的pH,测得溶液中-lgc(X)[X为R2-、]随-lgc(Ba2+)的变化关系如图所示。下列说法错误的是 (C)
A.曲线L2表示-lgc(Ba2+)与-lg[]变化曲线
B.Ksp(BaR)=10-6.8
C.a点溶液中:c(Ba2+)=c(Cl-)+c(OH-)+c(R2-)
D.b点溶液中:
lgc(R2-)=
7.(2024山东青岛二模,15)弱酸H2A在有机相和水相中存在平衡:H2A(环己烷) H2A(aq),平衡常数为Kd。25 ℃时,向V mL 0.1 mol·L-1 H2A环己烷溶液中加入V mL水进行萃取,用NaOH(s)或HCl(g)调节水溶液pH。测得水溶液中H2A、HA-、A2-浓度、环己烷中H2A的浓度[c环己烷(H2A)]与水相萃取率α[α=1-]随pH的变化关系如图所示。下列说法正确的是 (C)
已知:①H2A在环己烷中不电离;②忽略溶液体积变化;③lg2=0.3。
A.Kd=0.2
B.pH=6时,95%<α<96%
C.若调节水溶液pH=3,应加NaOH固体调节
D.若加水体积为2V mL,则交点N会由pH=4.6移至pH=4.3
综合拔高练
建议用时:30分钟
1.(2024北京东城二模,3)下列关于浓度均为0.1 mol·L-1的Na2CO3溶液和NaHCO3溶液的说法不正确的是 (B)
A.溶液pH:Na2CO3>NaHCO3
B.两种溶液中粒子种类不相同
C.均能与Ca(OH)2反应产生沉淀
D.溶液中均存在:c(H+)+c(Na+)=c(HC)+2c(C)+c(OH-)
2.(2024天津十二校一模,12)常温下,将SO2通入NaOH溶液中,得到一组c(H2SO3)+c(HS)+c(S)=0.100 mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH变化的关系曲线如下图所示。
下列有关说法错误的是 (B)
A.H2SO3的=10-1.9
B.在c(Na+)=0.100 mol·L-1的溶液中c(H+)+c(S)=c(OH-)+c(H2SO3)
C.在c(S)=c(HS)的溶液中c(H+)+c(Na+)+c(H2SO3)=0.100+c(OH-)+c(HS)
D.pH=1.9的溶液中:c(HS)>c(Na+)
3.(2024湖北八市3月联考,15)室温下,向10 mL 0.05 mol·L-1的NaHCO3溶液中滴加0.05 mol·L-1的盐酸(或0.05 mol·L-1 NaOH溶液),溶液的pH随加入酸(或碱)体积的变化如图所示。下列说法正确的是 (B)
A.根据题中信息不能判断NaHCO3溶液中HC的水解程度与电离程度的大小
B.a→n→m过程中:c(HC)+2c(C)+c(OH-)逐渐减小
C.a→b→c过程中:c(Na+)D.m点的[c(Na+)+c(H+)]小于c点的[c(Na+)+c(H+)]
4.(2024湖南雅礼中学4月测试,13)常温下,现有0.1 mol·L-1的NH4HCO3溶液,pH=7.8。已知含氮或含碳各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示,下列说法错误的是 (B)
A.常温下,Kb(NH3·H2O)>(H2CO3)
B.向pH=7.8的上述溶液中逐滴滴加NaOH溶液时,N浓度都逐渐减小
C.NH4HCO3溶液中存在下列守恒关系:c(N)+c(NH3·H2O)=c(HC)+c(C)+c(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HC)>c(N)>c(NH3·H2O)>c(C)
5.(2024北京朝阳二模,10)粗盐中的杂质离子主要有S、Ca2+、Mg2+,采用如下方法得到精制盐水,进而制取精盐(部分流程略)。
已知:ⅰ.
物质 BaSO4 BaCO3 CaCO3 Mg(OH)2
Ksp(25 ℃) 1.1×10-10 2.6×10-9 3.4×10-9 5.6×10-12
ⅱ.粗盐水中c(S)>c(Ca2+)
下列说法不合理的是 (B)
A.常温下,过程Ⅰ中当溶液pH=11时,Mg2+已沉淀完全
B.过程Ⅱ中加入足量的BaCO3,盐水b中的阴离子仅含有Cl-、OH-
C.过程Ⅱ中若改为先加BaCl2溶液、过滤后再加Na2CO3溶液也能达到除杂目的
D.过程Ⅲ中滴加盐酸调节pH时,应调至溶液呈中性或微酸性
6.(2024广东梅州二模,15)常温下,用一定浓度NaOH溶液滴定某一元酸HA溶液。滴定过程中溶液pH和导电能力的变化如下图所示。下列说法正确的是 (D)
A.HA为一元强酸
B.a点对应的溶液中:c(A-)=c(Na+)=c(H+)=c(OH-)
C.根据溶液pH和导电能力的变化可判断V2>V3
D.a、b、c三点对应的溶液中b点水的电离程度最大
7.(2024黑龙江哈三中一模,15)MB是一种难溶盐,H2B是一种二元弱酸(=1.3×10-7,=2.6×10-15),难挥发;M2+不发生水解。室温下,将MB溶于一定浓度的一元强酸HA溶液中,直到不再溶解,所得溶液中c2(H+)与c2(M2+)有如图所示的线性关系(已知:=2.6,忽略溶液体积变化)。下列说法错误的是 (D)
A.在图示实线对应的pH范围内,溶液中c(M2+)≈c(H2B)
B.Ksp(MB)≈2.0×10-24
C.溶液中存在c(HB-)+c(H+)+2c(H2B)=c(A-)+c(OH-)
D.将0.02 mol MB溶于1.0 L HA溶液中,所需HA的最低浓度为0.26 mol·L-1
8.(2024九省联考吉林、黑龙江卷,15)室温下,向c(Al3+)、c(Zn2+)均为0.1 mol·L-1的混合溶液中持续通入H2S气体,始终保持H2S饱和(H2S的物质的量浓度为0.1 mol·L-1),通过调节pH使Al3+、Zn2+分别沉淀,溶液中-lgc与pH的关系如下图所示。其中,c表示Al3+、Zn2+、OH-和S2-的物质的量浓度的数值,Ksp[Zn(OH)2]=1.2×10-17。下列说法错误的是 (D)
A.①代表-lgc(S2-)与pH的关系曲线
B.pH逐渐增大时,溶液中优先析出的沉淀为ZnS
C.Al(OH)3的Ksp=10-32.8
D.Zn2+(aq)+H2S(g) ZnS(s)+2H+(aq)的平衡常数K=10-0.4
9.(2024河北石家庄一模,14)氧化铅(PbO)在不同pH的水溶液体系中存在以下溶解平衡:
①PbO(s)+2H+(aq) Pb2+(aq)+H2O(l) K1
②PbO(s)+H+(aq) Pb(OH)+(aq) K2
③PbO(s)+H2O(l) Pb(OH)2(aq) K3
④PbO(s)+2H2O(l) Pb(OH(aq)+H+(aq) K4
lgc(X)[X为Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH]随pH变化的关系如图所示。下列说法错误的是 (C)
A.c表示lg[Pb(OH)+]与pH的关系
B.K3的数量级为10-5
C.随pH增大,溶液中所有含铅微粒的总浓度c总(Pb)逐渐降低
D.2Pb(OH)2(aq) Pb(OH)+(aq)+Pb(OH(aq)的K=
10.(2024甘肃兰州一模,14)1922年范斯莱克(Vanslyke)提出用缓冲容量β来描述缓冲溶液缓冲能力大小,β越大,缓冲能力越大。下图是常温下CH3COOH和CH3COONa组成的缓冲溶液的β-pH关系图,其中A、B两条曲线分别对应c总=c(CH3COOH)+c(CH3COO-)=0.1 mol/L和c总=c(CH3COOH)+c(CH3COO-)=0.2 mol/L。已知常温下,Ka(CH3COOH)=10-4.76,下列说法不正确的是 (C)
A.向pH=4.76的上述缓冲溶液中加入少量NaOH溶液,水的电离程度会增大
B.A曲线上任意一点的溶液中均存在c(Na+)+c(CH3COOH)+c(H+)=0.1+c(OH-)
C.B曲线代表的溶液缓冲能力最大时,溶液中c(Na+)>c(CH3COOH)
D.pH=4时,A、B曲线所代表的溶液中相等
11.(2024河北邢台二模,14)常温下,将一定浓度的氨水逐滴加入25 mL 0.12 mol·L-1 AgNO3溶液中,该过程中溶液AG[AG=lg]与加入氨水的体积V的关系如图所示。已知e点对应的溶液迅速由浑浊变澄清,且此时溶液中的c(Ag+)与c(NH3)均约为2×10-3 mol·L-1。下列叙述错误的是(D)
A.a点对应溶液中由水电离出的c(H+)=10-5 mol·L-1
B.b点对应溶液中:c(Ag+)+c{[Ag(NH3)2]+}C.由e点可知,反应Ag++2NH3 [Ag(NH3)2]+的平衡常数约为1.25×107
D.最好选择d-e段溶液与葡萄糖等含有醛基的有机物发生银镜反应
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025版新教材高考化学第二轮复习
专题十一 盐类水解和沉淀溶解平衡
五年高考
考点1 盐类水解
1.(2024安徽,13,3分)环境保护工程师研究利用Na2S、FeS和H2S处理水样中的Cd2+。
已知25 ℃时,H2S饱和溶液浓度约为0.1 mol·L-1,(H2S)=10-6.97,(H2S)=10-12.90,Ksp(FeS)=10-17.20,Ksp(CdS)=10-26.10。
下列说法错误的是 ( )
A.Na2S溶液中:c(H+)+c(Na+)=c(OH-)+c(HS-)+2c(S2-)
B.0.01 mol·L-1 Na2S溶液中:c(Na+)>c(S2-)>c(OH-)>c(HS-)
C.向c(Cd2+)=0.01 mol·L-1的溶液中加入FeS,可使c(Cd2+)<10-8 mol·L-1
D.向c(Cd2+)=0.01 mol·L-1的溶液中通入H2S气体至饱和,所得溶液中:c(H+)>c(Cd2+)
2.(2023北京,3,3分)下列过程与水解反应无关的是 ( )
A.热的纯碱溶液去除油脂
B.重油在高温、高压和催化剂作用下转化为小分子烃
C.蛋白质在酶的作用下转化为氨基酸
D.向沸水中滴入饱和FeCl3溶液制备Fe(OH)3胶体
3.(2023重庆,11,3分)(NH4)2SO4溶解度随温度变化的曲线如图所示,关于各点对应的溶液,下列说法正确的是 ( )
A.M点KW等于N点KW
B.M点pH大于N点pH
C.N点降温过程中有2个平衡发生移动
D.P点c(H+)+c(N)+c(NH3·H2O)=c(OH-)+2c(S)
4.(2023海南,14,4分)25 ℃下,Na2CO3水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是 ( )
A.c(Na2CO3)=0.6 mol·L-1时,溶液中c(OH-)<0.01 mol·L-1
B.Na2CO3水解程度随其浓度增大而减小
C.在水中H2CO3的<4×10-11
D.0.2 mol·L-1的Na2CO3溶液和0.3 mol·L-1的NaHCO3溶液等体积混合,得到的溶液中c(OH-)<2×10-4 mol·L-1
5.(2023福建,10,4分)25 ℃时,某二元酸(H2A)的=10-4.37。1.0 mol·L-1 NaHA溶液稀释过程中δ(H2A)、δ(HA-)、δ(A2-)与pc(Na+)的关系如图所示。已知pc(Na+)=-lgc(Na+),HA-的分布系数δ(HA-)=。下列说法错误的是 ( )
A.曲线n为δ(HA-)的变化曲线
B.a点:pH=4.37
C.b点:2c(H2A)+c(HA-)=c(Na+)
D.c点:c(Na+)+c(H+)=3c(HA-)+c(OH-)
6.(2023江苏,12,3分)室温下,用含少量Mg2+的MnSO4溶液制备MnCO3的过程如图所示。已知Ksp(MgF2)=5.2×10-11,Ka(HF)=6.3×10-4。下列说法正确的是 ( )
A.0.1 mol·L-1 NaF溶液中:c(F-)=c(Na+)+c(H+)
B.“除镁”得到的上层清液中:c(Mg2+)=
C.0.1 mol·L-1 NaHCO3溶液中:c(C)=c(H+)+c(H2CO3)-c(OH-)
D.“沉锰”后的滤液中:c(Na+)+c(H+)=c(OH-)+c(HC)+2c(C)
7.(2023浙江6月选考,15,3分)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验:
实验Ⅰ:往20 mL 0.1 mol·L-1 NaHC2O4溶液中滴加0.1 mol·L-1 NaOH溶液。
实验Ⅱ:往20 mL 0.10 mol·L-1 NaHC2O4溶液中滴加0.10 mol·L-1 CaCl2溶液。
[已知:H2C2O4的电离常数=5.4×10-2,=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计],下列说法正确的是 ( )
A.实验Ⅰ可选用甲基橙作指示剂,指示反应终点
B.实验Ⅰ中V(NaOH)=10 mL时,存在c(C2)
D.实验Ⅱ中V(CaCl2)=80 mL时,溶液中c(C2)=4.0×10-8 mol·L-1
8.(双选)(2022海南,13,4分)NaClO溶液具有漂白能力。已知25 ℃时,Ka(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是 ( )
A.0.01 mol·L-1溶液中,c(ClO-)<0.01 mol·L-1
B.长期露置在空气中,释放Cl2,漂白能力减弱
C.通入过量SO2,反应的离子方程式为SO2+ClO-+H2O HS+HClO
D.25 ℃,pH=7.0的NaClO和HClO的混合溶液中,c(HClO)>c(ClO-)=c(Na+)
9.(2022辽宁,15,3分)甘氨酸(NH2CH2COOH)是人体必需氨基酸之一。在25 ℃时,NCH2COO-和NH2CH2COO-的分布分数[如δ(A2-)=]与溶液pH关系如图。下列说法错误的是 ( )
A.甘氨酸具有两性
B.曲线c代表NH2CH2COO-
C.NCH2COOH+OH-的平衡常数K=10-11.65
D.c2(NCH2COO-)
下列说法正确的是 ( )
A.图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸
B.当滴加盐酸的体积为V1 mL时(a点、b点),所发生的反应用离子方程式表示为:HC+H+ CO2↑+H2O
C.根据pH-V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点
D.Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(C)=c(OH-)-c(H+)
11.(2021重庆,14,3分)下列叙述正确的是 ( )
A.向氨水中加入醋酸使溶液呈酸性,则c(N)>c(CH3COO-)
B.向NH4Cl溶液中加入少量Al2(SO4)3固体,则水的电离程度减小
C.向Na2CO3溶液中滴加盐酸至c(Na+)=2c(Cl-),则c(HC)>c(H2CO3)
D.向0.2 mol/L磷酸中加水至原体积的两倍,则c(H+)>0.1 mol/L
12.(2021广东,8,2分)鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl表示)。已知GHCl水溶液呈酸性,下列叙述正确的是 ( )
A.0.001 mol/L GHCl水溶液加水稀释,pH升高
B.0.001 mol/L GHCl水溶液的pH=3
C.GHCl在水中的电离方程式为:GHCl G+HCl
D.GHCl水溶液中:c(OH-)+c(Cl-)=c(GH+)+c(G)
13.(2021河北,6,3分)BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
下列说法错误的是 ( )
A.酸浸工序中分次加入稀HNO3可降低反应剧烈程度
B.转化工序中加入稀HCl可抑制生成BiONO3
C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度
D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成
14.(2021福建,10,4分)下图为某实验测得0.1 mol·L-1 NaHCO3溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法正确的是 ( )
A.a点溶液的c(OH-)比c点溶液的小
B.a点时,KW<(H2CO3)·(H2CO3)
C.b点溶液中,c(Na+)=c(HC)+2c(C)
D.ab段,pH减小说明升温抑制了HC的水解
15.(2021辽宁,15,3分)用0.100 0 mol·L-1盐酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-的分布分数δ随pH变化曲线及滴定曲线如图。[如A2-分布分数:δ(A2-)=]
下列说法正确的是 ( )
A.H2A的为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选酚酞作指示剂
D.c(Na2A)=0.200 0 mol·L-1
16.(2021湖南,9,3分)常温下,用0.100 0 mol·L-1的盐酸分别滴定20.00 mL浓度均为0.100 0 mol·L-1的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是 ( )
A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)
C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)
D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-)
17.(2020海南,12,4分)某弱酸HA溶液中主要成分的分布分数随pH的变化如图所示。下列说法错误的是 ( )
A.该酸-lgKa≈4.7
B.NaA的水解平衡常数Kh=
C.当该溶液的pH=7.0时,c(HA)
18.(2020天津,7,3分)常温下,下列有关电解质溶液的说法错误的是 ( )
A.相同浓度的HCOONa和NaF两溶液,前者的pH较大,则Ka(HCOOH)>Ka(HF)
B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则Ksp(FeS)>Ksp(CuS)
D.在1 mol·L-1 Na2S溶液中,c(S2-)+c(HS-)+c(H2S)=1 mol·L-1
考点2 沉淀溶解平衡
19.(2024黑、吉、辽,15,3分)25 ℃下,AgCl、AgBr和Ag2CrO4的沉淀溶解平衡曲线如下图所示。某实验小组以K2CrO4为指示剂,用AgNO3标准溶液分别滴定含Cl-水样、含Br-水样。
已知:①Ag2CrO4为砖红色沉淀;
②相同条件下AgCl溶解度大于AgBr;
③25 ℃时,p(H2CrO4)=0.7,p(H2CrO4)=6.5。
下列说法错误的是 ( )
A.曲线②为AgCl沉淀溶解平衡曲线
B.反应Ag2CrO4+H+ 2Ag++HCr的平衡常数K=10-5.2
C.滴定Cl-时,理论上混合液中指示剂浓度不宜超过10-2.0 mol·L-1
D.滴定Br-达终点时,溶液中=10-0.5
20.(2024江西,13,3分)废弃电池中锰可通过浸取回收。某温度下,MnSO4在不同浓度的KOH水溶液中,Mn(Ⅱ)的分布系数δ与pH的关系如图。下列说法正确的是 ( )
已知:δ(MnOH+)=
;Mn(OH)2难溶于水,具有两性。
A.曲线z为δ(MnOH+)
B.O点,c(H+)=×10-10.3 mol·L-1
C.P点,c(Mn2+)
21.(2024全国甲,13,6分)将0.10 mmol Ag2CrO4配制成1.0 mL悬浊液,向其中滴加0.10 mol·L-1的NaCl溶液。lg [cM/(mol·L-1)](M代表Ag+、Cl-或Cr)随加入NaCl溶液体积(V)的变化关系如图所示。
下列叙述正确的是 ( )
A.交点a处:c(Na+)=2c(Cl-)
B.=10-2.21
C.V≤2.0 mL时不变
D.y1=-7.82,y2=-lg34
22.(2023河北,14,3分)某温度下,两种难溶盐AgxX、AgyY的饱和溶液中-lg c(Xx-)或-lg c(Yy-)与-lg c(Ag+)的关系如图所示。下列说法错误的是 ( )
A.x∶y=3∶1
B.若混合溶液中各离子浓度如J点所示,加入AgNO3(s),则平衡时变小
C.向AgxX固体中加入NayY溶液,可发生AgxX→AgyY的转化
D.若混合溶液中各离子起始浓度如T点所示,待平衡时c(Xx-)+c(Yy-)<2c(Ag+)
23.(2023北京,14,3分)利用平衡移动原理,分析一定温度下Mg2+在不同pH的Na2CO3体系中的可能产物。
已知:①图1中曲线表示Na2CO3体系中各含碳粒子的物质的量分数与pH的关系。
②图2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=Ksp[Mg(OH)2];曲线Ⅱ的离子浓度关系符合c(Mg2+)·c(C)=Ksp(MgCO3)[注:起始c(Na2CO3)=0.1 mol·L-1,不同pH下c(C)由图1得到]。
下列说法不正确的是 ( )
A.由图1,pH=10.25,c(HC)=c(C)
B.由图2,初始状态pH=11、lg[c(Mg2+)]=-6,无沉淀生成
C.由图2,初始状态pH=9、lg[c(Mg2+)]=-2,平衡后溶液中存在c(H2CO3)+c(HC)+c(C)=0.1 mol·L-1
D.由图1和图2,初始状态pH=8、lg[c(Mg2+)]=-1,发生反应:Mg2++2HC MgCO3↓+CO2↑+H2O
24.(2023全国乙,13,6分)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是 ( )
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)=c(Cr),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl- 2AgCl+Cr的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
25.(2023新课标,13,6分)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3 [Ag(NH3)]+和NH3+[Ag(NH3)]+ [Ag(NH3)2]+。lg[c(M)/(mol·L-1)]与lg[c(NH3)/(mol·L-1)]的关系如下图所示{其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+}。
下列说法错误的是 ( )
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线
B.AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-9.75
C.反应[Ag(NH3)]++NH3 [Ag(NH3)2]+的平衡常数K的值为103.81
D.c(NH3)=0.01 mol·L-1时,溶液中c{[Ag(NH3)2]+}>c{[Ag(NH3)]+}>c(Ag+)
26.(2023辽宁,15,3分)某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol·L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lg c关系如图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol·L-1。已知Ksp(NiS)>Ksp(CdS),下列说法正确的是 ( )
A.Ksp(CdS)=10-18.4
B.③为pH与-lg c(HS-)的关系曲线
C.Ka1(H2S)=10-8.1
D.Ka2(H2S)=10-14.7
27.(双选)(2023山东,15,4分)在含HgI2(s)的溶液中,一定c(I-)范围内,存在平衡关系:HgI2(s) HgI2(aq);HgI2(aq) Hg2++2I-;HgI2(aq) HgI++I-;HgI2(aq)+I- Hg;HgI2(aq)+2I- Hg,平衡常数依次为K0、K1、K2、K3、K4。已知lgc(Hg2+)、lgc(HgI+)、lgc(Hg)、lgc(Hg)随lgc(I-)的变化关系如图所示。下列说法错误的是 ( )
A.线L表示lgc(Hg)的变化情况
B.随c(I-)增大,c[HgI2(aq)]先增大后减小
C.a=lg
D.溶液中I元素与Hg元素的物质的量之比始终为2∶1
28.(2022重庆,11,3分)某小组模拟成垢—除垢过程如下。
100 mL 0.1 mol·L-1 CaCl2水溶液
……
忽略体积变化,且步骤②中反应完全。下列说法正确的是 ( )
A.经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-)
B.经过步骤②,溶液中c(Na+)=4c(S)
C.经过步骤②,溶液中c(Cl-)=c(C)+c(HC)+c(H2CO3)
D.经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)
29.(双选)(2022海南,14,4分)某元素M的氢氧化物M(OH)2(s)在水中的溶解反应为:
M(OH)2(s) M2+(aq)+2OH-(aq)
M(OH)2(s)+2OH-(aq) M(OH(aq)
25 ℃,-lgc与pH的关系如图所示,c为M2+或M(OH 浓度的值。下列说法错误的是 ( )
A.曲线①代表-lgc(M2+)与pH的关系
B.M(OH)2的Ksp约为1×10-10
C.向c(M2+)=0.1 mol·L-1的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以M(OH)2(s)存在
D.向c[M(OH]=0.1 mol·L-1的溶液中加入等体积0.4 mol·L-1的HCl溶液后,体系中元素M主要以M2+存在
30.(2022福建,7,3分)锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有Fe3+、Al3+、Fe2+和Mg2+杂质离子,可在0~14范围内调节pH对其净化(即相关离子浓度c<10-5 mol·L-1)。25 ℃时,lgc与pH关系见如图[碱性过强时Fe(OH)3和Fe(OH)2会部分溶解]。下列说法正确的是 ( )
A.Mg2+可被净化的pH区间最大
B.加入适量H2O2,可进一步提升净化程度
C.净化的先后顺序:Mg2+、Fe2+、Fe3+、Al3+
D.Ksp[Fe(OH)3]
A.反应SrSO4(s)+C SrCO3(s)+S
B.a=-6.5
C.曲线④代表含SrCO3(s)的1.0 mol·L-1 Na2CO3溶液的变化曲线
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
三年模拟
题型强化练
题型 溶液中离子平衡图像分析
1.(2024安徽合肥三模,13)25 ℃,取浓度均为0.1 mol·L-1的ROH溶液和HX溶液各20 mL,分别用0.1 mol·L-1的盐酸、0.1 mol·L-1的NaOH溶液进行滴定。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法正确的是 ( )
A.HX为弱酸,ROH为强碱
B.曲线ⅡV=10 mL时溶液中:c(OH-)-c(H+)=c(HX)-c(X-)
C.滴定前,ROH溶液中:c(ROH)>c(OH-)>c(R+)>c(H+)
D.滴定至V=40 mL的过程中,两种溶液中由水电离出的c(H+)·c(OH-)始终保持不变
2.(2024东北三省一模,15)菠萝“扎嘴”的原因之一是菠萝中含有一种难溶于水的草酸钙针晶。常温下,草酸钙在不同pH体系中lgc(M)与pH的关系如图所示(M代表H2C2O4、HC2、Ca2+),已知Ksp(CaC2O4)=10-8.62、Ksp[Ca(OH)2]=10-5.6。下列有关说法正确的是 ( )
A.(H2C2O4)的数量级为10-4
B.溶液pH=7时,c(HC2)+2c(C2)=2c(Ca2+)
C.pH>12时,曲线①呈上升趋势的原因是部分CaC2O4转化为Ca(OH)2
D.A点时,体系中c(Ca2+)>c(H2C2O4)=c(HC2)>c(C2)>c(H+)>c(OH-)
3.(2024广东湛江二模,16)常温下,等浓度的氨水和醋酸溶液互相滴定过程中,溶液中pH与pX[pX=-lg]的关系如图所示。下列说法错误的是 ( )
A.常温下,Ka(CH3COOH)=1×10-4.76
B.水的电离程度:f
D.g点c(CH3COO-)=c(N)>c(CH3COOH)=c(NH3·H2O)
4.(2024湖北武汉4月调研,15)为测定[Ag(CN)n]1-n中Ag+的配位数n,将浓度均为0.01 mol·L-1的AgNO3和KCN溶液按不同体积比混合,其用量和溶液浑浊度的关系如下图所示。已知:Ksp(AgCN)=1.6×10-14。下列说法错误的是 ( )
A.b点对应的V[AgNO3(aq)]= mL
B.[Ag(CN)n]1-n中Ag+配位数n=2
C.当V[KCN(aq)]=4 mL时,c(CN-)≈8.0×10-12 mol·L-1
D.当V[KCN(aq)]=6 mL时,n(AgCN)≈4.0×10-5 mol
5.(2024福建泉州三模,10)常温下,用浓度均为0.10 mol·L-1的HCl和CH3COOH溶液进行实验:①各取10 mL,混合后滴加一定浓度的KOH溶液。测得溶液的电导率随KOH溶液体积的变化如图1所示;②各取10 mL,分别滴加上述KOH溶液。测得溶液的电导率随KOH溶液体积的变化如图2所示。下列说法正确的是 ( )
图1图2
A.a点溶液:pH=1
B.水的电离程度:b
D.由图2可知等浓度时的电导率:Cl->CH3COO-
6.(2024山东临沂二模,15,改编)常温下,用盐酸调节草酸钡(用BaR表示)浊液的pH,测得溶液中-lgc(X)[X为R2-、]随-lgc(Ba2+)的变化关系如图所示。下列说法错误的是 ( )
A.曲线L2表示-lgc(Ba2+)与-lg[]变化曲线
B.Ksp(BaR)=10-6.8
C.a点溶液中:c(Ba2+)=c(Cl-)+c(OH-)+c(R2-)
D.b点溶液中:
lgc(R2-)=
7.(2024山东青岛二模,15)弱酸H2A在有机相和水相中存在平衡:H2A(环己烷) H2A(aq),平衡常数为Kd。25 ℃时,向V mL 0.1 mol·L-1 H2A环己烷溶液中加入V mL水进行萃取,用NaOH(s)或HCl(g)调节水溶液pH。测得水溶液中H2A、HA-、A2-浓度、环己烷中H2A的浓度[c环己烷(H2A)]与水相萃取率α[α=1-]随pH的变化关系如图所示。下列说法正确的是 ( )
已知:①H2A在环己烷中不电离;②忽略溶液体积变化;③lg2=0.3。
A.Kd=0.2
B.pH=6时,95%<α<96%
C.若调节水溶液pH=3,应加NaOH固体调节
D.若加水体积为2V mL,则交点N会由pH=4.6移至pH=4.3
综合拔高练
建议用时:30分钟
1.(2024北京东城二模,3)下列关于浓度均为0.1 mol·L-1的Na2CO3溶液和NaHCO3溶液的说法不正确的是 ( )
A.溶液pH:Na2CO3>NaHCO3
B.两种溶液中粒子种类不相同
C.均能与Ca(OH)2反应产生沉淀
D.溶液中均存在:c(H+)+c(Na+)=c(HC)+2c(C)+c(OH-)
2.(2024天津十二校一模,12)常温下,将SO2通入NaOH溶液中,得到一组c(H2SO3)+c(HS)+c(S)=0.100 mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH变化的关系曲线如下图所示。
下列有关说法错误的是 ( )
A.H2SO3的=10-1.9
B.在c(Na+)=0.100 mol·L-1的溶液中c(H+)+c(S)=c(OH-)+c(H2SO3)
C.在c(S)=c(HS)的溶液中c(H+)+c(Na+)+c(H2SO3)=0.100+c(OH-)+c(HS)
D.pH=1.9的溶液中:c(HS)>c(Na+)
3.(2024湖北八市3月联考,15)室温下,向10 mL 0.05 mol·L-1的NaHCO3溶液中滴加0.05 mol·L-1的盐酸(或0.05 mol·L-1 NaOH溶液),溶液的pH随加入酸(或碱)体积的变化如图所示。下列说法正确的是 ( )
A.根据题中信息不能判断NaHCO3溶液中HC的水解程度与电离程度的大小
B.a→n→m过程中:c(HC)+2c(C)+c(OH-)逐渐减小
C.a→b→c过程中:c(Na+)
4.(2024湖南雅礼中学4月测试,13)常温下,现有0.1 mol·L-1的NH4HCO3溶液,pH=7.8。已知含氮或含碳各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示,下列说法错误的是 ( )
A.常温下,Kb(NH3·H2O)>(H2CO3)
B.向pH=7.8的上述溶液中逐滴滴加NaOH溶液时,N浓度都逐渐减小
C.NH4HCO3溶液中存在下列守恒关系:c(N)+c(NH3·H2O)=c(HC)+c(C)+c(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HC)>c(N)>c(NH3·H2O)>c(C)
5.(2024北京朝阳二模,10)粗盐中的杂质离子主要有S、Ca2+、Mg2+,采用如下方法得到精制盐水,进而制取精盐(部分流程略)。
已知:ⅰ.
物质 BaSO4 BaCO3 CaCO3 Mg(OH)2
Ksp(25 ℃) 1.1×10-10 2.6×10-9 3.4×10-9 5.6×10-12
ⅱ.粗盐水中c(S)>c(Ca2+)
下列说法不合理的是 ( )
A.常温下,过程Ⅰ中当溶液pH=11时,Mg2+已沉淀完全
B.过程Ⅱ中加入足量的BaCO3,盐水b中的阴离子仅含有Cl-、OH-
C.过程Ⅱ中若改为先加BaCl2溶液、过滤后再加Na2CO3溶液也能达到除杂目的
D.过程Ⅲ中滴加盐酸调节pH时,应调至溶液呈中性或微酸性
6.(2024广东梅州二模,15)常温下,用一定浓度NaOH溶液滴定某一元酸HA溶液。滴定过程中溶液pH和导电能力的变化如下图所示。下列说法正确的是 ( )
A.HA为一元强酸
B.a点对应的溶液中:c(A-)=c(Na+)=c(H+)=c(OH-)
C.根据溶液pH和导电能力的变化可判断V2>V3
D.a、b、c三点对应的溶液中b点水的电离程度最大
7.(2024黑龙江哈三中一模,15)MB是一种难溶盐,H2B是一种二元弱酸(=1.3×10-7,=2.6×10-15),难挥发;M2+不发生水解。室温下,将MB溶于一定浓度的一元强酸HA溶液中,直到不再溶解,所得溶液中c2(H+)与c2(M2+)有如图所示的线性关系(已知:=2.6,忽略溶液体积变化)。下列说法错误的是 ( )
A.在图示实线对应的pH范围内,溶液中c(M2+)≈c(H2B)
B.Ksp(MB)≈2.0×10-24
C.溶液中存在c(HB-)+c(H+)+2c(H2B)=c(A-)+c(OH-)
D.将0.02 mol MB溶于1.0 L HA溶液中,所需HA的最低浓度为0.26 mol·L-1
8.(2024九省联考吉林、黑龙江卷,15)室温下,向c(Al3+)、c(Zn2+)均为0.1 mol·L-1的混合溶液中持续通入H2S气体,始终保持H2S饱和(H2S的物质的量浓度为0.1 mol·L-1),通过调节pH使Al3+、Zn2+分别沉淀,溶液中-lgc与pH的关系如下图所示。其中,c表示Al3+、Zn2+、OH-和S2-的物质的量浓度的数值,Ksp[Zn(OH)2]=1.2×10-17。下列说法错误的是 ( )
A.①代表-lgc(S2-)与pH的关系曲线
B.pH逐渐增大时,溶液中优先析出的沉淀为ZnS
C.Al(OH)3的Ksp=10-32.8
D.Zn2+(aq)+H2S(g) ZnS(s)+2H+(aq)的平衡常数K=10-0.4
9.(2024河北石家庄一模,14)氧化铅(PbO)在不同pH的水溶液体系中存在以下溶解平衡:
①PbO(s)+2H+(aq) Pb2+(aq)+H2O(l) K1
②PbO(s)+H+(aq) Pb(OH)+(aq) K2
③PbO(s)+H2O(l) Pb(OH)2(aq) K3
④PbO(s)+2H2O(l) Pb(OH(aq)+H+(aq) K4
lgc(X)[X为Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH]随pH变化的关系如图所示。下列说法错误的是 ( )
A.c表示lg[Pb(OH)+]与pH的关系
B.K3的数量级为10-5
C.随pH增大,溶液中所有含铅微粒的总浓度c总(Pb)逐渐降低
D.2Pb(OH)2(aq) Pb(OH)+(aq)+Pb(OH(aq)的K=
10.(2024甘肃兰州一模,14)1922年范斯莱克(Vanslyke)提出用缓冲容量β来描述缓冲溶液缓冲能力大小,β越大,缓冲能力越大。下图是常温下CH3COOH和CH3COONa组成的缓冲溶液的β-pH关系图,其中A、B两条曲线分别对应c总=c(CH3COOH)+c(CH3COO-)=0.1 mol/L和c总=c(CH3COOH)+c(CH3COO-)=0.2 mol/L。已知常温下,Ka(CH3COOH)=10-4.76,下列说法不正确的是 ( )
A.向pH=4.76的上述缓冲溶液中加入少量NaOH溶液,水的电离程度会增大
B.A曲线上任意一点的溶液中均存在c(Na+)+c(CH3COOH)+c(H+)=0.1+c(OH-)
C.B曲线代表的溶液缓冲能力最大时,溶液中c(Na+)>c(CH3COOH)
D.pH=4时,A、B曲线所代表的溶液中相等
11.(2024河北邢台二模,14)常温下,将一定浓度的氨水逐滴加入25 mL 0.12 mol·L-1 AgNO3溶液中,该过程中溶液AG[AG=lg]与加入氨水的体积V的关系如图所示。已知e点对应的溶液迅速由浑浊变澄清,且此时溶液中的c(Ag+)与c(NH3)均约为2×10-3 mol·L-1。下列叙述错误的是( )
A.a点对应溶液中由水电离出的c(H+)=10-5 mol·L-1
B.b点对应溶液中:c(Ag+)+c{[Ag(NH3)2]+}
D.最好选择d-e段溶液与葡萄糖等含有醛基的有机物发生银镜反应
专题十一 盐类水解和沉淀溶解平衡
五年高考
考点1 盐类水解
1.(2024安徽,13,3分)环境保护工程师研究利用Na2S、FeS和H2S处理水样中的Cd2+。
已知25 ℃时,H2S饱和溶液浓度约为0.1 mol·L-1,(H2S)=10-6.97,(H2S)=10-12.90,Ksp(FeS)=10-17.20,Ksp(CdS)=10-26.10。
下列说法错误的是 (B)
A.Na2S溶液中:c(H+)+c(Na+)=c(OH-)+c(HS-)+2c(S2-)
B.0.01 mol·L-1 Na2S溶液中:c(Na+)>c(S2-)>c(OH-)>c(HS-)
C.向c(Cd2+)=0.01 mol·L-1的溶液中加入FeS,可使c(Cd2+)<10-8 mol·L-1
D.向c(Cd2+)=0.01 mol·L-1的溶液中通入H2S气体至饱和,所得溶液中:c(H+)>c(Cd2+)
2.(2023北京,3,3分)下列过程与水解反应无关的是 (B)
A.热的纯碱溶液去除油脂
B.重油在高温、高压和催化剂作用下转化为小分子烃
C.蛋白质在酶的作用下转化为氨基酸
D.向沸水中滴入饱和FeCl3溶液制备Fe(OH)3胶体
3.(2023重庆,11,3分)(NH4)2SO4溶解度随温度变化的曲线如图所示,关于各点对应的溶液,下列说法正确的是 (B)
A.M点KW等于N点KW
B.M点pH大于N点pH
C.N点降温过程中有2个平衡发生移动
D.P点c(H+)+c(N)+c(NH3·H2O)=c(OH-)+2c(S)
4.(2023海南,14,4分)25 ℃下,Na2CO3水溶液的pH随其浓度的变化关系如图所示。下列说法正确的是 (B)
A.c(Na2CO3)=0.6 mol·L-1时,溶液中c(OH-)<0.01 mol·L-1
B.Na2CO3水解程度随其浓度增大而减小
C.在水中H2CO3的<4×10-11
D.0.2 mol·L-1的Na2CO3溶液和0.3 mol·L-1的NaHCO3溶液等体积混合,得到的溶液中c(OH-)<2×10-4 mol·L-1
5.(2023福建,10,4分)25 ℃时,某二元酸(H2A)的=10-4.37。1.0 mol·L-1 NaHA溶液稀释过程中δ(H2A)、δ(HA-)、δ(A2-)与pc(Na+)的关系如图所示。已知pc(Na+)=-lgc(Na+),HA-的分布系数δ(HA-)=。下列说法错误的是 (B)
A.曲线n为δ(HA-)的变化曲线
B.a点:pH=4.37
C.b点:2c(H2A)+c(HA-)=c(Na+)
D.c点:c(Na+)+c(H+)=3c(HA-)+c(OH-)
6.(2023江苏,12,3分)室温下,用含少量Mg2+的MnSO4溶液制备MnCO3的过程如图所示。已知Ksp(MgF2)=5.2×10-11,Ka(HF)=6.3×10-4。下列说法正确的是 (C)
A.0.1 mol·L-1 NaF溶液中:c(F-)=c(Na+)+c(H+)
B.“除镁”得到的上层清液中:c(Mg2+)=
C.0.1 mol·L-1 NaHCO3溶液中:c(C)=c(H+)+c(H2CO3)-c(OH-)
D.“沉锰”后的滤液中:c(Na+)+c(H+)=c(OH-)+c(HC)+2c(C)
7.(2023浙江6月选考,15,3分)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验:
实验Ⅰ:往20 mL 0.1 mol·L-1 NaHC2O4溶液中滴加0.1 mol·L-1 NaOH溶液。
实验Ⅱ:往20 mL 0.10 mol·L-1 NaHC2O4溶液中滴加0.10 mol·L-1 CaCl2溶液。
[已知:H2C2O4的电离常数=5.4×10-2,=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计],下列说法正确的是 (D)
A.实验Ⅰ可选用甲基橙作指示剂,指示反应终点
B.实验Ⅰ中V(NaOH)=10 mL时,存在c(C2)
D.实验Ⅱ中V(CaCl2)=80 mL时,溶液中c(C2)=4.0×10-8 mol·L-1
8.(双选)(2022海南,13,4分)NaClO溶液具有漂白能力。已知25 ℃时,Ka(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是 (AD)
A.0.01 mol·L-1溶液中,c(ClO-)<0.01 mol·L-1
B.长期露置在空气中,释放Cl2,漂白能力减弱
C.通入过量SO2,反应的离子方程式为SO2+ClO-+H2O HS+HClO
D.25 ℃,pH=7.0的NaClO和HClO的混合溶液中,c(HClO)>c(ClO-)=c(Na+)
9.(2022辽宁,15,3分)甘氨酸(NH2CH2COOH)是人体必需氨基酸之一。在25 ℃时,NCH2COO-和NH2CH2COO-的分布分数[如δ(A2-)=]与溶液pH关系如图。下列说法错误的是 (D)
A.甘氨酸具有两性
B.曲线c代表NH2CH2COO-
C.NCH2COOH+OH-的平衡常数K=10-11.65
D.c2(NCH2COO-)
下列说法正确的是 (C)
A.图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸
B.当滴加盐酸的体积为V1 mL时(a点、b点),所发生的反应用离子方程式表示为:HC+H+ CO2↑+H2O
C.根据pH-V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点
D.Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(C)=c(OH-)-c(H+)
11.(2021重庆,14,3分)下列叙述正确的是 (C)
A.向氨水中加入醋酸使溶液呈酸性,则c(N)>c(CH3COO-)
B.向NH4Cl溶液中加入少量Al2(SO4)3固体,则水的电离程度减小
C.向Na2CO3溶液中滴加盐酸至c(Na+)=2c(Cl-),则c(HC)>c(H2CO3)
D.向0.2 mol/L磷酸中加水至原体积的两倍,则c(H+)>0.1 mol/L
12.(2021广东,8,2分)鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl表示)。已知GHCl水溶液呈酸性,下列叙述正确的是 (A)
A.0.001 mol/L GHCl水溶液加水稀释,pH升高
B.0.001 mol/L GHCl水溶液的pH=3
C.GHCl在水中的电离方程式为:GHCl G+HCl
D.GHCl水溶液中:c(OH-)+c(Cl-)=c(GH+)+c(G)
13.(2021河北,6,3分)BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
下列说法错误的是 (D)
A.酸浸工序中分次加入稀HNO3可降低反应剧烈程度
B.转化工序中加入稀HCl可抑制生成BiONO3
C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度
D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成
14.(2021福建,10,4分)下图为某实验测得0.1 mol·L-1 NaHCO3溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法正确的是 (A)
A.a点溶液的c(OH-)比c点溶液的小
B.a点时,KW<(H2CO3)·(H2CO3)
C.b点溶液中,c(Na+)=c(HC)+2c(C)
D.ab段,pH减小说明升温抑制了HC的水解
15.(2021辽宁,15,3分)用0.100 0 mol·L-1盐酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-的分布分数δ随pH变化曲线及滴定曲线如图。[如A2-分布分数:δ(A2-)=]
下列说法正确的是 (C)
A.H2A的为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选酚酞作指示剂
D.c(Na2A)=0.200 0 mol·L-1
16.(2021湖南,9,3分)常温下,用0.100 0 mol·L-1的盐酸分别滴定20.00 mL浓度均为0.100 0 mol·L-1的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是 (C)
A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)
C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)
D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-)
17.(2020海南,12,4分)某弱酸HA溶液中主要成分的分布分数随pH的变化如图所示。下列说法错误的是 (B)
A.该酸-lgKa≈4.7
B.NaA的水解平衡常数Kh=
C.当该溶液的pH=7.0时,c(HA)
18.(2020天津,7,3分)常温下,下列有关电解质溶液的说法错误的是 (A)
A.相同浓度的HCOONa和NaF两溶液,前者的pH较大,则Ka(HCOOH)>Ka(HF)
B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则Ksp(FeS)>Ksp(CuS)
D.在1 mol·L-1 Na2S溶液中,c(S2-)+c(HS-)+c(H2S)=1 mol·L-1
考点2 沉淀溶解平衡
19.(2024黑、吉、辽,15,3分)25 ℃下,AgCl、AgBr和Ag2CrO4的沉淀溶解平衡曲线如下图所示。某实验小组以K2CrO4为指示剂,用AgNO3标准溶液分别滴定含Cl-水样、含Br-水样。
已知:①Ag2CrO4为砖红色沉淀;
②相同条件下AgCl溶解度大于AgBr;
③25 ℃时,p(H2CrO4)=0.7,p(H2CrO4)=6.5。
下列说法错误的是 (D)
A.曲线②为AgCl沉淀溶解平衡曲线
B.反应Ag2CrO4+H+ 2Ag++HCr的平衡常数K=10-5.2
C.滴定Cl-时,理论上混合液中指示剂浓度不宜超过10-2.0 mol·L-1
D.滴定Br-达终点时,溶液中=10-0.5
20.(2024江西,13,3分)废弃电池中锰可通过浸取回收。某温度下,MnSO4在不同浓度的KOH水溶液中,Mn(Ⅱ)的分布系数δ与pH的关系如图。下列说法正确的是 (C)
已知:δ(MnOH+)=
;Mn(OH)2难溶于水,具有两性。
A.曲线z为δ(MnOH+)
B.O点,c(H+)=×10-10.3 mol·L-1
C.P点,c(Mn2+)
21.(2024全国甲,13,6分)将0.10 mmol Ag2CrO4配制成1.0 mL悬浊液,向其中滴加0.10 mol·L-1的NaCl溶液。lg [cM/(mol·L-1)](M代表Ag+、Cl-或Cr)随加入NaCl溶液体积(V)的变化关系如图所示。
下列叙述正确的是 (D)
A.交点a处:c(Na+)=2c(Cl-)
B.=10-2.21
C.V≤2.0 mL时不变
D.y1=-7.82,y2=-lg34
22.(2023河北,14,3分)某温度下,两种难溶盐AgxX、AgyY的饱和溶液中-lg c(Xx-)或-lg c(Yy-)与-lg c(Ag+)的关系如图所示。下列说法错误的是 (D)
A.x∶y=3∶1
B.若混合溶液中各离子浓度如J点所示,加入AgNO3(s),则平衡时变小
C.向AgxX固体中加入NayY溶液,可发生AgxX→AgyY的转化
D.若混合溶液中各离子起始浓度如T点所示,待平衡时c(Xx-)+c(Yy-)<2c(Ag+)
23.(2023北京,14,3分)利用平衡移动原理,分析一定温度下Mg2+在不同pH的Na2CO3体系中的可能产物。
已知:①图1中曲线表示Na2CO3体系中各含碳粒子的物质的量分数与pH的关系。
②图2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=Ksp[Mg(OH)2];曲线Ⅱ的离子浓度关系符合c(Mg2+)·c(C)=Ksp(MgCO3)[注:起始c(Na2CO3)=0.1 mol·L-1,不同pH下c(C)由图1得到]。
下列说法不正确的是 (C)
A.由图1,pH=10.25,c(HC)=c(C)
B.由图2,初始状态pH=11、lg[c(Mg2+)]=-6,无沉淀生成
C.由图2,初始状态pH=9、lg[c(Mg2+)]=-2,平衡后溶液中存在c(H2CO3)+c(HC)+c(C)=0.1 mol·L-1
D.由图1和图2,初始状态pH=8、lg[c(Mg2+)]=-1,发生反应:Mg2++2HC MgCO3↓+CO2↑+H2O
24.(2023全国乙,13,6分)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是 (C)
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)=c(Cr),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl- 2AgCl+Cr的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
25.(2023新课标,13,6分)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3 [Ag(NH3)]+和NH3+[Ag(NH3)]+ [Ag(NH3)2]+。lg[c(M)/(mol·L-1)]与lg[c(NH3)/(mol·L-1)]的关系如下图所示{其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+}。
下列说法错误的是 (A)
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线
B.AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-9.75
C.反应[Ag(NH3)]++NH3 [Ag(NH3)2]+的平衡常数K的值为103.81
D.c(NH3)=0.01 mol·L-1时,溶液中c{[Ag(NH3)2]+}>c{[Ag(NH3)]+}>c(Ag+)
26.(2023辽宁,15,3分)某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol·L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lg c关系如图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol·L-1。已知Ksp(NiS)>Ksp(CdS),下列说法正确的是 (D)
A.Ksp(CdS)=10-18.4
B.③为pH与-lg c(HS-)的关系曲线
C.Ka1(H2S)=10-8.1
D.Ka2(H2S)=10-14.7
27.(双选)(2023山东,15,4分)在含HgI2(s)的溶液中,一定c(I-)范围内,存在平衡关系:HgI2(s) HgI2(aq);HgI2(aq) Hg2++2I-;HgI2(aq) HgI++I-;HgI2(aq)+I- Hg;HgI2(aq)+2I- Hg,平衡常数依次为K0、K1、K2、K3、K4。已知lgc(Hg2+)、lgc(HgI+)、lgc(Hg)、lgc(Hg)随lgc(I-)的变化关系如图所示。下列说法错误的是 (BD)
A.线L表示lgc(Hg)的变化情况
B.随c(I-)增大,c[HgI2(aq)]先增大后减小
C.a=lg
D.溶液中I元素与Hg元素的物质的量之比始终为2∶1
28.(2022重庆,11,3分)某小组模拟成垢—除垢过程如下。
100 mL 0.1 mol·L-1 CaCl2水溶液
……
忽略体积变化,且步骤②中反应完全。下列说法正确的是 (D)
A.经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-)
B.经过步骤②,溶液中c(Na+)=4c(S)
C.经过步骤②,溶液中c(Cl-)=c(C)+c(HC)+c(H2CO3)
D.经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)
29.(双选)(2022海南,14,4分)某元素M的氢氧化物M(OH)2(s)在水中的溶解反应为:
M(OH)2(s) M2+(aq)+2OH-(aq)
M(OH)2(s)+2OH-(aq) M(OH(aq)
25 ℃,-lgc与pH的关系如图所示,c为M2+或M(OH 浓度的值。下列说法错误的是 (BD)
A.曲线①代表-lgc(M2+)与pH的关系
B.M(OH)2的Ksp约为1×10-10
C.向c(M2+)=0.1 mol·L-1的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以M(OH)2(s)存在
D.向c[M(OH]=0.1 mol·L-1的溶液中加入等体积0.4 mol·L-1的HCl溶液后,体系中元素M主要以M2+存在
30.(2022福建,7,3分)锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有Fe3+、Al3+、Fe2+和Mg2+杂质离子,可在0~14范围内调节pH对其净化(即相关离子浓度c<10-5 mol·L-1)。25 ℃时,lgc与pH关系见如图[碱性过强时Fe(OH)3和Fe(OH)2会部分溶解]。下列说法正确的是 (B)
A.Mg2+可被净化的pH区间最大
B.加入适量H2O2,可进一步提升净化程度
C.净化的先后顺序:Mg2+、Fe2+、Fe3+、Al3+
D.Ksp[Fe(OH)3]
A.反应SrSO4(s)+C SrCO3(s)+S
B.a=-6.5
C.曲线④代表含SrCO3(s)的1.0 mol·L-1 Na2CO3溶液的变化曲线
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
三年模拟
题型强化练
题型 溶液中离子平衡图像分析
1.(2024安徽合肥三模,13)25 ℃,取浓度均为0.1 mol·L-1的ROH溶液和HX溶液各20 mL,分别用0.1 mol·L-1的盐酸、0.1 mol·L-1的NaOH溶液进行滴定。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法正确的是 (C)
A.HX为弱酸,ROH为强碱
B.曲线ⅡV=10 mL时溶液中:c(OH-)-c(H+)=c(HX)-c(X-)
C.滴定前,ROH溶液中:c(ROH)>c(OH-)>c(R+)>c(H+)
D.滴定至V=40 mL的过程中,两种溶液中由水电离出的c(H+)·c(OH-)始终保持不变
2.(2024东北三省一模,15)菠萝“扎嘴”的原因之一是菠萝中含有一种难溶于水的草酸钙针晶。常温下,草酸钙在不同pH体系中lgc(M)与pH的关系如图所示(M代表H2C2O4、HC2、Ca2+),已知Ksp(CaC2O4)=10-8.62、Ksp[Ca(OH)2]=10-5.6。下列有关说法正确的是 (B)
A.(H2C2O4)的数量级为10-4
B.溶液pH=7时,c(HC2)+2c(C2)=2c(Ca2+)
C.pH>12时,曲线①呈上升趋势的原因是部分CaC2O4转化为Ca(OH)2
D.A点时,体系中c(Ca2+)>c(H2C2O4)=c(HC2)>c(C2)>c(H+)>c(OH-)
3.(2024广东湛江二模,16)常温下,等浓度的氨水和醋酸溶液互相滴定过程中,溶液中pH与pX[pX=-lg]的关系如图所示。下列说法错误的是 (B)
A.常温下,Ka(CH3COOH)=1×10-4.76
B.水的电离程度:f
D.g点c(CH3COO-)=c(N)>c(CH3COOH)=c(NH3·H2O)
4.(2024湖北武汉4月调研,15)为测定[Ag(CN)n]1-n中Ag+的配位数n,将浓度均为0.01 mol·L-1的AgNO3和KCN溶液按不同体积比混合,其用量和溶液浑浊度的关系如下图所示。已知:Ksp(AgCN)=1.6×10-14。下列说法错误的是 (D)
A.b点对应的V[AgNO3(aq)]= mL
B.[Ag(CN)n]1-n中Ag+配位数n=2
C.当V[KCN(aq)]=4 mL时,c(CN-)≈8.0×10-12 mol·L-1
D.当V[KCN(aq)]=6 mL时,n(AgCN)≈4.0×10-5 mol
5.(2024福建泉州三模,10)常温下,用浓度均为0.10 mol·L-1的HCl和CH3COOH溶液进行实验:①各取10 mL,混合后滴加一定浓度的KOH溶液。测得溶液的电导率随KOH溶液体积的变化如图1所示;②各取10 mL,分别滴加上述KOH溶液。测得溶液的电导率随KOH溶液体积的变化如图2所示。下列说法正确的是 (D)
图1图2
A.a点溶液:pH=1
B.水的电离程度:b
D.由图2可知等浓度时的电导率:Cl->CH3COO-
6.(2024山东临沂二模,15,改编)常温下,用盐酸调节草酸钡(用BaR表示)浊液的pH,测得溶液中-lgc(X)[X为R2-、]随-lgc(Ba2+)的变化关系如图所示。下列说法错误的是 (C)
A.曲线L2表示-lgc(Ba2+)与-lg[]变化曲线
B.Ksp(BaR)=10-6.8
C.a点溶液中:c(Ba2+)=c(Cl-)+c(OH-)+c(R2-)
D.b点溶液中:
lgc(R2-)=
7.(2024山东青岛二模,15)弱酸H2A在有机相和水相中存在平衡:H2A(环己烷) H2A(aq),平衡常数为Kd。25 ℃时,向V mL 0.1 mol·L-1 H2A环己烷溶液中加入V mL水进行萃取,用NaOH(s)或HCl(g)调节水溶液pH。测得水溶液中H2A、HA-、A2-浓度、环己烷中H2A的浓度[c环己烷(H2A)]与水相萃取率α[α=1-]随pH的变化关系如图所示。下列说法正确的是 (C)
已知:①H2A在环己烷中不电离;②忽略溶液体积变化;③lg2=0.3。
A.Kd=0.2
B.pH=6时,95%<α<96%
C.若调节水溶液pH=3,应加NaOH固体调节
D.若加水体积为2V mL,则交点N会由pH=4.6移至pH=4.3
综合拔高练
建议用时:30分钟
1.(2024北京东城二模,3)下列关于浓度均为0.1 mol·L-1的Na2CO3溶液和NaHCO3溶液的说法不正确的是 (B)
A.溶液pH:Na2CO3>NaHCO3
B.两种溶液中粒子种类不相同
C.均能与Ca(OH)2反应产生沉淀
D.溶液中均存在:c(H+)+c(Na+)=c(HC)+2c(C)+c(OH-)
2.(2024天津十二校一模,12)常温下,将SO2通入NaOH溶液中,得到一组c(H2SO3)+c(HS)+c(S)=0.100 mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH变化的关系曲线如下图所示。
下列有关说法错误的是 (B)
A.H2SO3的=10-1.9
B.在c(Na+)=0.100 mol·L-1的溶液中c(H+)+c(S)=c(OH-)+c(H2SO3)
C.在c(S)=c(HS)的溶液中c(H+)+c(Na+)+c(H2SO3)=0.100+c(OH-)+c(HS)
D.pH=1.9的溶液中:c(HS)>c(Na+)
3.(2024湖北八市3月联考,15)室温下,向10 mL 0.05 mol·L-1的NaHCO3溶液中滴加0.05 mol·L-1的盐酸(或0.05 mol·L-1 NaOH溶液),溶液的pH随加入酸(或碱)体积的变化如图所示。下列说法正确的是 (B)
A.根据题中信息不能判断NaHCO3溶液中HC的水解程度与电离程度的大小
B.a→n→m过程中:c(HC)+2c(C)+c(OH-)逐渐减小
C.a→b→c过程中:c(Na+)
4.(2024湖南雅礼中学4月测试,13)常温下,现有0.1 mol·L-1的NH4HCO3溶液,pH=7.8。已知含氮或含碳各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示,下列说法错误的是 (B)
A.常温下,Kb(NH3·H2O)>(H2CO3)
B.向pH=7.8的上述溶液中逐滴滴加NaOH溶液时,N浓度都逐渐减小
C.NH4HCO3溶液中存在下列守恒关系:c(N)+c(NH3·H2O)=c(HC)+c(C)+c(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HC)>c(N)>c(NH3·H2O)>c(C)
5.(2024北京朝阳二模,10)粗盐中的杂质离子主要有S、Ca2+、Mg2+,采用如下方法得到精制盐水,进而制取精盐(部分流程略)。
已知:ⅰ.
物质 BaSO4 BaCO3 CaCO3 Mg(OH)2
Ksp(25 ℃) 1.1×10-10 2.6×10-9 3.4×10-9 5.6×10-12
ⅱ.粗盐水中c(S)>c(Ca2+)
下列说法不合理的是 (B)
A.常温下,过程Ⅰ中当溶液pH=11时,Mg2+已沉淀完全
B.过程Ⅱ中加入足量的BaCO3,盐水b中的阴离子仅含有Cl-、OH-
C.过程Ⅱ中若改为先加BaCl2溶液、过滤后再加Na2CO3溶液也能达到除杂目的
D.过程Ⅲ中滴加盐酸调节pH时,应调至溶液呈中性或微酸性
6.(2024广东梅州二模,15)常温下,用一定浓度NaOH溶液滴定某一元酸HA溶液。滴定过程中溶液pH和导电能力的变化如下图所示。下列说法正确的是 (D)
A.HA为一元强酸
B.a点对应的溶液中:c(A-)=c(Na+)=c(H+)=c(OH-)
C.根据溶液pH和导电能力的变化可判断V2>V3
D.a、b、c三点对应的溶液中b点水的电离程度最大
7.(2024黑龙江哈三中一模,15)MB是一种难溶盐,H2B是一种二元弱酸(=1.3×10-7,=2.6×10-15),难挥发;M2+不发生水解。室温下,将MB溶于一定浓度的一元强酸HA溶液中,直到不再溶解,所得溶液中c2(H+)与c2(M2+)有如图所示的线性关系(已知:=2.6,忽略溶液体积变化)。下列说法错误的是 (D)
A.在图示实线对应的pH范围内,溶液中c(M2+)≈c(H2B)
B.Ksp(MB)≈2.0×10-24
C.溶液中存在c(HB-)+c(H+)+2c(H2B)=c(A-)+c(OH-)
D.将0.02 mol MB溶于1.0 L HA溶液中,所需HA的最低浓度为0.26 mol·L-1
8.(2024九省联考吉林、黑龙江卷,15)室温下,向c(Al3+)、c(Zn2+)均为0.1 mol·L-1的混合溶液中持续通入H2S气体,始终保持H2S饱和(H2S的物质的量浓度为0.1 mol·L-1),通过调节pH使Al3+、Zn2+分别沉淀,溶液中-lgc与pH的关系如下图所示。其中,c表示Al3+、Zn2+、OH-和S2-的物质的量浓度的数值,Ksp[Zn(OH)2]=1.2×10-17。下列说法错误的是 (D)
A.①代表-lgc(S2-)与pH的关系曲线
B.pH逐渐增大时,溶液中优先析出的沉淀为ZnS
C.Al(OH)3的Ksp=10-32.8
D.Zn2+(aq)+H2S(g) ZnS(s)+2H+(aq)的平衡常数K=10-0.4
9.(2024河北石家庄一模,14)氧化铅(PbO)在不同pH的水溶液体系中存在以下溶解平衡:
①PbO(s)+2H+(aq) Pb2+(aq)+H2O(l) K1
②PbO(s)+H+(aq) Pb(OH)+(aq) K2
③PbO(s)+H2O(l) Pb(OH)2(aq) K3
④PbO(s)+2H2O(l) Pb(OH(aq)+H+(aq) K4
lgc(X)[X为Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH]随pH变化的关系如图所示。下列说法错误的是 (C)
A.c表示lg[Pb(OH)+]与pH的关系
B.K3的数量级为10-5
C.随pH增大,溶液中所有含铅微粒的总浓度c总(Pb)逐渐降低
D.2Pb(OH)2(aq) Pb(OH)+(aq)+Pb(OH(aq)的K=
10.(2024甘肃兰州一模,14)1922年范斯莱克(Vanslyke)提出用缓冲容量β来描述缓冲溶液缓冲能力大小,β越大,缓冲能力越大。下图是常温下CH3COOH和CH3COONa组成的缓冲溶液的β-pH关系图,其中A、B两条曲线分别对应c总=c(CH3COOH)+c(CH3COO-)=0.1 mol/L和c总=c(CH3COOH)+c(CH3COO-)=0.2 mol/L。已知常温下,Ka(CH3COOH)=10-4.76,下列说法不正确的是 (C)
A.向pH=4.76的上述缓冲溶液中加入少量NaOH溶液,水的电离程度会增大
B.A曲线上任意一点的溶液中均存在c(Na+)+c(CH3COOH)+c(H+)=0.1+c(OH-)
C.B曲线代表的溶液缓冲能力最大时,溶液中c(Na+)>c(CH3COOH)
D.pH=4时,A、B曲线所代表的溶液中相等
11.(2024河北邢台二模,14)常温下,将一定浓度的氨水逐滴加入25 mL 0.12 mol·L-1 AgNO3溶液中,该过程中溶液AG[AG=lg]与加入氨水的体积V的关系如图所示。已知e点对应的溶液迅速由浑浊变澄清,且此时溶液中的c(Ag+)与c(NH3)均约为2×10-3 mol·L-1。下列叙述错误的是(D)
A.a点对应溶液中由水电离出的c(H+)=10-5 mol·L-1
B.b点对应溶液中:c(Ag+)+c{[Ag(NH3)2]+}
D.最好选择d-e段溶液与葡萄糖等含有醛基的有机物发生银镜反应
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
