8.2 常见的酸和碱 课件(共86张PPT)
文档属性
| 名称 | 8.2 常见的酸和碱 课件(共86张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 32.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-08 19:03:18 | ||
图片预览











文档简介
(共86张PPT)
第2节 常见的酸和碱
溶液的酸碱性
酸性溶液和碱性溶液
溶液酸碱性的强弱
能使紫色石蕊溶液变红,表现出酸性
能使紫色石蕊溶液变蓝,这些溶液显碱性
pH试纸可以粗略测定溶液酸碱性的强弱
pH<7,溶液呈酸性;pH>7,溶液呈碱性
溶液酸碱性与生命活动的关系
健康人的体液pH必须维持在一定的范围内
人们通常把 pH小于5.6的降水称为酸雨
用pH计和pH传感器测定溶液酸碱度
pH计是一种用于测定液体pH的电子仪器
小型 pH 计也称 pH 测试笔
酸的性质与应用
人的胃液中有盐酸汽车常用的电瓶(铅蓄电池)中含有硫酸,酸雨中溶有极少量的硫酸和硝酸,食醋中含有一定量的醋酸。盐酸、硫酸、硝酸和醋酸都是重要的酸
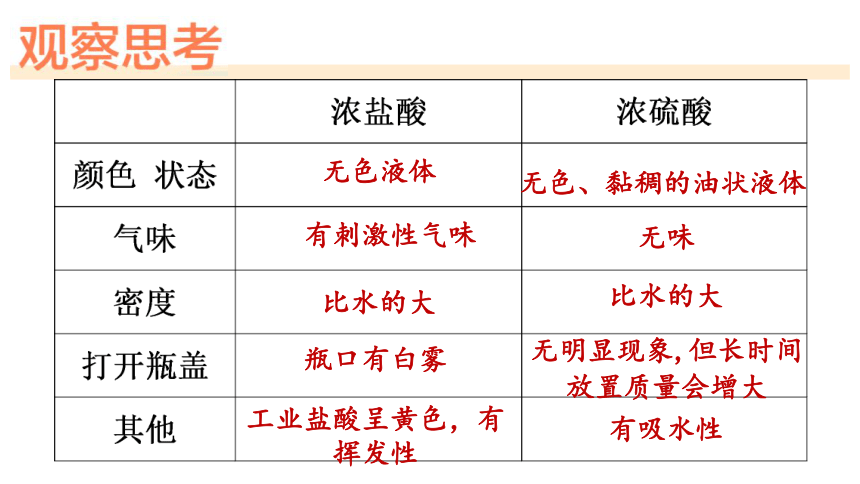
无色液体
无色、黏稠的油状液体
瓶口有白雾
无明显现象,但长时间放置质量会增大
有刺激性气味
无味
比水的大
比水的大
工业盐酸呈黄色,有挥发性
有吸水性
浓盐酸挥发出的氯化氢气体遇空气中的水蒸气,结合成盐酸小液滴,这些小液滴向四周扩散形成白雾。
浓盐酸具有挥发性,使制得的二氧化碳中混有较多氯化氢气体。
浓硫酸
CO2和H2O
的混合气体
浓硫酸可做某些气体的干燥剂。
CO2
浓盐酸
浓硫酸
浓硫酸的稀释操作:
把浓硫酸缓缓注入盛有水的烧杯中,用玻璃棒引流(或沿着烧杯壁缓缓倾倒)
并不断搅拌。
酸的化学性质
红色
不变色
红色
不变色
反应剧烈,有大量气泡产生
反应剧烈,有大量气泡产生
反应较剧烈,有气泡产生
不反应
不反应
反应较剧烈,有气泡产生
发生反应,有气泡产生
发生反应,有气泡产生
结论:酸+较活泼金属 盐+氢气
2HCl+Zn = ZnCl2+H2
H2SO4+Zn = ZnSO4+H2
2HCl+Mg = MgCl2+H2
H2SO4+Mg = MgSO4+H2
2HCl+Fe = FeCl2+H2
H2SO4+Fe = FeSO4+H2
砂纸
想一想
铁锈溶解,生成黄色的溶液
铁锈溶解,生成黄色的溶液
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+2HCl==CuCl2+H2O
CuO+H2SO4==CuSO4+H2O
CuO+2HCl = CuCl2+H2O
CuO+H2SO4 = CuSO4+H2O
固体溶解,生成蓝色的溶液
固体溶解,生成蓝色的溶液
Fe2O3+6HCl = 2FeCl3+3H2O
Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
CuO+H2SO4 = CuSO4+H2O
CuO+2HCl = CuCl2+H2O
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
有大量气泡冒出
有白色沉淀生成
AgNO3+HCl ===AgCl↓+HNO3
H2SO4+BaCl2 = BaSO4↓+2HCl
有白色沉淀生成
碱的性质与应用
石灰乳和石灰水中含有碱--氢氧化钙氢氧化钙俗称熟石灰或消石灰。氢氧化钠,俗称烧碱、火碱或苛性钠氢氧化钠和氢氧化钙都是重要的碱。
1. 氢氧化钠(NaOH)
实验 现象 分析
观察
放表面皿上
放入水中
白色块状固体
表面潮湿
试管外壁温度较高
氢氧化钠吸收空气中的水分
溶解时放热
肥 皂
炼油
造 纸
纺 织
印 染
含NaOH:除油污
放入约20%的氢氧化钠溶液中
20分钟后取出
高温
氢氧化钙
氢氧化钠
加无色酚酞试液
加紫色石蕊试液
蓝色
蓝色
红色
红色
只有溶于水的碱能使酸碱指示剂变色。
CO2 + Ca(OH)2 ==== CaCO3↓+ H2O
氢氧化钠溶液
二氧化碳气体
水
烧瓶内形成喷泉
CuSO4 + 2NaOH
== Cu(OH)2↓+ Na2SO4
有蓝色沉淀生成
FeCl3 + 3NaOH
== Fe(OH)3↓+ 3NaCl
有红褐色色沉淀生成
CuSO4 +Ca(OH)2
==Cu(OH)2↓+ CaSO4
有蓝色沉淀生成
2FeCl3 + 3Ca(OH)2
== 2Fe(OH)3↓+ 3CaCl2
有红褐色沉淀生成
2NaOH+CuSO4 = Na2SO4+Cu(OH)2↓
Ca(OH)2+Na2CO3 = CaCO3↓+2NaOH
Ca(OH)2+CuSO4 = CaSO4+ Cu(OH)2↓
3NaOH + FeCl3 = Fe(OH)3↓+ 3NaCl
(NH4)2SO4 + 2NaOH
== Na2SO4+ 2NH3↑+2H2O
能使紫色石蕊试剂变蓝色,无色酚酞变红色
CO2 + 2NaOH == Na2CO3 + H2O
2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO4
SO2 +2NaOH == Na2SO3 + H2O
3NaOH + FeCl3 ==Fe(OH)3↓+ 3NaCl
能使紫色石蕊试剂变蓝色,无色酚酞变红色
CO2 + Ca(OH)2 == CaCO3↓+ H2O
Ca(OH)2+ CuSO4 ==Cu(OH)2↓+ CaSO4
Ca(OH)2+Na2CO3 ==CaCO3↓+2NaOH
碱的通性
1.能使紫色石蕊试剂变蓝色;无色酚酞变红色
2.碱+酸→盐+水
3.碱+某些非金属氧化物→盐+水
4.碱+盐→新盐+新碱
1.酸与碱作用生成盐和水的反应,叫做中和反应。它在工农业生产和日常生活中有广泛的用途。下列应用一定与中和反应原理无关的是( )
A.施用熟石灰改良酸性土壤
B.服用含Al(OH)3的药物治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸
C
C
B
B
B
6.下列物质放入到稀盐酸中,无气体生成的是( )
A.铝 B.碳酸钠 C.铁锈 D.石灰石
7.稀盐酸和硫酸具有许多相似化学性质的原因是( )
A.它们都是溶液 B.它们都含有酸根离子
C.它们都含有氢元素
D.它们的水溶液中都含有大量氢离子
C
D
第2节 常见的酸和碱
常见的酸
酸的性质
高锰酸、盐酸(氢氯酸)、硫酸、硝酸
弱酸:氢氟酸、磷酸、甲酸
物理性质:无色液体 易挥发 有刺激性气味
化学性质:腐蚀性 挥发性
常见的碱
强碱:氢氧化钠、氢氧化钾、熟石灰
弱碱:氨水、醋酸、硼酸
碱的性质
物理性质:白色固体 吸湿性,容易潮解
化学性质:腐蚀性
第2节 常见的酸和碱
溶液的酸碱性
酸性溶液和碱性溶液
溶液酸碱性的强弱
能使紫色石蕊溶液变红,表现出酸性
能使紫色石蕊溶液变蓝,这些溶液显碱性
pH试纸可以粗略测定溶液酸碱性的强弱
pH<7,溶液呈酸性;pH>7,溶液呈碱性
溶液酸碱性与生命活动的关系
健康人的体液pH必须维持在一定的范围内
人们通常把 pH小于5.6的降水称为酸雨
用pH计和pH传感器测定溶液酸碱度
pH计是一种用于测定液体pH的电子仪器
小型 pH 计也称 pH 测试笔
酸的性质与应用
人的胃液中有盐酸汽车常用的电瓶(铅蓄电池)中含有硫酸,酸雨中溶有极少量的硫酸和硝酸,食醋中含有一定量的醋酸。盐酸、硫酸、硝酸和醋酸都是重要的酸
无色液体
无色、黏稠的油状液体
瓶口有白雾
无明显现象,但长时间放置质量会增大
有刺激性气味
无味
比水的大
比水的大
工业盐酸呈黄色,有挥发性
有吸水性
浓盐酸挥发出的氯化氢气体遇空气中的水蒸气,结合成盐酸小液滴,这些小液滴向四周扩散形成白雾。
浓盐酸具有挥发性,使制得的二氧化碳中混有较多氯化氢气体。
浓硫酸
CO2和H2O
的混合气体
浓硫酸可做某些气体的干燥剂。
CO2
浓盐酸
浓硫酸
浓硫酸的稀释操作:
把浓硫酸缓缓注入盛有水的烧杯中,用玻璃棒引流(或沿着烧杯壁缓缓倾倒)
并不断搅拌。
酸的化学性质
红色
不变色
红色
不变色
反应剧烈,有大量气泡产生
反应剧烈,有大量气泡产生
反应较剧烈,有气泡产生
不反应
不反应
反应较剧烈,有气泡产生
发生反应,有气泡产生
发生反应,有气泡产生
结论:酸+较活泼金属 盐+氢气
2HCl+Zn = ZnCl2+H2
H2SO4+Zn = ZnSO4+H2
2HCl+Mg = MgCl2+H2
H2SO4+Mg = MgSO4+H2
2HCl+Fe = FeCl2+H2
H2SO4+Fe = FeSO4+H2
砂纸
想一想
铁锈溶解,生成黄色的溶液
铁锈溶解,生成黄色的溶液
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+2HCl==CuCl2+H2O
CuO+H2SO4==CuSO4+H2O
CuO+2HCl = CuCl2+H2O
CuO+H2SO4 = CuSO4+H2O
固体溶解,生成蓝色的溶液
固体溶解,生成蓝色的溶液
Fe2O3+6HCl = 2FeCl3+3H2O
Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
CuO+H2SO4 = CuSO4+H2O
CuO+2HCl = CuCl2+H2O
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
有大量气泡冒出
有白色沉淀生成
AgNO3+HCl ===AgCl↓+HNO3
H2SO4+BaCl2 = BaSO4↓+2HCl
有白色沉淀生成
碱的性质与应用
石灰乳和石灰水中含有碱--氢氧化钙氢氧化钙俗称熟石灰或消石灰。氢氧化钠,俗称烧碱、火碱或苛性钠氢氧化钠和氢氧化钙都是重要的碱。
1. 氢氧化钠(NaOH)
实验 现象 分析
观察
放表面皿上
放入水中
白色块状固体
表面潮湿
试管外壁温度较高
氢氧化钠吸收空气中的水分
溶解时放热
肥 皂
炼油
造 纸
纺 织
印 染
含NaOH:除油污
放入约20%的氢氧化钠溶液中
20分钟后取出
高温
氢氧化钙
氢氧化钠
加无色酚酞试液
加紫色石蕊试液
蓝色
蓝色
红色
红色
只有溶于水的碱能使酸碱指示剂变色。
CO2 + Ca(OH)2 ==== CaCO3↓+ H2O
氢氧化钠溶液
二氧化碳气体
水
烧瓶内形成喷泉
CuSO4 + 2NaOH
== Cu(OH)2↓+ Na2SO4
有蓝色沉淀生成
FeCl3 + 3NaOH
== Fe(OH)3↓+ 3NaCl
有红褐色色沉淀生成
CuSO4 +Ca(OH)2
==Cu(OH)2↓+ CaSO4
有蓝色沉淀生成
2FeCl3 + 3Ca(OH)2
== 2Fe(OH)3↓+ 3CaCl2
有红褐色沉淀生成
2NaOH+CuSO4 = Na2SO4+Cu(OH)2↓
Ca(OH)2+Na2CO3 = CaCO3↓+2NaOH
Ca(OH)2+CuSO4 = CaSO4+ Cu(OH)2↓
3NaOH + FeCl3 = Fe(OH)3↓+ 3NaCl
(NH4)2SO4 + 2NaOH
== Na2SO4+ 2NH3↑+2H2O
能使紫色石蕊试剂变蓝色,无色酚酞变红色
CO2 + 2NaOH == Na2CO3 + H2O
2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO4
SO2 +2NaOH == Na2SO3 + H2O
3NaOH + FeCl3 ==Fe(OH)3↓+ 3NaCl
能使紫色石蕊试剂变蓝色,无色酚酞变红色
CO2 + Ca(OH)2 == CaCO3↓+ H2O
Ca(OH)2+ CuSO4 ==Cu(OH)2↓+ CaSO4
Ca(OH)2+Na2CO3 ==CaCO3↓+2NaOH
碱的通性
1.能使紫色石蕊试剂变蓝色;无色酚酞变红色
2.碱+酸→盐+水
3.碱+某些非金属氧化物→盐+水
4.碱+盐→新盐+新碱
1.酸与碱作用生成盐和水的反应,叫做中和反应。它在工农业生产和日常生活中有广泛的用途。下列应用一定与中和反应原理无关的是( )
A.施用熟石灰改良酸性土壤
B.服用含Al(OH)3的药物治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸
C
C
B
B
B
6.下列物质放入到稀盐酸中,无气体生成的是( )
A.铝 B.碳酸钠 C.铁锈 D.石灰石
7.稀盐酸和硫酸具有许多相似化学性质的原因是( )
A.它们都是溶液 B.它们都含有酸根离子
C.它们都含有氢元素
D.它们的水溶液中都含有大量氢离子
C
D
第2节 常见的酸和碱
常见的酸
酸的性质
高锰酸、盐酸(氢氯酸)、硫酸、硝酸
弱酸:氢氟酸、磷酸、甲酸
物理性质:无色液体 易挥发 有刺激性气味
化学性质:腐蚀性 挥发性
常见的碱
强碱:氢氧化钠、氢氧化钾、熟石灰
弱碱:氨水、醋酸、硼酸
碱的性质
物理性质:白色固体 吸湿性,容易潮解
化学性质:腐蚀性
同课章节目录
