8.3 酸和碱反应 课件(共38张PPT)
文档属性
| 名称 | 8.3 酸和碱反应 课件(共38张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-11 15:31:20 | ||
图片预览







文档简介
(共38张PPT)
8.3酸和碱反应
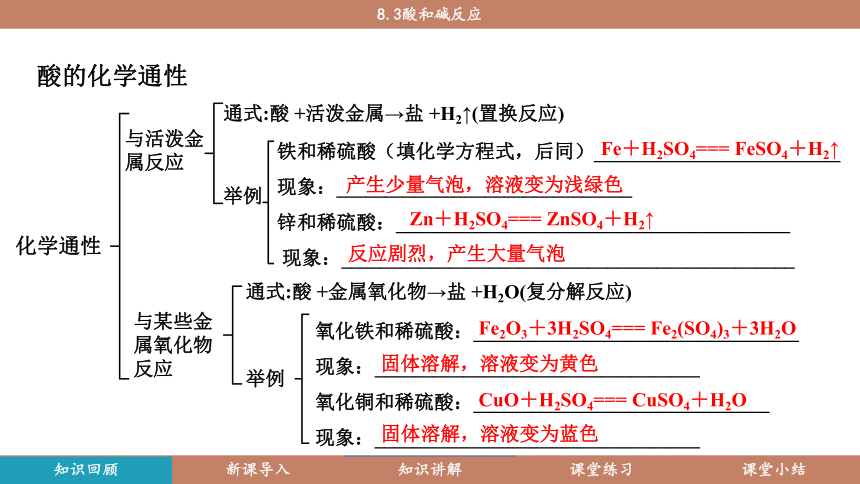
酸的化学通性
化学通性
与活泼金属反应
通式:酸 +活泼金属→盐 +H2↑(置换反应)
举例
铁和稀硫酸(填化学方程式,后同)_________________________
现象:______________________________
锌和稀硫酸:________________________________________
现象:______________________________________________
与某些金属氧化物反应
通式:酸 +金属氧化物→盐 +H2O(复分解反应)
氧化铁和稀硫酸:_________________________________
现象:_________________________________
氧化铜和稀硫酸:______________________________
现象:_________________________________
举例
反应剧烈,产生大量气泡
Fe+H2SO4=== FeSO4+H2↑
产生少量气泡,溶液变为浅绿色
固体溶解,溶液变为黄色
Zn+H2SO4=== ZnSO4+H2↑
Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O
CuO+H2SO4=== CuSO4+H2O
固体溶解,溶液变为蓝色
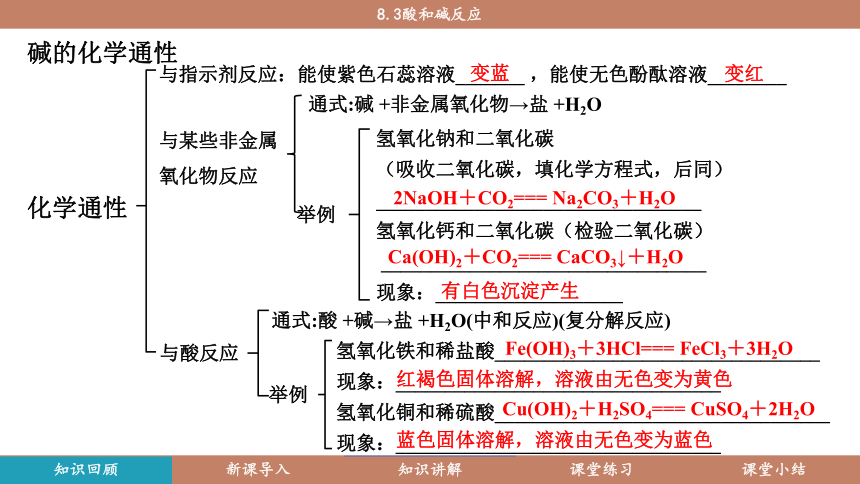
碱的化学通性
化学通性
与指示剂反应:能使紫色石蕊溶液_______ ,能使无色酚酞溶液________
与某些非金属氧化物反应
通式:碱 +非金属氧化物→盐 +H2O
举例
氢氧化钠和二氧化碳
(吸收二氧化碳,填化学方程式,后同) _________________________________
氢氧化钙和二氧化碳(检验二氧化碳)
_________________________________
现象:___________________
与酸反应
通式:酸 +碱→盐 +H2O(中和反应)(复分解反应)
氢氧化铁和稀盐酸_________________________________
现象:_________________________________
氢氧化铜和稀硫酸__________________________________
现象:_________________________________
举例
变蓝
蓝色固体溶解,溶液由无色变为蓝色
红褐色固体溶解,溶液由无色变为黄色
有白色沉淀产生
变红
2NaOH+CO2=== Na2CO3+H2O
Ca(OH)2+CO2=== CaCO3↓+H2O
Fe(OH)3+3HCl=== FeCl3+3H2O
Cu(OH)2+H2SO4=== CuSO4+2H2O
为什么要往酸性的土壤里撒熟石灰呢
从上节学习中,你已经知道酸、碱各自有相似的化学性质,这是什么原因造成的呢
观察活动 >>
目的 知道酸、碱溶液能够导电
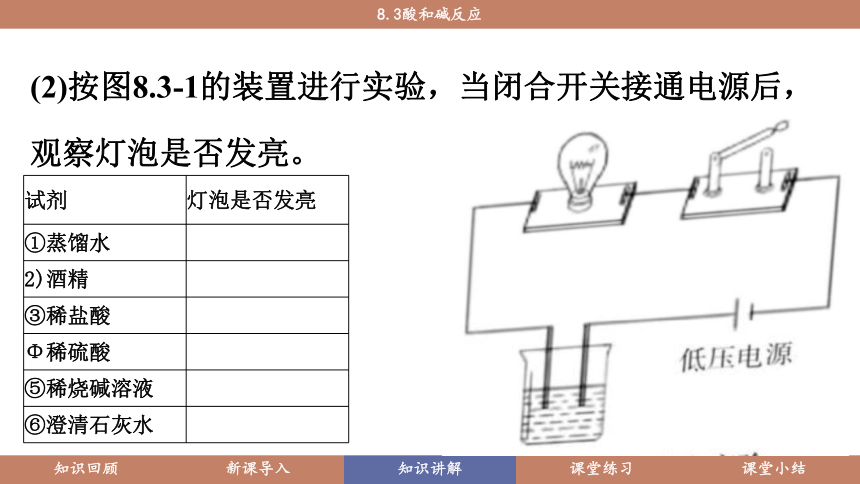
【实验8-12】(1)在6只依次标有①~⑥号的小烧杯中分别装下表列出的试剂各100mL
(2)按图8.3-1的装置进行实验,当闭合开关接通电源后,观察灯泡是否发亮。
试剂 灯泡是否发亮
①蒸馏水
2)酒精
③稀盐酸
Φ稀硫酸
⑤稀烧碱溶液
⑥澄清石灰水
由实验可知,蒸馏水、酒精不导电,而酸溶液和碱溶液能够导电。
这说明酸、碱溶液中存在可自由移动的带电微观粒子。这些带电微观粒子是什么呢
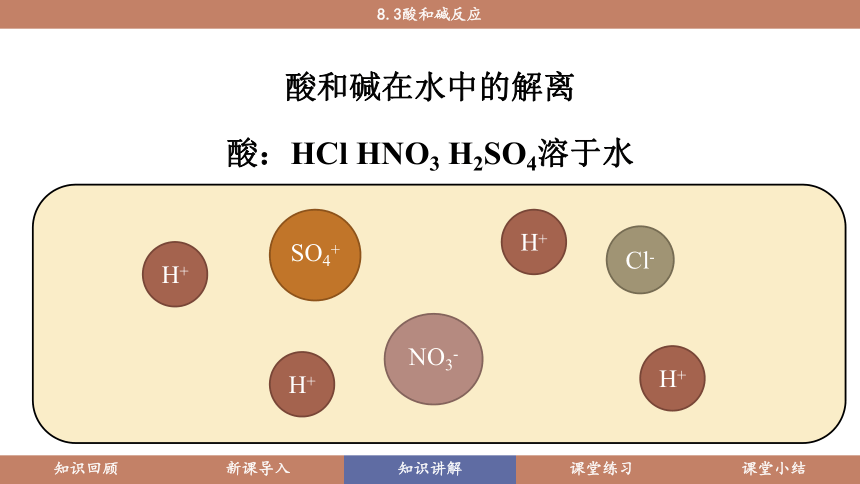
只要分析酸和碱的组成,就可以看出酸和碱在水中都能解离出阳离子和阴离子(如图8.3-2)。
酸和碱在水中的解离
酸:HCl HNO3 H2SO4溶于水
H+
SO4+
H+
Cl-
H+
NO3-
H+
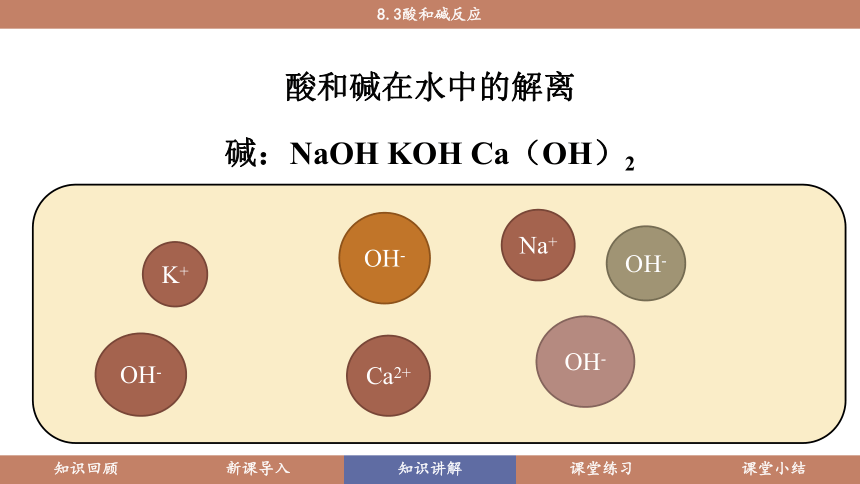
酸和碱在水中的解离
碱:NaOH KOH Ca(OH)2
K+
OH-
Na+
OH-
OH-
OH-
Ca2+
由此可知:酸和碱溶于水后各自都能解离出一种相同的离子,在酸溶液中是氢离子,在碱溶液中是氢氧根离子。这正是它们会各自有相似化学性质的原因。
中和反应
把酸溶液和碱溶液相混合,它们之间又会发生什么反应呢
请通过以下实验寻求答案
学生实验探究 >>>
目的 认识酸与碱的中和反应。
●提出问题
【实验8-13】在烧杯中加入约5ml稀氢氧化钠溶液,用滴管慢慢滴入稀盐酸,观察到什么现象 有没有反应发生
思考:为了能观察到上述两种溶液混合后是否发生了化学反应,应采取什么方法
实验设计与实施
【实验8-14】实验用品:稀盐酸、稀硫酸、稀氢氧化钠溶液、澄清石灰水、紫色石蕊溶液、无色酚酞溶液。如下表实验(1)所示,在烧杯中加入约5mL稀氨氧化钠溶液,滴入几滴无色酚酞溶液。
用滴管逐滴滴入稀盐酸,并不断搅拌。你还能想到哪些实验方案呢 请设计实验(2)(3)和(4)并进行验证。
解释与结论
指示剂颜色的变化说明酸溶液与碱溶液发生了化学反应。
酸与碱作用生成盐和水的反应,叫作中和反应
酸与碱发生中和反应
同样是酸和碱重要的化学性质之一
利用手持技术数字化实验寻找酸碱中和反应发生的证据
对于没有明显实验现象的酸碱中和反应,同学们还可以运用手持技术数字化实验,通过pH传感器定量测量反应过程中溶液的pH,通过分析 pH 变化曲线寻找酸和碱发生反应的证据。也可以通过温度传感器定量测量反应过程中温度的变化(如图8.3-3)。
向稀氢氧化钠溶液中逐滴加入稀盐酸过程中pH和温度的变化
下表归纳了酸和碱的主要化学性质
项目 酸的主要化学性质 碱的主要化学性质
与指示剂作用 紫色石蕊 使紫色石蕊溶液( ) 使紫色石蕊溶液( )
无色酚酞 使无色酚酞溶液( ) 无色酚酞溶液( )
酸碱相互反应 酸+碱→( )+( ) 与氧化物反应 酸+氧化物→( )+( ) 酸+氧化物→( )+( )
与盐反应 酸+盐→( )+( ) 盐+碱→( )+( )
与较活泼金属反应 酸+较活泼金属→( )+( ) ————————————
上述酸和碱的许多反应中都有这样的特点:
参加反应的两种化合物互相交换成分生成另外两种化合物。
像这种类型的反应,叫作复分解反应
讨论与交流 >>>
1.若用 AB 和CD分别表示两种化合物,如何表示复分解反应的通式
2.中和反应和复分解反应两者有什么关系 为什么
3.大家已经学习过化合、分解、置换、复分解这四种基本反应类型。
你能归纳出它们各自的特点,并准确判断某个具体化学反应属于什么基本反应类型吗 请举例说明
思路与方法导引 >>>
认识化学反应的视角
可以从多个角度(物质的的变化、反应条件、现象和反应类型等)来认识一个化学反应。例如在[实验8-13、8-14]中,酸和碱反应生成盐和水,从反应类型来看属于复分解反应。
从能量变化来看实验过程中放出热量。
学习从多个角度认识化学交应能帮助你形成认识化学变化的系统思维。
中和反应的应用
1.改良酸性或碱性土壤
夏天到农村去,常常看到养鱼的农户向放干的鱼塘底撒熟石灰,这是为了中和鱼塘底泥中过多的有机酸(同时达到杀菌消毒的目的),使放水后的鱼塘水达到适合鱼苗生长的pH。
另外,由于工业生产排放的酸性物质随雨水落下,形成酸雨。
酸雨对工业设备、石材建筑和文物古迹的腐蚀十分严重,对农作物等植物的危害也十分明显。
我们可以利用熟石灰来中和土壤和某些水源中过多的酸,以减轻酸雨的危害。
2.废水处理
如果废水中含有酸性物质(如硫酸、盐酸等),必须先用碱性物质(如烧碱、熟石灰等)将其中和成中性以后才能排放,否则会造成水体污染。
3.医药应用
如果你被蚊虫叮咬,皮肤会出现红肿疼痛,这是因为蚊虫向你的皮肤“注射”了蚁酸--甲酸等有毒物质。这时可以涂抹弱碱性的肥皂水、稀氨水或清凉油以减轻疼痛。有胃病的人常常胃酸(主要成分是盐酸)过多,可以口服碱性胃药(有效成分是氢氧化铝),以中和胃中过多的胃酸。
酸雨
部分非金属氧化物能跟水化合生成酸,例如:
煤和石油燃烧后所产生的烟气中,含有二氧化硫和氮氧化物,排放到空气中被云层吸收,并经过化学作用形成酸雾,随同雨水下降便成为显酸性的雨水,若其 pH 小于5.6,称为酸雨。
酸雨的危害性很大,如影响人类健康;使森林大面积枯死;使湖水酸化,鱼类死亡;使农作物生长受到影响而减产;使名胜古迹、建筑物腐蚀损坏等。
SO2+H2O === H2SO3
(亚硫酸)
SO3+H2O === H2SO4
1.食用松花蛋时常感到有涩味,这是因为制作松花蛋的过程中用到了熟石灰和纯碱等原料。 为了减轻涩味,可在食用松花蛋时添加某种调味品,这种调味品最好是( )
A.食盐 B.食醋
C.香油 D.味精
2.下列实际应用中,利用中和反应原理的是( )
①用氢氧化钠溶液洗去石油产品中的残余硫酸;
②用稀硫酸除铁锈;
③用熟石灰改良酸性土壤;
④用碳酸氢钠治疗胃酸过多
A.①③ B.③④ C.①②④ D.①③④
3.X可以发生如下反应:①X+酸→盐+水;②X+非金属氧化物→盐+水。X可能是( )
A.氧化铜 B.盐酸
C.氢氧化钠 D.碳酸钠
4.鱼味道鲜美,但剖鱼时弄破鱼胆,胆汁沾在鱼肉上,便有苦味,产生苦味的是胆汁酸,其pH约为6,且难溶于水。则在沾有胆汁的地方涂上下列物质可消除苦味的是( )
A.纯碱溶液 B.食醋
C.食盐水 D.自来水
5.下列反应属于复分解反应的是( )
A.Na2O + H2O === 2NaOH
B.H2 + CuO === Cu + H2O
C.Cu(OH)2 === CuO + H2O
D.H2SO4 + Ca(OH)2 === CaSO4 + 2H2O
定义:______ 和_______ 作用生成______ 和______ 的反应
表达式:酸 +碱→盐 +H2O(复分解反应)
中和反应的探究
应用
改良土壤的酸碱性。如:用熟石灰改良酸性土壤
处理工厂废水。如:用熟石灰处理酸性废水
用于医药。如:用含氢氧化镁[Mg(OH)2]或氢氧化铝[Al(OH)3]的药物治疗胃酸过多
_________________________________ (用化学方程式表示,写一个)
蚊虫叮咬后涂抹肥皂水、牙膏等
酸
水
盐
碱
Mg(OH)2+2HCl === MgCl2+2H2O
8.3酸和碱反应
酸的化学通性
化学通性
与活泼金属反应
通式:酸 +活泼金属→盐 +H2↑(置换反应)
举例
铁和稀硫酸(填化学方程式,后同)_________________________
现象:______________________________
锌和稀硫酸:________________________________________
现象:______________________________________________
与某些金属氧化物反应
通式:酸 +金属氧化物→盐 +H2O(复分解反应)
氧化铁和稀硫酸:_________________________________
现象:_________________________________
氧化铜和稀硫酸:______________________________
现象:_________________________________
举例
反应剧烈,产生大量气泡
Fe+H2SO4=== FeSO4+H2↑
产生少量气泡,溶液变为浅绿色
固体溶解,溶液变为黄色
Zn+H2SO4=== ZnSO4+H2↑
Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O
CuO+H2SO4=== CuSO4+H2O
固体溶解,溶液变为蓝色
碱的化学通性
化学通性
与指示剂反应:能使紫色石蕊溶液_______ ,能使无色酚酞溶液________
与某些非金属氧化物反应
通式:碱 +非金属氧化物→盐 +H2O
举例
氢氧化钠和二氧化碳
(吸收二氧化碳,填化学方程式,后同) _________________________________
氢氧化钙和二氧化碳(检验二氧化碳)
_________________________________
现象:___________________
与酸反应
通式:酸 +碱→盐 +H2O(中和反应)(复分解反应)
氢氧化铁和稀盐酸_________________________________
现象:_________________________________
氢氧化铜和稀硫酸__________________________________
现象:_________________________________
举例
变蓝
蓝色固体溶解,溶液由无色变为蓝色
红褐色固体溶解,溶液由无色变为黄色
有白色沉淀产生
变红
2NaOH+CO2=== Na2CO3+H2O
Ca(OH)2+CO2=== CaCO3↓+H2O
Fe(OH)3+3HCl=== FeCl3+3H2O
Cu(OH)2+H2SO4=== CuSO4+2H2O
为什么要往酸性的土壤里撒熟石灰呢
从上节学习中,你已经知道酸、碱各自有相似的化学性质,这是什么原因造成的呢
观察活动 >>
目的 知道酸、碱溶液能够导电
【实验8-12】(1)在6只依次标有①~⑥号的小烧杯中分别装下表列出的试剂各100mL
(2)按图8.3-1的装置进行实验,当闭合开关接通电源后,观察灯泡是否发亮。
试剂 灯泡是否发亮
①蒸馏水
2)酒精
③稀盐酸
Φ稀硫酸
⑤稀烧碱溶液
⑥澄清石灰水
由实验可知,蒸馏水、酒精不导电,而酸溶液和碱溶液能够导电。
这说明酸、碱溶液中存在可自由移动的带电微观粒子。这些带电微观粒子是什么呢
只要分析酸和碱的组成,就可以看出酸和碱在水中都能解离出阳离子和阴离子(如图8.3-2)。
酸和碱在水中的解离
酸:HCl HNO3 H2SO4溶于水
H+
SO4+
H+
Cl-
H+
NO3-
H+
酸和碱在水中的解离
碱:NaOH KOH Ca(OH)2
K+
OH-
Na+
OH-
OH-
OH-
Ca2+
由此可知:酸和碱溶于水后各自都能解离出一种相同的离子,在酸溶液中是氢离子,在碱溶液中是氢氧根离子。这正是它们会各自有相似化学性质的原因。
中和反应
把酸溶液和碱溶液相混合,它们之间又会发生什么反应呢
请通过以下实验寻求答案
学生实验探究 >>>
目的 认识酸与碱的中和反应。
●提出问题
【实验8-13】在烧杯中加入约5ml稀氢氧化钠溶液,用滴管慢慢滴入稀盐酸,观察到什么现象 有没有反应发生
思考:为了能观察到上述两种溶液混合后是否发生了化学反应,应采取什么方法
实验设计与实施
【实验8-14】实验用品:稀盐酸、稀硫酸、稀氢氧化钠溶液、澄清石灰水、紫色石蕊溶液、无色酚酞溶液。如下表实验(1)所示,在烧杯中加入约5mL稀氨氧化钠溶液,滴入几滴无色酚酞溶液。
用滴管逐滴滴入稀盐酸,并不断搅拌。你还能想到哪些实验方案呢 请设计实验(2)(3)和(4)并进行验证。
解释与结论
指示剂颜色的变化说明酸溶液与碱溶液发生了化学反应。
酸与碱作用生成盐和水的反应,叫作中和反应
酸与碱发生中和反应
同样是酸和碱重要的化学性质之一
利用手持技术数字化实验寻找酸碱中和反应发生的证据
对于没有明显实验现象的酸碱中和反应,同学们还可以运用手持技术数字化实验,通过pH传感器定量测量反应过程中溶液的pH,通过分析 pH 变化曲线寻找酸和碱发生反应的证据。也可以通过温度传感器定量测量反应过程中温度的变化(如图8.3-3)。
向稀氢氧化钠溶液中逐滴加入稀盐酸过程中pH和温度的变化
下表归纳了酸和碱的主要化学性质
项目 酸的主要化学性质 碱的主要化学性质
与指示剂作用 紫色石蕊 使紫色石蕊溶液( ) 使紫色石蕊溶液( )
无色酚酞 使无色酚酞溶液( ) 无色酚酞溶液( )
酸碱相互反应 酸+碱→( )+( ) 与氧化物反应 酸+氧化物→( )+( ) 酸+氧化物→( )+( )
与盐反应 酸+盐→( )+( ) 盐+碱→( )+( )
与较活泼金属反应 酸+较活泼金属→( )+( ) ————————————
上述酸和碱的许多反应中都有这样的特点:
参加反应的两种化合物互相交换成分生成另外两种化合物。
像这种类型的反应,叫作复分解反应
讨论与交流 >>>
1.若用 AB 和CD分别表示两种化合物,如何表示复分解反应的通式
2.中和反应和复分解反应两者有什么关系 为什么
3.大家已经学习过化合、分解、置换、复分解这四种基本反应类型。
你能归纳出它们各自的特点,并准确判断某个具体化学反应属于什么基本反应类型吗 请举例说明
思路与方法导引 >>>
认识化学反应的视角
可以从多个角度(物质的的变化、反应条件、现象和反应类型等)来认识一个化学反应。例如在[实验8-13、8-14]中,酸和碱反应生成盐和水,从反应类型来看属于复分解反应。
从能量变化来看实验过程中放出热量。
学习从多个角度认识化学交应能帮助你形成认识化学变化的系统思维。
中和反应的应用
1.改良酸性或碱性土壤
夏天到农村去,常常看到养鱼的农户向放干的鱼塘底撒熟石灰,这是为了中和鱼塘底泥中过多的有机酸(同时达到杀菌消毒的目的),使放水后的鱼塘水达到适合鱼苗生长的pH。
另外,由于工业生产排放的酸性物质随雨水落下,形成酸雨。
酸雨对工业设备、石材建筑和文物古迹的腐蚀十分严重,对农作物等植物的危害也十分明显。
我们可以利用熟石灰来中和土壤和某些水源中过多的酸,以减轻酸雨的危害。
2.废水处理
如果废水中含有酸性物质(如硫酸、盐酸等),必须先用碱性物质(如烧碱、熟石灰等)将其中和成中性以后才能排放,否则会造成水体污染。
3.医药应用
如果你被蚊虫叮咬,皮肤会出现红肿疼痛,这是因为蚊虫向你的皮肤“注射”了蚁酸--甲酸等有毒物质。这时可以涂抹弱碱性的肥皂水、稀氨水或清凉油以减轻疼痛。有胃病的人常常胃酸(主要成分是盐酸)过多,可以口服碱性胃药(有效成分是氢氧化铝),以中和胃中过多的胃酸。
酸雨
部分非金属氧化物能跟水化合生成酸,例如:
煤和石油燃烧后所产生的烟气中,含有二氧化硫和氮氧化物,排放到空气中被云层吸收,并经过化学作用形成酸雾,随同雨水下降便成为显酸性的雨水,若其 pH 小于5.6,称为酸雨。
酸雨的危害性很大,如影响人类健康;使森林大面积枯死;使湖水酸化,鱼类死亡;使农作物生长受到影响而减产;使名胜古迹、建筑物腐蚀损坏等。
SO2+H2O === H2SO3
(亚硫酸)
SO3+H2O === H2SO4
1.食用松花蛋时常感到有涩味,这是因为制作松花蛋的过程中用到了熟石灰和纯碱等原料。 为了减轻涩味,可在食用松花蛋时添加某种调味品,这种调味品最好是( )
A.食盐 B.食醋
C.香油 D.味精
2.下列实际应用中,利用中和反应原理的是( )
①用氢氧化钠溶液洗去石油产品中的残余硫酸;
②用稀硫酸除铁锈;
③用熟石灰改良酸性土壤;
④用碳酸氢钠治疗胃酸过多
A.①③ B.③④ C.①②④ D.①③④
3.X可以发生如下反应:①X+酸→盐+水;②X+非金属氧化物→盐+水。X可能是( )
A.氧化铜 B.盐酸
C.氢氧化钠 D.碳酸钠
4.鱼味道鲜美,但剖鱼时弄破鱼胆,胆汁沾在鱼肉上,便有苦味,产生苦味的是胆汁酸,其pH约为6,且难溶于水。则在沾有胆汁的地方涂上下列物质可消除苦味的是( )
A.纯碱溶液 B.食醋
C.食盐水 D.自来水
5.下列反应属于复分解反应的是( )
A.Na2O + H2O === 2NaOH
B.H2 + CuO === Cu + H2O
C.Cu(OH)2 === CuO + H2O
D.H2SO4 + Ca(OH)2 === CaSO4 + 2H2O
定义:______ 和_______ 作用生成______ 和______ 的反应
表达式:酸 +碱→盐 +H2O(复分解反应)
中和反应的探究
应用
改良土壤的酸碱性。如:用熟石灰改良酸性土壤
处理工厂废水。如:用熟石灰处理酸性废水
用于医药。如:用含氢氧化镁[Mg(OH)2]或氢氧化铝[Al(OH)3]的药物治疗胃酸过多
_________________________________ (用化学方程式表示,写一个)
蚊虫叮咬后涂抹肥皂水、牙膏等
酸
水
盐
碱
Mg(OH)2+2HCl === MgCl2+2H2O
