8.2 海水“晒盐” 第3课时 课件(共33张PPT)
文档属性
| 名称 | 8.2 海水“晒盐” 第3课时 课件(共33张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-08 21:32:29 | ||
图片预览










文档简介
(共33张PPT)
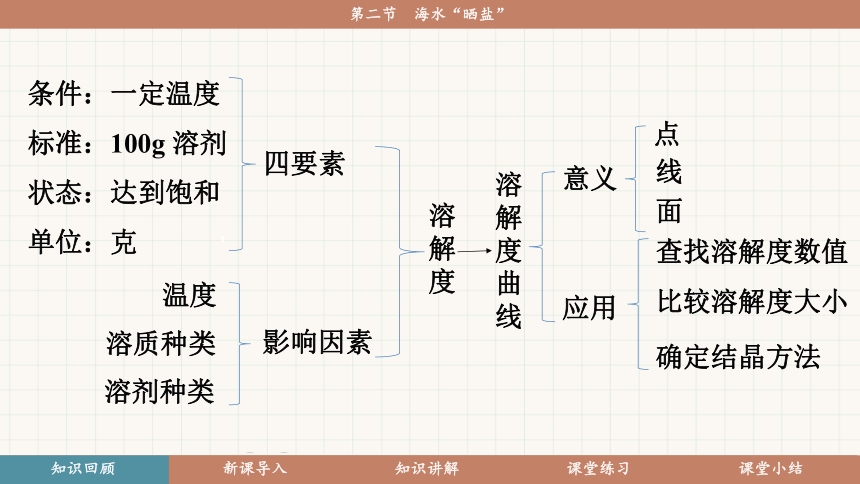
你还记得上节课学过哪些知识吗?
溶解度
溶解度
溶解度曲线
四要素
影响因素
温度
溶质种类
溶剂种类
意义
点
线
面
应用
查找溶解度数值
比较溶解度大小
确定结晶方法
条件:一定温度
标准:100g 溶剂
状态:达到饱和
单位:克
欣赏以下图片,你都认识是什么盐吗?
……
海盐
湖盐
岩盐
井盐
优质大粒盐
海水“晒盐”得到的粗盐,往往含有可溶性杂质(如氯化镁、氯化钙等)和不溶性杂质(如泥沙等),必须对其进行分离和提纯,才能用于工业生产和人们的日常生活。
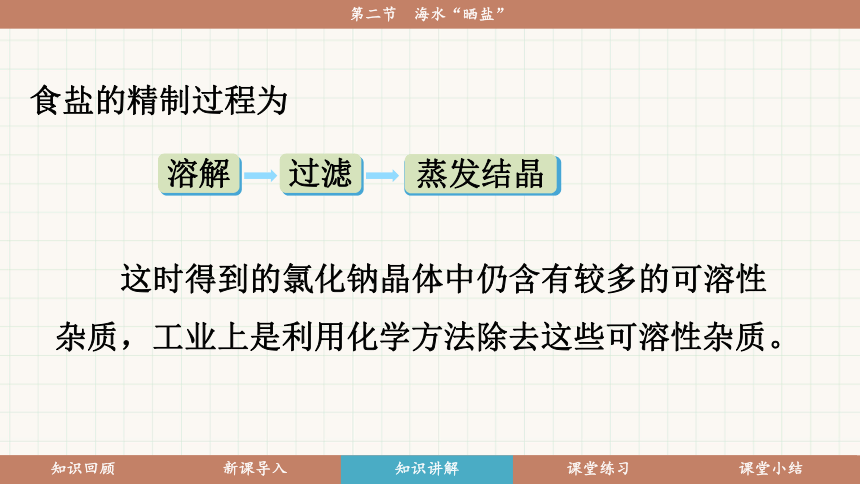
知识点一 粗盐的提纯
食盐的精制过程为
溶解
过滤
蒸发结晶
这时得到的氯化钠晶体中仍含有较多的可溶性杂质,工业上是利用化学方法除去这些可溶性杂质。
除去难溶性杂质后的食盐水中还含有SO42-、 Ca2+和Mg2+等杂质离子。
怎样去除这些杂质离子呢?
OH- Cl- SO42- CO32-
H+ 溶 溶 溶
Na+ 溶 溶 溶 溶
Ca2+ 微 溶 微 不
Ba2+ 溶 溶 不 不
Mg2+ 不 溶 溶 微
除去食盐中可溶性杂质的化学方法
选择试剂时应注意哪些问题?
不能引入新的杂质
为了将杂质除尽,所加试剂应该过量
过量的试剂在后续实验中必须除去
一般将杂质离子转换为沉淀、气体或水而除去
加入过量的BaCl2溶液
Na2SO4+BaCl2 2NaCl+BaSO4↓
加入过量的NaOH溶液
MgCl2+2NaOH 2NaCl+Mg(OH)2↓
加入过量的Na2CO3溶液
CaCl2+Na2CO3 2NaCl+CaCO3↓
BaCl2+Na2CO3 2NaCl+BaCO3↓
过滤除沉淀后
加入适量的盐酸
NaOH +HCl NaCl+H2O
Na2CO3 +2HCl 2NaCl+H2O+CO2↑
思 考
我们所选用的除杂试剂的加入顺序可以变动吗?
Na2CO3 要除去Ca2+和Ba2+,所以Na2CO3要在BaCl2之后加入,盐酸要除去CO32-,最后加入。所以顺序可以是
BaCl2、NaOH、Na2CO3
NaOH、BaCl2、Na2CO3
BaCl2、Na2CO3、NaOH
HCl
食盐是人体进行正常新陈代谢的必需品,是重要的调味品和食品添加剂。食盐还是制造烧碱、氯气、盐酸和纯碱等的基本原料。
例1.为了除去粗盐中的CaCl2、MgSO4及泥沙,可将粗盐溶于水,然后进行下列5项操作:①过滤;②加过量的NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量的BaCl2溶液.正确的操作顺序是( )
A. ①④②⑤③
B. ④①②⑤③
C. ②⑤④①③
D. ⑤③②④①
C
从海水中提炼金属镁
海水“晒盐”后剩下的苦卤也是宝贵的化学资源,其中主要是由氯、钠、硫、钙、钾、澳等元素组成的盐。向其中加入熟石灰,将苦卤中的氯化镁转化为氢氧化镁沉淀,向氢氧化镁中加入盐酸,可将氢氧化镁转化为氯化镁。向熔融状态的氯化镁中通入直流电,即可得到金属镁。
海水或卤水
氢氧化镁
氯化镁
镁
熟石灰
盐酸
通电
上述转化过程中发生的化学反应主要有:
MgCl+Ca(OH) = Mg(OH) ↓+CaCl
Mg(OH) +2HCI = MgCl +2H O
MgCl = Mg+Cl ↑
通电
思考:
1.海水提镁的过程中,为什么要将苦卤中的氯化镁先转化为氢氧化镁,再将氢氧化镁重新转化为氯化镁?
2.海水中的含盐量虽远超陆地,但是分布非常分散,需要通过物理或化学方法进行“富集”才能提炼使用。想一想本单元你学习了哪些富集方法。
1.固体物质从它的饱和溶液中以晶体形式析出的过程叫作结晶。海水“晒盐”是通过蒸发结晶实现的。
2.固体物质的溶解度是指在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量。
3.除去粗盐中难溶性杂质的步骤有溶解、过滤和蒸发。
1.下列关于海水“晒盐”的叙述不正确的是( )
A.海水“晒盐”主要是利用了降温结晶的方法
B.盐场需要建在阳光充足、风力大、雨量少的地方
C.结晶池中析出盐后的母液是氯化钠的饱和溶液
D.蒸发池中水分不断蒸发,溶质的质量分数增大到一定数值不再发生变化
2.下列有关粗盐提纯过程的叙述错误的是( )
A.利用物理方法除去食盐中的难溶性杂质
B.利用化学方法除去食盐中的可溶性杂质
C.除去食盐中的难溶性杂质所涉及的操作主要包括溶解和蒸发
D.当蒸发皿中出现较多晶体时停止加热,利用余热蒸干剩余水分
3.如右图所示,甲、乙两支试管中分别盛有硝酸钾、
氢氧化钙的饱和溶液,并都有少量固体存在。将两支试管放入烧杯中,并向烧杯中加入适量的热水,请分析推断可能产生的现象和原因。
4.NaC1和KNO 在不同温度时溶解度如下表所示,请根据相关数据回答下列问题。
(1)20℃时.氯化钠的溶解度为 .
(2)60℃时,向100g水中加入120g硝酸钾固体,可以得到 g溶液。
(3)分析表格数据,说说氯化钠和硝酸钾的溶解度分别呈现了什么样的变化趋势。
。
5.甲、乙两种物质的溶解度曲线如右图所示。下列说法不正确的是( )
A.t ℃时,甲和乙的溶解度相等
B. t ℃时.甲和乙的饱和溶液升温到t ℃时,均变为不饱和溶液
C. t ℃时,甲和乙各25g分别加入50g水中,
均形成饱和溶液
D. t ℃时,在100g水中加入60g甲,所得溶液
为不饱和溶液
粗盐中难溶性杂质的去除
粗盐中可溶性杂质的去除
不能引入新的杂质
为了将杂质除尽,所加试剂应该过量
过量的试剂在后续实验中必须除去
一般将杂质离子转换为沉淀、气体或水而除去
你还记得上节课学过哪些知识吗?
溶解度
溶解度
溶解度曲线
四要素
影响因素
温度
溶质种类
溶剂种类
意义
点
线
面
应用
查找溶解度数值
比较溶解度大小
确定结晶方法
条件:一定温度
标准:100g 溶剂
状态:达到饱和
单位:克
欣赏以下图片,你都认识是什么盐吗?
……
海盐
湖盐
岩盐
井盐
优质大粒盐
海水“晒盐”得到的粗盐,往往含有可溶性杂质(如氯化镁、氯化钙等)和不溶性杂质(如泥沙等),必须对其进行分离和提纯,才能用于工业生产和人们的日常生活。
知识点一 粗盐的提纯
食盐的精制过程为
溶解
过滤
蒸发结晶
这时得到的氯化钠晶体中仍含有较多的可溶性杂质,工业上是利用化学方法除去这些可溶性杂质。
除去难溶性杂质后的食盐水中还含有SO42-、 Ca2+和Mg2+等杂质离子。
怎样去除这些杂质离子呢?
OH- Cl- SO42- CO32-
H+ 溶 溶 溶
Na+ 溶 溶 溶 溶
Ca2+ 微 溶 微 不
Ba2+ 溶 溶 不 不
Mg2+ 不 溶 溶 微
除去食盐中可溶性杂质的化学方法
选择试剂时应注意哪些问题?
不能引入新的杂质
为了将杂质除尽,所加试剂应该过量
过量的试剂在后续实验中必须除去
一般将杂质离子转换为沉淀、气体或水而除去
加入过量的BaCl2溶液
Na2SO4+BaCl2 2NaCl+BaSO4↓
加入过量的NaOH溶液
MgCl2+2NaOH 2NaCl+Mg(OH)2↓
加入过量的Na2CO3溶液
CaCl2+Na2CO3 2NaCl+CaCO3↓
BaCl2+Na2CO3 2NaCl+BaCO3↓
过滤除沉淀后
加入适量的盐酸
NaOH +HCl NaCl+H2O
Na2CO3 +2HCl 2NaCl+H2O+CO2↑
思 考
我们所选用的除杂试剂的加入顺序可以变动吗?
Na2CO3 要除去Ca2+和Ba2+,所以Na2CO3要在BaCl2之后加入,盐酸要除去CO32-,最后加入。所以顺序可以是
BaCl2、NaOH、Na2CO3
NaOH、BaCl2、Na2CO3
BaCl2、Na2CO3、NaOH
HCl
食盐是人体进行正常新陈代谢的必需品,是重要的调味品和食品添加剂。食盐还是制造烧碱、氯气、盐酸和纯碱等的基本原料。
例1.为了除去粗盐中的CaCl2、MgSO4及泥沙,可将粗盐溶于水,然后进行下列5项操作:①过滤;②加过量的NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量的BaCl2溶液.正确的操作顺序是( )
A. ①④②⑤③
B. ④①②⑤③
C. ②⑤④①③
D. ⑤③②④①
C
从海水中提炼金属镁
海水“晒盐”后剩下的苦卤也是宝贵的化学资源,其中主要是由氯、钠、硫、钙、钾、澳等元素组成的盐。向其中加入熟石灰,将苦卤中的氯化镁转化为氢氧化镁沉淀,向氢氧化镁中加入盐酸,可将氢氧化镁转化为氯化镁。向熔融状态的氯化镁中通入直流电,即可得到金属镁。
海水或卤水
氢氧化镁
氯化镁
镁
熟石灰
盐酸
通电
上述转化过程中发生的化学反应主要有:
MgCl+Ca(OH) = Mg(OH) ↓+CaCl
Mg(OH) +2HCI = MgCl +2H O
MgCl = Mg+Cl ↑
通电
思考:
1.海水提镁的过程中,为什么要将苦卤中的氯化镁先转化为氢氧化镁,再将氢氧化镁重新转化为氯化镁?
2.海水中的含盐量虽远超陆地,但是分布非常分散,需要通过物理或化学方法进行“富集”才能提炼使用。想一想本单元你学习了哪些富集方法。
1.固体物质从它的饱和溶液中以晶体形式析出的过程叫作结晶。海水“晒盐”是通过蒸发结晶实现的。
2.固体物质的溶解度是指在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量。
3.除去粗盐中难溶性杂质的步骤有溶解、过滤和蒸发。
1.下列关于海水“晒盐”的叙述不正确的是( )
A.海水“晒盐”主要是利用了降温结晶的方法
B.盐场需要建在阳光充足、风力大、雨量少的地方
C.结晶池中析出盐后的母液是氯化钠的饱和溶液
D.蒸发池中水分不断蒸发,溶质的质量分数增大到一定数值不再发生变化
2.下列有关粗盐提纯过程的叙述错误的是( )
A.利用物理方法除去食盐中的难溶性杂质
B.利用化学方法除去食盐中的可溶性杂质
C.除去食盐中的难溶性杂质所涉及的操作主要包括溶解和蒸发
D.当蒸发皿中出现较多晶体时停止加热,利用余热蒸干剩余水分
3.如右图所示,甲、乙两支试管中分别盛有硝酸钾、
氢氧化钙的饱和溶液,并都有少量固体存在。将两支试管放入烧杯中,并向烧杯中加入适量的热水,请分析推断可能产生的现象和原因。
4.NaC1和KNO 在不同温度时溶解度如下表所示,请根据相关数据回答下列问题。
(1)20℃时.氯化钠的溶解度为 .
(2)60℃时,向100g水中加入120g硝酸钾固体,可以得到 g溶液。
(3)分析表格数据,说说氯化钠和硝酸钾的溶解度分别呈现了什么样的变化趋势。
。
5.甲、乙两种物质的溶解度曲线如右图所示。下列说法不正确的是( )
A.t ℃时,甲和乙的溶解度相等
B. t ℃时.甲和乙的饱和溶液升温到t ℃时,均变为不饱和溶液
C. t ℃时,甲和乙各25g分别加入50g水中,
均形成饱和溶液
D. t ℃时,在100g水中加入60g甲,所得溶液
为不饱和溶液
粗盐中难溶性杂质的去除
粗盐中可溶性杂质的去除
不能引入新的杂质
为了将杂质除尽,所加试剂应该过量
过量的试剂在后续实验中必须除去
一般将杂质离子转换为沉淀、气体或水而除去
同课章节目录
