9.2 金属的化学性质 第1课时 课件(共32张PPT)
文档属性
| 名称 | 9.2 金属的化学性质 第1课时 课件(共32张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-08 00:00:00 | ||
图片预览











文档简介
(共32张PPT)
上节课学了哪些知识?
……
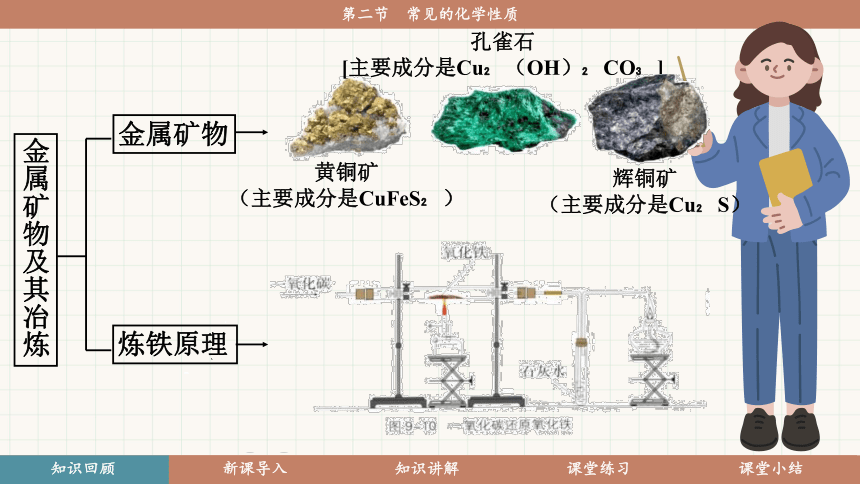
金属矿物
炼铁原理
金属矿物及其冶炼
黄铜矿
(主要成分是CuFeS )
孔雀石
[主要成分是Cu (OH) CO ]
辉铜矿
(主要成分是Cu S)
氧化铜与木炭反应:
氧化铁与一氧化碳反应:
Fe2O3+3CO===2Fe+3CO2
高温
CuO+C===2Fe+ CO2 ↑
高温
还原反应
定义:含氧化合物中的___被夺去的反应属于还原反应。
氧
黄金的化学性质非常稳定,而冒牌货则能够与氧气、酸或盐溶液发生反应。
怎样用化学知识来鉴别金项链的真伪?
不法商贩常用黄铜假冒黄金首饰,黄铜中的锌能够与酸反应。你还知道其他的鉴别方法吗?
知识点一 金属与氧气的反应
我们知道金属镁、铁、铜都能与氧气发生化学反应。实验证明,许多金属在一定条件下都能与空气中的氧气发生化学反应,生成相应的氧化物。
铝和氧气的反应
取少量铝粉,均匀地铺在滤纸上,再将滤纸卷起,用坩埚钳夹持,在酒精灯上,点燃,迅速伸入盛有氧气的集气瓶中。观察现象。
条件 现象 化学方程式
氧气中、点燃 剧烈燃烧,发出耀眼的强光,放热,生成___色固体 _____________________
白
4Al+3O2 === 2Al2O3
点燃
[注意]铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,铝具有很好的抗腐蚀性能。
铝制品的可靠保护层
铝比铁更易与氧气或其他物质发生化学反应,但生活中我们很少见到铝被腐蚀,这是为什么呢?这是因为铝是一种比较活泼的金属,在常温下就很容易跟氧气发生反应,生成一层致密而坚固的氧化铝薄膜。这层薄膜阻止了内层的铝进一步被氧化,从而对铝制品起到保护作用,所以铝制品具有很好的抗腐蚀性能。
核心一 金属与氧气的反应
例1 下列关于金属与氧气反应的说法中正确的是( )
A.红热的铁丝在空气中能燃烧
B.各种金属在常温下都能与氧气反应
C.根据金属与氧气反应的难易程度,可以初步比较一些金属
的活动性
D.在较高温度下能与氧气反应的金属,在常温下也能与氧气
反应。
C
[解析] 铁丝只有在氧气中才会燃烧;不活泼的金属如金,在常温下不能与氧气反应;在较高温度下铜能与氧气反应,但在常温下两者不发生反应。
【方法点拨】多数金属能与氧气反应,但反应的难易和剧烈程度不同,这与金属的活动性有关系:K、Ca、Na常温下即可与氧气反应生成相应的氧化物;Mg、Al、Zn、Fe、Sn、Pb在常温下能被氧化,但难度逐渐变大;Cu需要加热才能与氧气反应;Hg、Ag加热能与氧气反应,温度过高生成的氧化物又会分解;Pt、Au不能被氧化。
金属与氧气反应的难易和剧烈程度首先与金属本身的性质有关,其次还与金属粉碎的程度、与氧气的接触面积、氧气的浓度、温度等因素有关。
知识点二 金属与酸的反应
你还记得铁与盐酸、硫酸的反应吗
事实上,很多金属都能与酸反应。
那么,金属与酸反应有什么特点?
用砂纸打磨铁丝、铜丝、锌片,分别放入盛有2 mL稀盐酸(10%)与稀硫酸(10%)的试管中。
观察现象,填表:
比较不同金属与酸的反应
反应物 反应现象 反应速率 反应的化学方式
稀盐酸或稀硫 酸 铁 缓慢反应产生____,溶液变为_____色 较慢 Fe+H2SO4 ===_____+H2↑
Fe+2HCl ===_____+H2↑
铜 无明显现象 不反应
锌 剧烈反应,产生大量_____ 较快 Zn+2HCl ===ZnCl2+H2↑
______+H2SO4 ===ZnSO4+H2↑
气泡
浅绿
FeSO4
FeCl2
气泡
Zn
金属与酸反应与金属活动性有关。
金属活动性越强,与酸反应越剧烈;
金属活动性越弱,与酸反应越慢,甚至不反应。
故这四种金属的活动性顺序为
Mɡ>Zn>Fe>Cu
核心二 金属与酸的反应
例2 将盛有等质量、等溶质质量分数稀硫酸的两个烧杯,放在托盘天平的左右两盘上,调节至平衡,再向两个烧杯中分别放入质量相等的铁和锌,待反应停止后(不考虑反应中水分挥发,不考虑空气成分参加反应),请判断下列说法合理的是( )
A.若天平仍保持平衡,烧杯中的铁一定没有剩余。
B.若天平失去平衡,指针一定偏向放锌的一边。
C.反应后两个烧杯中溶液的质量都比反应前的溶液质量减轻了。
D.放铁的一边产生的氢气一定比放锌的一边产生的氢气多。
B
【方法点拨】根据反应的化学方程式,可从酸过量和金属过量两个方面来分析。如果金属过量,则酸完全反应,由于氢气的量是由酸决定的,所以会产生相同质量的氢气,此时天平平衡;如果酸过量,则产生氢气的量由金属决定,常见金属在质量相等的情况下产生氢气由多到少的顺序为:铝、镁、铁、锌。
例3 现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中的化合价均为+2)。则下列说法中不正确的是( )
A.生成氢气的质量:甲>乙>丙
B.相对原子质量:乙>丙>甲
C.金属活动性:乙>甲>丙
D.消耗硫酸的质量:甲>乙>丙
B
【方法点拨】涉及金属与稀盐酸、稀硫酸反应的图像题,侧重于考查金属的活动性、金属的相对原子质量、氢气的质量(或体积)、溶液的质量、溶质的质量分数等相关量的变化关系。解答这类题的关键是读懂图像本意,审清图像内涵。常需要用到下列规律:①在温度、金属颗粒大小和稀酸溶液溶质质量分数一定的条件下,金属的活动性越强(金属越活泼),生成氢气的速率就越快;②当金属的化合价相同且酸足量时,对于相同质量的金属,金属的相对原子质量越大,生成的氢气就越少。
常见金属在溶液中的活动顺序:
K
Ca
Na
Mɡ
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hɡ
Aɡ
Pt
Au
金属活动性由强逐渐减弱
上述实验中得到的金属排序,也叫金属活动性
顺序。人们经过长期的实践,总结出常见金属在水
溶液中的活动性顺序如下:
知识点三 置换反应
置换反应:一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应。
Mɡ + 2HCl = MɡCl2 + H2
Zn + 2HCl = ZnCl2 + H2
单质
单质
化合物
化合物
置换反应:
(A、B是单质)
条件:判断一个反应是否是置换反应,必须同时符合两个条件:反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物。
金属与酸溶液反应的特点
1.在上面的实验中,铁分别与稀盐酸、稀硫酸反应生成氯化亚铁(FcCl )、硫酸亚铁(FeSO ),并放出氢气:锌分别与稀盐酸、稀硫酸反应生成氯化(ZnCl )、硫酸锌(ZnSO ),并放出氢气。试写出这些反应的化学方程式。
铁与稀盐酸反应:
铁与稀硫酸反应:
锌与稀盐酸反应:
锌与稀硫酸反应:
观察上述反应的化学方程式,分析这些反应的共同特点
Zn + 2HCl = ZnCl2 + H2 ↑
Zn +H2SO4 ===ZnSO4+H2↑
Fe+H2SO4 ===FeSO4+H2↑
Fe+2HCl ===FeCl2+H2↑
4Al+3O2 === 2Al2O3
点燃
铁与稀盐酸反应:
铁与稀硫酸反应:
锌与稀盐酸反应:
锌与稀硫酸反应:
Zn + 2HCl = ZnCl2 + H2 ↑
Zn +H2SO4 ===ZnSO4+H2↑
Fe+H2SO4 ===FeSO4+H2↑
Fe+2HCl ===FeCl2+H2↑
1.大多数金属可与氧气反应
2.金属与酸发生置换反应,金属+酸→盐+H2↑
3.常见金属在溶液中的活动顺序:
K
Ca
Na
Mɡ
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hɡ
Aɡ
Pt
Au
金属活动性由强逐渐减弱
上节课学了哪些知识?
……
金属矿物
炼铁原理
金属矿物及其冶炼
黄铜矿
(主要成分是CuFeS )
孔雀石
[主要成分是Cu (OH) CO ]
辉铜矿
(主要成分是Cu S)
氧化铜与木炭反应:
氧化铁与一氧化碳反应:
Fe2O3+3CO===2Fe+3CO2
高温
CuO+C===2Fe+ CO2 ↑
高温
还原反应
定义:含氧化合物中的___被夺去的反应属于还原反应。
氧
黄金的化学性质非常稳定,而冒牌货则能够与氧气、酸或盐溶液发生反应。
怎样用化学知识来鉴别金项链的真伪?
不法商贩常用黄铜假冒黄金首饰,黄铜中的锌能够与酸反应。你还知道其他的鉴别方法吗?
知识点一 金属与氧气的反应
我们知道金属镁、铁、铜都能与氧气发生化学反应。实验证明,许多金属在一定条件下都能与空气中的氧气发生化学反应,生成相应的氧化物。
铝和氧气的反应
取少量铝粉,均匀地铺在滤纸上,再将滤纸卷起,用坩埚钳夹持,在酒精灯上,点燃,迅速伸入盛有氧气的集气瓶中。观察现象。
条件 现象 化学方程式
氧气中、点燃 剧烈燃烧,发出耀眼的强光,放热,生成___色固体 _____________________
白
4Al+3O2 === 2Al2O3
点燃
[注意]铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,铝具有很好的抗腐蚀性能。
铝制品的可靠保护层
铝比铁更易与氧气或其他物质发生化学反应,但生活中我们很少见到铝被腐蚀,这是为什么呢?这是因为铝是一种比较活泼的金属,在常温下就很容易跟氧气发生反应,生成一层致密而坚固的氧化铝薄膜。这层薄膜阻止了内层的铝进一步被氧化,从而对铝制品起到保护作用,所以铝制品具有很好的抗腐蚀性能。
核心一 金属与氧气的反应
例1 下列关于金属与氧气反应的说法中正确的是( )
A.红热的铁丝在空气中能燃烧
B.各种金属在常温下都能与氧气反应
C.根据金属与氧气反应的难易程度,可以初步比较一些金属
的活动性
D.在较高温度下能与氧气反应的金属,在常温下也能与氧气
反应。
C
[解析] 铁丝只有在氧气中才会燃烧;不活泼的金属如金,在常温下不能与氧气反应;在较高温度下铜能与氧气反应,但在常温下两者不发生反应。
【方法点拨】多数金属能与氧气反应,但反应的难易和剧烈程度不同,这与金属的活动性有关系:K、Ca、Na常温下即可与氧气反应生成相应的氧化物;Mg、Al、Zn、Fe、Sn、Pb在常温下能被氧化,但难度逐渐变大;Cu需要加热才能与氧气反应;Hg、Ag加热能与氧气反应,温度过高生成的氧化物又会分解;Pt、Au不能被氧化。
金属与氧气反应的难易和剧烈程度首先与金属本身的性质有关,其次还与金属粉碎的程度、与氧气的接触面积、氧气的浓度、温度等因素有关。
知识点二 金属与酸的反应
你还记得铁与盐酸、硫酸的反应吗
事实上,很多金属都能与酸反应。
那么,金属与酸反应有什么特点?
用砂纸打磨铁丝、铜丝、锌片,分别放入盛有2 mL稀盐酸(10%)与稀硫酸(10%)的试管中。
观察现象,填表:
比较不同金属与酸的反应
反应物 反应现象 反应速率 反应的化学方式
稀盐酸或稀硫 酸 铁 缓慢反应产生____,溶液变为_____色 较慢 Fe+H2SO4 ===_____+H2↑
Fe+2HCl ===_____+H2↑
铜 无明显现象 不反应
锌 剧烈反应,产生大量_____ 较快 Zn+2HCl ===ZnCl2+H2↑
______+H2SO4 ===ZnSO4+H2↑
气泡
浅绿
FeSO4
FeCl2
气泡
Zn
金属与酸反应与金属活动性有关。
金属活动性越强,与酸反应越剧烈;
金属活动性越弱,与酸反应越慢,甚至不反应。
故这四种金属的活动性顺序为
Mɡ>Zn>Fe>Cu
核心二 金属与酸的反应
例2 将盛有等质量、等溶质质量分数稀硫酸的两个烧杯,放在托盘天平的左右两盘上,调节至平衡,再向两个烧杯中分别放入质量相等的铁和锌,待反应停止后(不考虑反应中水分挥发,不考虑空气成分参加反应),请判断下列说法合理的是( )
A.若天平仍保持平衡,烧杯中的铁一定没有剩余。
B.若天平失去平衡,指针一定偏向放锌的一边。
C.反应后两个烧杯中溶液的质量都比反应前的溶液质量减轻了。
D.放铁的一边产生的氢气一定比放锌的一边产生的氢气多。
B
【方法点拨】根据反应的化学方程式,可从酸过量和金属过量两个方面来分析。如果金属过量,则酸完全反应,由于氢气的量是由酸决定的,所以会产生相同质量的氢气,此时天平平衡;如果酸过量,则产生氢气的量由金属决定,常见金属在质量相等的情况下产生氢气由多到少的顺序为:铝、镁、铁、锌。
例3 现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中的化合价均为+2)。则下列说法中不正确的是( )
A.生成氢气的质量:甲>乙>丙
B.相对原子质量:乙>丙>甲
C.金属活动性:乙>甲>丙
D.消耗硫酸的质量:甲>乙>丙
B
【方法点拨】涉及金属与稀盐酸、稀硫酸反应的图像题,侧重于考查金属的活动性、金属的相对原子质量、氢气的质量(或体积)、溶液的质量、溶质的质量分数等相关量的变化关系。解答这类题的关键是读懂图像本意,审清图像内涵。常需要用到下列规律:①在温度、金属颗粒大小和稀酸溶液溶质质量分数一定的条件下,金属的活动性越强(金属越活泼),生成氢气的速率就越快;②当金属的化合价相同且酸足量时,对于相同质量的金属,金属的相对原子质量越大,生成的氢气就越少。
常见金属在溶液中的活动顺序:
K
Ca
Na
Mɡ
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hɡ
Aɡ
Pt
Au
金属活动性由强逐渐减弱
上述实验中得到的金属排序,也叫金属活动性
顺序。人们经过长期的实践,总结出常见金属在水
溶液中的活动性顺序如下:
知识点三 置换反应
置换反应:一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应。
Mɡ + 2HCl = MɡCl2 + H2
Zn + 2HCl = ZnCl2 + H2
单质
单质
化合物
化合物
置换反应:
(A、B是单质)
条件:判断一个反应是否是置换反应,必须同时符合两个条件:反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物。
金属与酸溶液反应的特点
1.在上面的实验中,铁分别与稀盐酸、稀硫酸反应生成氯化亚铁(FcCl )、硫酸亚铁(FeSO ),并放出氢气:锌分别与稀盐酸、稀硫酸反应生成氯化(ZnCl )、硫酸锌(ZnSO ),并放出氢气。试写出这些反应的化学方程式。
铁与稀盐酸反应:
铁与稀硫酸反应:
锌与稀盐酸反应:
锌与稀硫酸反应:
观察上述反应的化学方程式,分析这些反应的共同特点
Zn + 2HCl = ZnCl2 + H2 ↑
Zn +H2SO4 ===ZnSO4+H2↑
Fe+H2SO4 ===FeSO4+H2↑
Fe+2HCl ===FeCl2+H2↑
4Al+3O2 === 2Al2O3
点燃
铁与稀盐酸反应:
铁与稀硫酸反应:
锌与稀盐酸反应:
锌与稀硫酸反应:
Zn + 2HCl = ZnCl2 + H2 ↑
Zn +H2SO4 ===ZnSO4+H2↑
Fe+H2SO4 ===FeSO4+H2↑
Fe+2HCl ===FeCl2+H2↑
1.大多数金属可与氧气反应
2.金属与酸发生置换反应,金属+酸→盐+H2↑
3.常见金属在溶液中的活动顺序:
K
Ca
Na
Mɡ
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hɡ
Aɡ
Pt
Au
金属活动性由强逐渐减弱
同课章节目录
