7.3 饱和溶液和不饱和溶液(33页) 课件 2024-2025学年化学沪教版九年级下册
文档属性
| 名称 | 7.3 饱和溶液和不饱和溶液(33页) 课件 2024-2025学年化学沪教版九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 57.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-12 09:14:37 | ||
图片预览










文档简介
(共36张PPT)
7.3 饱和溶液和不饱和溶液
1.能认识绝大多数物质在一定量某种溶剂中的溶解是有限度的。
2.了解饱和溶液与不饱和溶液的概念;知道饱和溶液与不饱和溶液的相互转化方法。
4.初步学会粗盐的提纯方法。
3.了解结晶现象及其在生产、生活中的应用。
小美非常爱吃甜食,今晚妈妈给小美做了美味的八宝粥。小美美滋滋的放了两大勺糖,但是怎么搅都化不了,碗底始终有沙沙的糖粒声,这是为什么?
现象:第一次加入氯化钠,搅拌后完全溶解。第三次将剩余部分全部加进去,一段时间后发现底部氯化钠固体有剩余,说明此时溶液饱和。
提出问题:
各种物质在水中的溶解是否和食盐、蔗糖相似,在一定条件下都有一定的限度 若改变条件,溶解的限度是否会发生改变
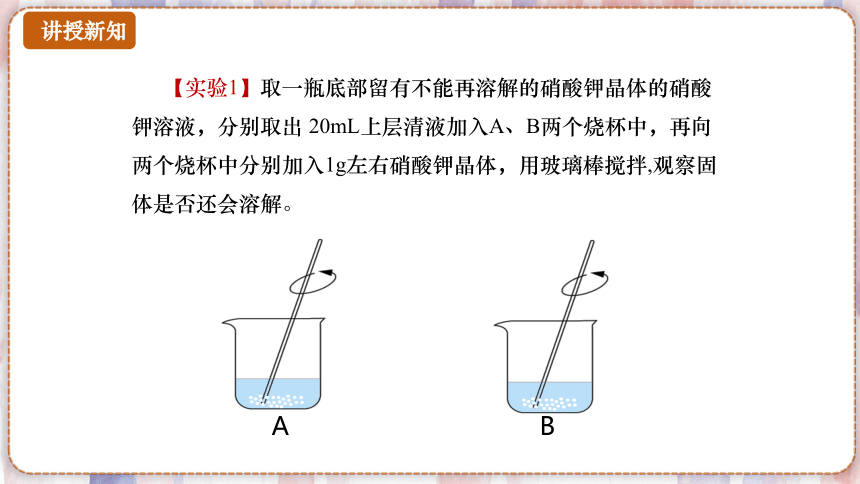
【实验1】取一瓶底部留有不能再溶解的硝酸钾晶体的硝酸钾溶液,分别取出 20mL上层清液加入A、B两个烧杯中,再向两个烧杯中分别加入1g左右硝酸钾晶体,用玻璃棒搅拌,观察固体是否还会溶解。
A
B
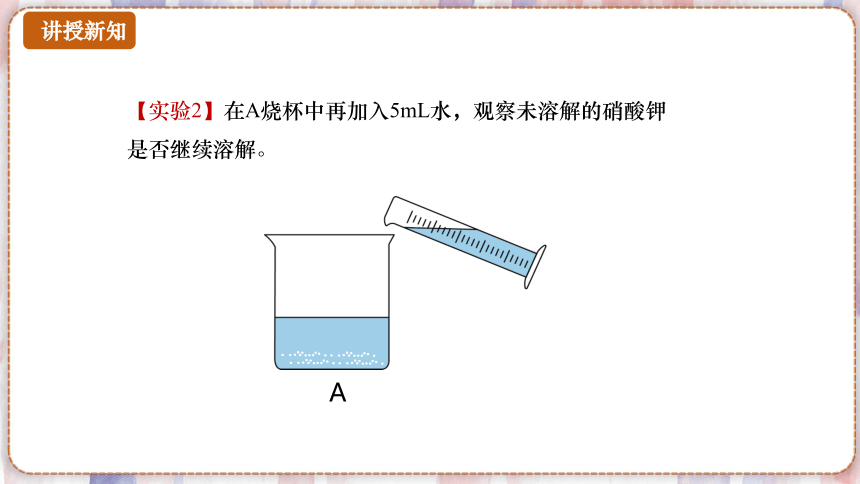
【实验2】在A烧杯中再加入5mL水,观察未溶解的硝酸钾是否继续溶解。
A
【实验3】用酒精灯加热B烧杯,观察未溶解的硝酸钾是否继续溶解。
加热B烧杯
【实验4】用冰水浴冷却B烧杯,观察烧杯中溶液是否有变化。
分析上述实验现象,你能得出什么结论
实验 实验现象 实验结论
实验1
实验2
实验3
实验4
硝酸钾固体有剩余,不能继续溶解
A烧杯中加入水后,未溶解的硝酸钾继续溶解
一定温度下,大多数物质在一定量溶剂中可溶解的量是有一定的限度的
水(或溶剂)越多,溶解的硝酸钾的量也越多
加热B烧杯后,未溶解的硝酸钾继续溶解
一般情况下,温度升高时,一定量的水中所能溶解的硝酸钾的量也增多
实验记录
烧杯中溶液析出硝酸钾晶体
一般情况下,温度降低时,一定量的水中所能溶解的硝酸钾的量减少
在一定的温度下,在一定量的溶剂里,不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。
还能继续溶解某种物质的溶液叫做这种溶质的不饱和溶液。
一、饱和溶液与不饱和溶液
①要明确“一定温度” 和“一定量溶剂”。这样饱和与不饱和才有意义。
②要明确“某一溶质”的饱和溶液与不饱和溶液。例如:在某一定温度下不能再溶解NaCl的饱和溶液,可能还能溶解KNO3。
溶液是否饱和的判断方法
实验法
观察法
饱和溶液
若溶液中有未溶解的溶质,且不再减少
向溶液中,加入该溶质
还能溶解
不能溶解
不饱和
溶液
饱和溶液 不饱和溶液
同一种物质的饱和溶液与不饱和溶液可以相互转化,请你总结饱和溶液与不饱和溶液相互转化方法。
思考讨论
饱和溶液
增加溶剂、升高温度
不饱和溶液
增加溶质、蒸发溶剂、降低温度
一般物质的饱和溶液和不饱和溶液的转化关系如下:
饱和溶液不再溶解的原因
溶质溶于溶剂的过程中,首先是溶质在溶剂中的扩散作用,在溶质表面的分子或离子开始溶解,进而扩散到溶剂中。被溶解了的分子或离子在溶液中不断的运动,当它们和固体表面碰撞时,就有停留在表面上的可能,这种沉淀作用是溶解的逆过程。当固体溶质继续溶解,溶液浓度不断增大到某个数值时,沉淀和溶解两种作用达成平衡状态。
即在单位时间内溶解在溶剂中的分子数和离子数,和沉淀到溶质表面上的分子或离子数相等,溶解和沉淀仍在不断的进行,但如果温度不改变,则溶液的浓度已经达到稳定状态,这样的溶液称为饱和溶液。
活动与探究
【实验1】
实验步骤:取10mL浓氯化钠溶液于蒸发皿中,用酒精灯加热,用玻璃棒搅拌直至出现较多固体时停止加热利用蒸发皿的余热使滤液蒸干。
实验现象:水分蒸发,蒸发皿中出现较多晶体。
实验结论:将氯化钠溶液蒸发溶剂,可以使氯化钠晶体析出。
二、结晶方法及其应用
蒸发
1.蒸发皿中的液体量不宜超过蒸发皿容积的 2/3;
2.加热时,应不断用玻璃棒搅拌溶液,防止液体因局部温度过高造成液滴飞溅;
3.加热到蒸发皿中出现较多量固体时,停止加热,并用玻璃棒不断搅拌,利用余热将滤液蒸干;
4.热的蒸发皿应用坩埚钳夹持小心地放在石棉网上。
巧记蒸发操作要点
勤搅拌,防飞溅;
大量析晶撤热源。
【实验2】
实验步骤:在一个盛有30mL沸水的烧杯中加入适量硝酸钾,配制成硝酸钾饱和容液,再将烧杯放在冷水中降温,观察实验现象。
实验现象:烧杯中不断有白色晶体析出。
实验结论:降温可以使硝酸钾饱和溶液析出晶体。
活动与探究
1.结晶的定义
人们通常把从溶液中析出晶体的过程称为结晶。
2.结晶的方法
(1)蒸发结晶:将溶液加热蒸发,使溶液达到饱和后,再蒸发掉溶剂,溶质就会结晶析出。
①蒸发操作所需的仪器和用品:蒸发皿、酒精灯、玻璃棒、带铁圈的铁架台、火柴。
②蒸发结晶适用对象:适用于大多数固体溶质的结晶析出,尤其适用于溶解度受温度变化影响不大的固体物质。
(2)降温结晶:将溶液制成温度较高的饱和溶液,然后降温冷却,析出大量晶体,再进行过滤,得到需要的晶体。
①降温结晶所需的仪器和用品:烧杯、玻璃棒、酒精灯、带铁圈的铁架台、漏斗、滤纸、火柴。
②降温结晶的适用对象:溶解度受温度变化影响较大的固体物质。
教师点拨
在进行降温结晶时要注意以下两点:
①先在加热的条件下制成热的饱和溶液;
②过滤时要按照“一贴”“二低”“三靠”的操作进行。
在工业生产中,合理地利用各类资源,使资源转化为所需的产品,才能创造更大的价值。
食 盐
3.结晶的应用
在工业生产中,合理地利用各类资源,使资源转化为所需的产品,才能创造更大的价值。
晒盐 熬盐
结晶技术被广泛应用于医药、食品、农药、化工、材料和环境等领域。
天气瓶 冰糖 提取药物成分
我国古代制盐法
《天工开物》作咸卷中记载了海盐制取之法:“凡淋煎法,掘坑二个,一浅一深。浅者尺许,以竹木架芦席于上,将帚来盐料(不论有灰无灰,淋法皆同),铺于席上。四围隆起,作一堤垱形,中以海水灌淋,渗下浅坑中。深者深七、八尺受浅坑所淋之汁,然后入锅煎炼。”
拓展
4.海水晒盐
(1)原理:把海水引入海滩,借助日光和风力使水分蒸发,从而得到食盐晶体。
(2)海水晒盐的过程
海水晒盐的过程中得到的母液是食盐的饱和溶液,但不一定是其他化工产品(如MgCl2、CaCl2等)的饱和溶液。
通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐。粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。粗盐通过溶解、沉淀、过滤、蒸发、结晶等处理,可以得到初步提纯。
海水晒盐
三、粗盐的初步提纯
1.实验目的
(1)学习除去粗盐中难溶性杂质的实验过程。
(2)掌握溶解、过滤、蒸发等实验的操作技能。
2.实验用品
烧杯、玻璃棒、蒸发皿、滤纸、酒精灯、漏斗、药匙、量筒、胶头滴管、铁架台(带铁圈)、托盘天平(含砝码)、纸片、粗盐(含难溶性杂质)、蒸馏水、坩埚钳、石棉网、火柴、剪刀等。
3.实验步骤
(1)称量与溶解:用托盘天平称取2 g左右粗盐,用量筒量取10 mL蒸馏水,将粗盐和蒸馏水转移到烧杯中,用玻璃棒搅拌,使粗盐充分溶解。
(2)过滤:如图所示,过滤食盐水。仔细观察滤纸上的剩余物及滤液的颜色,如果滤液仍浑浊,应再过滤一次。
(3)蒸发:将所得澄清滤液倒入蒸发皿中,如图所示,将蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃棒不断搅拌滤液,以防液滴飞溅。待蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热将滤液蒸干。
蒸发操作结束后,用玻璃棒将固体转移到纸片上,比较食盐提纯前后的状态(可以通过称量精盐的质量计算精盐的产率)。
教师点拨
(1)蒸发皿是可直接加热的仪器,蒸发时,倒入液体的体积不超过蒸发皿容积的2/3。
(2)待蒸发皿中出现较多量固体时停止加热,利用余热将滤液蒸干,不能待滤液完全蒸干再停止加热,否则会造成液滴飞溅。
(3)热的蒸发皿不能直接放在实验台上,以免烫坏实验台,应用坩埚钳取下,放在石棉网上。
1.为证明某硝酸钾溶液是否达到饱和状态,设计了以下方案。一定能达到目的的是( )
A.温度不变,向溶液中加入少量硝酸钾溶液
B.温度不变,向溶液中加入少量硝酸钾晶体
C.将溶液加热,直至有硝酸钾晶体析出
D.将溶液降温,直至有硝酸钾晶体析出
B
根据饱和溶液的概念,向溶液中加入少量硝酸钾晶体,若有晶体析出,则证明该溶液是饱和溶液。
2.在一定温度下,有一杯完全溶解的、饱和的氯化铵溶液,如果想把它变为不饱和溶液,下列可采取的指施有(已知氯化铵固体的溶解能力随温度的升高而增大)( )
①降低温度;②升高温度;③加氯化铵固体;④加溶剂;
⑤恒温蒸发溶剂。
C
A.①③④ B. ①③⑤ C. ②④ D. ②⑤
加溶剂和升高温度都能使饱和的氯化铵溶液变为不饱和溶液。
3.欲从碳酸钙和硝酸钾的混合物中除去碳酸钙,正确的操作是( )
A.过滤—溶解—结晶 B.溶解—结晶—过滤
C.溶解—过滤—结晶 D.过滤—结晶—溶解
C
4.下列关于海水晒盐原理的分析,正确的是( )
A.利用阳光照射使海水升温得到食盐
B.利用机械动力搅拌得到食盐
C.利用阳光和风力使水分蒸发得到食盐
D.利用海水在阳光下发生分解反应制得食盐
C
7.3 饱和溶液和不饱和溶液
1.能认识绝大多数物质在一定量某种溶剂中的溶解是有限度的。
2.了解饱和溶液与不饱和溶液的概念;知道饱和溶液与不饱和溶液的相互转化方法。
4.初步学会粗盐的提纯方法。
3.了解结晶现象及其在生产、生活中的应用。
小美非常爱吃甜食,今晚妈妈给小美做了美味的八宝粥。小美美滋滋的放了两大勺糖,但是怎么搅都化不了,碗底始终有沙沙的糖粒声,这是为什么?
现象:第一次加入氯化钠,搅拌后完全溶解。第三次将剩余部分全部加进去,一段时间后发现底部氯化钠固体有剩余,说明此时溶液饱和。
提出问题:
各种物质在水中的溶解是否和食盐、蔗糖相似,在一定条件下都有一定的限度 若改变条件,溶解的限度是否会发生改变
【实验1】取一瓶底部留有不能再溶解的硝酸钾晶体的硝酸钾溶液,分别取出 20mL上层清液加入A、B两个烧杯中,再向两个烧杯中分别加入1g左右硝酸钾晶体,用玻璃棒搅拌,观察固体是否还会溶解。
A
B
【实验2】在A烧杯中再加入5mL水,观察未溶解的硝酸钾是否继续溶解。
A
【实验3】用酒精灯加热B烧杯,观察未溶解的硝酸钾是否继续溶解。
加热B烧杯
【实验4】用冰水浴冷却B烧杯,观察烧杯中溶液是否有变化。
分析上述实验现象,你能得出什么结论
实验 实验现象 实验结论
实验1
实验2
实验3
实验4
硝酸钾固体有剩余,不能继续溶解
A烧杯中加入水后,未溶解的硝酸钾继续溶解
一定温度下,大多数物质在一定量溶剂中可溶解的量是有一定的限度的
水(或溶剂)越多,溶解的硝酸钾的量也越多
加热B烧杯后,未溶解的硝酸钾继续溶解
一般情况下,温度升高时,一定量的水中所能溶解的硝酸钾的量也增多
实验记录
烧杯中溶液析出硝酸钾晶体
一般情况下,温度降低时,一定量的水中所能溶解的硝酸钾的量减少
在一定的温度下,在一定量的溶剂里,不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。
还能继续溶解某种物质的溶液叫做这种溶质的不饱和溶液。
一、饱和溶液与不饱和溶液
①要明确“一定温度” 和“一定量溶剂”。这样饱和与不饱和才有意义。
②要明确“某一溶质”的饱和溶液与不饱和溶液。例如:在某一定温度下不能再溶解NaCl的饱和溶液,可能还能溶解KNO3。
溶液是否饱和的判断方法
实验法
观察法
饱和溶液
若溶液中有未溶解的溶质,且不再减少
向溶液中,加入该溶质
还能溶解
不能溶解
不饱和
溶液
饱和溶液 不饱和溶液
同一种物质的饱和溶液与不饱和溶液可以相互转化,请你总结饱和溶液与不饱和溶液相互转化方法。
思考讨论
饱和溶液
增加溶剂、升高温度
不饱和溶液
增加溶质、蒸发溶剂、降低温度
一般物质的饱和溶液和不饱和溶液的转化关系如下:
饱和溶液不再溶解的原因
溶质溶于溶剂的过程中,首先是溶质在溶剂中的扩散作用,在溶质表面的分子或离子开始溶解,进而扩散到溶剂中。被溶解了的分子或离子在溶液中不断的运动,当它们和固体表面碰撞时,就有停留在表面上的可能,这种沉淀作用是溶解的逆过程。当固体溶质继续溶解,溶液浓度不断增大到某个数值时,沉淀和溶解两种作用达成平衡状态。
即在单位时间内溶解在溶剂中的分子数和离子数,和沉淀到溶质表面上的分子或离子数相等,溶解和沉淀仍在不断的进行,但如果温度不改变,则溶液的浓度已经达到稳定状态,这样的溶液称为饱和溶液。
活动与探究
【实验1】
实验步骤:取10mL浓氯化钠溶液于蒸发皿中,用酒精灯加热,用玻璃棒搅拌直至出现较多固体时停止加热利用蒸发皿的余热使滤液蒸干。
实验现象:水分蒸发,蒸发皿中出现较多晶体。
实验结论:将氯化钠溶液蒸发溶剂,可以使氯化钠晶体析出。
二、结晶方法及其应用
蒸发
1.蒸发皿中的液体量不宜超过蒸发皿容积的 2/3;
2.加热时,应不断用玻璃棒搅拌溶液,防止液体因局部温度过高造成液滴飞溅;
3.加热到蒸发皿中出现较多量固体时,停止加热,并用玻璃棒不断搅拌,利用余热将滤液蒸干;
4.热的蒸发皿应用坩埚钳夹持小心地放在石棉网上。
巧记蒸发操作要点
勤搅拌,防飞溅;
大量析晶撤热源。
【实验2】
实验步骤:在一个盛有30mL沸水的烧杯中加入适量硝酸钾,配制成硝酸钾饱和容液,再将烧杯放在冷水中降温,观察实验现象。
实验现象:烧杯中不断有白色晶体析出。
实验结论:降温可以使硝酸钾饱和溶液析出晶体。
活动与探究
1.结晶的定义
人们通常把从溶液中析出晶体的过程称为结晶。
2.结晶的方法
(1)蒸发结晶:将溶液加热蒸发,使溶液达到饱和后,再蒸发掉溶剂,溶质就会结晶析出。
①蒸发操作所需的仪器和用品:蒸发皿、酒精灯、玻璃棒、带铁圈的铁架台、火柴。
②蒸发结晶适用对象:适用于大多数固体溶质的结晶析出,尤其适用于溶解度受温度变化影响不大的固体物质。
(2)降温结晶:将溶液制成温度较高的饱和溶液,然后降温冷却,析出大量晶体,再进行过滤,得到需要的晶体。
①降温结晶所需的仪器和用品:烧杯、玻璃棒、酒精灯、带铁圈的铁架台、漏斗、滤纸、火柴。
②降温结晶的适用对象:溶解度受温度变化影响较大的固体物质。
教师点拨
在进行降温结晶时要注意以下两点:
①先在加热的条件下制成热的饱和溶液;
②过滤时要按照“一贴”“二低”“三靠”的操作进行。
在工业生产中,合理地利用各类资源,使资源转化为所需的产品,才能创造更大的价值。
食 盐
3.结晶的应用
在工业生产中,合理地利用各类资源,使资源转化为所需的产品,才能创造更大的价值。
晒盐 熬盐
结晶技术被广泛应用于医药、食品、农药、化工、材料和环境等领域。
天气瓶 冰糖 提取药物成分
我国古代制盐法
《天工开物》作咸卷中记载了海盐制取之法:“凡淋煎法,掘坑二个,一浅一深。浅者尺许,以竹木架芦席于上,将帚来盐料(不论有灰无灰,淋法皆同),铺于席上。四围隆起,作一堤垱形,中以海水灌淋,渗下浅坑中。深者深七、八尺受浅坑所淋之汁,然后入锅煎炼。”
拓展
4.海水晒盐
(1)原理:把海水引入海滩,借助日光和风力使水分蒸发,从而得到食盐晶体。
(2)海水晒盐的过程
海水晒盐的过程中得到的母液是食盐的饱和溶液,但不一定是其他化工产品(如MgCl2、CaCl2等)的饱和溶液。
通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐。粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。粗盐通过溶解、沉淀、过滤、蒸发、结晶等处理,可以得到初步提纯。
海水晒盐
三、粗盐的初步提纯
1.实验目的
(1)学习除去粗盐中难溶性杂质的实验过程。
(2)掌握溶解、过滤、蒸发等实验的操作技能。
2.实验用品
烧杯、玻璃棒、蒸发皿、滤纸、酒精灯、漏斗、药匙、量筒、胶头滴管、铁架台(带铁圈)、托盘天平(含砝码)、纸片、粗盐(含难溶性杂质)、蒸馏水、坩埚钳、石棉网、火柴、剪刀等。
3.实验步骤
(1)称量与溶解:用托盘天平称取2 g左右粗盐,用量筒量取10 mL蒸馏水,将粗盐和蒸馏水转移到烧杯中,用玻璃棒搅拌,使粗盐充分溶解。
(2)过滤:如图所示,过滤食盐水。仔细观察滤纸上的剩余物及滤液的颜色,如果滤液仍浑浊,应再过滤一次。
(3)蒸发:将所得澄清滤液倒入蒸发皿中,如图所示,将蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃棒不断搅拌滤液,以防液滴飞溅。待蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热将滤液蒸干。
蒸发操作结束后,用玻璃棒将固体转移到纸片上,比较食盐提纯前后的状态(可以通过称量精盐的质量计算精盐的产率)。
教师点拨
(1)蒸发皿是可直接加热的仪器,蒸发时,倒入液体的体积不超过蒸发皿容积的2/3。
(2)待蒸发皿中出现较多量固体时停止加热,利用余热将滤液蒸干,不能待滤液完全蒸干再停止加热,否则会造成液滴飞溅。
(3)热的蒸发皿不能直接放在实验台上,以免烫坏实验台,应用坩埚钳取下,放在石棉网上。
1.为证明某硝酸钾溶液是否达到饱和状态,设计了以下方案。一定能达到目的的是( )
A.温度不变,向溶液中加入少量硝酸钾溶液
B.温度不变,向溶液中加入少量硝酸钾晶体
C.将溶液加热,直至有硝酸钾晶体析出
D.将溶液降温,直至有硝酸钾晶体析出
B
根据饱和溶液的概念,向溶液中加入少量硝酸钾晶体,若有晶体析出,则证明该溶液是饱和溶液。
2.在一定温度下,有一杯完全溶解的、饱和的氯化铵溶液,如果想把它变为不饱和溶液,下列可采取的指施有(已知氯化铵固体的溶解能力随温度的升高而增大)( )
①降低温度;②升高温度;③加氯化铵固体;④加溶剂;
⑤恒温蒸发溶剂。
C
A.①③④ B. ①③⑤ C. ②④ D. ②⑤
加溶剂和升高温度都能使饱和的氯化铵溶液变为不饱和溶液。
3.欲从碳酸钙和硝酸钾的混合物中除去碳酸钙,正确的操作是( )
A.过滤—溶解—结晶 B.溶解—结晶—过滤
C.溶解—过滤—结晶 D.过滤—结晶—溶解
C
4.下列关于海水晒盐原理的分析,正确的是( )
A.利用阳光照射使海水升温得到食盐
B.利用机械动力搅拌得到食盐
C.利用阳光和风力使水分蒸发得到食盐
D.利用海水在阳光下发生分解反应制得食盐
C
同课章节目录
