8.2 课时1 酸的性质与应用 课件 (共31张PPT内嵌视频)2024-2025学年化学沪教版九年级下册
文档属性
| 名称 | 8.2 课时1 酸的性质与应用 课件 (共31张PPT内嵌视频)2024-2025学年化学沪教版九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 173.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-10 23:15:59 | ||
图片预览









文档简介
(共31张PPT)
8.2 常见的酸和碱
课时1 酸的性质与应用
第8单元 酸碱盐及其应用
1.能列举生活中常见的酸;
2.能通过实验探究酸的性质;
3.能列举常见的酸的用途,感受酸在生产生活中的重要作用;
4.能遵守实验操作规范,强化实验安全意识。
白醋和稀盐酸都呈酸性
石灰水和氨水都都呈碱性
含有一类特殊的物质——酸
酸和碱是两类重要的物质。
含有一类特殊的物质——碱
交流讨论
这些食物都给你留下了什么印象?
“酸”最早指“有酸味的酒”。在酿酒的时候,有时把比较珍贵的酒放在窖中保存,酒在微生物的作用下会产生酸味。
食醋中的醋酸
柠檬中的柠檬酸
汽水中的碳酸
一、常见的酸
胃液中含有盐酸
食醋中含有醋酸
汽车电瓶中含有硫酸
酸雨中含有硫酸、硝酸
盐酸、硫酸、硝酸和醋酸都是重要的酸。
几种常见的酸
在实验室,我们经常用到的酸是盐酸和硫酸。
它们有哪些性质和用途呢?
探究一
观察浓盐酸和浓硫酸的状态、颜色,比较它们与同体积水的质量大小。打开瓶塞,观察发生的现象;闻一闻是否有气味。
盐酸 化学纯(CP)
(500mL)
品 名:盐酸
化学式:HCl
相对分子质量:36.5
密 度:1.18g/cm3
质量分数:36.5%
硫酸 化学纯(CP)
(500mL)
品 名:硫酸
化学式:H2SO4
相对分子质量:98
密 度:1.84g/cm3
质量分数:98%
二、酸的性质
观察思考
1. 浓盐酸和浓硫酸的物理性质
浓盐酸 浓硫酸
溶质的化学式
颜色、状态
气味
密度(与水比较)
打开试剂瓶塞 后瓶 口的现 象
1. 浓盐酸和浓硫酸的物理性质
HCl
H2SO4
无色液体
无色、黏稠的油状液体
刺激性气味
无气味
密度大于水
密度大于水
白雾(挥发性)
无明显现象
2. 浓硫酸的吸水性
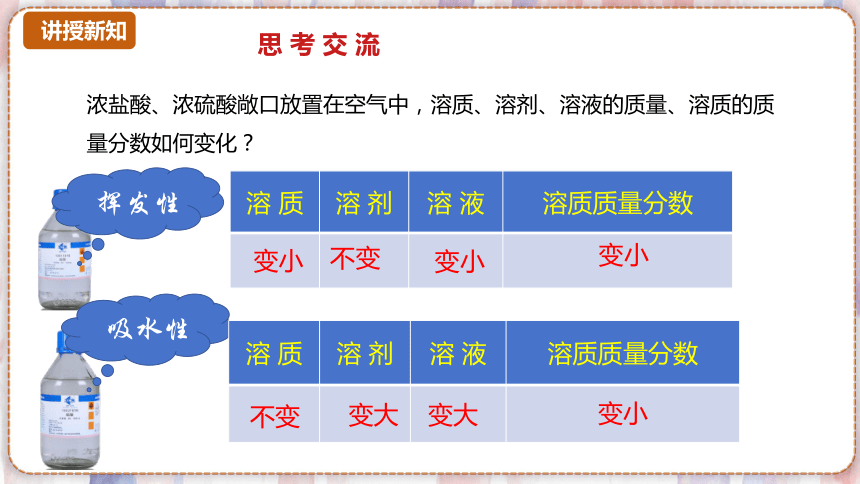
浓盐酸、浓硫酸敞口放置在空气中,溶质、溶剂、溶液的质量、溶质的质量分数如何变化?
溶 质 溶 剂 溶 液 溶质质量分数
变小
不变
变小
变小
思 考 交 流
挥发性
吸水性
溶 质 溶 剂 溶 液 溶质质量分数
不变
变大
变大
变小
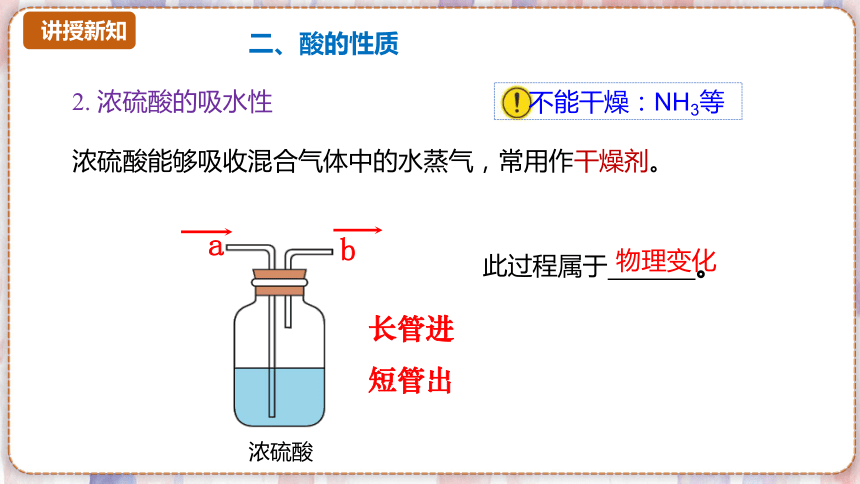
不能干燥:NH3等
浓硫酸能够吸收混合气体中的水蒸气,常用作干燥剂。
a
b
浓硫酸
长管进
短管出
此过程属于 。
物理变化
二、酸的性质
2. 浓硫酸的吸水性
3. 浓硫酸的脱水性
实验操作 放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上写字 字迹________
用小木棍蘸少量浓硫酸 小木棍触及浓硫酸的部位________
将浓硫酸滴到一小块布上 滴有浓硫酸的部位________
变黑
变黑
变黑
3. 浓硫酸的脱水性
浓硫酸能将纸张、木材、布料、皮肤中的氢、氧元素按水的组成比脱出,生成黑色的炭,发生炭化现象,此过程属于 。
化学变化
若不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%~5%的NaHCO3溶液。
注意:
3. 浓硫酸的脱水性
酸入水
沿器壁
慢慢倒
不断搅
(1)浓硫酸溶于水_____热
(2)添加顺序:__________________
②颠倒后果:______________________
①玻璃棒作用:______________________
搅拌,使热量及时扩散
酸液沸溅,造成危险
放
酸入水
4. 浓硫酸的稀释
二、酸的物理性质
4. 浓硫酸的稀释
用稀硫酸和稀盐酸做如下实验 ,把实验现象填入表 8-5中 ,并 讨论以下问题 :
1.镁 、铝 、铜三种金属中,哪些能从酸溶液中置换出氢 ,哪些不能 写出有关的化学方程式。
2.描述、比较酸溶液与上述金属反应的实验现象,讨论可能的原因。
实验操作 实验现象与结论 结论
将镁条、铝片、铜片分别放入稀硫酸中
将镁条、铝片、铜片分 别放入稀盐酸中
镁条、铝片表面有气泡产生,且镁条表面产生气泡的速率较快,铜片表面无明显变化
在金属活动性顺序中,排在氢前面的金属可以与稀硫酸(或稀盐酸)反应产生氢气,且金属活动性越强,产生气泡速率越快
酸+活泼金属 → 盐+氢气(H2)
金属 与稀盐酸反应 与稀硫酸反应
镁 Mg+2HCl = MgCl2+H2↑ Mg+H2SO4 = MgSO4+H2↑
铝 2Al+6HCl = 2AlCl3+3H2↑ 2Al+3H2SO4 = Al2(SO4)3+3H2↑
铜 不反应 不反应
酸除铁锈
实验现象
铁锈消失,无色溶液变为黄色
反应原理
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
两交换,价不变→复分解反应
用途→金属表面除锈
存在Fe3+
注 意
除铁锈时,铁钉不可长时间浸没在酸液中→酸能与铁反应
实验现象
黑色粉末消失,无色溶液变为蓝色
反应原理
存在Cu2+
H2SO4 + CuO = CuSO4 + H2O
2HCl + CuO = CuCl2 + H2O
两交换,价不变→复分解反应
实验操作 实验现象与结论 反应的化学方程式
向氧化铜中加入稀硫酸
向氧化铁中加入稀盐酸
向氧化铜中加入稀硫酸,向 氧化铁中加入稀盐酸,观察实验现象并书写相应的化学方程式。对比两个实验的现象,结合化学方程式进行分析, 你发现了什么
铁钉表面的铁锈逐渐消失,铁钉变光亮,溶液由无色变为黄色
黑色固体逐渐消失,溶液由无色变为蓝色
酸在生产生活中有广泛应用。在工业上,盐酸常用于溶解
矿石原料,也是制各许多化合物所必需的试剂;硫酸和硝酸
可用于制造肥料 、药物和炸药;醋酸在食品行业中常用作调味剂。
常见的酸
常见的酸和碱
汽车电瓶中含有硫酸
胃液中含有盐酸
食醋中含有醋酸
酸的性质
浓盐酸和浓硫酸的物理性质
浓硫酸的吸水性
浓硫酸的脱水性
酸雨中含有硫酸、硝酸
浓硫酸的稀释
1. 将浓盐酸和浓硫酸敞口放置在空气中一段时间后,关于两者溶质质量分数的变化,描述正确的是( )
A.两者溶质质量分数都变大
B.两者溶质质量分数都不变
C.两者溶质质量分数都变小
D.浓盐酸溶质质量分数变小,
C
2. 下列有关盐酸和硫酸的比较中,错误的是( )
A.浓盐酸有挥发性,浓硫酸有强腐蚀性
B.盐酸可用于制造药物,浓硫酸常用作干燥剂
C.打开试剂瓶瓶盖,观察现象可鉴别浓盐酸和浓硫酸
D.可用稀硫酸代替稀盐酸与大理石反应制取二氧化碳
D
3.下列图示的化学实验基本操作中,正确的是( )
A
4. 实验室要用如图装置干燥氧气,则瓶内所用的试剂和气体的流向均正确的是( )
A.稀硫酸 从a端通入
B.浓盐酸 从a端通入
C.浓硫酸 从a端通入
D.浓硫酸 从b端通入
C
5.生锈的铁钉,加入盛有足量稀盐酸的烧杯中。观察到固体溶解,溶液由无色变为黄色,后有气泡产生,回答下列问题
(1)溶液由无色变为黄色的反应的化学方程式
(2)有气泡产生的反应的化学方程式
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe+2HCl=FeCl2 + H2 ↑
8.2 常见的酸和碱
课时1 酸的性质与应用
第8单元 酸碱盐及其应用
1.能列举生活中常见的酸;
2.能通过实验探究酸的性质;
3.能列举常见的酸的用途,感受酸在生产生活中的重要作用;
4.能遵守实验操作规范,强化实验安全意识。
白醋和稀盐酸都呈酸性
石灰水和氨水都都呈碱性
含有一类特殊的物质——酸
酸和碱是两类重要的物质。
含有一类特殊的物质——碱
交流讨论
这些食物都给你留下了什么印象?
“酸”最早指“有酸味的酒”。在酿酒的时候,有时把比较珍贵的酒放在窖中保存,酒在微生物的作用下会产生酸味。
食醋中的醋酸
柠檬中的柠檬酸
汽水中的碳酸
一、常见的酸
胃液中含有盐酸
食醋中含有醋酸
汽车电瓶中含有硫酸
酸雨中含有硫酸、硝酸
盐酸、硫酸、硝酸和醋酸都是重要的酸。
几种常见的酸
在实验室,我们经常用到的酸是盐酸和硫酸。
它们有哪些性质和用途呢?
探究一
观察浓盐酸和浓硫酸的状态、颜色,比较它们与同体积水的质量大小。打开瓶塞,观察发生的现象;闻一闻是否有气味。
盐酸 化学纯(CP)
(500mL)
品 名:盐酸
化学式:HCl
相对分子质量:36.5
密 度:1.18g/cm3
质量分数:36.5%
硫酸 化学纯(CP)
(500mL)
品 名:硫酸
化学式:H2SO4
相对分子质量:98
密 度:1.84g/cm3
质量分数:98%
二、酸的性质
观察思考
1. 浓盐酸和浓硫酸的物理性质
浓盐酸 浓硫酸
溶质的化学式
颜色、状态
气味
密度(与水比较)
打开试剂瓶塞 后瓶 口的现 象
1. 浓盐酸和浓硫酸的物理性质
HCl
H2SO4
无色液体
无色、黏稠的油状液体
刺激性气味
无气味
密度大于水
密度大于水
白雾(挥发性)
无明显现象
2. 浓硫酸的吸水性
浓盐酸、浓硫酸敞口放置在空气中,溶质、溶剂、溶液的质量、溶质的质量分数如何变化?
溶 质 溶 剂 溶 液 溶质质量分数
变小
不变
变小
变小
思 考 交 流
挥发性
吸水性
溶 质 溶 剂 溶 液 溶质质量分数
不变
变大
变大
变小
不能干燥:NH3等
浓硫酸能够吸收混合气体中的水蒸气,常用作干燥剂。
a
b
浓硫酸
长管进
短管出
此过程属于 。
物理变化
二、酸的性质
2. 浓硫酸的吸水性
3. 浓硫酸的脱水性
实验操作 放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上写字 字迹________
用小木棍蘸少量浓硫酸 小木棍触及浓硫酸的部位________
将浓硫酸滴到一小块布上 滴有浓硫酸的部位________
变黑
变黑
变黑
3. 浓硫酸的脱水性
浓硫酸能将纸张、木材、布料、皮肤中的氢、氧元素按水的组成比脱出,生成黑色的炭,发生炭化现象,此过程属于 。
化学变化
若不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%~5%的NaHCO3溶液。
注意:
3. 浓硫酸的脱水性
酸入水
沿器壁
慢慢倒
不断搅
(1)浓硫酸溶于水_____热
(2)添加顺序:__________________
②颠倒后果:______________________
①玻璃棒作用:______________________
搅拌,使热量及时扩散
酸液沸溅,造成危险
放
酸入水
4. 浓硫酸的稀释
二、酸的物理性质
4. 浓硫酸的稀释
用稀硫酸和稀盐酸做如下实验 ,把实验现象填入表 8-5中 ,并 讨论以下问题 :
1.镁 、铝 、铜三种金属中,哪些能从酸溶液中置换出氢 ,哪些不能 写出有关的化学方程式。
2.描述、比较酸溶液与上述金属反应的实验现象,讨论可能的原因。
实验操作 实验现象与结论 结论
将镁条、铝片、铜片分别放入稀硫酸中
将镁条、铝片、铜片分 别放入稀盐酸中
镁条、铝片表面有气泡产生,且镁条表面产生气泡的速率较快,铜片表面无明显变化
在金属活动性顺序中,排在氢前面的金属可以与稀硫酸(或稀盐酸)反应产生氢气,且金属活动性越强,产生气泡速率越快
酸+活泼金属 → 盐+氢气(H2)
金属 与稀盐酸反应 与稀硫酸反应
镁 Mg+2HCl = MgCl2+H2↑ Mg+H2SO4 = MgSO4+H2↑
铝 2Al+6HCl = 2AlCl3+3H2↑ 2Al+3H2SO4 = Al2(SO4)3+3H2↑
铜 不反应 不反应
酸除铁锈
实验现象
铁锈消失,无色溶液变为黄色
反应原理
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
两交换,价不变→复分解反应
用途→金属表面除锈
存在Fe3+
注 意
除铁锈时,铁钉不可长时间浸没在酸液中→酸能与铁反应
实验现象
黑色粉末消失,无色溶液变为蓝色
反应原理
存在Cu2+
H2SO4 + CuO = CuSO4 + H2O
2HCl + CuO = CuCl2 + H2O
两交换,价不变→复分解反应
实验操作 实验现象与结论 反应的化学方程式
向氧化铜中加入稀硫酸
向氧化铁中加入稀盐酸
向氧化铜中加入稀硫酸,向 氧化铁中加入稀盐酸,观察实验现象并书写相应的化学方程式。对比两个实验的现象,结合化学方程式进行分析, 你发现了什么
铁钉表面的铁锈逐渐消失,铁钉变光亮,溶液由无色变为黄色
黑色固体逐渐消失,溶液由无色变为蓝色
酸在生产生活中有广泛应用。在工业上,盐酸常用于溶解
矿石原料,也是制各许多化合物所必需的试剂;硫酸和硝酸
可用于制造肥料 、药物和炸药;醋酸在食品行业中常用作调味剂。
常见的酸
常见的酸和碱
汽车电瓶中含有硫酸
胃液中含有盐酸
食醋中含有醋酸
酸的性质
浓盐酸和浓硫酸的物理性质
浓硫酸的吸水性
浓硫酸的脱水性
酸雨中含有硫酸、硝酸
浓硫酸的稀释
1. 将浓盐酸和浓硫酸敞口放置在空气中一段时间后,关于两者溶质质量分数的变化,描述正确的是( )
A.两者溶质质量分数都变大
B.两者溶质质量分数都不变
C.两者溶质质量分数都变小
D.浓盐酸溶质质量分数变小,
C
2. 下列有关盐酸和硫酸的比较中,错误的是( )
A.浓盐酸有挥发性,浓硫酸有强腐蚀性
B.盐酸可用于制造药物,浓硫酸常用作干燥剂
C.打开试剂瓶瓶盖,观察现象可鉴别浓盐酸和浓硫酸
D.可用稀硫酸代替稀盐酸与大理石反应制取二氧化碳
D
3.下列图示的化学实验基本操作中,正确的是( )
A
4. 实验室要用如图装置干燥氧气,则瓶内所用的试剂和气体的流向均正确的是( )
A.稀硫酸 从a端通入
B.浓盐酸 从a端通入
C.浓硫酸 从a端通入
D.浓硫酸 从b端通入
C
5.生锈的铁钉,加入盛有足量稀盐酸的烧杯中。观察到固体溶解,溶液由无色变为黄色,后有气泡产生,回答下列问题
(1)溶液由无色变为黄色的反应的化学方程式
(2)有气泡产生的反应的化学方程式
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe+2HCl=FeCl2 + H2 ↑
同课章节目录
