3.1.2 金属晶体 课时跟踪检测(学生版+教师版)(含解析)2025年高中化学 选择性必修2 (苏教版2019)
文档属性
| 名称 | 3.1.2 金属晶体 课时跟踪检测(学生版+教师版)(含解析)2025年高中化学 选择性必修2 (苏教版2019) |

|
|
| 格式 | docx | ||
| 文件大小 | 453.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-12 00:00:00 | ||
图片预览



文档简介
第二课时 金属晶体
题组一 金属晶体的结构与性质
1.下列关于金属晶体的叙述中,正确的是( )
A.温度越高,金属的导电性越强
B.常温下,金属单质都以金属晶体形式存在
C.金属晶体堆积密度大,能充分利用空间的原因是金属键没有饱和性和方向性
D.金属离子与自由电子之间的强烈相互作用,在外力作用下会发生断裂,故金属无延展性
2.下列关于金属物理性质原因的描述不正确的是( )
A.金属具有良好的导电性,是因为金属晶体中的自由电子在电场作用下作定向移动
B.金属具有良好的导热性能,是因为自由电子受热后运动速率增大,与金属离子碰撞频率增大,传递了能量
C.金属晶体具有良好的延展性,是因为金属晶体中的原子层在滑动过程中金属键未被破坏
D.金属一般具有银白色光泽,是物理性质,与金属键没有关系
3.下列有关金属的说法不正确的是( )
A.金属的导电性、导热性、延展性都与自由电子有关
B.简单立方堆积的空间利用率最低
C.钠晶胞结构如图,则钠晶胞中每个钠原子的配位数为6
D.温度升高,金属的导电性将变弱
题组二 晶体的计算
4.(2024·南京高二检测)“嫦娥五号”某核心部件的主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部)。已知该结构单元底面(正六边形)边长为a nm,该合金的密度为ρ g·cm-3,NA为阿伏加德罗常数的值。下列有关说法正确的是( )
A.Ti位于元素周期表ds区
B.该合金不导电
C.每摩尔结构单元中含有16NA个原子
D.该结构单元中h=×1021 cm
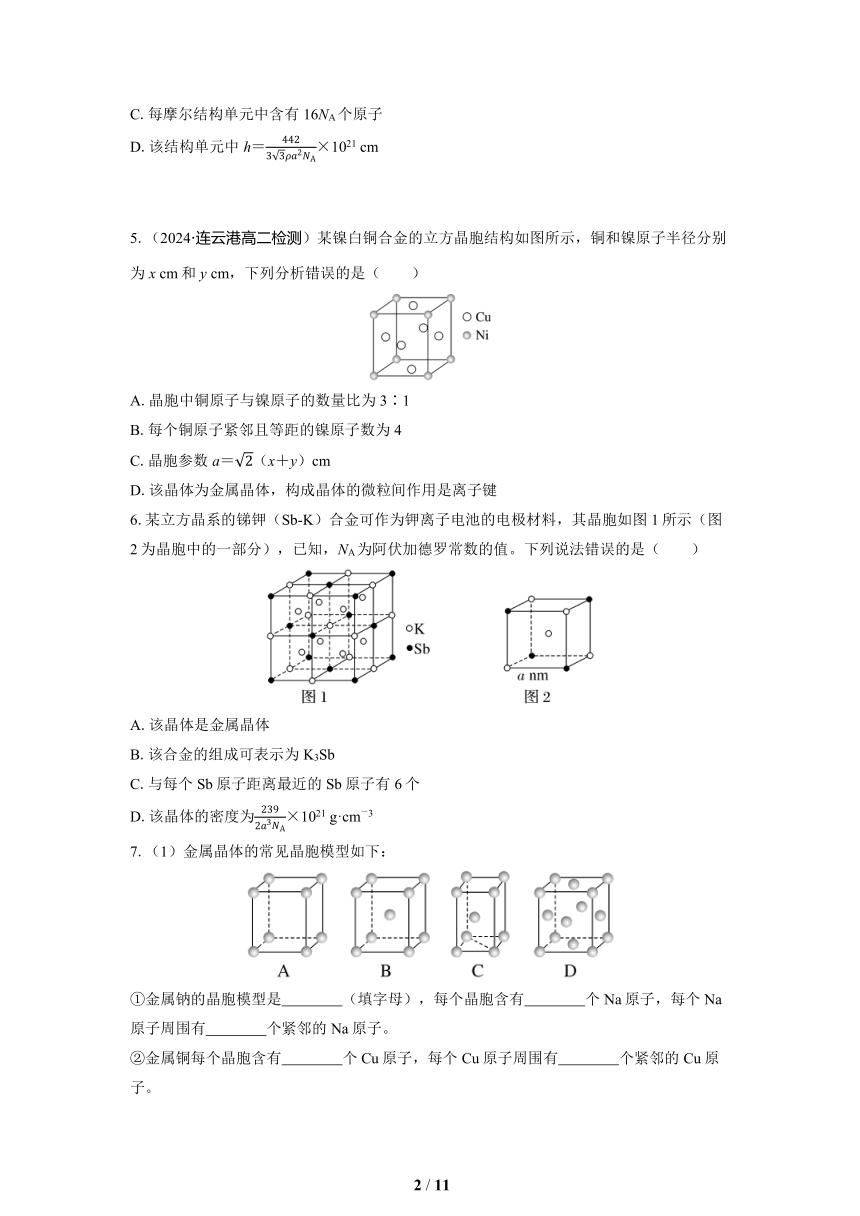
5.(2024·连云港高二检测)某镍白铜合金的立方晶胞结构如图所示,铜和镍原子半径分别为x cm和y cm,下列分析错误的是( )
A.晶胞中铜原子与镍原子的数量比为3∶1
B.每个铜原子紧邻且等距的镍原子数为4
C.晶胞参数a=(x+y)cm
D.该晶体为金属晶体,构成晶体的微粒间作用是离子键
6.某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,其晶胞如图1所示(图2为晶胞中的一部分),已知,NA为阿伏加德罗常数的值。下列说法错误的是( )
A.该晶体是金属晶体
B.该合金的组成可表示为K3Sb
C.与每个Sb原子距离最近的Sb原子有6个
D.该晶体的密度为×1021 g·cm-3
7.(1)金属晶体的常见晶胞模型如下:
①金属钠的晶胞模型是 (填字母),每个晶胞含有 个Na原子,每个Na原子周围有 个紧邻的Na原子。
②金属铜每个晶胞含有 个Cu原子,每个Cu原子周围有 个紧邻的Cu原子。
(2)在(1)中的晶胞示意图中,把金属原子抽象成质点,而事实上在堆积模型中我们把金属原子看成互相接触的球体则更接近实际情况。对于简单立方堆积的晶胞中,“金属球”在晶胞的棱心处接触,设晶胞(立方体)的棱长为a,球的半径为r,则a与r的关系是a=2r。
那么,在体心立方堆积模型中,“金属球”应在 处接触,则晶胞棱长a与球半径r的关系是 ;晶胞的体积为 ;该晶胞中拥有 个原子,故金属原子所占的体积为 。
8.(2024·苏州高二检测)某纳米钛铝合金晶胞结构如图甲(Al、Ti各有1个原子在晶胞内部),金属铬的晶胞如图乙所示,已知铬的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。下列说法中正确的是( )
A.甲中Al与Ti原子个数比为11∶5
B.1个基态Ti原子中含有4个未成对电子
C.乙中与铬原子距离最近的铬原子共有12个
D.铬原子的半径r=××1010 pm
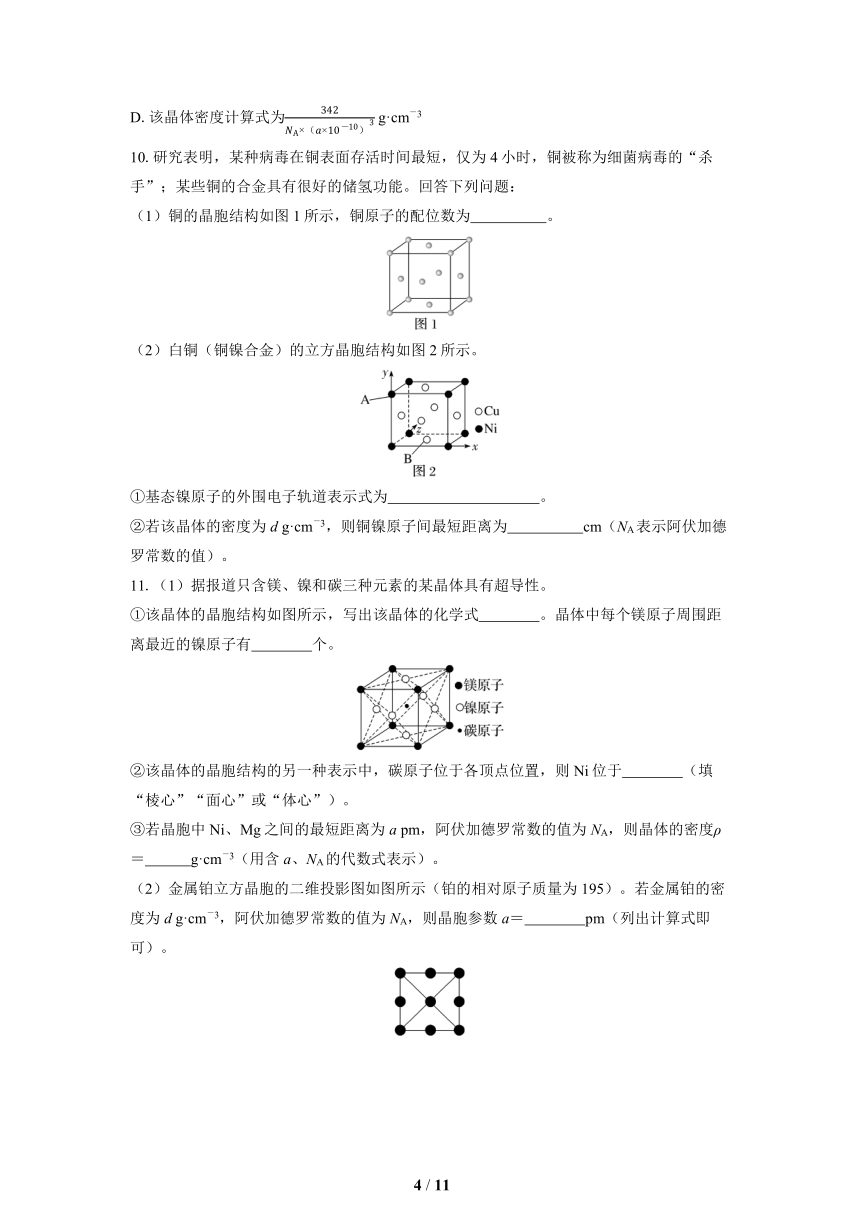
9.(2024·镇江高二检测)磷青铜是铜与锡、磷的合金,质地坚硬,主要用作耐磨零件和弹性元件。某立方磷青铜晶胞结构如图所示,晶胞参数为a pm(NA表示阿伏加德罗常数的值),下列说法错误的是( )
A.Cu、Sn均为ds区元素
B.Sn和Cu间最短的距离为 pm
C.晶胞中Sn周围距离最近且等距的Cu有12个
D.该晶体密度计算式为 g·cm-3
10.研究表明,某种病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”;某些铜的合金具有很好的储氢功能。回答下列问题:
(1)铜的晶胞结构如图1所示,铜原子的配位数为 。
(2)白铜(铜镍合金)的立方晶胞结构如图2所示。
①基态镍原子的外围电子轨道表示式为 。
②若该晶体的密度为d g·cm-3,则铜镍原子间最短距离为 cm(NA表示阿伏加德罗常数的值)。
11.(1)据报道只含镁、镍和碳三种元素的某晶体具有超导性。
①该晶体的晶胞结构如图所示,写出该晶体的化学式 。晶体中每个镁原子周围距离最近的镍原子有 个。
②该晶体的晶胞结构的另一种表示中,碳原子位于各顶点位置,则Ni位于 (填“棱心”“面心”或“体心”)。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ= g·cm-3(用含a、NA的代数式表示)。
(2)金属铂立方晶胞的二维投影图如图所示(铂的相对原子质量为195)。若金属铂的密度为d g·cm-3,阿伏加德罗常数的值为NA,则晶胞参数a= pm(列出计算式即可)。
题组一 金属晶体的结构与性质
1.下列关于金属晶体的叙述中,正确的是( )
A.温度越高,金属的导电性越强
B.常温下,金属单质都以金属晶体形式存在
C.金属晶体堆积密度大,能充分利用空间的原因是金属键没有饱和性和方向性
D.金属离子与自由电子之间的强烈相互作用,在外力作用下会发生断裂,故金属无延展性
解析:C 温度越高,金属的导电性越弱,A错误;常温下,如Hg为液态,不以晶体形式存在,B错误;因为金属键无方向性和饱和性,所以金属晶体中的金属原子可以采用紧密堆积方式进行堆积,充分利用空间,C正确;在外力作用下,金属离子与自由电子之间仍有强烈的相互作用,不会断裂,所以金属有延展性,D错误。
2.下列关于金属物理性质原因的描述不正确的是( )
A.金属具有良好的导电性,是因为金属晶体中的自由电子在电场作用下作定向移动
B.金属具有良好的导热性能,是因为自由电子受热后运动速率增大,与金属离子碰撞频率增大,传递了能量
C.金属晶体具有良好的延展性,是因为金属晶体中的原子层在滑动过程中金属键未被破坏
D.金属一般具有银白色光泽,是物理性质,与金属键没有关系
解析:D 金属中的自由电子在外加电场作用下定向移动,金属可以导电,A正确;金属中的自由电子受热后运动速率增大,与金属离子碰撞频率增大,传递了能量,金属有良好的导热性,B正确;当金属晶体受到外力作用时,晶体中的各原子层发生相对滑动而仍然存在金属键,所以表现出良好的延展性,C正确;金属一般具有银白色光泽,是由于金属中的自由电子在吸收可见光以后,发生跃迁,成为高能态,然后又会回到低能态,把多余的能量以可见光的形式释放出来,所以金属一般具有银白色光泽与金属键有关系,D错误。
3.下列有关金属的说法不正确的是( )
A.金属的导电性、导热性、延展性都与自由电子有关
B.简单立方堆积的空间利用率最低
C.钠晶胞结构如图,则钠晶胞中每个钠原子的配位数为6
D.温度升高,金属的导电性将变弱
解析:C 由钠晶胞结构可知,钠为体心立方堆积,每个钠原子的配位数是8。
题组二 晶体的计算
4.(2024·南京高二检测)“嫦娥五号”某核心部件的主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部)。已知该结构单元底面(正六边形)边长为a nm,该合金的密度为ρ g·cm-3,NA为阿伏加德罗常数的值。下列有关说法正确的是( )
A.Ti位于元素周期表ds区
B.该合金不导电
C.每摩尔结构单元中含有16NA个原子
D.该结构单元中h=×1021 cm
解析:D Ti位于元素周期表d区,A项错误;金属晶体均导电,B项错误;每个结构单元中含Al原子数为4×+1=,Ti原子数为8×+2×+1+1×=,则每摩尔结构单元中含有NA个原子,C项错误;ρ= g·cm-3,则高h=×1021 cm,D项正确。
5.(2024·连云港高二检测)某镍白铜合金的立方晶胞结构如图所示,铜和镍原子半径分别为x cm和y cm,下列分析错误的是( )
A.晶胞中铜原子与镍原子的数量比为3∶1
B.每个铜原子紧邻且等距的镍原子数为4
C.晶胞参数a=(x+y)cm
D.该晶体为金属晶体,构成晶体的微粒间作用是离子键
解析:D 晶胞中,Ni原子处于立方晶胞的顶点,Cu原子处于立方晶胞的面心,每个晶胞中含有Cu原子的个数为6×=3,含有Ni原子的个数为8×=1,Cu原子与Ni原子个数比为3∶1,A正确;以处于晶胞面心处的Cu原子来看,它与该面四个顶点处的Ni原子紧邻且等距,故每个铜原子紧邻等距的镍原子数为4,B正确;晶胞参数为a cm,则面对角线为a cm,2x+2y=a cm,a=(x+y)cm,C正确;Cu、Ni均属于金属,金属通过金属键形成晶体,D错误。
6.某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,其晶胞如图1所示(图2为晶胞中的一部分),已知,NA为阿伏加德罗常数的值。下列说法错误的是( )
A.该晶体是金属晶体
B.该合金的组成可表示为K3Sb
C.与每个Sb原子距离最近的Sb原子有6个
D.该晶体的密度为×1021 g·cm-3
解析:C 该晶体是合金,形成的金属晶体,A正确;该晶胞中K的个数为12×+9=12,Sb的个数为8×+6×=4,K和Sb原子数之比为3∶1,该合金的组成可表示为K3Sb,B正确;根据晶胞的结构可知,与每个Sb原子距离最近的Sb原子有12个,C错误;一个晶胞中含有4个“K3Sb”,晶胞质量为×239 g,晶胞的密度为×1021 g·cm-3,D正确。
7.(1)金属晶体的常见晶胞模型如下:
①金属钠的晶胞模型是B(填字母),每个晶胞含有2个Na原子,每个Na原子周围有8个紧邻的Na原子。
②金属铜每个晶胞含有4个Cu原子,每个Cu原子周围有12个紧邻的Cu原子。
(2)在(1)中的晶胞示意图中,把金属原子抽象成质点,而事实上在堆积模型中我们把金属原子看成互相接触的球体则更接近实际情况。对于简单立方堆积的晶胞中,“金属球”在晶胞的棱心处接触,设晶胞(立方体)的棱长为a,球的半径为r,则a与r的关系是a=2r。
那么,在体心立方堆积模型中,“金属球”应在晶胞体对角线的 处接触,则晶胞棱长a与球半径r的关系是r= a;晶胞的体积为a3;该晶胞中拥有2个原子,故金属原子所占的体积为πa3。
解析:(1)①钠晶体与钾晶体均为体心立方堆积,每个晶胞中含有2个钠原子,其配位数是8。②铜晶体为面心立方堆积,每个晶胞中含有4个铜原子,配位数为12。
(2)由体心立方堆积模型(如图B)知,“金属球”应在晶胞体对角线的 (或 )处接触,若晶胞的棱长为a,则立方体对角线为 a,“金属球”的半径r= a,晶胞的体积V=a3。处于顶点上的原子,同时为8个晶胞所共有,处于晶胞内部的原子则完全属于该晶胞,晶胞中有8× +1=2个原子。晶胞的体积V=a3,金属原子所占的体积V=2×πr3=2×π=πa3。
8.(2024·苏州高二检测)某纳米钛铝合金晶胞结构如图甲(Al、Ti各有1个原子在晶胞内部),金属铬的晶胞如图乙所示,已知铬的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。下列说法中正确的是( )
A.甲中Al与Ti原子个数比为11∶5
B.1个基态Ti原子中含有4个未成对电子
C.乙中与铬原子距离最近的铬原子共有12个
D.铬原子的半径r=××1010 pm
解析:D 甲中Al原子个数为4×+1=,Ti原子个数为8×+2×+1×+1=,Al与Ti原子个数比为5∶11,A错误;Ti是22号元素,基态Ti原子外围电子排布式为3d24s2,含有2个未成对电子,B错误;铬晶体属于体心立方堆积,则与铬原子距离最近的铬原子共有8个,C错误;由图乙可知,该晶胞含有8×+1=2个Cr原子,且晶胞中体对角线上的3个原子紧密相邻,已知铬的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,设Cr原子半径为r,晶胞的体积为V=×1030 pm3,晶胞棱长为×1010 pm=pm,则铬原子的半径r=××1010 pm,D正确。
9.(2024·镇江高二检测)磷青铜是铜与锡、磷的合金,质地坚硬,主要用作耐磨零件和弹性元件。某立方磷青铜晶胞结构如图所示,晶胞参数为a pm(NA表示阿伏加德罗常数的值),下列说法错误的是( )
A.Cu、Sn均为ds区元素
B.Sn和Cu间最短的距离为 pm
C.晶胞中Sn周围距离最近且等距的Cu有12个
D.该晶体密度计算式为 g·cm-3
解析:A 锡为50号元素,外围电子排布式为5s25p2,处于元素周期表p区,A错误;晶胞中锡原子与铜原子的最短距离为面对角线长度的,则锡原子和铜原子的最短距离为 pm,B正确;晶胞中位于顶点锡原子与位于面心的铜原子距离最近,则晶胞中锡原子周围距离最近且等距的铜原子有12个,C正确;晶胞中位于顶点锡原子个数为8×=1,位于面心的铜原子个数为6×=3,位于体心的磷原子个数为1,化学式为Cu3SnP,设晶体的密度为d g·cm-3,由晶胞的质量公式可得:=(a×10-10)3d,解得d=g·cm-3,D正确。
10.研究表明,某种病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”;某些铜的合金具有很好的储氢功能。回答下列问题:
(1)铜的晶胞结构如图1所示,铜原子的配位数为12。
(2)白铜(铜镍合金)的立方晶胞结构如图2所示。
①基态镍原子的外围电子轨道表示式为。
②若该晶体的密度为d g·cm-3,则铜镍原子间最短距离为 ×m(NA表示阿伏加德罗常数的值)。
解析:(1)晶体铜属于面心立方最密堆积,Cu原子处于顶点与面心,顶点Cu原子与面心Cu原子相邻,每个顶点为8个晶胞所共用,每个面为2个晶胞所共用,则晶胞中Cu原子配位数=×3×8=12。(2)①Ni为28号元素,基态Ni的外围电子排布式为3d84s2,外围电子轨道表示式为。②晶胞中铜原子位于面心,镍原子位于顶点,根据均摊法计算,晶胞中铜原子个数为6×=3,镍原子的个数为8×=1;该晶胞的组成为Cu3Ni,密度为d,NA为阿伏加德罗常数的值,根据密度ρ=,即d=g·cm-3,则晶胞参数a= cm,如题图所示,设晶体中任意1个Ni原子到最近Cu原子的距离为x,则2x2=a2,x=a cm,x=× cm。
11.(1)据报道只含镁、镍和碳三种元素的某晶体具有超导性。
①该晶体的晶胞结构如图所示,写出该晶体的化学式MgCNi3。晶体中每个镁原子周围距离最近的镍原子有12个。
②该晶体的晶胞结构的另一种表示中,碳原子位于各顶点位置,则Ni位于棱心(填“棱心”“面心”或“体心”)。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=×1030g·cm-3(用含a、NA的代数式表示)。
(2)金属铂立方晶胞的二维投影图如图所示(铂的相对原子质量为195)。若金属铂的密度为d g·cm-3,阿伏加德罗常数的值为NA,则晶胞参数a= ×1010pm(列出计算式即可)。
解析:(1)①碳原子位于晶胞体心,晶胞中有1个C原子,镁原子位于顶点,晶胞中Mg原子数为8×=1,镍原子位于面心,每个晶胞中所含镍原子数为6×=3,晶体的化学式为MgCNi3。Mg原子位于顶点,与之最近的Ni原子处于面心,面心上的原子被2个晶胞所共用,则共有=12个。②该晶体的晶胞结构的另一种表示中,碳原子位于各顶点位置。将晶胞扩展,C原子作为新的晶胞的顶点,此时Ni原子位于棱心。③晶胞棱长=a×10-10 cm,晶胞体积=(a×10-10 cm)3=2a3×10-30 cm3,
则晶体密度ρ== g·cm-3=×1030 g·cm-3。
(2)根据金属Pt的晶胞的二维投影图可知,晶胞为面心立方晶胞,一个晶胞中含有Pt原子的个数为8×+6×=4。根据m=Vρ,则V== cm3=a3,解得a=×1010 pm。
4 / 4
题组一 金属晶体的结构与性质
1.下列关于金属晶体的叙述中,正确的是( )
A.温度越高,金属的导电性越强
B.常温下,金属单质都以金属晶体形式存在
C.金属晶体堆积密度大,能充分利用空间的原因是金属键没有饱和性和方向性
D.金属离子与自由电子之间的强烈相互作用,在外力作用下会发生断裂,故金属无延展性
2.下列关于金属物理性质原因的描述不正确的是( )
A.金属具有良好的导电性,是因为金属晶体中的自由电子在电场作用下作定向移动
B.金属具有良好的导热性能,是因为自由电子受热后运动速率增大,与金属离子碰撞频率增大,传递了能量
C.金属晶体具有良好的延展性,是因为金属晶体中的原子层在滑动过程中金属键未被破坏
D.金属一般具有银白色光泽,是物理性质,与金属键没有关系
3.下列有关金属的说法不正确的是( )
A.金属的导电性、导热性、延展性都与自由电子有关
B.简单立方堆积的空间利用率最低
C.钠晶胞结构如图,则钠晶胞中每个钠原子的配位数为6
D.温度升高,金属的导电性将变弱
题组二 晶体的计算
4.(2024·南京高二检测)“嫦娥五号”某核心部件的主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部)。已知该结构单元底面(正六边形)边长为a nm,该合金的密度为ρ g·cm-3,NA为阿伏加德罗常数的值。下列有关说法正确的是( )
A.Ti位于元素周期表ds区
B.该合金不导电
C.每摩尔结构单元中含有16NA个原子
D.该结构单元中h=×1021 cm
5.(2024·连云港高二检测)某镍白铜合金的立方晶胞结构如图所示,铜和镍原子半径分别为x cm和y cm,下列分析错误的是( )
A.晶胞中铜原子与镍原子的数量比为3∶1
B.每个铜原子紧邻且等距的镍原子数为4
C.晶胞参数a=(x+y)cm
D.该晶体为金属晶体,构成晶体的微粒间作用是离子键
6.某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,其晶胞如图1所示(图2为晶胞中的一部分),已知,NA为阿伏加德罗常数的值。下列说法错误的是( )
A.该晶体是金属晶体
B.该合金的组成可表示为K3Sb
C.与每个Sb原子距离最近的Sb原子有6个
D.该晶体的密度为×1021 g·cm-3
7.(1)金属晶体的常见晶胞模型如下:
①金属钠的晶胞模型是 (填字母),每个晶胞含有 个Na原子,每个Na原子周围有 个紧邻的Na原子。
②金属铜每个晶胞含有 个Cu原子,每个Cu原子周围有 个紧邻的Cu原子。
(2)在(1)中的晶胞示意图中,把金属原子抽象成质点,而事实上在堆积模型中我们把金属原子看成互相接触的球体则更接近实际情况。对于简单立方堆积的晶胞中,“金属球”在晶胞的棱心处接触,设晶胞(立方体)的棱长为a,球的半径为r,则a与r的关系是a=2r。
那么,在体心立方堆积模型中,“金属球”应在 处接触,则晶胞棱长a与球半径r的关系是 ;晶胞的体积为 ;该晶胞中拥有 个原子,故金属原子所占的体积为 。
8.(2024·苏州高二检测)某纳米钛铝合金晶胞结构如图甲(Al、Ti各有1个原子在晶胞内部),金属铬的晶胞如图乙所示,已知铬的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。下列说法中正确的是( )
A.甲中Al与Ti原子个数比为11∶5
B.1个基态Ti原子中含有4个未成对电子
C.乙中与铬原子距离最近的铬原子共有12个
D.铬原子的半径r=××1010 pm
9.(2024·镇江高二检测)磷青铜是铜与锡、磷的合金,质地坚硬,主要用作耐磨零件和弹性元件。某立方磷青铜晶胞结构如图所示,晶胞参数为a pm(NA表示阿伏加德罗常数的值),下列说法错误的是( )
A.Cu、Sn均为ds区元素
B.Sn和Cu间最短的距离为 pm
C.晶胞中Sn周围距离最近且等距的Cu有12个
D.该晶体密度计算式为 g·cm-3
10.研究表明,某种病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”;某些铜的合金具有很好的储氢功能。回答下列问题:
(1)铜的晶胞结构如图1所示,铜原子的配位数为 。
(2)白铜(铜镍合金)的立方晶胞结构如图2所示。
①基态镍原子的外围电子轨道表示式为 。
②若该晶体的密度为d g·cm-3,则铜镍原子间最短距离为 cm(NA表示阿伏加德罗常数的值)。
11.(1)据报道只含镁、镍和碳三种元素的某晶体具有超导性。
①该晶体的晶胞结构如图所示,写出该晶体的化学式 。晶体中每个镁原子周围距离最近的镍原子有 个。
②该晶体的晶胞结构的另一种表示中,碳原子位于各顶点位置,则Ni位于 (填“棱心”“面心”或“体心”)。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ= g·cm-3(用含a、NA的代数式表示)。
(2)金属铂立方晶胞的二维投影图如图所示(铂的相对原子质量为195)。若金属铂的密度为d g·cm-3,阿伏加德罗常数的值为NA,则晶胞参数a= pm(列出计算式即可)。
题组一 金属晶体的结构与性质
1.下列关于金属晶体的叙述中,正确的是( )
A.温度越高,金属的导电性越强
B.常温下,金属单质都以金属晶体形式存在
C.金属晶体堆积密度大,能充分利用空间的原因是金属键没有饱和性和方向性
D.金属离子与自由电子之间的强烈相互作用,在外力作用下会发生断裂,故金属无延展性
解析:C 温度越高,金属的导电性越弱,A错误;常温下,如Hg为液态,不以晶体形式存在,B错误;因为金属键无方向性和饱和性,所以金属晶体中的金属原子可以采用紧密堆积方式进行堆积,充分利用空间,C正确;在外力作用下,金属离子与自由电子之间仍有强烈的相互作用,不会断裂,所以金属有延展性,D错误。
2.下列关于金属物理性质原因的描述不正确的是( )
A.金属具有良好的导电性,是因为金属晶体中的自由电子在电场作用下作定向移动
B.金属具有良好的导热性能,是因为自由电子受热后运动速率增大,与金属离子碰撞频率增大,传递了能量
C.金属晶体具有良好的延展性,是因为金属晶体中的原子层在滑动过程中金属键未被破坏
D.金属一般具有银白色光泽,是物理性质,与金属键没有关系
解析:D 金属中的自由电子在外加电场作用下定向移动,金属可以导电,A正确;金属中的自由电子受热后运动速率增大,与金属离子碰撞频率增大,传递了能量,金属有良好的导热性,B正确;当金属晶体受到外力作用时,晶体中的各原子层发生相对滑动而仍然存在金属键,所以表现出良好的延展性,C正确;金属一般具有银白色光泽,是由于金属中的自由电子在吸收可见光以后,发生跃迁,成为高能态,然后又会回到低能态,把多余的能量以可见光的形式释放出来,所以金属一般具有银白色光泽与金属键有关系,D错误。
3.下列有关金属的说法不正确的是( )
A.金属的导电性、导热性、延展性都与自由电子有关
B.简单立方堆积的空间利用率最低
C.钠晶胞结构如图,则钠晶胞中每个钠原子的配位数为6
D.温度升高,金属的导电性将变弱
解析:C 由钠晶胞结构可知,钠为体心立方堆积,每个钠原子的配位数是8。
题组二 晶体的计算
4.(2024·南京高二检测)“嫦娥五号”某核心部件的主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部)。已知该结构单元底面(正六边形)边长为a nm,该合金的密度为ρ g·cm-3,NA为阿伏加德罗常数的值。下列有关说法正确的是( )
A.Ti位于元素周期表ds区
B.该合金不导电
C.每摩尔结构单元中含有16NA个原子
D.该结构单元中h=×1021 cm
解析:D Ti位于元素周期表d区,A项错误;金属晶体均导电,B项错误;每个结构单元中含Al原子数为4×+1=,Ti原子数为8×+2×+1+1×=,则每摩尔结构单元中含有NA个原子,C项错误;ρ= g·cm-3,则高h=×1021 cm,D项正确。
5.(2024·连云港高二检测)某镍白铜合金的立方晶胞结构如图所示,铜和镍原子半径分别为x cm和y cm,下列分析错误的是( )
A.晶胞中铜原子与镍原子的数量比为3∶1
B.每个铜原子紧邻且等距的镍原子数为4
C.晶胞参数a=(x+y)cm
D.该晶体为金属晶体,构成晶体的微粒间作用是离子键
解析:D 晶胞中,Ni原子处于立方晶胞的顶点,Cu原子处于立方晶胞的面心,每个晶胞中含有Cu原子的个数为6×=3,含有Ni原子的个数为8×=1,Cu原子与Ni原子个数比为3∶1,A正确;以处于晶胞面心处的Cu原子来看,它与该面四个顶点处的Ni原子紧邻且等距,故每个铜原子紧邻等距的镍原子数为4,B正确;晶胞参数为a cm,则面对角线为a cm,2x+2y=a cm,a=(x+y)cm,C正确;Cu、Ni均属于金属,金属通过金属键形成晶体,D错误。
6.某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,其晶胞如图1所示(图2为晶胞中的一部分),已知,NA为阿伏加德罗常数的值。下列说法错误的是( )
A.该晶体是金属晶体
B.该合金的组成可表示为K3Sb
C.与每个Sb原子距离最近的Sb原子有6个
D.该晶体的密度为×1021 g·cm-3
解析:C 该晶体是合金,形成的金属晶体,A正确;该晶胞中K的个数为12×+9=12,Sb的个数为8×+6×=4,K和Sb原子数之比为3∶1,该合金的组成可表示为K3Sb,B正确;根据晶胞的结构可知,与每个Sb原子距离最近的Sb原子有12个,C错误;一个晶胞中含有4个“K3Sb”,晶胞质量为×239 g,晶胞的密度为×1021 g·cm-3,D正确。
7.(1)金属晶体的常见晶胞模型如下:
①金属钠的晶胞模型是B(填字母),每个晶胞含有2个Na原子,每个Na原子周围有8个紧邻的Na原子。
②金属铜每个晶胞含有4个Cu原子,每个Cu原子周围有12个紧邻的Cu原子。
(2)在(1)中的晶胞示意图中,把金属原子抽象成质点,而事实上在堆积模型中我们把金属原子看成互相接触的球体则更接近实际情况。对于简单立方堆积的晶胞中,“金属球”在晶胞的棱心处接触,设晶胞(立方体)的棱长为a,球的半径为r,则a与r的关系是a=2r。
那么,在体心立方堆积模型中,“金属球”应在晶胞体对角线的 处接触,则晶胞棱长a与球半径r的关系是r= a;晶胞的体积为a3;该晶胞中拥有2个原子,故金属原子所占的体积为πa3。
解析:(1)①钠晶体与钾晶体均为体心立方堆积,每个晶胞中含有2个钠原子,其配位数是8。②铜晶体为面心立方堆积,每个晶胞中含有4个铜原子,配位数为12。
(2)由体心立方堆积模型(如图B)知,“金属球”应在晶胞体对角线的 (或 )处接触,若晶胞的棱长为a,则立方体对角线为 a,“金属球”的半径r= a,晶胞的体积V=a3。处于顶点上的原子,同时为8个晶胞所共有,处于晶胞内部的原子则完全属于该晶胞,晶胞中有8× +1=2个原子。晶胞的体积V=a3,金属原子所占的体积V=2×πr3=2×π=πa3。
8.(2024·苏州高二检测)某纳米钛铝合金晶胞结构如图甲(Al、Ti各有1个原子在晶胞内部),金属铬的晶胞如图乙所示,已知铬的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。下列说法中正确的是( )
A.甲中Al与Ti原子个数比为11∶5
B.1个基态Ti原子中含有4个未成对电子
C.乙中与铬原子距离最近的铬原子共有12个
D.铬原子的半径r=××1010 pm
解析:D 甲中Al原子个数为4×+1=,Ti原子个数为8×+2×+1×+1=,Al与Ti原子个数比为5∶11,A错误;Ti是22号元素,基态Ti原子外围电子排布式为3d24s2,含有2个未成对电子,B错误;铬晶体属于体心立方堆积,则与铬原子距离最近的铬原子共有8个,C错误;由图乙可知,该晶胞含有8×+1=2个Cr原子,且晶胞中体对角线上的3个原子紧密相邻,已知铬的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,设Cr原子半径为r,晶胞的体积为V=×1030 pm3,晶胞棱长为×1010 pm=pm,则铬原子的半径r=××1010 pm,D正确。
9.(2024·镇江高二检测)磷青铜是铜与锡、磷的合金,质地坚硬,主要用作耐磨零件和弹性元件。某立方磷青铜晶胞结构如图所示,晶胞参数为a pm(NA表示阿伏加德罗常数的值),下列说法错误的是( )
A.Cu、Sn均为ds区元素
B.Sn和Cu间最短的距离为 pm
C.晶胞中Sn周围距离最近且等距的Cu有12个
D.该晶体密度计算式为 g·cm-3
解析:A 锡为50号元素,外围电子排布式为5s25p2,处于元素周期表p区,A错误;晶胞中锡原子与铜原子的最短距离为面对角线长度的,则锡原子和铜原子的最短距离为 pm,B正确;晶胞中位于顶点锡原子与位于面心的铜原子距离最近,则晶胞中锡原子周围距离最近且等距的铜原子有12个,C正确;晶胞中位于顶点锡原子个数为8×=1,位于面心的铜原子个数为6×=3,位于体心的磷原子个数为1,化学式为Cu3SnP,设晶体的密度为d g·cm-3,由晶胞的质量公式可得:=(a×10-10)3d,解得d=g·cm-3,D正确。
10.研究表明,某种病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”;某些铜的合金具有很好的储氢功能。回答下列问题:
(1)铜的晶胞结构如图1所示,铜原子的配位数为12。
(2)白铜(铜镍合金)的立方晶胞结构如图2所示。
①基态镍原子的外围电子轨道表示式为。
②若该晶体的密度为d g·cm-3,则铜镍原子间最短距离为 ×m(NA表示阿伏加德罗常数的值)。
解析:(1)晶体铜属于面心立方最密堆积,Cu原子处于顶点与面心,顶点Cu原子与面心Cu原子相邻,每个顶点为8个晶胞所共用,每个面为2个晶胞所共用,则晶胞中Cu原子配位数=×3×8=12。(2)①Ni为28号元素,基态Ni的外围电子排布式为3d84s2,外围电子轨道表示式为。②晶胞中铜原子位于面心,镍原子位于顶点,根据均摊法计算,晶胞中铜原子个数为6×=3,镍原子的个数为8×=1;该晶胞的组成为Cu3Ni,密度为d,NA为阿伏加德罗常数的值,根据密度ρ=,即d=g·cm-3,则晶胞参数a= cm,如题图所示,设晶体中任意1个Ni原子到最近Cu原子的距离为x,则2x2=a2,x=a cm,x=× cm。
11.(1)据报道只含镁、镍和碳三种元素的某晶体具有超导性。
①该晶体的晶胞结构如图所示,写出该晶体的化学式MgCNi3。晶体中每个镁原子周围距离最近的镍原子有12个。
②该晶体的晶胞结构的另一种表示中,碳原子位于各顶点位置,则Ni位于棱心(填“棱心”“面心”或“体心”)。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=×1030g·cm-3(用含a、NA的代数式表示)。
(2)金属铂立方晶胞的二维投影图如图所示(铂的相对原子质量为195)。若金属铂的密度为d g·cm-3,阿伏加德罗常数的值为NA,则晶胞参数a= ×1010pm(列出计算式即可)。
解析:(1)①碳原子位于晶胞体心,晶胞中有1个C原子,镁原子位于顶点,晶胞中Mg原子数为8×=1,镍原子位于面心,每个晶胞中所含镍原子数为6×=3,晶体的化学式为MgCNi3。Mg原子位于顶点,与之最近的Ni原子处于面心,面心上的原子被2个晶胞所共用,则共有=12个。②该晶体的晶胞结构的另一种表示中,碳原子位于各顶点位置。将晶胞扩展,C原子作为新的晶胞的顶点,此时Ni原子位于棱心。③晶胞棱长=a×10-10 cm,晶胞体积=(a×10-10 cm)3=2a3×10-30 cm3,
则晶体密度ρ== g·cm-3=×1030 g·cm-3。
(2)根据金属Pt的晶胞的二维投影图可知,晶胞为面心立方晶胞,一个晶胞中含有Pt原子的个数为8×+6×=4。根据m=Vρ,则V== cm3=a3,解得a=×1010 pm。
4 / 4
