1.2.1 分离、提纯 学案设计 (表格式) 2024-2025学年高二下学期化学人教版(2019)选择性必修3
文档属性
| 名称 | 1.2.1 分离、提纯 学案设计 (表格式) 2024-2025学年高二下学期化学人教版(2019)选择性必修3 |

|
|
| 格式 | docx | ||
| 文件大小 | 581.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-13 15:20:02 | ||
图片预览



文档简介
第二节 研究有机化合物的一般方法
第1课时 分离、提纯 学案设计
学习目标
1.了解有机化合物分离、提纯的原理和操作,能结合实际情况应用蒸馏、萃取或重结晶的方法进行有机化合物的分离和提纯。
2.通过重结晶法提纯苯甲酸的实验探究,感受科学研究的方法。
3.认识科学探究过程的步骤,形成科学探究与创新意识的学科素养。
学习重难点
重结晶法提纯苯甲酸的实验探究。
课堂探究
主题 学习探究过程 提升素养
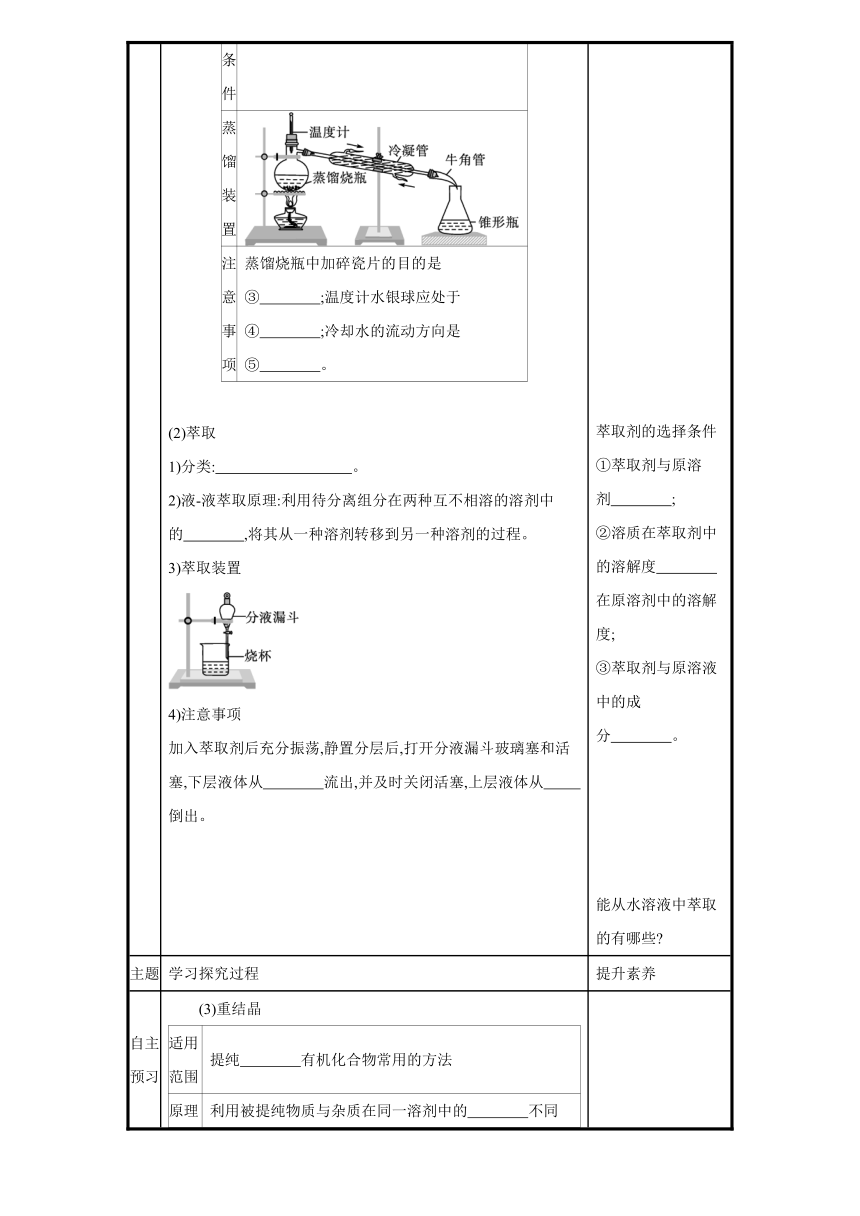
自主预习 1.研究有机化合物的一般步骤 分离、提纯→确定 →确定 →确定 2.有机化合物的分离与提纯 提纯含杂质的有机化合物的基本方法是利用有机化合物与杂质 的差异将它们分离。在有机化学中常用的分离和提纯方法有 、 和 等。 3.常用方法 (1)蒸馏 蒸馏原理在一定温度和压强下,加热液态混合物,利用物质沸点差异进行物质分离的方法。该方法使沸点低的物质汽化,然后冷凝、收集,从而达到与沸点高的物质相分离的目的适用条件有机化合物① 较高;有机化合物与杂质的②相差较大 蒸馏装置注意事项蒸馏烧瓶中加碎瓷片的目的是③ ;温度计水银球应处于④ ;冷却水的流动方向是⑤ 。
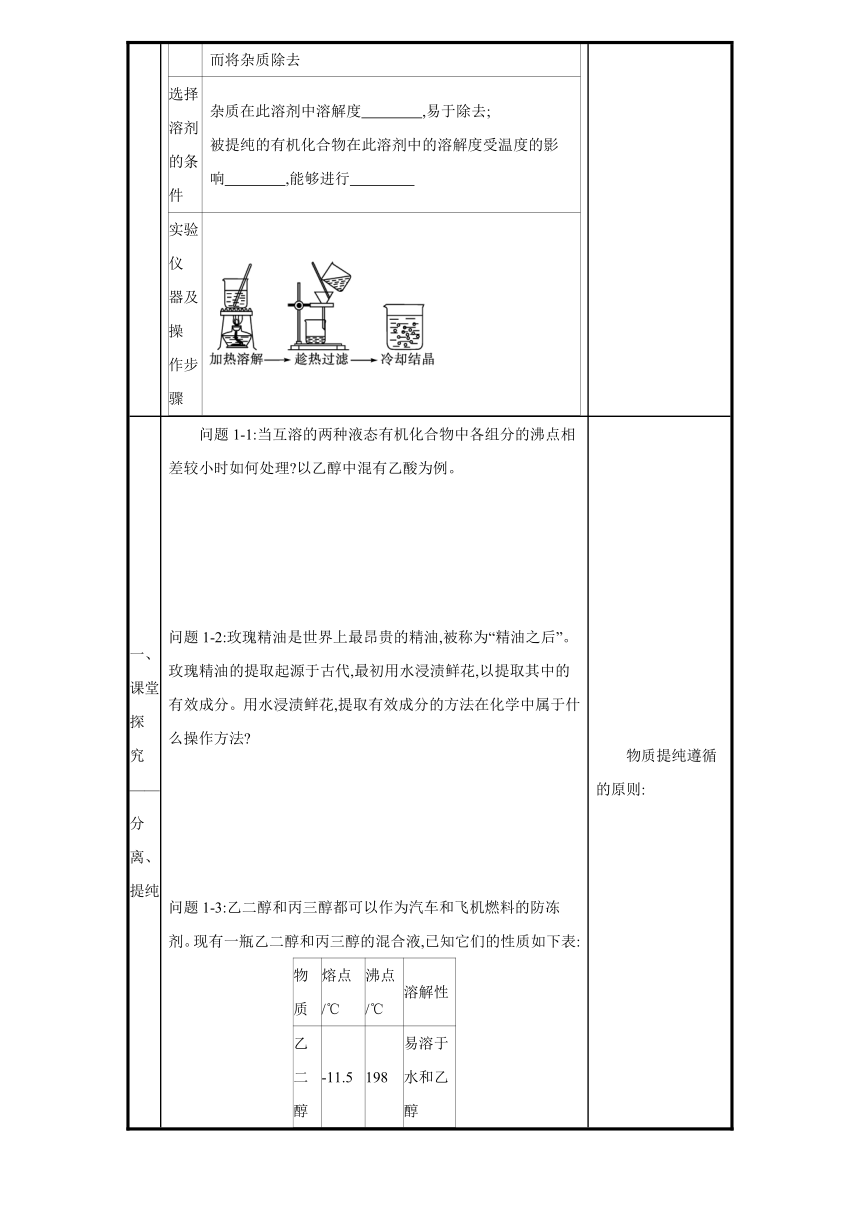
(2)萃取 1)分类: 。 2)液-液萃取原理:利用待分离组分在两种互不相溶的溶剂中的 ,将其从一种溶剂转移到另一种溶剂的过程。 3)萃取装置 4)注意事项 加入萃取剂后充分振荡,静置分层后,打开分液漏斗玻璃塞和活塞,下层液体从 流出,并及时关闭活塞,上层液体从 倒出。 物质分离、提纯的思维模型: 温度计和冷凝管在使用时需要注意: 萃取剂的选择条件 ①萃取剂与原溶剂 ; ②溶质在萃取剂中的溶解度 在原溶剂中的溶解度; ③萃取剂与原溶液中的成分 。 能从水溶液中萃取的有哪些
主题 学习探究过程 提升素养
自主预习 (3)重结晶 适用范围提纯 有机化合物常用的方法 原理利用被提纯物质与杂质在同一溶剂中的 不同而将杂质除去 选择溶剂 的条件杂质在此溶剂中溶解度 ,易于除去; 被提纯的有机化合物在此溶剂中的溶解度受温度的影响 ,能够进行 实验仪 器及操 作步骤
一、课堂探 究——分 离、提纯 问题1-1:当互溶的两种液态有机化合物中各组分的沸点相差较小时如何处理 以乙醇中混有乙酸为例。 问题1-2:玫瑰精油是世界上最昂贵的精油,被称为“精油之后”。玫瑰精油的提取起源于古代,最初用水浸渍鲜花,以提取其中的有效成分。用水浸渍鲜花,提取有效成分的方法在化学中属于什么操作方法 问题1-3:乙二醇和丙三醇都可以作为汽车和飞机燃料的防冻剂。现有一瓶乙二醇和丙三醇的混合液,已知它们的性质如下表: 物质熔点/℃沸点/℃溶解性乙二醇-11.5198易溶于水和乙醇丙三醇17.9290与水和乙醇 任意比互溶
分离乙二醇和丙三醇的最佳方法是什么 物质提纯遵循的原则:
主题 学习探究过程 提升素养
二、课堂实 验——苯 甲酸的提纯 【思考】完成表格: 实验步骤实验现象Ⅰ观察粗苯甲酸样品(含少量氯化钠和泥沙)的状态 Ⅱ将1.0 g粗苯甲酸放入100 mL烧杯,加入50 mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解加热前有大量晶体存在,加热后,晶体 ,溶液变 Ⅲ使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶有 Ⅳ待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量得到
问题2-1:重结晶法提纯苯甲酸的原理是什么 有哪些主要操作步骤 问题2-2:溶解粗苯甲酸时加热的作用是什么 趁热过滤的目的是什么 问题2-3:实验操作中多次使用了玻璃棒,分别起到了哪些作用 问题2-4:如何检验提纯后的苯甲酸中氯化钠已被除净 问题2-5:在重结晶过程中进行趁热过滤后,要用少量热溶剂冲洗几遍,其目的是什么 问题2-6:在晶体析出后,分离晶体和滤液时,要用少量的冷溶剂洗涤晶体,其洗涤的目的是什么 为什么要用冷溶剂 问题2-7:温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好 重结晶实验:
主题 学习探究过程 提升素养
总结 分离、提纯 的方法目的主要仪器实例分液分离硝基苯与水蒸馏分离乙醛与乙醇渗析除去淀粉中的氯化钠、葡萄糖盐析分离硬脂酸钠和甘油洗气除去甲烷中的乙烯过滤分离硬脂酸与氯化钠
课后专练
1.下列分离或除杂方法不正确的是( )
A.可用饱和碳酸钠溶液通过分液的方法除去乙酸乙酯中的乙酸
B.可用蒸馏的方法分离工业乙醇
C.用催化加氢的方法可除去乙烷中混有的少量乙烯
D.利用重结晶的方法可提纯粗苯甲酸
2.以下关于萃取、分液操作的叙述中,正确的是( )
A.把混合液体转移至分液漏斗,塞上玻璃塞,如图所示用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经过几次振荡并放气后,手持分液漏斗静置待液体分层
D.分液时,需先将上口玻璃塞打开或使玻璃塞上的凹槽对准漏斗口上的小孔,再打开活塞
3.下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 目的 分离方法 原理
A 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去KNO3固体中混有的NaCl 重结晶 NaCl在水中的溶解度很大
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
4.工业上常用水蒸气蒸馏的方法(蒸馏装置如图)从柠檬、橙子和柚子等水果的果皮中提取精油(香料),90%以上是柠檬烯。
提取柠檬烯的实验操作步骤如下:
(1)将1~2个橙子皮剪成细碎的碎片,投入乙装置中,加入约30 mL水;
(2)松开活塞K,加热水蒸气发生器至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧,打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。
下列说法不正确的是( )
A.当馏出液无明显油珠,澄清透明时,说明蒸馏完成
B.蒸馏结束后,为防止倒吸,立即停止加热
C.长玻璃管做安全管,能平衡气压,防止由于导管堵塞引起爆炸
D.要得到纯精油,还需要用到以下分离提纯方法:萃取、分液、蒸馏
5.已知和的一些物理性质如表所示:
物质 熔点/℃ 沸点/℃ 密度/ (g·cm-3) 水溶性
-10 212 1.162 2 不溶
54 238 1.158 1 不溶
(1)分离这两种物质的混合物可采用的方法是 (填字母)。
a.过滤 b.分液 c.蒸发 d.蒸馏
(2)该实验需要用到的主要玻璃仪器是 、 、 、 、 、牛角管。
6.选择下列实验方法分离提纯物质,分离提纯方法的字母填在横线上。
A.萃取分液 B.升华 C.重结晶 D.分液 E.蒸馏 F.过滤 G.洗气
(1) 分离食盐水与沙子的混合物。
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
(3) 分离水和汽油的混合物。
(4) 分离CCl4(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。
(5) 除去混在乙烷中的乙烯。
(6) 提取碘水中的碘。
参考答案
课堂探究
【自主预习】
1.实验式 分子式 分子结构
2.物理性质 蒸馏 萃取 重结晶
3.(1)
适用条件 有机化合物①热稳定性较高;有机化合物与杂质的②沸点相差较大
注意事项 蒸馏烧瓶中加碎瓷片的目的是③受热均匀,防止暴沸;温度计水银球应处于④蒸馏烧瓶支管口处;冷却水的流动方向是⑤下口进入,上口流出
(2)1)固-液萃取、液-液萃取
2)溶解度不同
4)[物质分离、提纯的思维模型]答案略
下口 上口
[温度计和冷凝管在使用时需要注意]答案略
[萃取剂的选择条件]①互不相溶 ②远大于 ③不发生反应
[能从水溶液中萃取的有哪些]答案略
(3)
适用 范围 提纯固体有机化合物常用的方法
原理 利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去
选择溶 剂的条件 杂质在此溶剂中溶解度很小或很大,易于除去; 被提纯的有机化合物在此溶剂中的溶解度受温度的影响较大,能够进行冷却结晶
实验仪 器及操 作步骤
【一、课堂探究——分离、提纯】
问题1-1:最好将混合物“预处理”,先将其中的一种物质转化为不挥发的盐类化合物,再进行蒸馏。比如乙醇中混有乙酸,可先加生石灰,将乙酸转化为乙酸钙再蒸馏。
问题1-2:固-液萃取。
问题1-3:蒸馏。两者均属于醇类,相互混溶。从表中数据可知两者的沸点相差较大,故可用蒸馏法将其分离。
[物质提纯遵循的原则]答案略
【二、课堂实验——苯甲酸的提纯】
实验步骤 实验现象
Ⅰ 观察粗苯甲酸样品(含少量氯化钠和泥沙)的状态 土黄色固体
Ⅱ 将1.0 g粗苯甲酸放入100 mL 烧杯,加入50 mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解 加热前有大量晶体存在,加热后,晶体溶解,溶液变浑浊
Ⅲ 使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶 有大量无色晶体析出
Ⅳ 待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量 得到无色晶体
问题2-1:原理是苯甲酸在水中的溶解度随温度变化较大,通过重结晶可以使它与杂质分离。重结晶法的一般步骤:加热溶解→趁热过滤→冷却结晶→过滤、洗涤→干燥→称重。
问题2-2:加热可促进苯甲酸的溶解。趁热过滤可避免苯甲酸提前结晶析出。
问题2-3:玻璃棒的作用是①溶解时搅拌,加快溶解速度;②过滤、洗涤时引流;③干燥时用于转移晶体。
问题2-4:用适量蒸馏水洗涤过滤器中的苯甲酸晶体,取一烧杯收集最后一次洗涤后的滤液,滴加几滴硝酸银溶液,观察是否有沉淀产生。若无,则氯化钠被除尽。
问题2-5:洗涤不溶性固体表面的可溶性有机物。
问题2-6:洗涤除去晶体表面附着的可溶性杂质;用冷溶剂洗涤可降低洗涤过程中晶体的损耗。
问题2-7:温度过低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯苯甲酸的目的;温度极低时,溶剂(水)也会结晶,给实验操作带来麻烦。
[重结晶实验]答案略
【总结】答案略
核心素养专练
1.C 解析:乙酸能与碳酸钠反应,乙酸乙酯不溶且不与碳酸钠反应,可用饱和碳酸钠溶液通过分液的方法除去乙酸乙酯中的乙酸,故A正确;蒸馏常用于分离沸点不同的液体混合物,故B正确;乙烯与氢气反应时H2的量无法控制,因此用催化加氢的方法除去乙烷中混有的少量乙烯,会引入新的杂质,故C错误;利用溶质在溶剂中溶解度受温度影响不同,用重结晶的方法可提纯物质,苯甲酸溶于水且溶解度随温度的变化影响较大,因此利用重结晶的方法可得到较纯的苯甲酸,故D正确。
2.D 解析:为使液体混合均匀,两手分别顶住玻璃塞和活塞,使分液漏斗倒转过来,振荡,A错误;振荡几次后打开活塞放气,不需打开分液漏斗上口的玻璃塞放气,B错误;液体混合均匀后将分液漏斗放在铁架台上静置待液体分层,C错误;分液时,将分液漏斗上口玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,打开活塞,待下层液体完全流尽时,关闭活塞后再从上口倒出上层液体,D正确。
3.D 解析:乙醇与水互溶,不能做萃取剂,A错误;乙酸乙酯与乙醇互溶,不能用分液的方法分离,B错误;除去硝酸钾中的氯化钠可用重结晶的方法,是由于氯化钠在水中的溶解度受温度变化的影响较小,C错误;乙醚和丁醇互溶,但沸点相差较大,可用蒸馏的方法进行分离,D正确。
4.B 解析:柠檬烯不溶于水,密度比水小,因此当馏出液无明显油珠,澄清透明时,说明蒸馏完成,A正确;蒸馏结束后,先把乙中的导气管从溶液中移出,再停止加热,B错误;长玻璃管与大气相通,能够平衡气压,防止导管堵塞引起爆炸,C正确;得到的精油中含有其他成分,要得到纯的柠檬烯,要进行萃取、分液、蒸馏操作才能实现目的,D正确。
5.答案:(1)d (2)酒精灯 蒸馏烧瓶 温度计 冷凝管 锥形瓶
解析:由于这两种有机物不溶于水,所以不能利用溶解度的差异性来分离,而二者互溶且沸点相差较大,所以采用蒸馏的方法分离。
6.答案:(1)F (2)CF (3)D (4)E (5)G (6)A
解析:沙子不溶于食盐水,采用过滤的方法即可分离;硝酸钾在水中的溶解度随温度升高明显增大,而NaCl在水中的溶解度受温度影响不大,采用重结晶法和过滤可将其分离;水和汽油互不相溶,分层,可用分液法进行分离;CCl4和甲苯两种互溶的液体,沸点相差较大,可用蒸馏法分离;乙烯中含碳碳双键,可被溴水吸收,可用洗气的方法除去;碘在有机溶剂中溶解度大,可用萃取分液方法提取。
第1课时 分离、提纯 学案设计
学习目标
1.了解有机化合物分离、提纯的原理和操作,能结合实际情况应用蒸馏、萃取或重结晶的方法进行有机化合物的分离和提纯。
2.通过重结晶法提纯苯甲酸的实验探究,感受科学研究的方法。
3.认识科学探究过程的步骤,形成科学探究与创新意识的学科素养。
学习重难点
重结晶法提纯苯甲酸的实验探究。
课堂探究
主题 学习探究过程 提升素养
自主预习 1.研究有机化合物的一般步骤 分离、提纯→确定 →确定 →确定 2.有机化合物的分离与提纯 提纯含杂质的有机化合物的基本方法是利用有机化合物与杂质 的差异将它们分离。在有机化学中常用的分离和提纯方法有 、 和 等。 3.常用方法 (1)蒸馏 蒸馏原理在一定温度和压强下,加热液态混合物,利用物质沸点差异进行物质分离的方法。该方法使沸点低的物质汽化,然后冷凝、收集,从而达到与沸点高的物质相分离的目的适用条件有机化合物① 较高;有机化合物与杂质的②相差较大 蒸馏装置注意事项蒸馏烧瓶中加碎瓷片的目的是③ ;温度计水银球应处于④ ;冷却水的流动方向是⑤ 。
(2)萃取 1)分类: 。 2)液-液萃取原理:利用待分离组分在两种互不相溶的溶剂中的 ,将其从一种溶剂转移到另一种溶剂的过程。 3)萃取装置 4)注意事项 加入萃取剂后充分振荡,静置分层后,打开分液漏斗玻璃塞和活塞,下层液体从 流出,并及时关闭活塞,上层液体从 倒出。 物质分离、提纯的思维模型: 温度计和冷凝管在使用时需要注意: 萃取剂的选择条件 ①萃取剂与原溶剂 ; ②溶质在萃取剂中的溶解度 在原溶剂中的溶解度; ③萃取剂与原溶液中的成分 。 能从水溶液中萃取的有哪些
主题 学习探究过程 提升素养
自主预习 (3)重结晶 适用范围提纯 有机化合物常用的方法 原理利用被提纯物质与杂质在同一溶剂中的 不同而将杂质除去 选择溶剂 的条件杂质在此溶剂中溶解度 ,易于除去; 被提纯的有机化合物在此溶剂中的溶解度受温度的影响 ,能够进行 实验仪 器及操 作步骤
一、课堂探 究——分 离、提纯 问题1-1:当互溶的两种液态有机化合物中各组分的沸点相差较小时如何处理 以乙醇中混有乙酸为例。 问题1-2:玫瑰精油是世界上最昂贵的精油,被称为“精油之后”。玫瑰精油的提取起源于古代,最初用水浸渍鲜花,以提取其中的有效成分。用水浸渍鲜花,提取有效成分的方法在化学中属于什么操作方法 问题1-3:乙二醇和丙三醇都可以作为汽车和飞机燃料的防冻剂。现有一瓶乙二醇和丙三醇的混合液,已知它们的性质如下表: 物质熔点/℃沸点/℃溶解性乙二醇-11.5198易溶于水和乙醇丙三醇17.9290与水和乙醇 任意比互溶
分离乙二醇和丙三醇的最佳方法是什么 物质提纯遵循的原则:
主题 学习探究过程 提升素养
二、课堂实 验——苯 甲酸的提纯 【思考】完成表格: 实验步骤实验现象Ⅰ观察粗苯甲酸样品(含少量氯化钠和泥沙)的状态 Ⅱ将1.0 g粗苯甲酸放入100 mL烧杯,加入50 mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解加热前有大量晶体存在,加热后,晶体 ,溶液变 Ⅲ使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶有 Ⅳ待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量得到
问题2-1:重结晶法提纯苯甲酸的原理是什么 有哪些主要操作步骤 问题2-2:溶解粗苯甲酸时加热的作用是什么 趁热过滤的目的是什么 问题2-3:实验操作中多次使用了玻璃棒,分别起到了哪些作用 问题2-4:如何检验提纯后的苯甲酸中氯化钠已被除净 问题2-5:在重结晶过程中进行趁热过滤后,要用少量热溶剂冲洗几遍,其目的是什么 问题2-6:在晶体析出后,分离晶体和滤液时,要用少量的冷溶剂洗涤晶体,其洗涤的目的是什么 为什么要用冷溶剂 问题2-7:温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好 重结晶实验:
主题 学习探究过程 提升素养
总结 分离、提纯 的方法目的主要仪器实例分液分离硝基苯与水蒸馏分离乙醛与乙醇渗析除去淀粉中的氯化钠、葡萄糖盐析分离硬脂酸钠和甘油洗气除去甲烷中的乙烯过滤分离硬脂酸与氯化钠
课后专练
1.下列分离或除杂方法不正确的是( )
A.可用饱和碳酸钠溶液通过分液的方法除去乙酸乙酯中的乙酸
B.可用蒸馏的方法分离工业乙醇
C.用催化加氢的方法可除去乙烷中混有的少量乙烯
D.利用重结晶的方法可提纯粗苯甲酸
2.以下关于萃取、分液操作的叙述中,正确的是( )
A.把混合液体转移至分液漏斗,塞上玻璃塞,如图所示用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经过几次振荡并放气后,手持分液漏斗静置待液体分层
D.分液时,需先将上口玻璃塞打开或使玻璃塞上的凹槽对准漏斗口上的小孔,再打开活塞
3.下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 目的 分离方法 原理
A 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去KNO3固体中混有的NaCl 重结晶 NaCl在水中的溶解度很大
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
4.工业上常用水蒸气蒸馏的方法(蒸馏装置如图)从柠檬、橙子和柚子等水果的果皮中提取精油(香料),90%以上是柠檬烯。
提取柠檬烯的实验操作步骤如下:
(1)将1~2个橙子皮剪成细碎的碎片,投入乙装置中,加入约30 mL水;
(2)松开活塞K,加热水蒸气发生器至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧,打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。
下列说法不正确的是( )
A.当馏出液无明显油珠,澄清透明时,说明蒸馏完成
B.蒸馏结束后,为防止倒吸,立即停止加热
C.长玻璃管做安全管,能平衡气压,防止由于导管堵塞引起爆炸
D.要得到纯精油,还需要用到以下分离提纯方法:萃取、分液、蒸馏
5.已知和的一些物理性质如表所示:
物质 熔点/℃ 沸点/℃ 密度/ (g·cm-3) 水溶性
-10 212 1.162 2 不溶
54 238 1.158 1 不溶
(1)分离这两种物质的混合物可采用的方法是 (填字母)。
a.过滤 b.分液 c.蒸发 d.蒸馏
(2)该实验需要用到的主要玻璃仪器是 、 、 、 、 、牛角管。
6.选择下列实验方法分离提纯物质,分离提纯方法的字母填在横线上。
A.萃取分液 B.升华 C.重结晶 D.分液 E.蒸馏 F.过滤 G.洗气
(1) 分离食盐水与沙子的混合物。
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
(3) 分离水和汽油的混合物。
(4) 分离CCl4(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。
(5) 除去混在乙烷中的乙烯。
(6) 提取碘水中的碘。
参考答案
课堂探究
【自主预习】
1.实验式 分子式 分子结构
2.物理性质 蒸馏 萃取 重结晶
3.(1)
适用条件 有机化合物①热稳定性较高;有机化合物与杂质的②沸点相差较大
注意事项 蒸馏烧瓶中加碎瓷片的目的是③受热均匀,防止暴沸;温度计水银球应处于④蒸馏烧瓶支管口处;冷却水的流动方向是⑤下口进入,上口流出
(2)1)固-液萃取、液-液萃取
2)溶解度不同
4)[物质分离、提纯的思维模型]答案略
下口 上口
[温度计和冷凝管在使用时需要注意]答案略
[萃取剂的选择条件]①互不相溶 ②远大于 ③不发生反应
[能从水溶液中萃取的有哪些]答案略
(3)
适用 范围 提纯固体有机化合物常用的方法
原理 利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去
选择溶 剂的条件 杂质在此溶剂中溶解度很小或很大,易于除去; 被提纯的有机化合物在此溶剂中的溶解度受温度的影响较大,能够进行冷却结晶
实验仪 器及操 作步骤
【一、课堂探究——分离、提纯】
问题1-1:最好将混合物“预处理”,先将其中的一种物质转化为不挥发的盐类化合物,再进行蒸馏。比如乙醇中混有乙酸,可先加生石灰,将乙酸转化为乙酸钙再蒸馏。
问题1-2:固-液萃取。
问题1-3:蒸馏。两者均属于醇类,相互混溶。从表中数据可知两者的沸点相差较大,故可用蒸馏法将其分离。
[物质提纯遵循的原则]答案略
【二、课堂实验——苯甲酸的提纯】
实验步骤 实验现象
Ⅰ 观察粗苯甲酸样品(含少量氯化钠和泥沙)的状态 土黄色固体
Ⅱ 将1.0 g粗苯甲酸放入100 mL 烧杯,加入50 mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解 加热前有大量晶体存在,加热后,晶体溶解,溶液变浑浊
Ⅲ 使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶 有大量无色晶体析出
Ⅳ 待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量 得到无色晶体
问题2-1:原理是苯甲酸在水中的溶解度随温度变化较大,通过重结晶可以使它与杂质分离。重结晶法的一般步骤:加热溶解→趁热过滤→冷却结晶→过滤、洗涤→干燥→称重。
问题2-2:加热可促进苯甲酸的溶解。趁热过滤可避免苯甲酸提前结晶析出。
问题2-3:玻璃棒的作用是①溶解时搅拌,加快溶解速度;②过滤、洗涤时引流;③干燥时用于转移晶体。
问题2-4:用适量蒸馏水洗涤过滤器中的苯甲酸晶体,取一烧杯收集最后一次洗涤后的滤液,滴加几滴硝酸银溶液,观察是否有沉淀产生。若无,则氯化钠被除尽。
问题2-5:洗涤不溶性固体表面的可溶性有机物。
问题2-6:洗涤除去晶体表面附着的可溶性杂质;用冷溶剂洗涤可降低洗涤过程中晶体的损耗。
问题2-7:温度过低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯苯甲酸的目的;温度极低时,溶剂(水)也会结晶,给实验操作带来麻烦。
[重结晶实验]答案略
【总结】答案略
核心素养专练
1.C 解析:乙酸能与碳酸钠反应,乙酸乙酯不溶且不与碳酸钠反应,可用饱和碳酸钠溶液通过分液的方法除去乙酸乙酯中的乙酸,故A正确;蒸馏常用于分离沸点不同的液体混合物,故B正确;乙烯与氢气反应时H2的量无法控制,因此用催化加氢的方法除去乙烷中混有的少量乙烯,会引入新的杂质,故C错误;利用溶质在溶剂中溶解度受温度影响不同,用重结晶的方法可提纯物质,苯甲酸溶于水且溶解度随温度的变化影响较大,因此利用重结晶的方法可得到较纯的苯甲酸,故D正确。
2.D 解析:为使液体混合均匀,两手分别顶住玻璃塞和活塞,使分液漏斗倒转过来,振荡,A错误;振荡几次后打开活塞放气,不需打开分液漏斗上口的玻璃塞放气,B错误;液体混合均匀后将分液漏斗放在铁架台上静置待液体分层,C错误;分液时,将分液漏斗上口玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,打开活塞,待下层液体完全流尽时,关闭活塞后再从上口倒出上层液体,D正确。
3.D 解析:乙醇与水互溶,不能做萃取剂,A错误;乙酸乙酯与乙醇互溶,不能用分液的方法分离,B错误;除去硝酸钾中的氯化钠可用重结晶的方法,是由于氯化钠在水中的溶解度受温度变化的影响较小,C错误;乙醚和丁醇互溶,但沸点相差较大,可用蒸馏的方法进行分离,D正确。
4.B 解析:柠檬烯不溶于水,密度比水小,因此当馏出液无明显油珠,澄清透明时,说明蒸馏完成,A正确;蒸馏结束后,先把乙中的导气管从溶液中移出,再停止加热,B错误;长玻璃管与大气相通,能够平衡气压,防止导管堵塞引起爆炸,C正确;得到的精油中含有其他成分,要得到纯的柠檬烯,要进行萃取、分液、蒸馏操作才能实现目的,D正确。
5.答案:(1)d (2)酒精灯 蒸馏烧瓶 温度计 冷凝管 锥形瓶
解析:由于这两种有机物不溶于水,所以不能利用溶解度的差异性来分离,而二者互溶且沸点相差较大,所以采用蒸馏的方法分离。
6.答案:(1)F (2)CF (3)D (4)E (5)G (6)A
解析:沙子不溶于食盐水,采用过滤的方法即可分离;硝酸钾在水中的溶解度随温度升高明显增大,而NaCl在水中的溶解度受温度影响不大,采用重结晶法和过滤可将其分离;水和汽油互不相溶,分层,可用分液法进行分离;CCl4和甲苯两种互溶的液体,沸点相差较大,可用蒸馏法分离;乙烯中含碳碳双键,可被溴水吸收,可用洗气的方法除去;碘在有机溶剂中溶解度大,可用萃取分液方法提取。
