2025届高三化学二轮复习 选择题提速练(六)(含解析)
文档属性
| 名称 | 2025届高三化学二轮复习 选择题提速练(六)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-12 12:27:59 | ||
图片预览


文档简介
选择题提速练(六)
(分值:42分)
单项选择题(本题包括14小题,每题3分,共42分,每小题只有一个选项符合题意)
1.化学与人类健康生活及环境保护息息相关。下列叙述正确的是 ( )
食品加工时不可添加任何防腐剂
温室气体是形成酸雨的主要物质
大量使用含磷洗涤剂会造成水体污染
小苏打常用作烘焙面包,它的主要成分是Na2CO3
2.下列物质应用错误的是 ( )
KMnO4溶液用作水果的保鲜剂
苯甲酸及其钠盐用作食品防腐剂
ClO2用作生活用水的消毒剂
用热NaOH溶液洗去铁表面沾有的柴油
3.NA是阿伏加德罗常数的值。下列说法错误的是 ( )
标准状况下,22.4 L氧气所含的质子数为16NA
1 mol SiO2晶体中含有的共价键数目为2NA
向100 mL 0.10 mol·L-1 FeCl3溶液中加入足量Cu粉充分反应,转移电子数目为0.01NA
1 L 1 mol·L-1溴化铵溶液中N与H+离子数之和大于NA
4.硅及其化合物广泛应用于光电材料领域,其中SiCl4与N 甲基咪唑()反应可以得到M2+,其结构如图所示。下列叙述错误的是 ( )
SiCl4的空间构型为正四面体
1个M2+中含有42个σ键
H、C、N的电负性由大到小的顺序为N>C>H
N 甲基咪唑分子中碳原子的杂化轨道类型为sp2、sp3
5.下列处理方法对应的反应方程式一定错误的是 ( )
利用沉淀剂NaHS除去废水中的Hg2+:S2-+Hg2+===HgS↓
加碘食盐中碘元素的检验:+5I-+6H+===3I2+3H2O
用生物质热解气CO将SO2还原为S:SO2+2COS+2CO2
用双氧水擦拭变黑的白色油画:PbS+4H2O2===PbSO4+4H2O
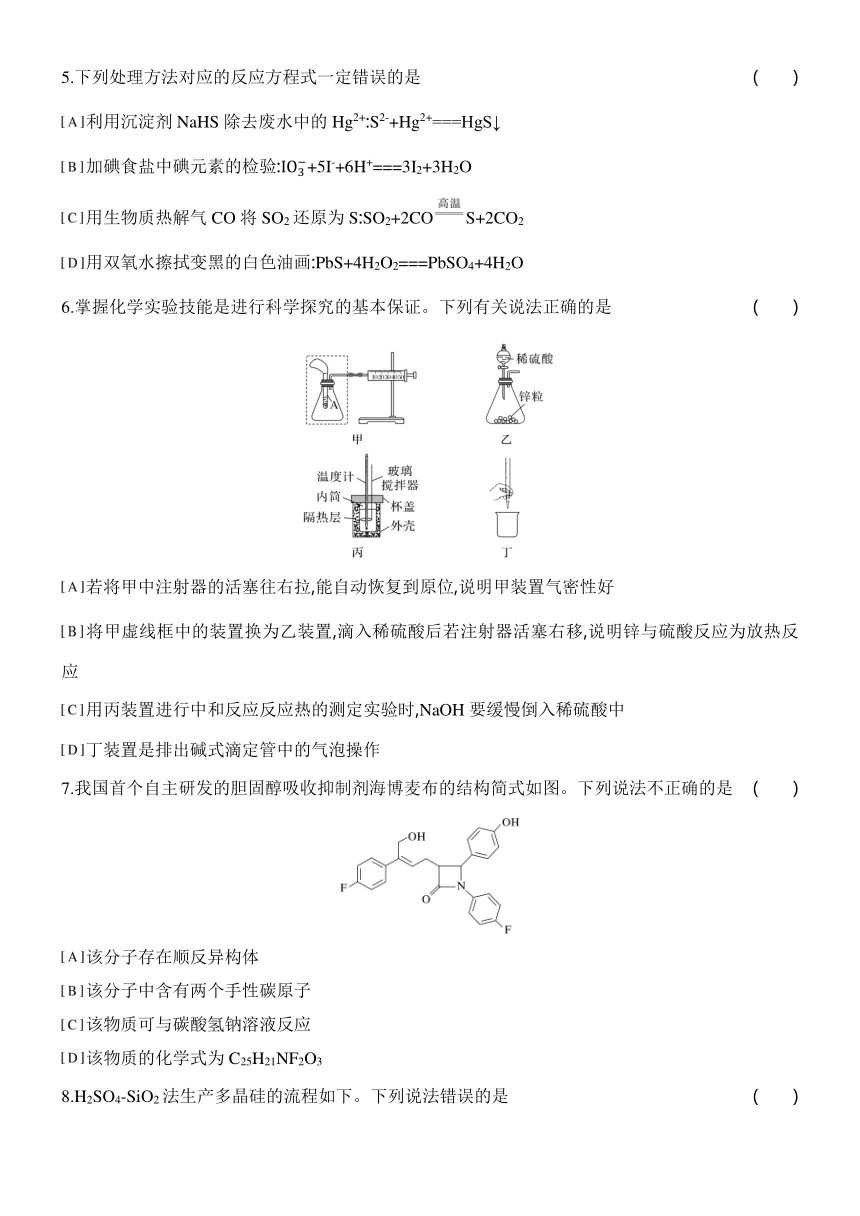
6.掌握化学实验技能是进行科学探究的基本保证。下列有关说法正确的是 ( )
若将甲中注射器的活塞往右拉,能自动恢复到原位,说明甲装置气密性好
将甲虚线框中的装置换为乙装置,滴入稀硫酸后若注射器活塞右移,说明锌与硫酸反应为放热反应
用丙装置进行中和反应反应热的测定实验时,NaOH要缓慢倒入稀硫酸中
丁装置是排出碱式滴定管中的气泡操作
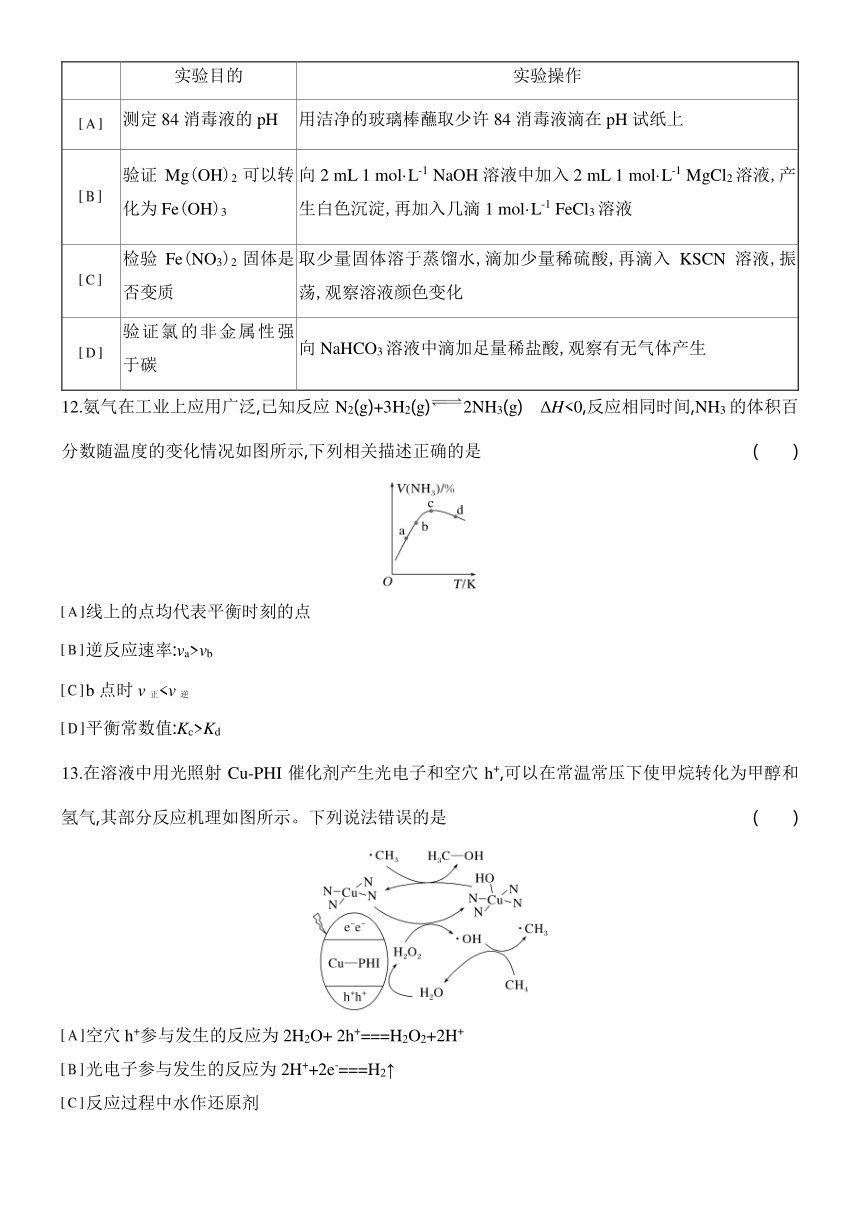
7.我国首个自主研发的胆固醇吸收抑制剂海博麦布的结构简式如图。下列说法不正确的是 ( )
该分子存在顺反异构体
该分子中含有两个手性碳原子
该物质可与碳酸氢钠溶液反应
该物质的化学式为C25H21NF2O3
8.H2SO4-SiO2法生产多晶硅的流程如下。下列说法错误的是 ( )
合成1反应中H2作氧化剂
合成2的反应为SiF4+NaAlH4===SiH4+NaAlF4
上述流程说明SiO2可溶于H2SO4
净化、热解中生成的多晶硅为还原产物
9.X、Y、Z、M为原子序数依次增大的短周期主族元素,X基态原子L层中p轨道电子数是s轨道电子数的2倍,Y是同周期元素中最活泼的金属元素,Z和X形成的一种化合物溶于水会形成酸雨。R是一种过渡元素,其基态原子4s和3d轨道均半充满。下列说法正确的是 ( )
离子半径X>Y>M
Y、Z、M的第一电离能和电负性的大小顺序不一致
Z的氢化物的沸点低于与其组成相似的X的氢化物的沸点,是因为范德华力较小
酸性条件下,R的橙色最高价含氧酸钾盐与X的一种氢化物按物质的量1∶3反应,R被还原为+3价
10.(2024·威海二模)硝酸盐电化学合成氨具有条件温和、能源清洁等优势。图1为电解KNO3溶液合成氨的装置示意图;双极膜(BPM)由离子交换膜AEL、CEL和中间层IL复合而成,装置工作时其内部结构如图2所示。下列说法错误的是 ( )
a接电源负极,发生还原反应
装置工作时,OH-通过AEL进入阳极区,阳极区溶液pH逐渐增大
总反应为KNO3+2H2ONH3↑+2O2↑+KOH
每生成17 g NH3,各有8 mol H+和OH-通过离子交换膜
11.下列操作能达到相应实验目的的是 ( )
实验目的 实验操作
测定84消毒液的pH 用洁净的玻璃棒蘸取少许84消毒液滴在pH试纸上
验证Mg(OH)2可以转化为Fe(OH)3 向2 mL 1 mol·L-1 NaOH溶液中加入2 mL 1 mol·L-1 MgCl2溶液,产生白色沉淀,再加入几滴1 mol·L-1 FeCl3溶液
检验Fe(NO3)2固体是否变质 取少量固体溶于蒸馏水,滴加少量稀硫酸,再滴入KSCN溶液,振荡,观察溶液颜色变化
验证氯的非金属性强于碳 向NaHCO3溶液中滴加足量稀盐酸,观察有无气体产生
12.氨气在工业上应用广泛,已知反应N2(g)+3H2(g)2NH3(g) ΔH<0,反应相同时间,NH3的体积百分数随温度的变化情况如图所示,下列相关描述正确的是 ( )
线上的点均代表平衡时刻的点
逆反应速率:va>vb
b点时v正平衡常数值:Kc>Kd
13.在溶液中用光照射Cu-PHI催化剂产生光电子和空穴h+,可以在常温常压下使甲烷转化为甲醇和氢气,其部分反应机理如图所示。下列说法错误的是 ( )
空穴h+参与发生的反应为2H2O+ 2h+===H2O2+2H+
光电子参与发生的反应为2H++2e-===H2↑
反应过程中水作还原剂
该反应的化学方程式为CH4+H2O CH3OH+H2
14.(2024·泰安二模)常温下,MX(白色)与M2Y(砖红色)两种难溶性盐(M均为+1价)的饱和溶液中离子浓度的关系如图所示。下列说法正确的是 ( )
L2表示M2Y的饱和溶液中离子浓度的关系
MX 和M2Y 的混合悬浊液中一定存在c(X-)>c(Y2-)
Na2Y 可作MNO3标准溶液测定溶液中X 物质的量浓度的指示剂
向含MX、M2Y悬浊液的a点体系中加水稀释后,X-、Y2-的浓度仍相等
选择题提速练(六)
1.C [A.只要按规定合理添加防腐剂,可以提高食物保存时间,因此食品加工可以添加防腐剂,但要注意在要求范围之内,故A错误;B.酸雨主要是二氧化硫、氮的氧化物引起,与温室气体无关,故B错误;C.磷是植物生长的需要的一种重要元素,含磷洗涤剂排入水中,会造成水体富营养化,造成赤潮或水华,故C正确;D.小苏打受热容易分解产生CO2气体,面包师是用小苏打发泡剂烘焙面包,其主要成分是NaHCO3,故D错误。]
2.D [A.酸性KMnO4能和乙烯发生氧化还原反应,可做水果的保鲜剂,A正确;B.苯甲酸及其钠盐作为一种食品添加剂,具有抑菌防腐作用,B正确;C.ClO2是净化饮用水的一种十分有效的净水剂,其中包括良好的除臭与脱色能力、低浓度下高效杀菌和杀病毒能力,C正确;D.柴油主要由烷烃、烯烃等组成,不与氢氧化钠互溶,也不反应,无法用NaOH溶液洗去,D错误。]
3.B [A.标准状况下,22.4 L氧气为1 mol,1个氧原子有8个质子,因此,1 mol O2所含质子数为16NA个,A正确;B.在SiO2晶体中,1个Si原子周围有4个以共价单键相连的O原子,1个O原子周围有2个以共价单键相连的Si原子,所以1个“SiO2”中平均含4个Si—O键,1 mol SiO2晶体中Si—O键数为4NA,B错误;C.100 mL 0.10 mol·L-1的FeCl3的物质的量为n(FeCl3)=c·V=0.1 L×0.10 mol·L-1=0.01 mol,FeCl3和Cu反应的离子方程式为2Fe3++Cu===2Fe2++Cu2+,FeCl3~e-,则0.01 mol FeCl3转移的电子数目为0.01NA,C项正确;D.1 L 1 mol·L-1溴化铵溶液中,由电荷守恒:c(N)+c(H+)=c(OH-)+c(Br-),c(Br-)=1 mol·L-1,故c(N)+c(H+)>1 mol·L-1,故N与H+离子数之和大于NA,D项正确。]
4.B [A.SiCl4分子中Si形成4个σ键,且不存在孤电子对,其结构与甲烷相似,空间构型是正四面体,A正确;B.共价单键为σ键、共价双键中含有1个σ键、1个π键,配位键为σ键,则中含有12个σ键,所以1个中含有12×4+6=54个σ键,B错误;C.根据同一周期从左往右元素的电负性依次增强,同一主族从上往下依次减弱,故H、C、N的电负性由大到小的顺序为N>C>H,C正确;D.由题干信息可知,N 甲基咪唑分子中存在甲基和碳碳双键,故碳原子的杂化轨道类型为sp2、sp3,D正确。]
5.A [A.NaHS溶液中含硫微粒主要以HS-存在,所以方程式中写法错误,故A错误;B.加碘食盐中的碘元素以 KIO3的形式存在,检验方法是将少量碘盐与淀粉 KI溶液及酸混合,若溶液变成蓝色,即证明食盐中含有碘元素,离子方程式为+5I-+6H+===3I2+3H2O,故B正确;C.CO将SO2还原为S,方程式为SO2+2COS+2CO2,故C正确;D.久置的油画,白色部分(PbSO4)常会变黑(PbS),用双氧水擦后又恢复原貌,方程式为PbS+4H2O2===PbSO4+4H2O,故D正确。]
6.A [A.若将甲中注射器的活塞往右拉,能自动恢复到原位,说明没有空气进入装置内,则甲装置气密性好,故A正确;B.将甲虚线框中的装置换为乙装置,锌与硫酸反应放出氢气,注射器活塞右移,不能说明锌与硫酸反应为放热反应,故B错误;C.用丙装置进行中和反应反应热的测定实验时,为防止热量过多散失,NaOH要快速倒入稀硫酸中,故C错误;D.排出碱式滴定管中的气泡,应将胶管向上弯曲,用力捏挤玻璃珠使溶液从尖嘴喷出,故D错误。]
7.C [A.分子中碳碳双键的每个不饱和碳原子均连接2个不同的原子或原子团,存在顺反异构,故A正确;B.四元环上的2个碳原子连接4个不同的原子,是手性碳原子,则分子中存在2个手性碳原子,故B正确;C.该分子中不含羧基,不能与碳酸氢钠溶液反应,故C错误;D.根据结构简式可知,该物质的化学式为C25H21NF2O3,故D正确。]
8.C [合成1中发生Na+Al+2H2===NaAlH4,合成2中发生NaAlH4+SiF4===SiH4+NaAlF4,合成3制备四氟化硅,净化、热解SiH4步骤中四氢化硅分解为晶体硅和氢气;A.合成1中发生Na+Al+2H2===NaAlH4,H由0价转化成-1价,化合价降低,氢气作氧化剂,故A说法正确;B.根据上述分析,合成2中发生NaAlH4+SiF4===SiH4+NaAlF4,故B说法正确;C.合成3中NaAlF4与硫酸反应生成HF,HF与二氧化硅反应生成SiF4,因此题中不能说明二氧化硅溶于硫酸,故C说法错误;D.四氢化硅分解为晶体硅和氢气,根据电负性分析,氢的电负性强于硅,硅元素显+4价,化合价降低,因此晶体硅为还原产物,故D说法正确。]
9.D [X基态原子价电子排布为2s22p4,X为O。Z和X形成的一种化合物溶于水会形成酸雨,且原子序数比X大,Z为S。Y为同周期最活泼的金属为Na。M为短周期主族元素,且其序数大于Z则M为Cl。R是一种过渡元素,其基态原子4s和3d轨道均半充满即[Ar]3d54s1,R为Cr。A.离子半径:电子层越多半径越大,同电子层核电荷数越多半径越小,Cl->O2->Na+,A项错误;B.同周期元素的电负性和第一电离能从左往右增大:Na10.B [电解KNO3溶液合成氨,NH3在a电极由硝酸根离子得电子生成,故a为阴极,连接电源负极,发生还原反应,A正确;阳极生成O2,电极反应为4OH--4e-===2H2O+O2↑,由图2,OH-进入阳极区,但是被电极反应消耗,阳极区溶液pH不变,B错误;电解KNO3溶液得NH3和O2,选项所给总反应方程式正确,C正确;由总反应,每生成17 g NH3,即生成1 mol NH3,生成2 mol O2,根据阳极电极反应,消耗8 mol OH-,由溶液电中性,有8 mol H+进入阴极区,即各有8 mol H+和OH-通过离子交换膜,D正确。]
11.B [A.84消毒液的有效成分是次氯酸钠,具有漂白性,能使pH试纸褪色,所以不能用pH试纸测定84消毒液的pH值,应该用pH计,故A错误;B.由操作和现象可知,发生沉淀转化,则Mg(OH)2沉淀可以转化为Fe(OH)3沉淀,故B正确;C.加入稀硫酸后,溶液中含有氢离子和硝酸根离子,相当于含有硝酸,硝酸能氧化亚铁离子生成铁离子,所以不能实现实验目的,故C错误;D.盐酸为无氧酸,由碳酸、盐酸的酸性强弱不能比较Cl、C的非金属性强弱,故D错误。]
12.D [由图可知,c点氨气的体积百分数最大,说明反应达到平衡,则c点以前为平衡的建立过程,c点以后为平衡的移动过程。A.由分析可知,c点以前均未达到平衡,故A错误;B.温度越高,反应速率越快,由于a点温度小于b点,且a点c(NH3)低于b点,故a点的逆反应速率比b点的小,故B错误;C.由分析可知,b点反应未达到平衡,正反应速率大于逆反应速率,故C错误;D.该反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,则c点平衡常数大于d点,故D正确。]
13.C [A.根据图中信息,空穴h+与水反应,其参与的反应为2H2O+ 2h+===H2O2+2H+,故A正确;B.氢离子得到光电子提供的电子,则参与发生的反应为2H++2e-===H2↑,故B正确;C.该反应的化学方程式为CH4+H2O CH3OH+H2,水中氢化合价降低,则反应过程中水作氧化剂,故C错误;D.根据图中信息常温常压下使甲烷和水转化为甲醇和氢气,则该反应的化学方程式为CH4+H2O CH3OH+H2,故D正确。]
14.C [由直线斜率可知,L1对应难溶盐的阳离子与阴离子的数目之比为2∶1,则L1表示M2Y的饱和溶液中离子浓度的关系,A项错误;由图可知Ksp(MX)=10-10,Ksp(M2Y)=10-12,c(X-)=,c(Y2-)=,则·c(M+)=10-2c(M+)。当c(M+)=102 mol·L-1时,c(X-)=c(Y2-),当c(M+)<102 mol·L-1时,c(X-)102 mol·L-1时,c(X-)>c(Y2-),故B项错误;若向含等浓度X-、Y2-的混合溶液中加入MNO3时,X-先沉淀,而当Na2Y作指示剂时,c(Y2-)会更小,可达到X-沉淀完全后Y2-再沉淀的效果,可通过生成砖红色沉淀判定滴定终点,C项正确;向含MX、M2Y悬浊液的a点体系中加水稀释后,c(M+)≠10-2mol·L-1,所以X-、Y2-浓度不可能相等,D项错误。]
(分值:42分)
单项选择题(本题包括14小题,每题3分,共42分,每小题只有一个选项符合题意)
1.化学与人类健康生活及环境保护息息相关。下列叙述正确的是 ( )
食品加工时不可添加任何防腐剂
温室气体是形成酸雨的主要物质
大量使用含磷洗涤剂会造成水体污染
小苏打常用作烘焙面包,它的主要成分是Na2CO3
2.下列物质应用错误的是 ( )
KMnO4溶液用作水果的保鲜剂
苯甲酸及其钠盐用作食品防腐剂
ClO2用作生活用水的消毒剂
用热NaOH溶液洗去铁表面沾有的柴油
3.NA是阿伏加德罗常数的值。下列说法错误的是 ( )
标准状况下,22.4 L氧气所含的质子数为16NA
1 mol SiO2晶体中含有的共价键数目为2NA
向100 mL 0.10 mol·L-1 FeCl3溶液中加入足量Cu粉充分反应,转移电子数目为0.01NA
1 L 1 mol·L-1溴化铵溶液中N与H+离子数之和大于NA
4.硅及其化合物广泛应用于光电材料领域,其中SiCl4与N 甲基咪唑()反应可以得到M2+,其结构如图所示。下列叙述错误的是 ( )
SiCl4的空间构型为正四面体
1个M2+中含有42个σ键
H、C、N的电负性由大到小的顺序为N>C>H
N 甲基咪唑分子中碳原子的杂化轨道类型为sp2、sp3
5.下列处理方法对应的反应方程式一定错误的是 ( )
利用沉淀剂NaHS除去废水中的Hg2+:S2-+Hg2+===HgS↓
加碘食盐中碘元素的检验:+5I-+6H+===3I2+3H2O
用生物质热解气CO将SO2还原为S:SO2+2COS+2CO2
用双氧水擦拭变黑的白色油画:PbS+4H2O2===PbSO4+4H2O
6.掌握化学实验技能是进行科学探究的基本保证。下列有关说法正确的是 ( )
若将甲中注射器的活塞往右拉,能自动恢复到原位,说明甲装置气密性好
将甲虚线框中的装置换为乙装置,滴入稀硫酸后若注射器活塞右移,说明锌与硫酸反应为放热反应
用丙装置进行中和反应反应热的测定实验时,NaOH要缓慢倒入稀硫酸中
丁装置是排出碱式滴定管中的气泡操作
7.我国首个自主研发的胆固醇吸收抑制剂海博麦布的结构简式如图。下列说法不正确的是 ( )
该分子存在顺反异构体
该分子中含有两个手性碳原子
该物质可与碳酸氢钠溶液反应
该物质的化学式为C25H21NF2O3
8.H2SO4-SiO2法生产多晶硅的流程如下。下列说法错误的是 ( )
合成1反应中H2作氧化剂
合成2的反应为SiF4+NaAlH4===SiH4+NaAlF4
上述流程说明SiO2可溶于H2SO4
净化、热解中生成的多晶硅为还原产物
9.X、Y、Z、M为原子序数依次增大的短周期主族元素,X基态原子L层中p轨道电子数是s轨道电子数的2倍,Y是同周期元素中最活泼的金属元素,Z和X形成的一种化合物溶于水会形成酸雨。R是一种过渡元素,其基态原子4s和3d轨道均半充满。下列说法正确的是 ( )
离子半径X>Y>M
Y、Z、M的第一电离能和电负性的大小顺序不一致
Z的氢化物的沸点低于与其组成相似的X的氢化物的沸点,是因为范德华力较小
酸性条件下,R的橙色最高价含氧酸钾盐与X的一种氢化物按物质的量1∶3反应,R被还原为+3价
10.(2024·威海二模)硝酸盐电化学合成氨具有条件温和、能源清洁等优势。图1为电解KNO3溶液合成氨的装置示意图;双极膜(BPM)由离子交换膜AEL、CEL和中间层IL复合而成,装置工作时其内部结构如图2所示。下列说法错误的是 ( )
a接电源负极,发生还原反应
装置工作时,OH-通过AEL进入阳极区,阳极区溶液pH逐渐增大
总反应为KNO3+2H2ONH3↑+2O2↑+KOH
每生成17 g NH3,各有8 mol H+和OH-通过离子交换膜
11.下列操作能达到相应实验目的的是 ( )
实验目的 实验操作
测定84消毒液的pH 用洁净的玻璃棒蘸取少许84消毒液滴在pH试纸上
验证Mg(OH)2可以转化为Fe(OH)3 向2 mL 1 mol·L-1 NaOH溶液中加入2 mL 1 mol·L-1 MgCl2溶液,产生白色沉淀,再加入几滴1 mol·L-1 FeCl3溶液
检验Fe(NO3)2固体是否变质 取少量固体溶于蒸馏水,滴加少量稀硫酸,再滴入KSCN溶液,振荡,观察溶液颜色变化
验证氯的非金属性强于碳 向NaHCO3溶液中滴加足量稀盐酸,观察有无气体产生
12.氨气在工业上应用广泛,已知反应N2(g)+3H2(g)2NH3(g) ΔH<0,反应相同时间,NH3的体积百分数随温度的变化情况如图所示,下列相关描述正确的是 ( )
线上的点均代表平衡时刻的点
逆反应速率:va>vb
b点时v正
13.在溶液中用光照射Cu-PHI催化剂产生光电子和空穴h+,可以在常温常压下使甲烷转化为甲醇和氢气,其部分反应机理如图所示。下列说法错误的是 ( )
空穴h+参与发生的反应为2H2O+ 2h+===H2O2+2H+
光电子参与发生的反应为2H++2e-===H2↑
反应过程中水作还原剂
该反应的化学方程式为CH4+H2O CH3OH+H2
14.(2024·泰安二模)常温下,MX(白色)与M2Y(砖红色)两种难溶性盐(M均为+1价)的饱和溶液中离子浓度的关系如图所示。下列说法正确的是 ( )
L2表示M2Y的饱和溶液中离子浓度的关系
MX 和M2Y 的混合悬浊液中一定存在c(X-)>c(Y2-)
Na2Y 可作MNO3标准溶液测定溶液中X 物质的量浓度的指示剂
向含MX、M2Y悬浊液的a点体系中加水稀释后,X-、Y2-的浓度仍相等
选择题提速练(六)
1.C [A.只要按规定合理添加防腐剂,可以提高食物保存时间,因此食品加工可以添加防腐剂,但要注意在要求范围之内,故A错误;B.酸雨主要是二氧化硫、氮的氧化物引起,与温室气体无关,故B错误;C.磷是植物生长的需要的一种重要元素,含磷洗涤剂排入水中,会造成水体富营养化,造成赤潮或水华,故C正确;D.小苏打受热容易分解产生CO2气体,面包师是用小苏打发泡剂烘焙面包,其主要成分是NaHCO3,故D错误。]
2.D [A.酸性KMnO4能和乙烯发生氧化还原反应,可做水果的保鲜剂,A正确;B.苯甲酸及其钠盐作为一种食品添加剂,具有抑菌防腐作用,B正确;C.ClO2是净化饮用水的一种十分有效的净水剂,其中包括良好的除臭与脱色能力、低浓度下高效杀菌和杀病毒能力,C正确;D.柴油主要由烷烃、烯烃等组成,不与氢氧化钠互溶,也不反应,无法用NaOH溶液洗去,D错误。]
3.B [A.标准状况下,22.4 L氧气为1 mol,1个氧原子有8个质子,因此,1 mol O2所含质子数为16NA个,A正确;B.在SiO2晶体中,1个Si原子周围有4个以共价单键相连的O原子,1个O原子周围有2个以共价单键相连的Si原子,所以1个“SiO2”中平均含4个Si—O键,1 mol SiO2晶体中Si—O键数为4NA,B错误;C.100 mL 0.10 mol·L-1的FeCl3的物质的量为n(FeCl3)=c·V=0.1 L×0.10 mol·L-1=0.01 mol,FeCl3和Cu反应的离子方程式为2Fe3++Cu===2Fe2++Cu2+,FeCl3~e-,则0.01 mol FeCl3转移的电子数目为0.01NA,C项正确;D.1 L 1 mol·L-1溴化铵溶液中,由电荷守恒:c(N)+c(H+)=c(OH-)+c(Br-),c(Br-)=1 mol·L-1,故c(N)+c(H+)>1 mol·L-1,故N与H+离子数之和大于NA,D项正确。]
4.B [A.SiCl4分子中Si形成4个σ键,且不存在孤电子对,其结构与甲烷相似,空间构型是正四面体,A正确;B.共价单键为σ键、共价双键中含有1个σ键、1个π键,配位键为σ键,则中含有12个σ键,所以1个中含有12×4+6=54个σ键,B错误;C.根据同一周期从左往右元素的电负性依次增强,同一主族从上往下依次减弱,故H、C、N的电负性由大到小的顺序为N>C>H,C正确;D.由题干信息可知,N 甲基咪唑分子中存在甲基和碳碳双键,故碳原子的杂化轨道类型为sp2、sp3,D正确。]
5.A [A.NaHS溶液中含硫微粒主要以HS-存在,所以方程式中写法错误,故A错误;B.加碘食盐中的碘元素以 KIO3的形式存在,检验方法是将少量碘盐与淀粉 KI溶液及酸混合,若溶液变成蓝色,即证明食盐中含有碘元素,离子方程式为+5I-+6H+===3I2+3H2O,故B正确;C.CO将SO2还原为S,方程式为SO2+2COS+2CO2,故C正确;D.久置的油画,白色部分(PbSO4)常会变黑(PbS),用双氧水擦后又恢复原貌,方程式为PbS+4H2O2===PbSO4+4H2O,故D正确。]
6.A [A.若将甲中注射器的活塞往右拉,能自动恢复到原位,说明没有空气进入装置内,则甲装置气密性好,故A正确;B.将甲虚线框中的装置换为乙装置,锌与硫酸反应放出氢气,注射器活塞右移,不能说明锌与硫酸反应为放热反应,故B错误;C.用丙装置进行中和反应反应热的测定实验时,为防止热量过多散失,NaOH要快速倒入稀硫酸中,故C错误;D.排出碱式滴定管中的气泡,应将胶管向上弯曲,用力捏挤玻璃珠使溶液从尖嘴喷出,故D错误。]
7.C [A.分子中碳碳双键的每个不饱和碳原子均连接2个不同的原子或原子团,存在顺反异构,故A正确;B.四元环上的2个碳原子连接4个不同的原子,是手性碳原子,则分子中存在2个手性碳原子,故B正确;C.该分子中不含羧基,不能与碳酸氢钠溶液反应,故C错误;D.根据结构简式可知,该物质的化学式为C25H21NF2O3,故D正确。]
8.C [合成1中发生Na+Al+2H2===NaAlH4,合成2中发生NaAlH4+SiF4===SiH4+NaAlF4,合成3制备四氟化硅,净化、热解SiH4步骤中四氢化硅分解为晶体硅和氢气;A.合成1中发生Na+Al+2H2===NaAlH4,H由0价转化成-1价,化合价降低,氢气作氧化剂,故A说法正确;B.根据上述分析,合成2中发生NaAlH4+SiF4===SiH4+NaAlF4,故B说法正确;C.合成3中NaAlF4与硫酸反应生成HF,HF与二氧化硅反应生成SiF4,因此题中不能说明二氧化硅溶于硫酸,故C说法错误;D.四氢化硅分解为晶体硅和氢气,根据电负性分析,氢的电负性强于硅,硅元素显+4价,化合价降低,因此晶体硅为还原产物,故D说法正确。]
9.D [X基态原子价电子排布为2s22p4,X为O。Z和X形成的一种化合物溶于水会形成酸雨,且原子序数比X大,Z为S。Y为同周期最活泼的金属为Na。M为短周期主族元素,且其序数大于Z则M为Cl。R是一种过渡元素,其基态原子4s和3d轨道均半充满即[Ar]3d54s1,R为Cr。A.离子半径:电子层越多半径越大,同电子层核电荷数越多半径越小,Cl->O2->Na+,A项错误;B.同周期元素的电负性和第一电离能从左往右增大:Na
11.B [A.84消毒液的有效成分是次氯酸钠,具有漂白性,能使pH试纸褪色,所以不能用pH试纸测定84消毒液的pH值,应该用pH计,故A错误;B.由操作和现象可知,发生沉淀转化,则Mg(OH)2沉淀可以转化为Fe(OH)3沉淀,故B正确;C.加入稀硫酸后,溶液中含有氢离子和硝酸根离子,相当于含有硝酸,硝酸能氧化亚铁离子生成铁离子,所以不能实现实验目的,故C错误;D.盐酸为无氧酸,由碳酸、盐酸的酸性强弱不能比较Cl、C的非金属性强弱,故D错误。]
12.D [由图可知,c点氨气的体积百分数最大,说明反应达到平衡,则c点以前为平衡的建立过程,c点以后为平衡的移动过程。A.由分析可知,c点以前均未达到平衡,故A错误;B.温度越高,反应速率越快,由于a点温度小于b点,且a点c(NH3)低于b点,故a点的逆反应速率比b点的小,故B错误;C.由分析可知,b点反应未达到平衡,正反应速率大于逆反应速率,故C错误;D.该反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,则c点平衡常数大于d点,故D正确。]
13.C [A.根据图中信息,空穴h+与水反应,其参与的反应为2H2O+ 2h+===H2O2+2H+,故A正确;B.氢离子得到光电子提供的电子,则参与发生的反应为2H++2e-===H2↑,故B正确;C.该反应的化学方程式为CH4+H2O CH3OH+H2,水中氢化合价降低,则反应过程中水作氧化剂,故C错误;D.根据图中信息常温常压下使甲烷和水转化为甲醇和氢气,则该反应的化学方程式为CH4+H2O CH3OH+H2,故D正确。]
14.C [由直线斜率可知,L1对应难溶盐的阳离子与阴离子的数目之比为2∶1,则L1表示M2Y的饱和溶液中离子浓度的关系,A项错误;由图可知Ksp(MX)=10-10,Ksp(M2Y)=10-12,c(X-)=,c(Y2-)=,则·c(M+)=10-2c(M+)。当c(M+)=102 mol·L-1时,c(X-)=c(Y2-),当c(M+)<102 mol·L-1时,c(X-)
同课章节目录
