2025届高三化学二轮复习 选择题提速练(四)(含解析)
文档属性
| 名称 | 2025届高三化学二轮复习 选择题提速练(四)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-12 12:30:22 | ||
图片预览



文档简介
选择题提速练(四)
(分值:36分)
单项选择题(本题包括12小题,每题3分,共36分,每小题只有一个选项符合题意)
1.化学与生产、生活息息相关。下列说法错误的是 ( )
推广使用可在自然界降解的聚乳酸作食品外包装材料
鼓励分类回收、再利用生活垃圾和废弃物
开发高效催化剂有利于环氧乙烷和CO2发生缩聚反应合成高分子材料
推广使用新能源汽车可有效减少碳排放
2.下列有关物质性质的应用正确的是 ( )
SO2具有还原性,可用作纸浆漂白
生石灰能与水反应,可用来干燥氯气
氢氧化铝受热分解,可用作中和过多的胃酸
聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层
3.央视兔年春晚《满庭芳·国色》唱了42个颜色名,艺术地表现了中国人对传统国色的极致表达和美学追求。一些矿物颜料的色彩和主要成分见下表:
色彩 霞光红 迎春黄 天霁蓝 瑞雪白
主要成分 朱砂 雌黄 石青 蛤灰
化学式 HgS As2S3 Cu(OH)2·2CuCO3 CaO
下列说法正确的是 ( )
石青颜料耐酸碱腐蚀
蛤灰加水后会放出大量的热
朱砂能化为汞涉及蒸发操作
《遁斋闲览》中记载:有误字,以雌黄灭之,为其与纸色相类。利用了雌黄的化学性质
4.黑磷具有与石墨相似的层状结构,其结构如图所示。下列分析错误的是 ( )
黑磷中既存在非极性共价键又存在范德华力
黑磷的熔点高于白磷
黑磷中P原子杂化方式为sp3
第三周期只有Cl元素的第一电离能大于P
5.我国科学家在寻找“点击反应”的砌块过程中,发现一种新的化合物,结构如图所示,其中X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与W是同一主族元素。下列说法正确的是 ( )
元素电负性:Z>Y>W
简单氢化物沸点:X>Y>W
简单离子半径:Z>Y>X
X、W氧化物的水化物均为强酸
6.磷化氢(PH3)是一种在空气中能自燃的剧毒气体,可通过以下流程制取:
下列说法错误的是 ( )
NaH2PO2既能与酸反应又能与碱反应
流程中有两处涉及氧化还原反应
该过程需要在无氧条件下进行
分解反应生成H3PO4和PH3的物质的量之比为1∶1
7.某催化固氮机理如图所示。下列说法正确的是 ( )
固氮过程是将气态含氮物质转化为固态含氮物质
整个过程中涉及到非极性键的断裂和形成
三步反应均为氧化还原反应
步骤Ⅲ可能为ΔH>0,ΔS<0的反应
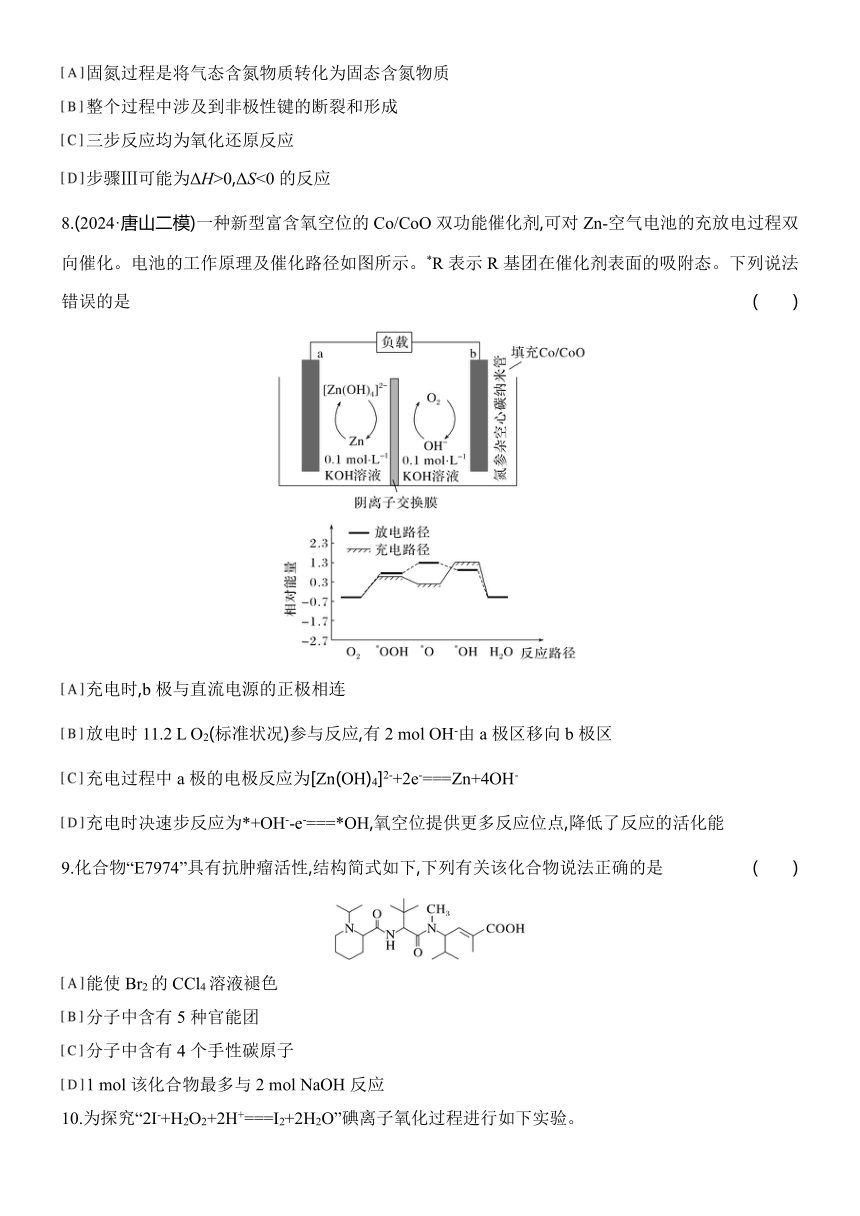
8.(2024·唐山二模)一种新型富含氧空位的Co/CoO双功能催化剂,可对Zn-空气电池的充放电过程双向催化。电池的工作原理及催化路径如图所示。*R表示R基团在催化剂表面的吸附态。下列说法错误的是 ( )
充电时,b极与直流电源的正极相连
放电时11.2 L O2(标准状况)参与反应,有2 mol OH-由a极区移向b极区
充电过程中a极的电极反应为[Zn(OH)4]2-+2e-===Zn+4OH-
充电时决速步反应为*+OH--e-===*OH,氧空位提供更多反应位点,降低了反应的活化能
9.化合物“E7974”具有抗肿瘤活性,结构简式如下,下列有关该化合物说法正确的是 ( )
能使Br2的CCl4溶液褪色
分子中含有5种官能团
分子中含有4个手性碳原子
1 mol该化合物最多与2 mol NaOH反应
10.为探究“2I-+H2O2+2H+===I2+2H2O”碘离子氧化过程进行如下实验。
编号 1 2
实验 内容
实验 现象 随着液体不断滴入,产生大量气体;溶液变黄并不断加深至棕黄色后又变浅 随着液体不断滴入,溶液变黄,摇匀后又褪色,不断重复直至析出紫色沉淀
下列说法不正确的是 ( )
实验1中溶液变浅是因为I2+5H2O2===2HIO3+4H2O
实验2中出现紫色沉淀是因为HIO3+5HI===3I2↓+3H2O
实验1中产生大量气体的原因是I-被氧化的过程大量放热
实验2相较于实验1,可节约H2O2用量且有利于反应终点观察
11.乙炔(HC≡CH)能在Hg2+催化下与水反应生成CH3CHO,反应历程及相对能垒如图所示。下列说法正确的是 ( )
过程①中,水分子中的氧原子向Hg2+的空轨道提供孤对电子
本反应历程涉及的物质中,CH2=CHOH最稳定
HC≡CH转化为CH3CHO的过程涉及消去反应
其他条件不变时,更换其他催化剂可改变由乙炔和水制备乙醛的焓变
12.(2024·枣庄二模)常温下,Na2CO3溶液体系中各含碳微粒的物质的量分数与pH的关系如图1所示。在c起始(Na2CO3)=0.1 mol·L-1的体系中,研究金属离子M2+在不同pH时的可能产物,c(M2+)与pH的关系如图2所示,曲线为MCO3和M(OH)2的Ksp图像。下列说法正确的是 ( )
用盐酸滴定Na2CO3溶液至中性时,c(C)∶c(H2CO3)=10-2.62
常温下,Ksp(MCO3)的数量级为10-5
P点的体系中,发生反应M2++2HC===MCO3↓+CO2↑+H2O
Q点的体系中,c(HC)+c(C)+c(H2CO3) <0.1 mol·L-1
选择题提速练(四)
1.C [聚乳酸在自然环境下可以自然降解,可以推广使用聚乳酸作食品外包装材料,A正确;鼓励分类回收、再利用生活垃圾和废弃物,可以减少环境污染,B正确;环氧乙烷与二氧化碳在一定条件下发生加聚反应合成高分子材料,C错误;推广使用新能源汽车可有效减少CO2的排放,减少碳排放,D正确。]
2.D [A.SO2可用作纸浆漂白,利用SO2的漂白性,故A错误;B.氯气是酸性气体,氧化钙是碱性干燥剂,不能用氧化钙干燥氯气,故B错误;C.氢氧化铝可用作中和过多的胃酸,是因为氢氧化铝能与酸反应,故C错误;D.聚四氟乙烯俗称“塑料王”,是一种以四氟乙烯作为单体聚合制得的高分子聚合物,这种材料具有抗酸抗碱、抗各种有机溶剂的特点,可用作化工反应器的内壁涂层,故D正确。]
3.B [Cu(OH)2·2CuCO3和酸会反应,则石青颜料不耐腐蚀,A项错误;反应CaO+H2O===Ca(OH)2是放热反应,则蛤灰加水后会放出大量的热,B项正确;HgS→Hg,Hg是还原产物,与蒸发无关,C项错误;书上有错误的地方,用雌黄涂抹,是因为雌黄的颜色与纸色差不多,所以可覆盖错字,利用了雌黄的物理性质,D项错误。]
4.D [A.黑磷中P与P之间存在非极性共价键,层与层之间存在范德华力,A正确;B.黑磷分子的相对分子质量远大于白磷,黑磷的熔点高于白磷,B正确;C.黑磷的结构为空间立体结构,故P原子杂化方式为sp3,C正确;D.第三周期中Ar与Cl的第一电离能都大于P的,D错误。]
5.A [X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与W是同一主族元素,W能形成6个化合键,则Y为氧、W为硫;Z形成1个共价键,为氟;X形成3个共价键,为氮;A.同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱;元素电负性:Z>Y>W,A正确;B.常温下水为液体、氨气为气体,则水沸点较高;氨气能形成氢键导致沸点高于硫化氢,故简单氢化物沸点:Y>X> W,B错误;C.电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小,则简单离子半径:X>Y > Z,C错误;D.亚硝酸、亚硫酸不是强酸,D错误。]
6.A [白磷与过量氢氧化钠溶液发生氧化还原反应生成PH3和NaH2PO2溶液,NaH2PO2溶液与稀硫酸反应生成H3PO2,H3PO2为一元弱酸,发生分解反应生成PH3和H3PO4。A.H3PO2为一元弱酸,NaH2PO2 为正盐,只能与酸反应,A错误;B.白磷与氢氧化钠溶液反应、H3PO2分解生成PH3和H3PO4,这两个反应中元素化合价发生变化,是氧化还原反应,B正确;C.PH3在空气中能自燃,整个过程中有PH3生成,故需要在无氧条件下进行,C正确;D.H3PO2中P元素为+1价,H3PO4 和 PH3中P元素分别为+5价和-3价,根据得失电子守恒规律, 反应生成 H3PO4 和 PH3的物质的量之比为1∶1,D正确。]
7.B [A.固氮过程是将大气中游离态的氮转化为氮的化合物的过程,A错误;B.整个过程中涉及到非极性键的断裂(N)和形成(O),B正确;C.第Ⅱ步反应为非氧化还原反应,C错误;D.步骤Ⅲ为熵增过程,ΔS>0,D错误。]
8.B [根据Zn-空气电池分析,放电时,锌失去电子,作负极即a为负极,b为正极,则充电时,b极与直流电源的正极相连,故A正确;根据O2+4e-+2H2O===4OH-,则放电时11.2 L O2(标准状况物质的量为0.5 mol)参与反应,有2 mol电子转移,则有2 mol OH-由b极区移向a极区,故B错误;放电过程中a极的电极反应为Zn+4OH--2e-===[Zn(OH)4]2-,则充电过程中a极的电极反应为[Zn(OH)4]2-+2e-===Zn+4OH-,故C正确;决速步反应是指活化能最高的一步,由图可以看出充电过程中活化能最大的是*O→*OH,催化剂从O上吸附到OH上的反应为*+OH--e-===*OH,氧空位提供更多反应位点,降低了反应的活化能,故D正确。]
9.A [A.根据结构,“E7974”含有碳碳双键,可使Br2的CCl4溶液褪色,A正确;B.由结构简式可知,分子中含有的官能团如图,其中有两个酰胺基,共4种官能团,B错误;C.连有4个不同基团的饱和碳原子是手性碳原子,因此化合物“E7974”含有的手性碳原子如图
,共3个,C错误;D.分子中均能与NaOH溶液反应,故1 mol该化合物最多与3 mol NaOH反应,D错误。]
10.C [A.溶液变黄说明生成碘单质,黄色不断加深至棕黄色后又变浅,说明生成的碘单质又和过氧化氢反应转化为高价态的碘酸,导致溶液颜色变浅,A正确;B.碘单质为紫黑色固体,溶液变黄,摇匀后又褪色,说明生成了碘酸,再加入过量的碘离子,碘离子具有还原性,和碘酸发生氧化还原反应生成碘单质,B正确;C.过氧化氢不稳定,在碘离子催化作用下会生成氧气,故产生大量气体的原因是过氧化氢在碘离子催化下生成了氧气,C错误; D.实验1中开始过氧化氢分解生成氧气导致过氧化氢没有和碘离子反应,且实验2中生成紫色沉淀现象明显,故实验2相较于实验1,可节约H2O2用量且有利于反应终点观察,D正确。]
11.A [A.由图可知,过程①中H2O与Hg2+形成配合物,水分子的氧原子具有孤对电子,可向Hg2+的空轨道提供孤对电子形成配位键,A正确;B.图中CH2=CHOH的能量最高,故其稳定性最弱,B错误;C.由本反应历程图示知,HC≡CH转化为CH3CHO的过程反应中碳碳三键转化为醛基,没有涉及消去反应,C错误;D.催化剂改变反应历程,降低活化能,加快反应速率,但不能改变反应的焓变,D错误。]
12.A [由图甲可知,c(C)=c(HC)时,pH=10.25,c(HC)=c(H2CO3)时,pH=6.37,则=10-6.37,=10-10.25,=10-16.62,至中性时,=10-16.62,则c(C)∶c(H2CO3)=10-2.62,A正确;R点时,c(M2+)=10-4 mol·L-1, pH=10.37, (H2CO3)=10-10.25,所以=100.12≈1,即c(C)=c(HC)≈0.05 mol·L-1,Ksp(MCO3)≈10-4×0.05=5×10-6,数量级为10-6,B错误;P点时,c(M2+)=10-6 mol·L-1,pH=12,根据图甲知此时,c(C)≈0.1 mol·L-1,Q(MCO3)≈10-7
(分值:36分)
单项选择题(本题包括12小题,每题3分,共36分,每小题只有一个选项符合题意)
1.化学与生产、生活息息相关。下列说法错误的是 ( )
推广使用可在自然界降解的聚乳酸作食品外包装材料
鼓励分类回收、再利用生活垃圾和废弃物
开发高效催化剂有利于环氧乙烷和CO2发生缩聚反应合成高分子材料
推广使用新能源汽车可有效减少碳排放
2.下列有关物质性质的应用正确的是 ( )
SO2具有还原性,可用作纸浆漂白
生石灰能与水反应,可用来干燥氯气
氢氧化铝受热分解,可用作中和过多的胃酸
聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层
3.央视兔年春晚《满庭芳·国色》唱了42个颜色名,艺术地表现了中国人对传统国色的极致表达和美学追求。一些矿物颜料的色彩和主要成分见下表:
色彩 霞光红 迎春黄 天霁蓝 瑞雪白
主要成分 朱砂 雌黄 石青 蛤灰
化学式 HgS As2S3 Cu(OH)2·2CuCO3 CaO
下列说法正确的是 ( )
石青颜料耐酸碱腐蚀
蛤灰加水后会放出大量的热
朱砂能化为汞涉及蒸发操作
《遁斋闲览》中记载:有误字,以雌黄灭之,为其与纸色相类。利用了雌黄的化学性质
4.黑磷具有与石墨相似的层状结构,其结构如图所示。下列分析错误的是 ( )
黑磷中既存在非极性共价键又存在范德华力
黑磷的熔点高于白磷
黑磷中P原子杂化方式为sp3
第三周期只有Cl元素的第一电离能大于P
5.我国科学家在寻找“点击反应”的砌块过程中,发现一种新的化合物,结构如图所示,其中X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与W是同一主族元素。下列说法正确的是 ( )
元素电负性:Z>Y>W
简单氢化物沸点:X>Y>W
简单离子半径:Z>Y>X
X、W氧化物的水化物均为强酸
6.磷化氢(PH3)是一种在空气中能自燃的剧毒气体,可通过以下流程制取:
下列说法错误的是 ( )
NaH2PO2既能与酸反应又能与碱反应
流程中有两处涉及氧化还原反应
该过程需要在无氧条件下进行
分解反应生成H3PO4和PH3的物质的量之比为1∶1
7.某催化固氮机理如图所示。下列说法正确的是 ( )
固氮过程是将气态含氮物质转化为固态含氮物质
整个过程中涉及到非极性键的断裂和形成
三步反应均为氧化还原反应
步骤Ⅲ可能为ΔH>0,ΔS<0的反应
8.(2024·唐山二模)一种新型富含氧空位的Co/CoO双功能催化剂,可对Zn-空气电池的充放电过程双向催化。电池的工作原理及催化路径如图所示。*R表示R基团在催化剂表面的吸附态。下列说法错误的是 ( )
充电时,b极与直流电源的正极相连
放电时11.2 L O2(标准状况)参与反应,有2 mol OH-由a极区移向b极区
充电过程中a极的电极反应为[Zn(OH)4]2-+2e-===Zn+4OH-
充电时决速步反应为*+OH--e-===*OH,氧空位提供更多反应位点,降低了反应的活化能
9.化合物“E7974”具有抗肿瘤活性,结构简式如下,下列有关该化合物说法正确的是 ( )
能使Br2的CCl4溶液褪色
分子中含有5种官能团
分子中含有4个手性碳原子
1 mol该化合物最多与2 mol NaOH反应
10.为探究“2I-+H2O2+2H+===I2+2H2O”碘离子氧化过程进行如下实验。
编号 1 2
实验 内容
实验 现象 随着液体不断滴入,产生大量气体;溶液变黄并不断加深至棕黄色后又变浅 随着液体不断滴入,溶液变黄,摇匀后又褪色,不断重复直至析出紫色沉淀
下列说法不正确的是 ( )
实验1中溶液变浅是因为I2+5H2O2===2HIO3+4H2O
实验2中出现紫色沉淀是因为HIO3+5HI===3I2↓+3H2O
实验1中产生大量气体的原因是I-被氧化的过程大量放热
实验2相较于实验1,可节约H2O2用量且有利于反应终点观察
11.乙炔(HC≡CH)能在Hg2+催化下与水反应生成CH3CHO,反应历程及相对能垒如图所示。下列说法正确的是 ( )
过程①中,水分子中的氧原子向Hg2+的空轨道提供孤对电子
本反应历程涉及的物质中,CH2=CHOH最稳定
HC≡CH转化为CH3CHO的过程涉及消去反应
其他条件不变时,更换其他催化剂可改变由乙炔和水制备乙醛的焓变
12.(2024·枣庄二模)常温下,Na2CO3溶液体系中各含碳微粒的物质的量分数与pH的关系如图1所示。在c起始(Na2CO3)=0.1 mol·L-1的体系中,研究金属离子M2+在不同pH时的可能产物,c(M2+)与pH的关系如图2所示,曲线为MCO3和M(OH)2的Ksp图像。下列说法正确的是 ( )
用盐酸滴定Na2CO3溶液至中性时,c(C)∶c(H2CO3)=10-2.62
常温下,Ksp(MCO3)的数量级为10-5
P点的体系中,发生反应M2++2HC===MCO3↓+CO2↑+H2O
Q点的体系中,c(HC)+c(C)+c(H2CO3) <0.1 mol·L-1
选择题提速练(四)
1.C [聚乳酸在自然环境下可以自然降解,可以推广使用聚乳酸作食品外包装材料,A正确;鼓励分类回收、再利用生活垃圾和废弃物,可以减少环境污染,B正确;环氧乙烷与二氧化碳在一定条件下发生加聚反应合成高分子材料,C错误;推广使用新能源汽车可有效减少CO2的排放,减少碳排放,D正确。]
2.D [A.SO2可用作纸浆漂白,利用SO2的漂白性,故A错误;B.氯气是酸性气体,氧化钙是碱性干燥剂,不能用氧化钙干燥氯气,故B错误;C.氢氧化铝可用作中和过多的胃酸,是因为氢氧化铝能与酸反应,故C错误;D.聚四氟乙烯俗称“塑料王”,是一种以四氟乙烯作为单体聚合制得的高分子聚合物,这种材料具有抗酸抗碱、抗各种有机溶剂的特点,可用作化工反应器的内壁涂层,故D正确。]
3.B [Cu(OH)2·2CuCO3和酸会反应,则石青颜料不耐腐蚀,A项错误;反应CaO+H2O===Ca(OH)2是放热反应,则蛤灰加水后会放出大量的热,B项正确;HgS→Hg,Hg是还原产物,与蒸发无关,C项错误;书上有错误的地方,用雌黄涂抹,是因为雌黄的颜色与纸色差不多,所以可覆盖错字,利用了雌黄的物理性质,D项错误。]
4.D [A.黑磷中P与P之间存在非极性共价键,层与层之间存在范德华力,A正确;B.黑磷分子的相对分子质量远大于白磷,黑磷的熔点高于白磷,B正确;C.黑磷的结构为空间立体结构,故P原子杂化方式为sp3,C正确;D.第三周期中Ar与Cl的第一电离能都大于P的,D错误。]
5.A [X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与W是同一主族元素,W能形成6个化合键,则Y为氧、W为硫;Z形成1个共价键,为氟;X形成3个共价键,为氮;A.同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱;元素电负性:Z>Y>W,A正确;B.常温下水为液体、氨气为气体,则水沸点较高;氨气能形成氢键导致沸点高于硫化氢,故简单氢化物沸点:Y>X> W,B错误;C.电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小,则简单离子半径:X>Y > Z,C错误;D.亚硝酸、亚硫酸不是强酸,D错误。]
6.A [白磷与过量氢氧化钠溶液发生氧化还原反应生成PH3和NaH2PO2溶液,NaH2PO2溶液与稀硫酸反应生成H3PO2,H3PO2为一元弱酸,发生分解反应生成PH3和H3PO4。A.H3PO2为一元弱酸,NaH2PO2 为正盐,只能与酸反应,A错误;B.白磷与氢氧化钠溶液反应、H3PO2分解生成PH3和H3PO4,这两个反应中元素化合价发生变化,是氧化还原反应,B正确;C.PH3在空气中能自燃,整个过程中有PH3生成,故需要在无氧条件下进行,C正确;D.H3PO2中P元素为+1价,H3PO4 和 PH3中P元素分别为+5价和-3价,根据得失电子守恒规律, 反应生成 H3PO4 和 PH3的物质的量之比为1∶1,D正确。]
7.B [A.固氮过程是将大气中游离态的氮转化为氮的化合物的过程,A错误;B.整个过程中涉及到非极性键的断裂(N)和形成(O),B正确;C.第Ⅱ步反应为非氧化还原反应,C错误;D.步骤Ⅲ为熵增过程,ΔS>0,D错误。]
8.B [根据Zn-空气电池分析,放电时,锌失去电子,作负极即a为负极,b为正极,则充电时,b极与直流电源的正极相连,故A正确;根据O2+4e-+2H2O===4OH-,则放电时11.2 L O2(标准状况物质的量为0.5 mol)参与反应,有2 mol电子转移,则有2 mol OH-由b极区移向a极区,故B错误;放电过程中a极的电极反应为Zn+4OH--2e-===[Zn(OH)4]2-,则充电过程中a极的电极反应为[Zn(OH)4]2-+2e-===Zn+4OH-,故C正确;决速步反应是指活化能最高的一步,由图可以看出充电过程中活化能最大的是*O→*OH,催化剂从O上吸附到OH上的反应为*+OH--e-===*OH,氧空位提供更多反应位点,降低了反应的活化能,故D正确。]
9.A [A.根据结构,“E7974”含有碳碳双键,可使Br2的CCl4溶液褪色,A正确;B.由结构简式可知,分子中含有的官能团如图,其中有两个酰胺基,共4种官能团,B错误;C.连有4个不同基团的饱和碳原子是手性碳原子,因此化合物“E7974”含有的手性碳原子如图
,共3个,C错误;D.分子中均能与NaOH溶液反应,故1 mol该化合物最多与3 mol NaOH反应,D错误。]
10.C [A.溶液变黄说明生成碘单质,黄色不断加深至棕黄色后又变浅,说明生成的碘单质又和过氧化氢反应转化为高价态的碘酸,导致溶液颜色变浅,A正确;B.碘单质为紫黑色固体,溶液变黄,摇匀后又褪色,说明生成了碘酸,再加入过量的碘离子,碘离子具有还原性,和碘酸发生氧化还原反应生成碘单质,B正确;C.过氧化氢不稳定,在碘离子催化作用下会生成氧气,故产生大量气体的原因是过氧化氢在碘离子催化下生成了氧气,C错误; D.实验1中开始过氧化氢分解生成氧气导致过氧化氢没有和碘离子反应,且实验2中生成紫色沉淀现象明显,故实验2相较于实验1,可节约H2O2用量且有利于反应终点观察,D正确。]
11.A [A.由图可知,过程①中H2O与Hg2+形成配合物,水分子的氧原子具有孤对电子,可向Hg2+的空轨道提供孤对电子形成配位键,A正确;B.图中CH2=CHOH的能量最高,故其稳定性最弱,B错误;C.由本反应历程图示知,HC≡CH转化为CH3CHO的过程反应中碳碳三键转化为醛基,没有涉及消去反应,C错误;D.催化剂改变反应历程,降低活化能,加快反应速率,但不能改变反应的焓变,D错误。]
12.A [由图甲可知,c(C)=c(HC)时,pH=10.25,c(HC)=c(H2CO3)时,pH=6.37,则=10-6.37,=10-10.25,=10-16.62,至中性时,=10-16.62,则c(C)∶c(H2CO3)=10-2.62,A正确;R点时,c(M2+)=10-4 mol·L-1, pH=10.37, (H2CO3)=10-10.25,所以=100.12≈1,即c(C)=c(HC)≈0.05 mol·L-1,Ksp(MCO3)≈10-4×0.05=5×10-6,数量级为10-6,B错误;P点时,c(M2+)=10-6 mol·L-1,pH=12,根据图甲知此时,c(C)≈0.1 mol·L-1,Q(MCO3)≈10-7
同课章节目录
