中考一轮复习 考点14 质量守恒定律及其应用 课件(共35张PPT)
文档属性
| 名称 | 中考一轮复习 考点14 质量守恒定律及其应用 课件(共35张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-14 09:52:45 | ||
图片预览










文档简介
(共35张PPT)
第一部分 基础训练
第一部分
主题四
主题四 物质的化学变化
考点14 质量守恒定律及其应用
CONTENTS
目录
考点对标
01
KAO DIAN DUI BIAO
02
ZHEN TI JIE DU
真题解读
知识构建
03
ZHI SHI GOU JIAN
04
HANG SHI JI CHU
夯实基础
基础练习
05
JI CHU LIAN XI
06
SU YANG TI SHENG
素养提升
考点对标
KAO DIAN DUI BIAO
PART ONE
01
真题解读
2025
考点对标
知识构建
夯实基础
基础练习
素养提升
1. 认识化学反应中各物质间存在定量关系,化学反应遵守质量守恒定律
2. 理解质量守恒定律的微观本质
3. 能熟练地应用质量守恒定律
ZHEN TI JIE DU
PART TWO
02
2025
真题解读
真题解读
考点对标
知识构建
夯实基础
基础练习
素养提升
【例题1】(2023广东)超氧化钾(KO2)为黄色固体,可分别与CO2、H2O反应生成O2和白色固体,产氧效率高,适合作生氧剂。原理分析:4KO2+2CO2 2K2CO3+3O2,4KO2+2H2O 4X+3O2↑,则X的化学式为 KOH 。
KOH
【点拨】本题考查质量守恒定律,根据同种原子的种类、数目保持不变,差额的原子种类和个数在未知物质X中提供,从而确定反应中生成物的化学式。反应物中有4个K原子、4个H原子、10个O原子,生成物已出现6个O原子,差额4个K原子、4个H原子、4个O原子,物质X前面有系数4,所以X物质含有的原子个数是1个K原子、1个H原子、1个O原子,故化学式为KOH。
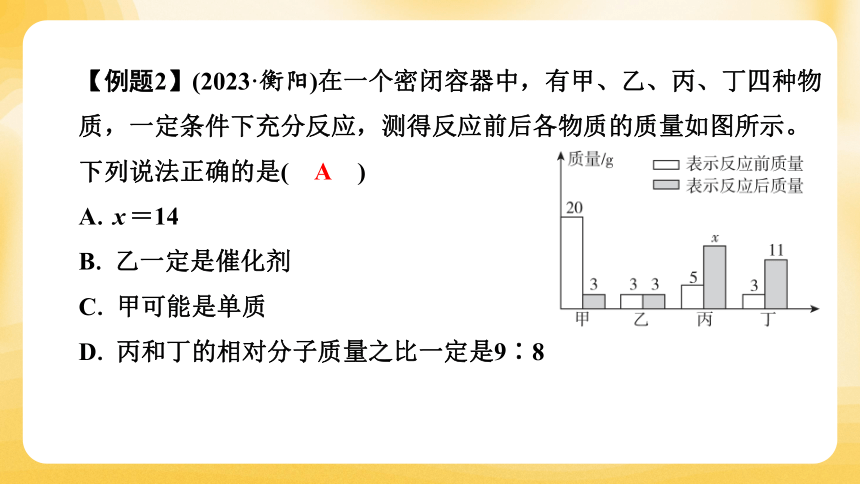
【例题2】(2023·衡阳)在一个密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如图所示。下列说法正确的是( A )
A
A. x=14
B. 乙一定是催化剂
C. 甲可能是单质
D. 丙和丁的相对分子质量之比一定是9∶8
【点拨】在密闭的体系反应,体系内外没有物质交换,所以反应前、后物质的总质量是不变的。对比反应前后,质量减少的是反应物,质量增加的是生成物,然后根据质量守恒定律:参加反应的物质总质量等于生成新物质的总质量,推出x=14,故答案是A。乙物质在反应前后质量不变,有可能是催化剂,也有可能是杂质,故B选项错;根据反应物和生成物可知,该反应是分解反应,所以甲一定是化合物,不可能是单质,故C选项错;根据反应过程,生成的丙和丁的质量比是9∶8,但不一定是相对分子质量之比是9∶8,故D选项错。
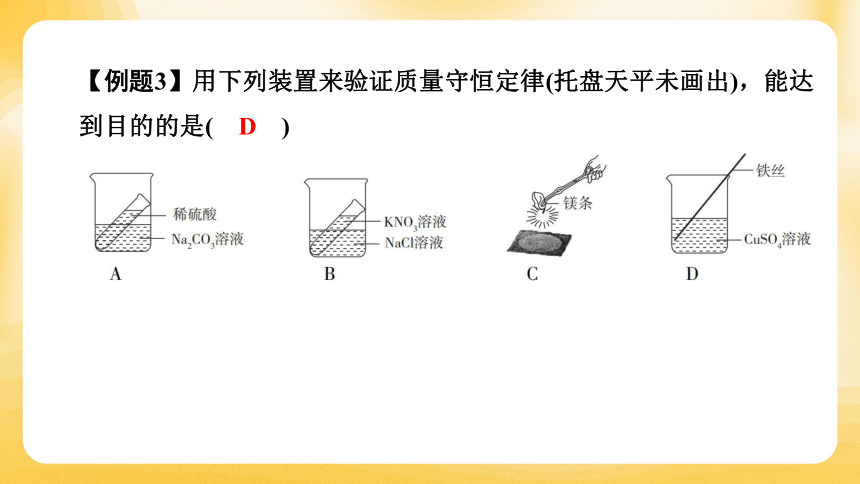
【例题3】用下列装置来验证质量守恒定律(托盘天平未画出),能达到目的的是( D )
D
【点拨】本题考查质量守恒定律的验证。A. 生成物中有气体,装置也不是密闭容器,不能验证。B. 两种物质不发生化学反应,不能验证。C. 镁带在空气中燃烧,反应后固体质量会明显增大,因为有氧气参加,另外该装置也不是在密闭容器中进行,不能验证。D. 铁与硫酸铜反应生成铜与硫酸亚铁,反应中没有气体参加,也没有气体生成,装置可不密闭,可以验证,故答案是D。
ZHI SHI GOU JIAN
PART THREE
03
2025
知识构建
真题解读
考点对标
知识构建
夯实基础
基础练习
素养提升
HANG SHI JI CHU
PART FOUR
04
2025
夯实基础
真题解读
考点对标
知识构建
夯实基础
基础练习
素养提升
一、质量守恒定律
1. 定义: 参加反应 的各物质的 总质量 ,等于反应后生成的各物质的 总质量 。
参加反应
总质量
总质量
2. 质量守恒的原因
(1)宏观原因:元素 种类 、质量都不变。
(2)微观原因:原子的 种类 、 个数 、 质量 都不变。
种类
种类
个数
质量
3. 化学反应前后,一定不变的有:原子的 种类 、 个 、
质量 及元素的 种类 ,物质的 总质量 。
一定改变的有:物质的 种类 、分子的 种类 。
可能发生改变的有:分子的 个数 、元素的化合价。
4. 质量守恒定律只适用于 化学变化,且一切 化学变化(化学反都必须遵守质量守恒定律。
种类
个数
质量
种类
总质量
种类
种类
个数
化学变化
化学变化(化学反应)
二、质量守恒定律的应用
1. 根据总质量不变,求化学反应中某物质的质量。(总质量守恒)
例:①已知A+B C,现有32克A与32克B恰好完全反应,则生成C的质量是( A )
A. 64克 B. 32克 C. 22克 D. 12克
②将10克高锰酸钾钾加热,当固体剩下8.4克时,生成氧气 1.6 克。
A
1.6
2. 根据元素种类不变,确定化学反应中某物质的元素种类。(元素种类守恒)
例:①某物质在氧气中完全燃烧后生成了水和二氧化碳,则该物质一定含有 碳、氢 元素,可能含有 氧 元素。
②铜绿在隔绝空气、加强热时分解生成了氧化铜、水和二氧化碳,则铜绿中含有的元素是 Cu、O、H、C (写元素符号)。
碳、氢
氧
Cu、O、H、C
3. 根据原子的种类、数目不变,确定反应中某物质的化学式。(原子种类和数目守恒)
例:①某化合物燃烧时发生的化学反应如下:R+2O2 CO2+2H2O,则R的化学式为( B )
A. C2H5OH B. CH4
C. CH3OH D. C2H4
②2KNO3+3C+S K2S+X↑+3CO2↑,据此推出X的化学式 N2 ,依据是 原子种类和数目守恒(质量守恒定律) 。
B
N2
原子种类和数目守恒(质量守恒定律)
三、易错点分析
1. 质量守恒定律适用所有的化学反应,而物理变化不一定会遵守质量守恒。
2. 质量守恒定律中的反应物总质量是指参加反应的物质质量,而不参加反应(剩余)的物质质量不在总质量之内。
3. 在根据化学方程式推断某未知物质化学式时,数原子个数时,一定要注意它的化学式前面是否有系数。
如C2H5OH +3 O2 2 CO2+3 X,求X物质的化学式,一个X分子里含有2个氢原子和1个氧原子,而不是6个氢原子和3个氧原子。
JI CHU LIAN XI
PART FIVE
05
2025
基础练习
真题解读
考点对标
知识构建
夯实基础
基础练习
素养提升
1. (2023·湖南)汽油中加入适量乙醇作为汽车燃料,可节省石油资源,减少汽车尾气污染。乙醇充分燃烧的化学方程式为C2H5OH+3O2 2CO2+3X,试推测X的化学式是( B )
A. H2 B. H2O C. CO D. H2O2
2. (2024·齐齐哈尔)在2023年杭州亚运会开幕式中,主火炬燃料创新使用了零碳甲醇。制备甲醇所发生反应的化学方程式为:X+3H2 CH3OH+H2O,其中X的化学式为( D )
A. H2CO3 B. C C. CO D. CO2
B
D
3. 丙烷(分子式为C3H8)燃烧的化学方程式为C3H8+5O2 xCO2+yH2O,其中x、y分别为 ( A )
A. 3、4 B. 3、8 C. 1、3 D. 1、5
A
4. (2024·黑龙江龙东)固定和利用二氧化碳能有效减少空气中的温室气体。工业上利用二氧化碳和物质X反应生产尿素,化学方程式为CO2+2X = CO(NH2)2+H2O,下列说法正确的是( B )
A. 该反应中有三种氧化物
B. X的化学式是NH3
C. 尿素属于铵态氮肥,不能与草木灰混合施用
D. CO2属于空气污染物
B
5. 下列实验能验证质量守恒定律的是( B )
A. ①镁条在空气中燃烧前后质量的测定
B. ②氯化钡溶液与硫酸铜溶液反应前后质量的测定
C. ③蜡烛燃烧前后质量的测定
D. ④锌粒和稀盐酸反应前后质量的测定
B
6. (2023·湖南)一定条件下,下列物质在密闭容器内反应一段时间,测得反应前后各物质的质量关系如表所示。
物质 X Y Z W
反应前质量/g 5 2.2 16.2 0.9
反应后质量/g a 4.4 8.1 1.8
根据上表信息判断,下列说法不.正.确.的是( B )
B
A. a=10.0
B. 该反应属于置换反应
C. Z为化合物
D. 反应中Y、W两种物质发生改变的质量比为22∶9
SU YANG TI SHENG
PART SIX
06
2025
素养提升
真题解读
考点对标
知识构建
夯实基础
基础练习
素养提升
7. (2024·宜宾)一定条件下,X、Y、乙、W四种物质在密闭容器中充分反应,测得反应前后各物质质量如下表。下列说法正确的是( D )
物质 X Y Z W
反应前的质量/g 6.8 1.0 93.2 0
反应后的质量/g 0 a 96.8 3.2
D
A. A=1.0,Y一定是该反应的催化剂
B. 该反应一定为化合反应
C. X与W相对分子质量之比一定为17∶8
D. Z与W质量变化之比一定为9∶8
8. (2024·黑龙江龙东)密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示。下列说法错.误.的是 ( C )
A. 该反应基本反应类型为化合反应
B. 该化学反应中乙、丙质量比为3∶17
C. 物质丙可能为单质
D. 物质丁可能是该反应的催化剂
C
9. (2024·山西)在一次实验课上,同学们通过小组合作,完成了对密闭容器中少量小苏打与少量白醋反应的质量测定。以下分析正确的是 ( C )
A. 反应后小苏打的质量增加
B. 反应过程中各物质的质量都不变
C. 反应前后各物质的质量总和相等
D. 反应前称量的是小苏打和白醋的总质量
C
10. (2023·湖北)水煤气中的CO和H2在一定条件下能发生化学反应,该过程的微观示意图如图所示。下列说法正确的是 ( C )
A. 该反应的基本反应类型为置换反应
B. 反应前后,原子和分子的个数均不变
C. 参加反应的CO和H2的质量比为14∶3
D. 丙的化学式为CH4,属于无机物
C
11. (2024·南通)合成氨是20世纪伟大的成就之一。研究氨气的组成、性质及用途具有重要意义。
(1)液氨可用作制冷剂。构成氨分子的微粒是氮原子和 氢原子 。液态的氨转化为氨气的过程中,氨分子间的距离 变大 (填“变大”或“变小”)。
氢原子
变大
(2)反应8NH3+3Cl2 6NH4Cl+N2可用于检查输送氯气的管道是否泄漏。
①N的质子数为7,核外第一层有2个电子,则第二层有 5 个电子。由Cl转化为Cl-的过程中,Cl 得到电子 (填“得到电子”或“失去电子”);
②N 中H的化合价为+1价,则N的化合价为 -3 价。
5
得到电子
-3
(3)NH3在能源与环境领域应用广泛。
①NH3燃烧生成N2和H2O,未来可用作化石燃料的替代能源,从产物的角度分析,作为燃料NH3相比于CH4的优点是 燃烧产物无污染(或环保) ;
②NH3可用于烟气脱硝,如4NH3+6R 5N2+6H2O,R的化学式为 NO 。
燃烧产物无污染
(或环保)
NO
12. (2023·广西改编)古有《齐民要术》记载“粟米曲作酢”,“酢”即醋酸也;今有我国科研人员研究出制取醋酸(CH3COOH)的新方法。新方法的反应微观示意图如图所示。
(1)古法酿醋是用粮食经过发酵而成,发酵属于 化学 变化。
(2)保持醋酸化学性质的最小微粒是 CH3COOH (写化学式)。
(3)新方法的反应化学方程式是 CO2+CH4 CH3COOH 。
化学
CH3COOH
CO2+CH4 CH3COOH
(4)这一新方法的重要意义除了制取醋酸外,还有助于减缓 温室 效应。
温室
第一部分 基础训练
第一部分
主题四
主题四 物质的化学变化
考点14 质量守恒定律及其应用
CONTENTS
目录
考点对标
01
KAO DIAN DUI BIAO
02
ZHEN TI JIE DU
真题解读
知识构建
03
ZHI SHI GOU JIAN
04
HANG SHI JI CHU
夯实基础
基础练习
05
JI CHU LIAN XI
06
SU YANG TI SHENG
素养提升
考点对标
KAO DIAN DUI BIAO
PART ONE
01
真题解读
2025
考点对标
知识构建
夯实基础
基础练习
素养提升
1. 认识化学反应中各物质间存在定量关系,化学反应遵守质量守恒定律
2. 理解质量守恒定律的微观本质
3. 能熟练地应用质量守恒定律
ZHEN TI JIE DU
PART TWO
02
2025
真题解读
真题解读
考点对标
知识构建
夯实基础
基础练习
素养提升
【例题1】(2023广东)超氧化钾(KO2)为黄色固体,可分别与CO2、H2O反应生成O2和白色固体,产氧效率高,适合作生氧剂。原理分析:4KO2+2CO2 2K2CO3+3O2,4KO2+2H2O 4X+3O2↑,则X的化学式为 KOH 。
KOH
【点拨】本题考查质量守恒定律,根据同种原子的种类、数目保持不变,差额的原子种类和个数在未知物质X中提供,从而确定反应中生成物的化学式。反应物中有4个K原子、4个H原子、10个O原子,生成物已出现6个O原子,差额4个K原子、4个H原子、4个O原子,物质X前面有系数4,所以X物质含有的原子个数是1个K原子、1个H原子、1个O原子,故化学式为KOH。
【例题2】(2023·衡阳)在一个密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如图所示。下列说法正确的是( A )
A
A. x=14
B. 乙一定是催化剂
C. 甲可能是单质
D. 丙和丁的相对分子质量之比一定是9∶8
【点拨】在密闭的体系反应,体系内外没有物质交换,所以反应前、后物质的总质量是不变的。对比反应前后,质量减少的是反应物,质量增加的是生成物,然后根据质量守恒定律:参加反应的物质总质量等于生成新物质的总质量,推出x=14,故答案是A。乙物质在反应前后质量不变,有可能是催化剂,也有可能是杂质,故B选项错;根据反应物和生成物可知,该反应是分解反应,所以甲一定是化合物,不可能是单质,故C选项错;根据反应过程,生成的丙和丁的质量比是9∶8,但不一定是相对分子质量之比是9∶8,故D选项错。
【例题3】用下列装置来验证质量守恒定律(托盘天平未画出),能达到目的的是( D )
D
【点拨】本题考查质量守恒定律的验证。A. 生成物中有气体,装置也不是密闭容器,不能验证。B. 两种物质不发生化学反应,不能验证。C. 镁带在空气中燃烧,反应后固体质量会明显增大,因为有氧气参加,另外该装置也不是在密闭容器中进行,不能验证。D. 铁与硫酸铜反应生成铜与硫酸亚铁,反应中没有气体参加,也没有气体生成,装置可不密闭,可以验证,故答案是D。
ZHI SHI GOU JIAN
PART THREE
03
2025
知识构建
真题解读
考点对标
知识构建
夯实基础
基础练习
素养提升
HANG SHI JI CHU
PART FOUR
04
2025
夯实基础
真题解读
考点对标
知识构建
夯实基础
基础练习
素养提升
一、质量守恒定律
1. 定义: 参加反应 的各物质的 总质量 ,等于反应后生成的各物质的 总质量 。
参加反应
总质量
总质量
2. 质量守恒的原因
(1)宏观原因:元素 种类 、质量都不变。
(2)微观原因:原子的 种类 、 个数 、 质量 都不变。
种类
种类
个数
质量
3. 化学反应前后,一定不变的有:原子的 种类 、 个 、
质量 及元素的 种类 ,物质的 总质量 。
一定改变的有:物质的 种类 、分子的 种类 。
可能发生改变的有:分子的 个数 、元素的化合价。
4. 质量守恒定律只适用于 化学变化,且一切 化学变化(化学反都必须遵守质量守恒定律。
种类
个数
质量
种类
总质量
种类
种类
个数
化学变化
化学变化(化学反应)
二、质量守恒定律的应用
1. 根据总质量不变,求化学反应中某物质的质量。(总质量守恒)
例:①已知A+B C,现有32克A与32克B恰好完全反应,则生成C的质量是( A )
A. 64克 B. 32克 C. 22克 D. 12克
②将10克高锰酸钾钾加热,当固体剩下8.4克时,生成氧气 1.6 克。
A
1.6
2. 根据元素种类不变,确定化学反应中某物质的元素种类。(元素种类守恒)
例:①某物质在氧气中完全燃烧后生成了水和二氧化碳,则该物质一定含有 碳、氢 元素,可能含有 氧 元素。
②铜绿在隔绝空气、加强热时分解生成了氧化铜、水和二氧化碳,则铜绿中含有的元素是 Cu、O、H、C (写元素符号)。
碳、氢
氧
Cu、O、H、C
3. 根据原子的种类、数目不变,确定反应中某物质的化学式。(原子种类和数目守恒)
例:①某化合物燃烧时发生的化学反应如下:R+2O2 CO2+2H2O,则R的化学式为( B )
A. C2H5OH B. CH4
C. CH3OH D. C2H4
②2KNO3+3C+S K2S+X↑+3CO2↑,据此推出X的化学式 N2 ,依据是 原子种类和数目守恒(质量守恒定律) 。
B
N2
原子种类和数目守恒(质量守恒定律)
三、易错点分析
1. 质量守恒定律适用所有的化学反应,而物理变化不一定会遵守质量守恒。
2. 质量守恒定律中的反应物总质量是指参加反应的物质质量,而不参加反应(剩余)的物质质量不在总质量之内。
3. 在根据化学方程式推断某未知物质化学式时,数原子个数时,一定要注意它的化学式前面是否有系数。
如C2H5OH +3 O2 2 CO2+3 X,求X物质的化学式,一个X分子里含有2个氢原子和1个氧原子,而不是6个氢原子和3个氧原子。
JI CHU LIAN XI
PART FIVE
05
2025
基础练习
真题解读
考点对标
知识构建
夯实基础
基础练习
素养提升
1. (2023·湖南)汽油中加入适量乙醇作为汽车燃料,可节省石油资源,减少汽车尾气污染。乙醇充分燃烧的化学方程式为C2H5OH+3O2 2CO2+3X,试推测X的化学式是( B )
A. H2 B. H2O C. CO D. H2O2
2. (2024·齐齐哈尔)在2023年杭州亚运会开幕式中,主火炬燃料创新使用了零碳甲醇。制备甲醇所发生反应的化学方程式为:X+3H2 CH3OH+H2O,其中X的化学式为( D )
A. H2CO3 B. C C. CO D. CO2
B
D
3. 丙烷(分子式为C3H8)燃烧的化学方程式为C3H8+5O2 xCO2+yH2O,其中x、y分别为 ( A )
A. 3、4 B. 3、8 C. 1、3 D. 1、5
A
4. (2024·黑龙江龙东)固定和利用二氧化碳能有效减少空气中的温室气体。工业上利用二氧化碳和物质X反应生产尿素,化学方程式为CO2+2X = CO(NH2)2+H2O,下列说法正确的是( B )
A. 该反应中有三种氧化物
B. X的化学式是NH3
C. 尿素属于铵态氮肥,不能与草木灰混合施用
D. CO2属于空气污染物
B
5. 下列实验能验证质量守恒定律的是( B )
A. ①镁条在空气中燃烧前后质量的测定
B. ②氯化钡溶液与硫酸铜溶液反应前后质量的测定
C. ③蜡烛燃烧前后质量的测定
D. ④锌粒和稀盐酸反应前后质量的测定
B
6. (2023·湖南)一定条件下,下列物质在密闭容器内反应一段时间,测得反应前后各物质的质量关系如表所示。
物质 X Y Z W
反应前质量/g 5 2.2 16.2 0.9
反应后质量/g a 4.4 8.1 1.8
根据上表信息判断,下列说法不.正.确.的是( B )
B
A. a=10.0
B. 该反应属于置换反应
C. Z为化合物
D. 反应中Y、W两种物质发生改变的质量比为22∶9
SU YANG TI SHENG
PART SIX
06
2025
素养提升
真题解读
考点对标
知识构建
夯实基础
基础练习
素养提升
7. (2024·宜宾)一定条件下,X、Y、乙、W四种物质在密闭容器中充分反应,测得反应前后各物质质量如下表。下列说法正确的是( D )
物质 X Y Z W
反应前的质量/g 6.8 1.0 93.2 0
反应后的质量/g 0 a 96.8 3.2
D
A. A=1.0,Y一定是该反应的催化剂
B. 该反应一定为化合反应
C. X与W相对分子质量之比一定为17∶8
D. Z与W质量变化之比一定为9∶8
8. (2024·黑龙江龙东)密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示。下列说法错.误.的是 ( C )
A. 该反应基本反应类型为化合反应
B. 该化学反应中乙、丙质量比为3∶17
C. 物质丙可能为单质
D. 物质丁可能是该反应的催化剂
C
9. (2024·山西)在一次实验课上,同学们通过小组合作,完成了对密闭容器中少量小苏打与少量白醋反应的质量测定。以下分析正确的是 ( C )
A. 反应后小苏打的质量增加
B. 反应过程中各物质的质量都不变
C. 反应前后各物质的质量总和相等
D. 反应前称量的是小苏打和白醋的总质量
C
10. (2023·湖北)水煤气中的CO和H2在一定条件下能发生化学反应,该过程的微观示意图如图所示。下列说法正确的是 ( C )
A. 该反应的基本反应类型为置换反应
B. 反应前后,原子和分子的个数均不变
C. 参加反应的CO和H2的质量比为14∶3
D. 丙的化学式为CH4,属于无机物
C
11. (2024·南通)合成氨是20世纪伟大的成就之一。研究氨气的组成、性质及用途具有重要意义。
(1)液氨可用作制冷剂。构成氨分子的微粒是氮原子和 氢原子 。液态的氨转化为氨气的过程中,氨分子间的距离 变大 (填“变大”或“变小”)。
氢原子
变大
(2)反应8NH3+3Cl2 6NH4Cl+N2可用于检查输送氯气的管道是否泄漏。
①N的质子数为7,核外第一层有2个电子,则第二层有 5 个电子。由Cl转化为Cl-的过程中,Cl 得到电子 (填“得到电子”或“失去电子”);
②N 中H的化合价为+1价,则N的化合价为 -3 价。
5
得到电子
-3
(3)NH3在能源与环境领域应用广泛。
①NH3燃烧生成N2和H2O,未来可用作化石燃料的替代能源,从产物的角度分析,作为燃料NH3相比于CH4的优点是 燃烧产物无污染(或环保) ;
②NH3可用于烟气脱硝,如4NH3+6R 5N2+6H2O,R的化学式为 NO 。
燃烧产物无污染
(或环保)
NO
12. (2023·广西改编)古有《齐民要术》记载“粟米曲作酢”,“酢”即醋酸也;今有我国科研人员研究出制取醋酸(CH3COOH)的新方法。新方法的反应微观示意图如图所示。
(1)古法酿醋是用粮食经过发酵而成,发酵属于 化学 变化。
(2)保持醋酸化学性质的最小微粒是 CH3COOH (写化学式)。
(3)新方法的反应化学方程式是 CO2+CH4 CH3COOH 。
化学
CH3COOH
CO2+CH4 CH3COOH
(4)这一新方法的重要意义除了制取醋酸外,还有助于减缓 温室 效应。
温室
同课章节目录
