中考二轮复习 专题2 科普阅读 课件(共52张PPT)
文档属性
| 名称 | 中考二轮复习 专题2 科普阅读 课件(共52张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-14 10:04:18 | ||
图片预览











文档简介
(共52张PPT)
第二部分 题型训练
第二部分
专题二
专题二 科普阅读
CONTENTS
目录
题型解读
01
KAO DIAN DUI BIAO
02
ZHEN TI JIE DU
真题解读
基础练习
03
ZHI SHI GOU JIAN
04
HANG SHI JI CHU
备考演练
SU YANG TI SHENG
PART ONE
01
2025
题型解读
真题解读
题型解读
基础练习
备考演练
1. 题型分析
科普阅读考查学生文字、图、表的阅读分析和提取信息能力,测评学生的化学素养。
2. 解题策略
①读题:快速阅读短文、了解图片信息,抓住解题题眼做必要的标注;
②审题:作答时带着设问中的问题反复阅读题干中的相关信息,寻找提取符合题意的有用信息,从化学的角度思考回答相应问题;
③联系:将短文信息与已学知识或生活常识联系,迁移应用后得出答案;
④规范:注意各类前提条件,如“在某温度下”“标准情况下”,气体、沉淀符号等。
ZHEN TI JIE DU
PART TWO
02
2025
真题解读
真题解读
题型解读
基础练习
备考演练
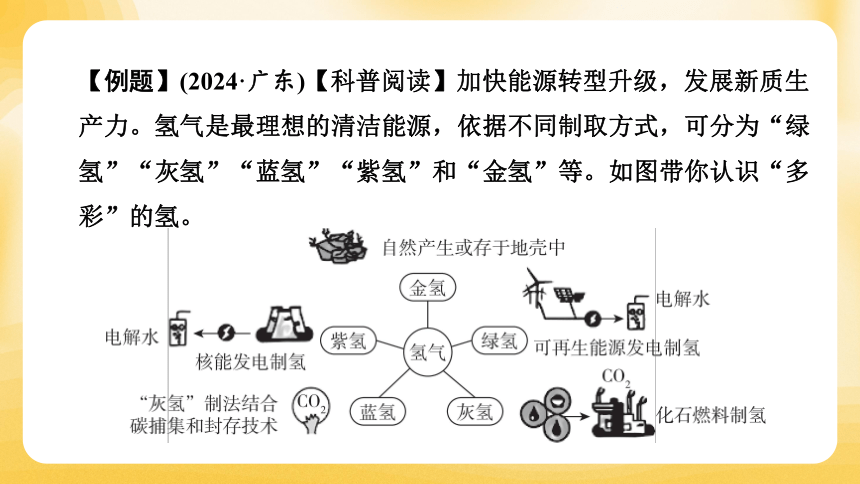
【例题】(2024·广东)【科普阅读】加快能源转型升级,发展新质生产力。氢气是最理想的清洁能源,依据不同制取方式,可分为“绿氢”“灰氢”“蓝氢”“紫氢”和“金氢”等。如图带你认识“多彩”的氢。
储氢是实现氢能广泛应用的重要环节,分为物理储氢和化学储氢,前者包括高压气态、低温液态、吸附等储存方式,后者将氢气转化为其他化合物进行储存。“液氨储氢”的原理是氢气与氮气在一定条件下生成液氨,进行储存。
依据上文,回答问题。
(1)电解水制氢的化学方程式为 2 H2O 2 H2↑+O2↑ 。
【详解】通电水分解生成氢气和氧气,化学方程式为2 H2O
2H2↑+O2↑。
2 H2O 2 H2↑+O2↑
(2)属于“绿氢”和“紫氢”的分别是 a 和 c (填字母)。
a.风能发电制氢 b.煤燃烧发电制氢 c.核能发电制氢
【详解】“绿氢”:可再生资源发电制氢,风能属于可再生能源,故选a;“紫氢”:核能发电制氢,故选c。
a
c
(3)从微观角度解释,氢气能被压缩储存的原因是 分子之间存在。
【详解】从微观角度解释,氢气能被压缩储存的原因是分子之间有间隔,受压后,分子之间的间隔变小;
分子之间存在间隔
(4)将氢气降温液化进行储存,属于物理储氢中的 低温液态 储存方式。
【详解】储氢是实现氢能广泛应用的重要环节,分为物理储氢和化学储氢,前者包括高压气态、低温液态、吸附等储存方式,后者将氢气转化为其他化合物进行储存。将氢气降温液化进行储存,属于物理储氢中的低温液态储存方式;
低温液态
(5)“液氨储氢”属于 化学 (填“物理”或“化学”)储氢。
【详解】“液氨储氢”的原理是氢气与氮气在一定条件下生成液氨,进行储存,则“液氨储氢”属于化学储氢;
(6)写出氢能的一种应用 作燃料等(合理即可) 。
【详解】氢气具有可燃性,氢能可用作燃料、还原剂等(合理即可)。
化学
作燃料等(合理即可)
【点拨】本题涉及书写电解水制氢的化学方程式;阅读信息举例说明什么是“绿氢”和“紫氢”;解释氢气能被压缩储存的原因;物理储氢的种类和原理;“液氨储氢”的本质是什么;举例说明氢能的一种应用。
JI CHU LIAN XI
PART THREE
03
2025
基础练习
真题解读
题型解读
基础练习
备考演练
1. (2023·广东)地球是一个美丽的“水球”,表面约71%被水覆盖,淡水仅占总水量的2.5%,其余是海水或咸水,海水淡化是解决人类淡水资源短缺的有效措施,全球海水淡化水用途如图1所示。
海水淡化技术主要有热分离法和膜分离法,热分离法利用蒸发和冷凝分离水与非挥发性物质,能耗大、成本高;膜分离法利用薄膜的选择透过性实现海水淡化,但现有薄膜的水通量低,应用受到限制。有科学家提出,给石墨烯“打上”许多特定大小的孔,制成单层纳米孔二维薄膜,可进行海水淡化。石墨烯海水淡化膜工作原理如图2所示。
依据上文,回答下列问题。
(1)全球海水淡化水用途排在首位的是 市政供水 。
(2)热分离法中,水发生了 物理变化 (填“物理变化”或“化学变化”)。限制热分离法大规模应用的原因是 能耗大、成本高 。
(3)石墨烯海水淡化膜允许 水分子 通过。
市政供水
物理变化
能耗大、成本高
水分子
(4)石墨烯、金刚石和C60均属于碳单质,下列说法正确的是 a (填字母)。
a.都由碳元素组成
b.都由碳原子构成
c.物理性质相似
(5)提出爱护水资源的一条建议 淘米的水用来浇花 。
a
淘米的水用来浇花
2. 地球是一个美丽的“水球”,表面约71%被水覆盖,淡水仅占总水量的2.5%;其余是海水或咸水。海水淡化是解决人类淡水资源短缺的有效措施。海水淡化技术主要有热分离法和膜分离法。我国科学家利用太阳光在某种新型催化剂表面高效分解水后,再利用某种高效催化剂将二氧化碳转化成有机物X。反应过程如图2所示。
根据上文,回答下列问题。
(1)图1为一种海水淡化装置示意图,该海水淡化方法为 热分离 。
(2)下列净水方法与图一海水淡化原理相似的是 C (填字母)。
A. 过滤 B. 吸附 C. 蒸馏 D. 消毒
(3)在图2中,反应①、②使用的新型催化剂在反应前后的 质量 和化学性质都没有发生变化。
热分离法
C
质量
(4)反应①的能量转化形式中存在光能转化为 化学能 能,产生的H2、O2的质量比约为 1∶8 。
(5)反应②的化学方程式:3H2+CO2 H2O+X ,则有机物X的分子式为 CH4O 。
化学能
1∶8
CH4O
3. (2021·广东)诗人陆游的笔记中记载“书灯勿用铜盏,想瓷盏最省油,蜀中有夹瓷盏…可省油之半”“一端作小窍,注清冷水于其中,每夕一易之”,夹瓷盏被称为省油灯,用棉绳做炷(灯芯),上层盏盛油,下层盏盛水。其结构示意图如图。
(1)图中属于可燃物的是 炷 和 油 ,这是燃烧的 三 个条件之一。
炷
油
三
(2)省油灯的原理是:油燃烧 放热 ,上层内盏油温 升高 ,下层盏内水吸热,减少油的 蒸发 ,以达到省油的目的。
放热
升高
蒸发
(3)“注清冷水于其中,每夕一易之”说明下层盏中的水不断减少。对该现象的微观解释正确的是 bc (多选,填字母)。
a.水分子受热分解 b.水分子不断运动
c.水分子间隔变大 d.水分子数目减少
bc
SU YANG TI SHENG
PART FOUR
04
2025
备考演练
真题解读
题型解读
基础练习
备考演练
4. 阅读科普短文,回答下列问题。
减少CO2排放的有效措施是CO2的捕集和开发可再生能源等。
CO2捕集关键是将CO2从排放物中分离出,主要方法为物理吸收法和化学吸收法。物理吸收法用活性炭、沸石等对CO2进行吸附性吸收;化学吸收法用氨水(NH3·H2O)与CO2反应生成NH3·H2O分离获得的CO2与由在一定条件下反应生成甲醇(CH3OH)和H2O,转化过程如图1所示。
开发可再生的氢能源也是减少CO2排放的方法。利用甲烷(CH4)和水催化重整可制得H2 (混有CO2)。提纯H2可用金属膜透氢;某温度下,H2在金属膜表面上解离成H,微观过程如图2所示。
(1)图1中反应 Ⅰ 的化学方程式为 2H2O 2H2 +,反应I消耗的H2O中氢元素质量 > 反应 Ⅱ 生成的甲醇中氢元素质量(选填“>”、“<”或“=”)。
(2)氢气作燃料的原因为 2H2+O2 2H2O (用化学方程式表示)。
2H2O 2H2+ O2
>
2H2+O2 2H2O
(3)从微观角度描述图2中金属膜提纯H2的过程 氢分子在金属膜表面解离成氢原子,氢原子(其它原子不能)穿过金属膜后,氢原子重新结合为氢分子 。
(4)作为中学生,我们应如何践行“低碳”生活? 绿色出行,多骑自行车 (只写1种做法)。
氢分子在金属膜
表面解离成氢原子,氢原子(其它原子不能)穿过金属膜后,氢原子重
新结合为氢分子
绿色出行,多骑
自行车
5. 阅读文本,回答问题。
气候变化中的海洋
海洋覆盖了地球70%以上的面积,是世界上最大的生物栖息地,有超过25万种生物生活在其中,为人类提供了食物、能源和交通,是应对气候变化的忠实“朋友”。
20世纪50年代以来,人类活动产生的温室气体导致地球系统热量不断增加。海洋吸收了绝大部分全球变暖的热量,还“消化”了2~3倍人为排放的二氧化碳,减缓了气候变化速度及影响。
20世纪90年代初以来,海洋变暖的速度增加了1倍。在过去的20年里,所有大洋盆地都观测到了持续数天到数月的极端海洋高温天气,即“海洋高温热浪”,它可以延伸数千千米的范围,深达数百米。热浪频发,易引起更强烈的热带气旋、厄尔尼诺现象等。2006~2015年,全球平均海平面每年上升约3.6 mm,为1901~1990年期间上升速度的2.5倍。海洋在溶解了二氧化碳后,酸性增强,会影响牡蛎、蛤蜊等贝类的外壳或骨骼的形成。
(1)海洋为人类提供的食物有 海鲜(或鱼,合理即可) (举1例)。
(2)海洋吸收热量发生的变化属于 物理变化 (填“物理变化”或“化学变化”)。
(3)文中涉及二氧化碳的物理性质有 可溶于水 ,化学性质有 溶于水后液体呈酸性 。(写1条即可)
(4)“海洋高温热浪”对海洋生物的危害是 降低生物活性(或危害生物的生存,合理即可) 。为保护海洋生态系统,人类应采取的有效措施是 减少化石能源的使用(或使用清洁能源,合理即可) 。
海鲜(或鱼,合理即可)
物理变化
可溶于水
溶
于水后液体呈酸性
降低生物活性(或危害生
物的生存,合理即可)
减少化石能源的使用(或使用清洁能源,合理即可)
6. (2024·湖南)阅读下列材料。
陶瓷基复合材料是以陶瓷材料为基体,以高强度纤维、晶须、晶片和颗粒为增强体通过适当的复合工艺所制成的复合材料。
陶瓷材料可分为氧化物陶瓷(如氧化铝陶瓷)和非氧化物陶瓷(如碳化物陶瓷、氢化物陶瓷等),具有硬度大、相对密度较小、抗氧化、高温磨损性能好和耐化学侵蚀性好等优点,但也存在断裂韧性低、断裂应变小、抗冷热交变和冲击载荷性能差的固有缺点。向陶瓷基体中加入增强体能够改善陶瓷材料固有的脆性,提高其韧性和抗脆性断裂能力。
陶瓷基复合材料优异的高温性能可显著降低发动机燃油消耗,提高运行效率,具有良好的应用前景。在航天航空领域,陶瓷基复合材料主要应用于液体推进火箭发动机的热结构件、喷气发动机等的高温部件。
依据材料内容,回答下列问题。
(1)材料中提到的氧化物是 氧化铝(或Al2O3) 。
(2)写出陶瓷材料的一条物理性质 硬度大(或相对密度较小) 。
(3)在航天航空领域,陶瓷基复合材料主要应用于 液体推进火箭发动机的热结构件或喷气发动机的高温部件 (写一条即可)。
氧化铝(或Al2O3)
硬度大(或相对密度较小)
液体推进火箭发
动机的热结构件或喷气发动机的高温部件
7. (2024·湖北)阅读科普短文。
液态阳光,是指利用太阳能和风能等可再生能源,将二氧化碳和水转化为以甲醇(CH3OH)为代表的液态燃料和有机化学品。它可以取代传统化石能源,实现二氧化碳的循环利用。液态阳光概念示意图如下。
2020年,我国“千吨级液态阳光甲醇合成示范项目”投产运行。该项目由太阳能光伏发电、电解水制氢、二氧化碳加氢制甲醇三个基本单元构成。标志着我国利用可再生能源制备液体燃料迈出了工业化的第一步。
甲醇作为液态阳光首要目标产物,能生产乙酸、烯烃等化学品,能用作内燃机燃料,也能用于燃料电池产生电能,还能通过重整反应释放出氢气。
(1)“液态阳光生产”利用的可再生能源是 太阳能(或风能或其他某种可再生能源) (写一种)。
(2)“液态阳光甲醇合成示范项目”使用的初始原料是 水或(H2O) 和CO2。
(3)可用NaOH溶液实现“碳捕获”,其反应的化学方程式为 2NaOH+CO2 Na2CO3+H2O 。
(4)相比氢气,液体燃料甲醇的优点有 便于储(贮)存和运输或便于储(贮)存,或便于运输,或安全性高 (写一条)。
太阳能(或风能或其他某
种可再生能源)
水或(H2O)
2NaOH+CO2 Na2CO3+H2O
便于储(贮)存和运输或便于
储(贮)存,或便于运输,或安全性高
8. (2024·四川宜宾) 阅读下面科普短文。
2023年杭州亚运会场馆外墙覆盖了一层纳米级二氧化钛(TiO2)光催化保护薄膜,该薄膜在太阳光的照射下能够快速分解建筑物表面的污染物,让场馆外墙拥有神奇的自净能力。这是世界上首次在大型国际体育赛事场馆上超大面积使用光催化材料。TiO2作为一种含量丰富、无毒且化学性质稳定的光催化材料,广泛应用于降解有机污染物、分解水制氢、还原CO2等领域。由于TiO2只在紫外光区有催化作用,因此需要通过改变形态、掺杂非金属或金属(铁、铂、金等)等方法,使TiO2能在可见光区有催化作用,以提高催化效果。
目前,改变形态的方法有:通过喷雾、球磨等物理技术制备纳米管状、颗粒状的TiO2,或让TiO2与H2在高温下反应生成表面积更大且具有特殊孔隙的空心球。当TiO2中掺杂非金属或金属时,掺入物质的类型、掺入的量会对其光催化效果产生不同影响。掺杂不同比例石墨氮化碳(g-C3N4)的纳米TiO2光催化分解水时,产生H2质量随时间变化关系如下图。
在今后的研究中,科研人员将不断探索和完善相关工艺,使TiO2带来更多经济与社会效益。
回答下列问题。
(1)TiO2中钛元素的化合价是 +4 。
(2)氮化碳(C3N4)属于 化合物 (填“单质”或“化合物”)。
(3)TiO2光催化分解水制氢的化学方程式是 2H2O 2H2↑+ 。与电解水制氢相比,该方法的优点是 节约能源 (答出一点即可)。
+4
化合物
2H2O 2H2↑+ O2↑
节约能源
(4)下列关于TiO2的说法正确的是 CD (填字母)。
A. 改变形态的方法均属于物理方法
B. 掺杂石墨氮化碳越多,光催化分解水效果越好
C. 与掺杂铁相比,掺杂金(Au)会提高生产成本
D. TiO2光催化还原CO2有利于实现“碳中和”目标
CD
9. (2024·烟台)2024年4月24日是第九个中国航天日,主题为“极目楚天,共襄星汉”。中国人探索宇宙的脚步驰而不息。
(1)空间站种菜。航天员在太空吃到了自己种的蔬菜。蔬菜能为航天员提供 维生素(合理即可) (写1种主要的营养素)。为使蔬菜枝叶茂盛,可以施用的一种化肥是 NH4Cl(合理即可) (写化学式)。太空蔬菜在塑料网篮中种植,塑料属于 B (填字母)。
A. 无机非金属材料 B. 有机高分子材料
C. 金属材料 D. 复合材料
维生素(合理即可)
NH4Cl(合理即可)
B
(2)固体火箭发射卫星。我国在海阳市附近海域使用“引力一号”运载火箭将3颗卫星顺利送入预定轨道,刷新了全球最大固体运载火箭记录。高氯酸铵、铝粉等是固体运载火箭的主要推进剂,发射时高氯酸铵发生的化学反应是:2NH4ClO4 N2↑+2O2↑+X↑+4H2O↑
①X的化学式是 Cl2 ,NH4ClO4中
氯元素的化合价是 +7 ;
②铝粉在氧气中燃烧的化学方程式是
4Al+3O2 2Al2O3。
Cl2
+7
(3)太空燃烧实验。航天员在燃烧科学实验柜中以甲烷为燃料进行在轨点火燃烧实验,观察到甲烷火焰与地面上对照实验的火焰相比,显得短而圆,且微弱。
①制作燃烧科学实验柜的材料需具有的性质是 防火(合理即可) (写1条);
防火(合理即可)
②从燃烧的条件分析,点火的作用是 使温度达到可燃物的着火 ;
使温度达到可燃物的着火点
③下列对燃烧实验分析正确的是 BC (填字母)。
A. 空间站甲烷燃烧,不需要氧气
B. 空间站失重条件下燃烧产生的热气流向四周扩散,地面上热气流向上扩散
C. 空间站失重条件下空气流动性差,甲烷燃烧的火焰比较微弱
BC
10. (2024·赤峰市)我国科学家在国际上首次实现了二氧化碳到淀粉的人工合成,其中二氧化碳制取甲醇(CH3OH)环节的微观示意图如图(图中的微观粒子恰好完全反应)。
(1)该变化前后不发生改变的微观粒子是 原子 (填“分子”“原子”或“离子”)。
原子
(2)物质丁的化学式为 H2O ,该物质属于 化合物(或氧化物等) (填物质类别)。
(3)甲醇(CH3OH)中碳元素和氢元素的质量比为 3∶1 。
(4)你认为人工合成淀粉技术对解决粮食、环境等社会热点问题的意义是 缓解温室效应,缓解粮食危机 。
H2O
化合物(或氧化物等)
3∶1
缓解温室效应,缓解粮食危机
11. 阅读下面科普短文。
火药是中国古代三大化学工艺之一、黑火药由硝酸钾、木炭和硫粉混合而成,一定条件下引燃会发生爆炸。制作烟花的过程中,还加入一些发光剂和发色剂,它们使烟花呈现五彩缤纷的颜色。发光剂是金属镁或金属铝的粉末。发色剂是一些金属化合物,不同金属元素的化合物在火焰上灼烧时,发出不同颜色的光。例如,氯化钠和硫酸钠等物质在火焰上灼烧时会发出黄色光;含钙化合物会发出砖红色光;含铜化合物会发出绿色光。因此,人们常通过燃放烟花来烘托节日气氛,但由于黑火药燃烧会产生有害气体,也带来一些环境问题。
(1)黑火药是一种 混合物 (填“混合物”或“纯净物”)。
(2)如果火药燃烧时发出砖红色光,火药中可能添加的化合物是 ③ (填序号)。
①氯化钠 ②硫酸钠
③氯化钙 ④硫酸铜
混合物
③
(3)镁粉做发光剂是因为它在空气中燃烧,发出 耀眼的白光 。
(4)黑火药燃烧时,除生成二氧化碳、氮气外,还生成硫化钾(K2S)。该反应的化学方程式为: S+2KNO3+3C K2S+N2↑+ 。
耀眼的白光
S+2KNO3+3C K2S+N2↑+3CO2↑
(5) 若有必要燃放少量烟花爆竹,燃放时应该做好哪些安全防范工作 选择开阔场地、远离易燃物、做好防护、准备适当灭火器材,结束后不遗留火种 。
选择开阔场地、远离易燃物、做好防护、准备适当灭火器材,
结束后不遗留火种
12. 在“碳达峰、碳中和”的大背景下,CO2地质封存技术是当前缓解CO2排放的有效措施。CO2地质封存通常是将CO2由气态压缩成超临界流体后,通过管道注入到密闭地质构造中,形成对CO2的油气田封存、咸水层封存或煤层封存。
三种CO2封存途径中,煤层CO2封存技术成本更低,同时可提高煤层气(主要含CH4)采出率,增加经济效益,符合国家绿色发展理念。典型的煤层CO2封存过程如图所示,烟气注入到煤层后,利用煤对三种气体的吸附能力差异,实现分离。
然而,煤层CO2封存也涉及多种安全风险。如CO2注入后,易引发地质体结构失稳,导致CO2泄漏,使土壤、水酸化,破坏周围的生态环境,对人类健康产生影响。
(1)CO2地质封存的途径主要有煤层封存、 油气田封存 、 咸水层封存 。
(2)将CO2由气态压缩成超临界流体的过程中,CO2发生了 物理 (填“物理”或“化学”)变化。
(3)CO2使水酸化的原因是 CO2+H2O=H2CO3 (用化学方程式解释)。
油气田封存
咸水
层封存
物理
CO2+H2O=H2CO3
(4)下列说法正确的是 ab (多选,填字母)。
a.煤层CO2封存成本较低,同时可实现煤层气高效采收
b.煤层对CO2的吸附能力强于CH4和N2
c.煤层的CO2封存技术非常成熟,安全可靠
(5)除CO2地质封存外,请提出一条实现“碳中和”的建议: 大力植树造林或开发清洁能源或减少化石燃料的使用等(合理即可) 。
ab
大力
植树造林或开发清洁能源或减少化石燃料的使用等(合理即可)
第二部分 题型训练
第二部分
专题二
专题二 科普阅读
CONTENTS
目录
题型解读
01
KAO DIAN DUI BIAO
02
ZHEN TI JIE DU
真题解读
基础练习
03
ZHI SHI GOU JIAN
04
HANG SHI JI CHU
备考演练
SU YANG TI SHENG
PART ONE
01
2025
题型解读
真题解读
题型解读
基础练习
备考演练
1. 题型分析
科普阅读考查学生文字、图、表的阅读分析和提取信息能力,测评学生的化学素养。
2. 解题策略
①读题:快速阅读短文、了解图片信息,抓住解题题眼做必要的标注;
②审题:作答时带着设问中的问题反复阅读题干中的相关信息,寻找提取符合题意的有用信息,从化学的角度思考回答相应问题;
③联系:将短文信息与已学知识或生活常识联系,迁移应用后得出答案;
④规范:注意各类前提条件,如“在某温度下”“标准情况下”,气体、沉淀符号等。
ZHEN TI JIE DU
PART TWO
02
2025
真题解读
真题解读
题型解读
基础练习
备考演练
【例题】(2024·广东)【科普阅读】加快能源转型升级,发展新质生产力。氢气是最理想的清洁能源,依据不同制取方式,可分为“绿氢”“灰氢”“蓝氢”“紫氢”和“金氢”等。如图带你认识“多彩”的氢。
储氢是实现氢能广泛应用的重要环节,分为物理储氢和化学储氢,前者包括高压气态、低温液态、吸附等储存方式,后者将氢气转化为其他化合物进行储存。“液氨储氢”的原理是氢气与氮气在一定条件下生成液氨,进行储存。
依据上文,回答问题。
(1)电解水制氢的化学方程式为 2 H2O 2 H2↑+O2↑ 。
【详解】通电水分解生成氢气和氧气,化学方程式为2 H2O
2H2↑+O2↑。
2 H2O 2 H2↑+O2↑
(2)属于“绿氢”和“紫氢”的分别是 a 和 c (填字母)。
a.风能发电制氢 b.煤燃烧发电制氢 c.核能发电制氢
【详解】“绿氢”:可再生资源发电制氢,风能属于可再生能源,故选a;“紫氢”:核能发电制氢,故选c。
a
c
(3)从微观角度解释,氢气能被压缩储存的原因是 分子之间存在。
【详解】从微观角度解释,氢气能被压缩储存的原因是分子之间有间隔,受压后,分子之间的间隔变小;
分子之间存在间隔
(4)将氢气降温液化进行储存,属于物理储氢中的 低温液态 储存方式。
【详解】储氢是实现氢能广泛应用的重要环节,分为物理储氢和化学储氢,前者包括高压气态、低温液态、吸附等储存方式,后者将氢气转化为其他化合物进行储存。将氢气降温液化进行储存,属于物理储氢中的低温液态储存方式;
低温液态
(5)“液氨储氢”属于 化学 (填“物理”或“化学”)储氢。
【详解】“液氨储氢”的原理是氢气与氮气在一定条件下生成液氨,进行储存,则“液氨储氢”属于化学储氢;
(6)写出氢能的一种应用 作燃料等(合理即可) 。
【详解】氢气具有可燃性,氢能可用作燃料、还原剂等(合理即可)。
化学
作燃料等(合理即可)
【点拨】本题涉及书写电解水制氢的化学方程式;阅读信息举例说明什么是“绿氢”和“紫氢”;解释氢气能被压缩储存的原因;物理储氢的种类和原理;“液氨储氢”的本质是什么;举例说明氢能的一种应用。
JI CHU LIAN XI
PART THREE
03
2025
基础练习
真题解读
题型解读
基础练习
备考演练
1. (2023·广东)地球是一个美丽的“水球”,表面约71%被水覆盖,淡水仅占总水量的2.5%,其余是海水或咸水,海水淡化是解决人类淡水资源短缺的有效措施,全球海水淡化水用途如图1所示。
海水淡化技术主要有热分离法和膜分离法,热分离法利用蒸发和冷凝分离水与非挥发性物质,能耗大、成本高;膜分离法利用薄膜的选择透过性实现海水淡化,但现有薄膜的水通量低,应用受到限制。有科学家提出,给石墨烯“打上”许多特定大小的孔,制成单层纳米孔二维薄膜,可进行海水淡化。石墨烯海水淡化膜工作原理如图2所示。
依据上文,回答下列问题。
(1)全球海水淡化水用途排在首位的是 市政供水 。
(2)热分离法中,水发生了 物理变化 (填“物理变化”或“化学变化”)。限制热分离法大规模应用的原因是 能耗大、成本高 。
(3)石墨烯海水淡化膜允许 水分子 通过。
市政供水
物理变化
能耗大、成本高
水分子
(4)石墨烯、金刚石和C60均属于碳单质,下列说法正确的是 a (填字母)。
a.都由碳元素组成
b.都由碳原子构成
c.物理性质相似
(5)提出爱护水资源的一条建议 淘米的水用来浇花 。
a
淘米的水用来浇花
2. 地球是一个美丽的“水球”,表面约71%被水覆盖,淡水仅占总水量的2.5%;其余是海水或咸水。海水淡化是解决人类淡水资源短缺的有效措施。海水淡化技术主要有热分离法和膜分离法。我国科学家利用太阳光在某种新型催化剂表面高效分解水后,再利用某种高效催化剂将二氧化碳转化成有机物X。反应过程如图2所示。
根据上文,回答下列问题。
(1)图1为一种海水淡化装置示意图,该海水淡化方法为 热分离 。
(2)下列净水方法与图一海水淡化原理相似的是 C (填字母)。
A. 过滤 B. 吸附 C. 蒸馏 D. 消毒
(3)在图2中,反应①、②使用的新型催化剂在反应前后的 质量 和化学性质都没有发生变化。
热分离法
C
质量
(4)反应①的能量转化形式中存在光能转化为 化学能 能,产生的H2、O2的质量比约为 1∶8 。
(5)反应②的化学方程式:3H2+CO2 H2O+X ,则有机物X的分子式为 CH4O 。
化学能
1∶8
CH4O
3. (2021·广东)诗人陆游的笔记中记载“书灯勿用铜盏,想瓷盏最省油,蜀中有夹瓷盏…可省油之半”“一端作小窍,注清冷水于其中,每夕一易之”,夹瓷盏被称为省油灯,用棉绳做炷(灯芯),上层盏盛油,下层盏盛水。其结构示意图如图。
(1)图中属于可燃物的是 炷 和 油 ,这是燃烧的 三 个条件之一。
炷
油
三
(2)省油灯的原理是:油燃烧 放热 ,上层内盏油温 升高 ,下层盏内水吸热,减少油的 蒸发 ,以达到省油的目的。
放热
升高
蒸发
(3)“注清冷水于其中,每夕一易之”说明下层盏中的水不断减少。对该现象的微观解释正确的是 bc (多选,填字母)。
a.水分子受热分解 b.水分子不断运动
c.水分子间隔变大 d.水分子数目减少
bc
SU YANG TI SHENG
PART FOUR
04
2025
备考演练
真题解读
题型解读
基础练习
备考演练
4. 阅读科普短文,回答下列问题。
减少CO2排放的有效措施是CO2的捕集和开发可再生能源等。
CO2捕集关键是将CO2从排放物中分离出,主要方法为物理吸收法和化学吸收法。物理吸收法用活性炭、沸石等对CO2进行吸附性吸收;化学吸收法用氨水(NH3·H2O)与CO2反应生成NH3·H2O分离获得的CO2与由在一定条件下反应生成甲醇(CH3OH)和H2O,转化过程如图1所示。
开发可再生的氢能源也是减少CO2排放的方法。利用甲烷(CH4)和水催化重整可制得H2 (混有CO2)。提纯H2可用金属膜透氢;某温度下,H2在金属膜表面上解离成H,微观过程如图2所示。
(1)图1中反应 Ⅰ 的化学方程式为 2H2O 2H2 +,反应I消耗的H2O中氢元素质量 > 反应 Ⅱ 生成的甲醇中氢元素质量(选填“>”、“<”或“=”)。
(2)氢气作燃料的原因为 2H2+O2 2H2O (用化学方程式表示)。
2H2O 2H2+ O2
>
2H2+O2 2H2O
(3)从微观角度描述图2中金属膜提纯H2的过程 氢分子在金属膜表面解离成氢原子,氢原子(其它原子不能)穿过金属膜后,氢原子重新结合为氢分子 。
(4)作为中学生,我们应如何践行“低碳”生活? 绿色出行,多骑自行车 (只写1种做法)。
氢分子在金属膜
表面解离成氢原子,氢原子(其它原子不能)穿过金属膜后,氢原子重
新结合为氢分子
绿色出行,多骑
自行车
5. 阅读文本,回答问题。
气候变化中的海洋
海洋覆盖了地球70%以上的面积,是世界上最大的生物栖息地,有超过25万种生物生活在其中,为人类提供了食物、能源和交通,是应对气候变化的忠实“朋友”。
20世纪50年代以来,人类活动产生的温室气体导致地球系统热量不断增加。海洋吸收了绝大部分全球变暖的热量,还“消化”了2~3倍人为排放的二氧化碳,减缓了气候变化速度及影响。
20世纪90年代初以来,海洋变暖的速度增加了1倍。在过去的20年里,所有大洋盆地都观测到了持续数天到数月的极端海洋高温天气,即“海洋高温热浪”,它可以延伸数千千米的范围,深达数百米。热浪频发,易引起更强烈的热带气旋、厄尔尼诺现象等。2006~2015年,全球平均海平面每年上升约3.6 mm,为1901~1990年期间上升速度的2.5倍。海洋在溶解了二氧化碳后,酸性增强,会影响牡蛎、蛤蜊等贝类的外壳或骨骼的形成。
(1)海洋为人类提供的食物有 海鲜(或鱼,合理即可) (举1例)。
(2)海洋吸收热量发生的变化属于 物理变化 (填“物理变化”或“化学变化”)。
(3)文中涉及二氧化碳的物理性质有 可溶于水 ,化学性质有 溶于水后液体呈酸性 。(写1条即可)
(4)“海洋高温热浪”对海洋生物的危害是 降低生物活性(或危害生物的生存,合理即可) 。为保护海洋生态系统,人类应采取的有效措施是 减少化石能源的使用(或使用清洁能源,合理即可) 。
海鲜(或鱼,合理即可)
物理变化
可溶于水
溶
于水后液体呈酸性
降低生物活性(或危害生
物的生存,合理即可)
减少化石能源的使用(或使用清洁能源,合理即可)
6. (2024·湖南)阅读下列材料。
陶瓷基复合材料是以陶瓷材料为基体,以高强度纤维、晶须、晶片和颗粒为增强体通过适当的复合工艺所制成的复合材料。
陶瓷材料可分为氧化物陶瓷(如氧化铝陶瓷)和非氧化物陶瓷(如碳化物陶瓷、氢化物陶瓷等),具有硬度大、相对密度较小、抗氧化、高温磨损性能好和耐化学侵蚀性好等优点,但也存在断裂韧性低、断裂应变小、抗冷热交变和冲击载荷性能差的固有缺点。向陶瓷基体中加入增强体能够改善陶瓷材料固有的脆性,提高其韧性和抗脆性断裂能力。
陶瓷基复合材料优异的高温性能可显著降低发动机燃油消耗,提高运行效率,具有良好的应用前景。在航天航空领域,陶瓷基复合材料主要应用于液体推进火箭发动机的热结构件、喷气发动机等的高温部件。
依据材料内容,回答下列问题。
(1)材料中提到的氧化物是 氧化铝(或Al2O3) 。
(2)写出陶瓷材料的一条物理性质 硬度大(或相对密度较小) 。
(3)在航天航空领域,陶瓷基复合材料主要应用于 液体推进火箭发动机的热结构件或喷气发动机的高温部件 (写一条即可)。
氧化铝(或Al2O3)
硬度大(或相对密度较小)
液体推进火箭发
动机的热结构件或喷气发动机的高温部件
7. (2024·湖北)阅读科普短文。
液态阳光,是指利用太阳能和风能等可再生能源,将二氧化碳和水转化为以甲醇(CH3OH)为代表的液态燃料和有机化学品。它可以取代传统化石能源,实现二氧化碳的循环利用。液态阳光概念示意图如下。
2020年,我国“千吨级液态阳光甲醇合成示范项目”投产运行。该项目由太阳能光伏发电、电解水制氢、二氧化碳加氢制甲醇三个基本单元构成。标志着我国利用可再生能源制备液体燃料迈出了工业化的第一步。
甲醇作为液态阳光首要目标产物,能生产乙酸、烯烃等化学品,能用作内燃机燃料,也能用于燃料电池产生电能,还能通过重整反应释放出氢气。
(1)“液态阳光生产”利用的可再生能源是 太阳能(或风能或其他某种可再生能源) (写一种)。
(2)“液态阳光甲醇合成示范项目”使用的初始原料是 水或(H2O) 和CO2。
(3)可用NaOH溶液实现“碳捕获”,其反应的化学方程式为 2NaOH+CO2 Na2CO3+H2O 。
(4)相比氢气,液体燃料甲醇的优点有 便于储(贮)存和运输或便于储(贮)存,或便于运输,或安全性高 (写一条)。
太阳能(或风能或其他某
种可再生能源)
水或(H2O)
2NaOH+CO2 Na2CO3+H2O
便于储(贮)存和运输或便于
储(贮)存,或便于运输,或安全性高
8. (2024·四川宜宾) 阅读下面科普短文。
2023年杭州亚运会场馆外墙覆盖了一层纳米级二氧化钛(TiO2)光催化保护薄膜,该薄膜在太阳光的照射下能够快速分解建筑物表面的污染物,让场馆外墙拥有神奇的自净能力。这是世界上首次在大型国际体育赛事场馆上超大面积使用光催化材料。TiO2作为一种含量丰富、无毒且化学性质稳定的光催化材料,广泛应用于降解有机污染物、分解水制氢、还原CO2等领域。由于TiO2只在紫外光区有催化作用,因此需要通过改变形态、掺杂非金属或金属(铁、铂、金等)等方法,使TiO2能在可见光区有催化作用,以提高催化效果。
目前,改变形态的方法有:通过喷雾、球磨等物理技术制备纳米管状、颗粒状的TiO2,或让TiO2与H2在高温下反应生成表面积更大且具有特殊孔隙的空心球。当TiO2中掺杂非金属或金属时,掺入物质的类型、掺入的量会对其光催化效果产生不同影响。掺杂不同比例石墨氮化碳(g-C3N4)的纳米TiO2光催化分解水时,产生H2质量随时间变化关系如下图。
在今后的研究中,科研人员将不断探索和完善相关工艺,使TiO2带来更多经济与社会效益。
回答下列问题。
(1)TiO2中钛元素的化合价是 +4 。
(2)氮化碳(C3N4)属于 化合物 (填“单质”或“化合物”)。
(3)TiO2光催化分解水制氢的化学方程式是 2H2O 2H2↑+ 。与电解水制氢相比,该方法的优点是 节约能源 (答出一点即可)。
+4
化合物
2H2O 2H2↑+ O2↑
节约能源
(4)下列关于TiO2的说法正确的是 CD (填字母)。
A. 改变形态的方法均属于物理方法
B. 掺杂石墨氮化碳越多,光催化分解水效果越好
C. 与掺杂铁相比,掺杂金(Au)会提高生产成本
D. TiO2光催化还原CO2有利于实现“碳中和”目标
CD
9. (2024·烟台)2024年4月24日是第九个中国航天日,主题为“极目楚天,共襄星汉”。中国人探索宇宙的脚步驰而不息。
(1)空间站种菜。航天员在太空吃到了自己种的蔬菜。蔬菜能为航天员提供 维生素(合理即可) (写1种主要的营养素)。为使蔬菜枝叶茂盛,可以施用的一种化肥是 NH4Cl(合理即可) (写化学式)。太空蔬菜在塑料网篮中种植,塑料属于 B (填字母)。
A. 无机非金属材料 B. 有机高分子材料
C. 金属材料 D. 复合材料
维生素(合理即可)
NH4Cl(合理即可)
B
(2)固体火箭发射卫星。我国在海阳市附近海域使用“引力一号”运载火箭将3颗卫星顺利送入预定轨道,刷新了全球最大固体运载火箭记录。高氯酸铵、铝粉等是固体运载火箭的主要推进剂,发射时高氯酸铵发生的化学反应是:2NH4ClO4 N2↑+2O2↑+X↑+4H2O↑
①X的化学式是 Cl2 ,NH4ClO4中
氯元素的化合价是 +7 ;
②铝粉在氧气中燃烧的化学方程式是
4Al+3O2 2Al2O3。
Cl2
+7
(3)太空燃烧实验。航天员在燃烧科学实验柜中以甲烷为燃料进行在轨点火燃烧实验,观察到甲烷火焰与地面上对照实验的火焰相比,显得短而圆,且微弱。
①制作燃烧科学实验柜的材料需具有的性质是 防火(合理即可) (写1条);
防火(合理即可)
②从燃烧的条件分析,点火的作用是 使温度达到可燃物的着火 ;
使温度达到可燃物的着火点
③下列对燃烧实验分析正确的是 BC (填字母)。
A. 空间站甲烷燃烧,不需要氧气
B. 空间站失重条件下燃烧产生的热气流向四周扩散,地面上热气流向上扩散
C. 空间站失重条件下空气流动性差,甲烷燃烧的火焰比较微弱
BC
10. (2024·赤峰市)我国科学家在国际上首次实现了二氧化碳到淀粉的人工合成,其中二氧化碳制取甲醇(CH3OH)环节的微观示意图如图(图中的微观粒子恰好完全反应)。
(1)该变化前后不发生改变的微观粒子是 原子 (填“分子”“原子”或“离子”)。
原子
(2)物质丁的化学式为 H2O ,该物质属于 化合物(或氧化物等) (填物质类别)。
(3)甲醇(CH3OH)中碳元素和氢元素的质量比为 3∶1 。
(4)你认为人工合成淀粉技术对解决粮食、环境等社会热点问题的意义是 缓解温室效应,缓解粮食危机 。
H2O
化合物(或氧化物等)
3∶1
缓解温室效应,缓解粮食危机
11. 阅读下面科普短文。
火药是中国古代三大化学工艺之一、黑火药由硝酸钾、木炭和硫粉混合而成,一定条件下引燃会发生爆炸。制作烟花的过程中,还加入一些发光剂和发色剂,它们使烟花呈现五彩缤纷的颜色。发光剂是金属镁或金属铝的粉末。发色剂是一些金属化合物,不同金属元素的化合物在火焰上灼烧时,发出不同颜色的光。例如,氯化钠和硫酸钠等物质在火焰上灼烧时会发出黄色光;含钙化合物会发出砖红色光;含铜化合物会发出绿色光。因此,人们常通过燃放烟花来烘托节日气氛,但由于黑火药燃烧会产生有害气体,也带来一些环境问题。
(1)黑火药是一种 混合物 (填“混合物”或“纯净物”)。
(2)如果火药燃烧时发出砖红色光,火药中可能添加的化合物是 ③ (填序号)。
①氯化钠 ②硫酸钠
③氯化钙 ④硫酸铜
混合物
③
(3)镁粉做发光剂是因为它在空气中燃烧,发出 耀眼的白光 。
(4)黑火药燃烧时,除生成二氧化碳、氮气外,还生成硫化钾(K2S)。该反应的化学方程式为: S+2KNO3+3C K2S+N2↑+ 。
耀眼的白光
S+2KNO3+3C K2S+N2↑+3CO2↑
(5) 若有必要燃放少量烟花爆竹,燃放时应该做好哪些安全防范工作 选择开阔场地、远离易燃物、做好防护、准备适当灭火器材,结束后不遗留火种 。
选择开阔场地、远离易燃物、做好防护、准备适当灭火器材,
结束后不遗留火种
12. 在“碳达峰、碳中和”的大背景下,CO2地质封存技术是当前缓解CO2排放的有效措施。CO2地质封存通常是将CO2由气态压缩成超临界流体后,通过管道注入到密闭地质构造中,形成对CO2的油气田封存、咸水层封存或煤层封存。
三种CO2封存途径中,煤层CO2封存技术成本更低,同时可提高煤层气(主要含CH4)采出率,增加经济效益,符合国家绿色发展理念。典型的煤层CO2封存过程如图所示,烟气注入到煤层后,利用煤对三种气体的吸附能力差异,实现分离。
然而,煤层CO2封存也涉及多种安全风险。如CO2注入后,易引发地质体结构失稳,导致CO2泄漏,使土壤、水酸化,破坏周围的生态环境,对人类健康产生影响。
(1)CO2地质封存的途径主要有煤层封存、 油气田封存 、 咸水层封存 。
(2)将CO2由气态压缩成超临界流体的过程中,CO2发生了 物理 (填“物理”或“化学”)变化。
(3)CO2使水酸化的原因是 CO2+H2O=H2CO3 (用化学方程式解释)。
油气田封存
咸水
层封存
物理
CO2+H2O=H2CO3
(4)下列说法正确的是 ab (多选,填字母)。
a.煤层CO2封存成本较低,同时可实现煤层气高效采收
b.煤层对CO2的吸附能力强于CH4和N2
c.煤层的CO2封存技术非常成熟,安全可靠
(5)除CO2地质封存外,请提出一条实现“碳中和”的建议: 大力植树造林或开发清洁能源或减少化石燃料的使用等(合理即可) 。
ab
大力
植树造林或开发清洁能源或减少化石燃料的使用等(合理即可)
同课章节目录
