中考二轮复习 专题5 综合能力题 课件(共54张PPT)
文档属性
| 名称 | 中考二轮复习 专题5 综合能力题 课件(共54张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-14 00:00:00 | ||
图片预览










文档简介
(共54张PPT)
第二部分 题型训练
第二部分
专题五
专题五 综合能力题
CONTENTS
目录
题型解读
01
KAO DIAN DUI BIAO
02
ZHEN TI JIE DU
真题解读
基础练习
03
ZHI SHI GOU JIAN
04
HANG SHI JI CHU
备考演练
SU YANG TI SHENG
PART ONE
01
2025
题型解读
真题解读
题型解读
基础练习
备考演练
1. 题型分析
随着广东中考化学试卷结构的改变,综合能力题结合了推断题及流程题的特点,能将化学知识与生产生活实际相结合,主动关心并参与有关空气和水资源保护、资源回收再利用、健康安全、化学品的合理使用等实际问题相融合的综合性试题。体现了化学与社会、化学与生活的理念。
编者综合了2020~2024年广东省综合能力题的考查情况,提出综合能力题的一般题型结构:以真实情景为背景信息,考查简单工艺生产的原料、目的和原理。将原料到产品以框图和箭头的形式呈现主要的生产工艺流程,考查学生化学知识融入到生产过程中的能力。
知识考查的重点有:①化学实验基本操作,如溶液的配制、过滤等方法;②混合物的分离和提纯的常见方法,如过滤、蒸发浓缩、结晶、吸附、蒸馏等;③物质之间的转化;④基本化学原理;⑤化学方程式的书写。综合能力的考查:包括分析、推理和评价的能力,提取和处理信息能力。往往表现为物质成分分析、对某些步骤中发生反应的判断、对整个生产过程进行评价以及根据提取信息解决问题等。
2. 解题策略
(1)审题与理解
了解实验目的:明确题目要求从混合物中分离、提纯某一物质还是制备另一物质。
整体把握:从题头(引入信息)→题干(提取信息,应用解题)→题尾(得出结论或产品),整体浏览题目
提取关键信息:注意题干的文字描述,提取出主要物质、杂质、所需试剂、操作步骤等关键信息。
(2)分析流程图
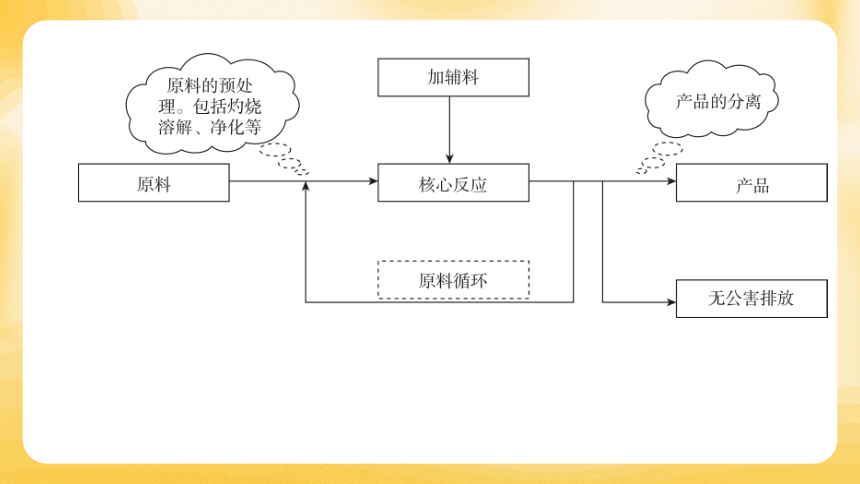
关注方框内所指:方框内可能以操作名称、物质名称或设备名称作为主线,明确每个方框代表的内容。
关注“箭头”:箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物)。通过箭头方向理解物质的流向和转化过程。
分析“三线”和“核心”:“三线”的出线和进线均表示物料流向或操作流程;主线通常代表主产品,分支代表副产品,可逆线表示物质循环使用。“核心”是指理解工艺流程中的核心反应或操作,它们对最终产品的生成起到关键作用。
(3)应用知识解题
回归课本知识,结合流程信息,考虑实际因素,还需要结合化工生产实际考虑原料成本低廉、环境友好、产量产率高等因素。
ZHEN TI JIE DU
PART TWO
02
2025
真题解读
真题解读
题型解读
基础练习
备考演练
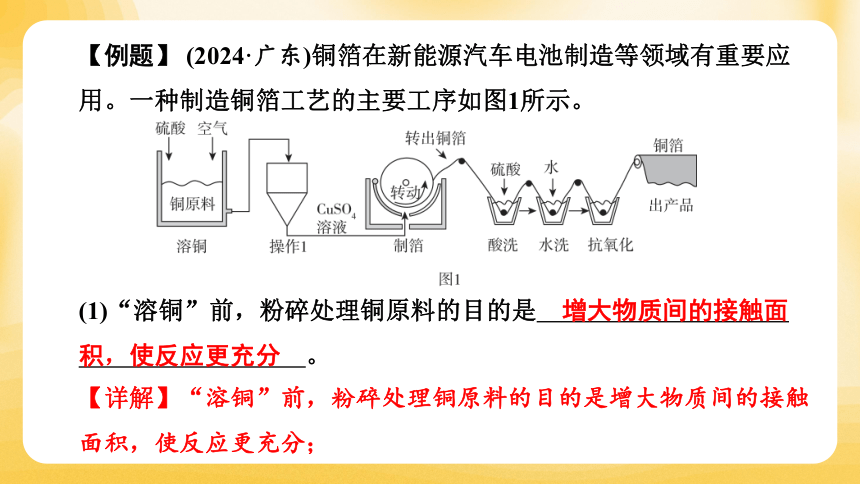
【例题】 (2024·广东)铜箔在新能源汽车电池制造等领域有重要应用。一种制造铜箔工艺的主要工序如图1所示。
(1)“溶铜”前,粉碎处理铜原料的目的是 增大物质间的接触面积,使反应更充分 。
【详解】“溶铜”前,粉碎处理铜原料的目的是增大物质间的接触面积,使反应更充分;
增大物质间的接触面
积,使反应更充分
(2)“溶铜”中,存在Cu与O2生成CuO的反应,该反应属于 化合反 (填基本反应类型)。“操作1”的目的是除去难溶性固体杂质,该操作名称为 过滤 。
【详解】“溶铜”中,存在Cu与O2生成CuO的反应,该反应属于化合反应;“操作1”的目的是除去难溶性固体杂质,该操作名称为过滤;
化合反应
过滤
(3)“制箔”中,发生反应的化学方程式:2CuSO4+2H2O 2Cu+O2↑+2X,X的化学式为 H2SO4。物质X可用于 溶铜和 酸洗 工序。
【详解】化学反应过程中,原子的种类和数目保持不变,“制箔”中,发生反应的化学方程式:2CuSO4+2H2O 2Cu+O2↑+2X,X的化学式为H2SO4;物质X可用于溶铜和酸洗工序。
H2SO4
溶铜
酸洗
(4)“制箔”中,需生产抗拉强度大于355MPa且延伸率大于13.5%的铜箔,据图2可知,温度应控制在 c (填字母)内。
c
a.45~49℃ b.50~52℃
c.53~55℃ d.56~60℃
【详解】“制箔”中,需生产抗拉强度大于355MPa且延伸率大于13.5%的铜箔,据图2可知,温度应控制在53~55℃内,故选C;
(5)“酸洗”后,用熟石灰中和酸性废液,其反应的化学方程式为 H2SO4+Ca(OH)2 CaSO4+2H2O 。
【详解】“酸洗”后,用熟石灰中和酸性废液,其反应的化学方程式为H2SO4+Ca(OH)2 CaSO4+2H2O。
H2SO4+Ca(OH)2 CaSO4+2H2O
JI CHU LIAN XI
PART THREE
03
2025
基础练习
真题解读
题型解读
基础练习
备考演练
1. (2023·广东)电解水制氢联合碳酸钙分解制备氧化钙,能减少碳排放,助力碳中和,该新方法的示意图如图1所示。
(1)传统方法:CaCO3在900 ℃以上完全分解生成CaO和 CO2 (填化学式)。
CO2
(2)新方法:
Ⅰ.电解水属于 分解 反应(填基本反应类型),反应前后氢元素的化合价 降低 (填“升高”“降低”或“不变”)。
Ⅱ.反应器1:一定的H2环境及较低温度下,CaCO3可与H2反应生成CaO、CO和H2O,CO与H2O的分子个数比为 1∶1 。
CaCO3还可以直接分解。反应器1中CO、CO2的含量随反应温度的变化如图2所示, 750 ℃时,抑制CO2生成的效果最好。
分解
降低
1∶1
750
Ⅲ.反应器2:一定条件下,CO与H2发生化合反应生成甲醇(CH3OH),化学方程式为 CO+2H2 CH3OH 。
(3)与传统方法相比,新方法的优点有 能减少碳排放,助力碳中和;节约能源 (写两条)。
CO+2H2 CH3OH
能减少碳排放,助力碳中
和;节约能源
2. (2022·广东)《千里江山图》是我国传世名画之一。宋代画家王希孟创造性地将炭照、赭石、孔雀石、蓝铜矿等矿物颜料用在不同的画层。
(1)画作用水墨打底,保存千年而不变色,说明常温下碳的化学性质 稳定(或不活泼) 。
(2)画作的青色用到蓝铜矿,其主要成分为 Cu2(OH)2(CO3)x,则x= 1 。
稳定(或不活泼)
1
(3)画作中所用的矿物颜料也可用于冶炼金属。如图为碳元素的价类转化二维图。利用图中化合物 CO (写化学式)的还原性冶炼赭石(主要成分为 Fe2O3),反应过程中碳元素的化合价 升高 (填“升高”“降低”或“不变”)。
(4)若反应a~d均属同一种基本反应类型,则该反应类型为 化合,其中属于吸热反应的是 d (填字母)。
CO
升高
化合反应
d
(5)孔雀石[主要成分为Cu2(OH)2CO3]受热分解(反应e),生成三种氧化物,其中一种为黑色固体,该反应的化学方程式为 Cu2(OH)2CO3 2CuO+H2O+CO2↑ 。
Cu2(OH)2CO3 2CuO+H2O+CO2↑
3. (2021·广东)牙膏中常用碳酸钙粉末做摩擦剂,利用石灰石(杂质不溶于水和酸)制备纯净碳酸钙的一种方法如图。
(1)反应①的化学方程式为 CaCO3 CaO+CO2↑ ;“操作Ⅰ”的名称是 过滤 。
CaCO3 CaO+CO2↑
过滤
(2)反应②的化学方程式为 Na2CO3+CaCl2 CaCO3↓+2NaCl ,该反应属于 复分解 反应(填基本反应类型)。
Na2CO3+CaCl2 CaCO3↓+
2NaCl
复分解
(3)该方法中,用稀硫酸代替稀盐酸对制备碳酸钙是否有影响?判断并简述理由 有影响,因为稀硫酸和氧化钙反应生成的硫酸钙微溶于水,导致部分钙离子随着不溶物而除去,使溶液B中钙离子减少,从而导致碳酸钙产率降低 。
有影响,因为稀硫酸和氧化钙反应生成的硫酸钙微溶
于水,导致部分钙离子随着不溶物而除去,使溶液B中钙离子减少,
从而导致碳酸钙产率降低
(4)大气中CO2含量不断上升,会导致 温室效应 。我国在联合国大会上提出:努力争取2060年前实现“碳中和”,请提出一条实现“碳中和”的措施 植树造林(或低碳出行等) 。
温室效应
植树造林(或低碳出行等)
4. (2020·广东)某废酸液主要含H2SO4和FeSO4,研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分为CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。工艺流程如图。
(1)该废酸液的pH <7(填“<”或“>”)。操作Ⅰ的名称为 过。
(2)电石渣转化为石灰乳的过程会 放出 (填“吸收”或“放出”)热量。
<
过滤
放出
(3)“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成的产物是 Fe(OH)2 和 CaSO4 (填化学式)。
(4)磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为 Fe3O4 。
Fe(OH)2
CaSO4
Fe3O4
(5)研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为 7.5~8.0 ,pH较低时产率较低的主要原因是 四氧化三铁能和酸反应 。
7.5~8.0
四氧化三铁能和酸反应
溶液 的pH 6.0 6.5 7.0 7.5 8.0 9.0
产物颜色 黄褐色 黄褐色 较黑 很黑 很黑 灰黑色
产率(%) 43.9 50.6 86.2 93.0 92.3 91.6
SU YANG TI SHENG
PART FOUR
04
2025
备考演练
真题解读
题型解读
基础练习
备考演练
Fe2O3+3H2SO4 Fe2(SO4)3+ 3H2O
5. (2024·深圳)铁黄(FeOOH)是一种颜料,以某硫铁矿废渣(主要成分Fe2O3,含有少量的SiO2,其余成分不考虑)为原料,制取铁黄,以下是制取工艺流程。
注:铁黄不与水反应,SiO2不与水和H2SO4反应
(1)过程Ⅰ的化学方程式为 Fe2O3+3H2SO4 Fe2(SO4)3+,滤渣Ⅰ中的物质有 SiO2 (填化学式)。
SiO2
(2)过程Ⅱ的操作名称为 过滤 。
(3)过程Ⅲ中的化学方程式为FeSO4+2NaOH Fe(OH)2↓+Na2SO4,该反应属于 复分解 反应(填基本反应类型)。
过滤
复分解
(4)①FeOOH随着温度的升高,可以加热分解成Fe2O3,写出其反应的化学方程式 FeOOH Fe2O3+H2O ;
②温度不同时,生成的Fe2O3颜色如下表:
温度/℃ 400 700 750 800
颜色 橘红 鲜红 鲜红 暗红
如果希希同学想获得鲜红的Fe2O3,应把温度控制在 7 00℃- 。
FeOOH Fe2O3+H2O
700℃- 750℃
6. (2023·广州)制盐在我国有着悠久的历史。某盐湖水样品含有NaCl、Na2SO4及少量MgSO4和CaSO4,某小组从中获取NaCl和Na2SO4的主要过程如图1。
(1)“除杂1”应依次加入的两种试剂是 Ca(OH)2 、 Na2CO3 ,“除杂2”应加入的试剂是 HCl 。[除杂限选试剂:HCl、HNO3、Na2CO3、Ca(OH)2]
Ca(OH)2
Na2CO3
HCl
(2)将“溶液A”在80 ℃蒸发浓缩至有少量固体析出。
①该小组分析溶解度曲线图2,推测析出的少量固体是NaCl,但检验后却发现是Na2SO4。请作出合理解释: 溶液中硫酸钠的含量比氯化钠高,硫酸钠先达到饱和析出 。
②该小组停止蒸发浓缩,经 降温结晶 、
过滤得到大量Na2SO4固体及母液;将母液中
的NaCl分离出来,操作是 加热蒸发溶剂至
有较多晶体析出,趁热过滤,洗涤 。
溶液中硫酸钠的含量比
氯化钠高,硫酸钠先达到饱和析出
降温结晶
加热蒸发溶剂至有
较多晶体析出,趁热过滤,洗涤
(3)设计由硫磺(单质硫)生产Na2SO4的转化路径,依次写出反应的化学方程式: S+O2 SO2、SO2+2NaOH Na2SO3+H2O、2Na2SO3+O2 2Na2SO4 。(提示:常见+4价硫的化合物可与O2化合为+6价硫的化合物)
S+O2 SO2、SO2+2NaOH Na2SO3+
H2O、2Na2SO3+O2 2Na2SO4
7. (2024·湖北)某工厂在粗盐的提纯过程中产生大量“盐泥”[主要成分为Mg(OH)2、BaSO4和NaCl]。利用“盐泥”制备硫酸镁晶体的工艺流程如图所示。
已知:两种物质在不同温度时的溶解度如下表。
温度/℃ 0 20 40 60 80
NaCl溶解度/g 35.7 36.0 36.6 37.3 38.4
MgSO4溶解度/g 22. 33.7 44.5 54.6 55.8
(1)20 ℃时,NaCl的溶解度为 36.0 g。
(2)“反应器”中反应的化学方程式为 M g(OH)2+H2SO4 MgSO4+2H2O 。
(3)“过滤器1”产生的“滤渣”为 硫酸钡 。
36.0
Mg(OH)2+ H2SO4
MgSO4+2H2O
硫酸钡
(4)“结晶槽”中获得硫酸镁晶体的方法是 冷却(或降温) 结晶。
(5)从结晶槽中获得的硫酸镁晶体表面附着有杂质,需用试剂洗去。为避免晶体损失,最适宜的洗涤试剂是 饱和硫酸镁溶液 。
冷却(或降温)
饱和硫酸镁溶液
8. (2024·贵州)贵州蕴藏丰富的铝、锰、锌、铁、铜等矿产资源。合理开采、充分利用这些矿产资源,可实现“富矿精开”。
Ⅰ.精准识矿
(1)金属的性质与存在形式。
①铝具有很好的抗腐蚀性,因为铝在空气中能与氧气反应形成一层致密的氧化铝薄膜,反应的化学方程式为 4Al+3O2 2A 。
4Al+3O2
2Al2O3
②分别在放有锰片、铜片的试管中加入稀硫酸,锰片表面有气泡产生,铜片表面无明显变化。由此可知金属活动性:锰 强 (填“强”或“弱”)于铜。
③在放有锌片的试管中加入硫酸铜溶液,观察到的现象是 锌片附着一层红色固体,溶液由蓝色变成无色 。
多数金属的化学性质比较活泼,它们主要以化合物的形式存在于自然界。如菱锌矿(ZnCO3)、铝土矿(Al2O3)、菱锰矿(MnCO3)等。
强
锌片附
着一层红色固体,溶液由蓝色变成无色
Ⅱ.精深用矿
(2)工业上用赤铁矿(Fe2O3)炼铁,CO与Fe2O3反应的化学方程式为 Fe2O3+3CO 2Fe+3CO2 。炼铁时,加入菱锰矿可制得冶炼锰钢的材料。锰钢用作高铁的钢轨,利用了锰钢的 硬度大、耐腐蚀 性能。
Fe2O3+3CO 2Fe+3CO2
硬度大、
耐腐蚀
(3)用某菱锰矿为原料制备高附加值新型电池材料Mn3O4的流程如图1。
已知:菱锰矿中除MnCO3外,还有SiO2;MnCO3能与稀硫酸发生复分解反应,SiO2不溶于水也不与稀硫酸反应;氨水呈碱性。
①过滤器中得到的滤渣是 SiO2 ;
②反应器中,MnSO4溶液与O2反应可生成锰的氧化物,如MnO2、Mn2O3、Mn3O4。发生的反应之一是6MnSO4+6H2O+O2 2Mn3O4↓+6X,X的化学式是 H2SO4 ;
SiO2
H2SO4
③70℃时,在反应器中保持通入的O2和MnSO4溶液的质量不变,只改变MnSO4溶液的溶质质量分数,测得生成含锰元素的固体中锰元素的质量分数与MnSO4溶液的溶质质量分数之间的关系如图2。由图可知,当MnSO4溶液的溶质质量分数为5.1%时,可获得高纯度的Mn3O4,当MnSO4溶液的溶质质量分数为其它数值时,Mn3O4纯度降低,原因可能是 MnSO4溶液的溶质质量分数不同,生成不同的锰的氧化物 。
MnSO4溶液的溶质质量分数不同,生成不同的
锰的氧化物
9. (2024·福建)排放含磷废水会使水体富营养化。为除去废水中的磷,某小组开展下列研究。
Ⅰ.制备吸附剂
【实验1】往桑枝木炭中加入Fe2(SO4)3溶液,浸泡后再加入NaOH
溶液,调节溶液的pH,经系列操作制得吸附剂A和吸附剂B。
(1)使用 pH试纸 可测定溶液的pH。
(2)Fe2(SO4)3溶液和NaOH溶液反应生成Fe(OH)3沉淀和Na2SO4,反应
的化学方程式为 Fe2(SO4)3+6NaOH 2Fe(OH)3↓+。
pH试纸
Fe2(SO4)3+6NaOH 2Fe(OH)3↓+ 3Na2SO4
Ⅱ.研究吸附剂的性能
【实验2】为比较两种吸附剂的除磷性能,25 ℃时,分别取含磷浓度为7.5 mg·L-1的两份等量含磷废水,将废水的pH均调至6,用两种吸附剂进行控制单一变量实验,结果如表(吸附量是指每克吸附剂吸附的废水中磷元素的质量)。
实验 编号 实验条件 实验结果 吸附剂 吸附剂 质量/g 废水的pH 吸附时 间/min 吸附率/% 吸附量/
(mg·g-1)
① A 0.2 6 x 75.7 1.42
② B y 6 260 98.1 1.84
(3)上表中x= 260 ,y= 0.2 。
260
0.2
【实验3】为研究废水的pH对吸附剂A除磷性能的影响,设计实验方案。
(4)该实验方案为 将废水的pH调成不同大小,控制其他条件相同,分别用吸附剂A进行除磷实验,测定吸附率和吸附量 。
将废水的pH调成不同大小,控制其他条件相同,
分别用吸附剂A进行除磷实验,测定吸附率和吸附量
Ⅲ.研究吸附剂的应用
含磷废水的净化处理过程如图所示。
(5)从实验2数据判断,“吸附剂X”应选择吸附剂 B (填“A”或“B”),除磷效果较好。
(6)从以上净水过程可以归纳出物质分离的一般思路:
明确混合物中的物质→( 分析各物质的性质差异 )→确定物质的分离方法。
B
分析各物质的性质差异
10. (2024·常州)兴趣小组对我国的太空舱制取氧气系统(其剖面如图所示)进行了研究性学习。
Ⅰ.多角度认识制氧原理电源
(1)太空舱制氧系统中电源A极是 负 极;将燃着的蜡烛放入b管收集的气体中,看到燃烧 更旺 。
(2)太空舱制氧原理的化学方程式为 2H2O 2H2↑+O2↑ ,反应过程中种类和数目均没有发生变化的微粒是 H、O(用符号表示)。
负
更旺
2H2O 2H2↑+O2↑
H、O
(3)太空舱制氧过程中消耗的水和生成的氧气的质量关系是 A (填字母)。
A
Ⅱ.多措施提高制氧效率
【查阅资料】
提高电解效率的措施主要包括:增强水的导电性、改变电解温度、设置超声波场等。
【讨论分析】
(4)用30%的KOH溶液代替水进行电解,增大了水中 离子 的浓度,增强了水的导电性。
(5)升高电解温度能提高制氧效率的原因之一:温度升高,微粒 运动速率加快。
离子
运动
速率加快
(6)如图分别为两种不同条件下不锈钢电极表面的气泡直径分布情况图。
①气泡覆盖在电极表面使电解反应界面 减小 (填“增大”或“减小”),降低了电解效率。
减小
②超声波振动能提高电解效率的原因是 超声波振动能减少电极表面的气泡 。
超声波振动能减少电极表
面的气泡
第二部分 题型训练
第二部分
专题五
专题五 综合能力题
CONTENTS
目录
题型解读
01
KAO DIAN DUI BIAO
02
ZHEN TI JIE DU
真题解读
基础练习
03
ZHI SHI GOU JIAN
04
HANG SHI JI CHU
备考演练
SU YANG TI SHENG
PART ONE
01
2025
题型解读
真题解读
题型解读
基础练习
备考演练
1. 题型分析
随着广东中考化学试卷结构的改变,综合能力题结合了推断题及流程题的特点,能将化学知识与生产生活实际相结合,主动关心并参与有关空气和水资源保护、资源回收再利用、健康安全、化学品的合理使用等实际问题相融合的综合性试题。体现了化学与社会、化学与生活的理念。
编者综合了2020~2024年广东省综合能力题的考查情况,提出综合能力题的一般题型结构:以真实情景为背景信息,考查简单工艺生产的原料、目的和原理。将原料到产品以框图和箭头的形式呈现主要的生产工艺流程,考查学生化学知识融入到生产过程中的能力。
知识考查的重点有:①化学实验基本操作,如溶液的配制、过滤等方法;②混合物的分离和提纯的常见方法,如过滤、蒸发浓缩、结晶、吸附、蒸馏等;③物质之间的转化;④基本化学原理;⑤化学方程式的书写。综合能力的考查:包括分析、推理和评价的能力,提取和处理信息能力。往往表现为物质成分分析、对某些步骤中发生反应的判断、对整个生产过程进行评价以及根据提取信息解决问题等。
2. 解题策略
(1)审题与理解
了解实验目的:明确题目要求从混合物中分离、提纯某一物质还是制备另一物质。
整体把握:从题头(引入信息)→题干(提取信息,应用解题)→题尾(得出结论或产品),整体浏览题目
提取关键信息:注意题干的文字描述,提取出主要物质、杂质、所需试剂、操作步骤等关键信息。
(2)分析流程图
关注方框内所指:方框内可能以操作名称、物质名称或设备名称作为主线,明确每个方框代表的内容。
关注“箭头”:箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物)。通过箭头方向理解物质的流向和转化过程。
分析“三线”和“核心”:“三线”的出线和进线均表示物料流向或操作流程;主线通常代表主产品,分支代表副产品,可逆线表示物质循环使用。“核心”是指理解工艺流程中的核心反应或操作,它们对最终产品的生成起到关键作用。
(3)应用知识解题
回归课本知识,结合流程信息,考虑实际因素,还需要结合化工生产实际考虑原料成本低廉、环境友好、产量产率高等因素。
ZHEN TI JIE DU
PART TWO
02
2025
真题解读
真题解读
题型解读
基础练习
备考演练
【例题】 (2024·广东)铜箔在新能源汽车电池制造等领域有重要应用。一种制造铜箔工艺的主要工序如图1所示。
(1)“溶铜”前,粉碎处理铜原料的目的是 增大物质间的接触面积,使反应更充分 。
【详解】“溶铜”前,粉碎处理铜原料的目的是增大物质间的接触面积,使反应更充分;
增大物质间的接触面
积,使反应更充分
(2)“溶铜”中,存在Cu与O2生成CuO的反应,该反应属于 化合反 (填基本反应类型)。“操作1”的目的是除去难溶性固体杂质,该操作名称为 过滤 。
【详解】“溶铜”中,存在Cu与O2生成CuO的反应,该反应属于化合反应;“操作1”的目的是除去难溶性固体杂质,该操作名称为过滤;
化合反应
过滤
(3)“制箔”中,发生反应的化学方程式:2CuSO4+2H2O 2Cu+O2↑+2X,X的化学式为 H2SO4。物质X可用于 溶铜和 酸洗 工序。
【详解】化学反应过程中,原子的种类和数目保持不变,“制箔”中,发生反应的化学方程式:2CuSO4+2H2O 2Cu+O2↑+2X,X的化学式为H2SO4;物质X可用于溶铜和酸洗工序。
H2SO4
溶铜
酸洗
(4)“制箔”中,需生产抗拉强度大于355MPa且延伸率大于13.5%的铜箔,据图2可知,温度应控制在 c (填字母)内。
c
a.45~49℃ b.50~52℃
c.53~55℃ d.56~60℃
【详解】“制箔”中,需生产抗拉强度大于355MPa且延伸率大于13.5%的铜箔,据图2可知,温度应控制在53~55℃内,故选C;
(5)“酸洗”后,用熟石灰中和酸性废液,其反应的化学方程式为 H2SO4+Ca(OH)2 CaSO4+2H2O 。
【详解】“酸洗”后,用熟石灰中和酸性废液,其反应的化学方程式为H2SO4+Ca(OH)2 CaSO4+2H2O。
H2SO4+Ca(OH)2 CaSO4+2H2O
JI CHU LIAN XI
PART THREE
03
2025
基础练习
真题解读
题型解读
基础练习
备考演练
1. (2023·广东)电解水制氢联合碳酸钙分解制备氧化钙,能减少碳排放,助力碳中和,该新方法的示意图如图1所示。
(1)传统方法:CaCO3在900 ℃以上完全分解生成CaO和 CO2 (填化学式)。
CO2
(2)新方法:
Ⅰ.电解水属于 分解 反应(填基本反应类型),反应前后氢元素的化合价 降低 (填“升高”“降低”或“不变”)。
Ⅱ.反应器1:一定的H2环境及较低温度下,CaCO3可与H2反应生成CaO、CO和H2O,CO与H2O的分子个数比为 1∶1 。
CaCO3还可以直接分解。反应器1中CO、CO2的含量随反应温度的变化如图2所示, 750 ℃时,抑制CO2生成的效果最好。
分解
降低
1∶1
750
Ⅲ.反应器2:一定条件下,CO与H2发生化合反应生成甲醇(CH3OH),化学方程式为 CO+2H2 CH3OH 。
(3)与传统方法相比,新方法的优点有 能减少碳排放,助力碳中和;节约能源 (写两条)。
CO+2H2 CH3OH
能减少碳排放,助力碳中
和;节约能源
2. (2022·广东)《千里江山图》是我国传世名画之一。宋代画家王希孟创造性地将炭照、赭石、孔雀石、蓝铜矿等矿物颜料用在不同的画层。
(1)画作用水墨打底,保存千年而不变色,说明常温下碳的化学性质 稳定(或不活泼) 。
(2)画作的青色用到蓝铜矿,其主要成分为 Cu2(OH)2(CO3)x,则x= 1 。
稳定(或不活泼)
1
(3)画作中所用的矿物颜料也可用于冶炼金属。如图为碳元素的价类转化二维图。利用图中化合物 CO (写化学式)的还原性冶炼赭石(主要成分为 Fe2O3),反应过程中碳元素的化合价 升高 (填“升高”“降低”或“不变”)。
(4)若反应a~d均属同一种基本反应类型,则该反应类型为 化合,其中属于吸热反应的是 d (填字母)。
CO
升高
化合反应
d
(5)孔雀石[主要成分为Cu2(OH)2CO3]受热分解(反应e),生成三种氧化物,其中一种为黑色固体,该反应的化学方程式为 Cu2(OH)2CO3 2CuO+H2O+CO2↑ 。
Cu2(OH)2CO3 2CuO+H2O+CO2↑
3. (2021·广东)牙膏中常用碳酸钙粉末做摩擦剂,利用石灰石(杂质不溶于水和酸)制备纯净碳酸钙的一种方法如图。
(1)反应①的化学方程式为 CaCO3 CaO+CO2↑ ;“操作Ⅰ”的名称是 过滤 。
CaCO3 CaO+CO2↑
过滤
(2)反应②的化学方程式为 Na2CO3+CaCl2 CaCO3↓+2NaCl ,该反应属于 复分解 反应(填基本反应类型)。
Na2CO3+CaCl2 CaCO3↓+
2NaCl
复分解
(3)该方法中,用稀硫酸代替稀盐酸对制备碳酸钙是否有影响?判断并简述理由 有影响,因为稀硫酸和氧化钙反应生成的硫酸钙微溶于水,导致部分钙离子随着不溶物而除去,使溶液B中钙离子减少,从而导致碳酸钙产率降低 。
有影响,因为稀硫酸和氧化钙反应生成的硫酸钙微溶
于水,导致部分钙离子随着不溶物而除去,使溶液B中钙离子减少,
从而导致碳酸钙产率降低
(4)大气中CO2含量不断上升,会导致 温室效应 。我国在联合国大会上提出:努力争取2060年前实现“碳中和”,请提出一条实现“碳中和”的措施 植树造林(或低碳出行等) 。
温室效应
植树造林(或低碳出行等)
4. (2020·广东)某废酸液主要含H2SO4和FeSO4,研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分为CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。工艺流程如图。
(1)该废酸液的pH <7(填“<”或“>”)。操作Ⅰ的名称为 过。
(2)电石渣转化为石灰乳的过程会 放出 (填“吸收”或“放出”)热量。
<
过滤
放出
(3)“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成的产物是 Fe(OH)2 和 CaSO4 (填化学式)。
(4)磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为 Fe3O4 。
Fe(OH)2
CaSO4
Fe3O4
(5)研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为 7.5~8.0 ,pH较低时产率较低的主要原因是 四氧化三铁能和酸反应 。
7.5~8.0
四氧化三铁能和酸反应
溶液 的pH 6.0 6.5 7.0 7.5 8.0 9.0
产物颜色 黄褐色 黄褐色 较黑 很黑 很黑 灰黑色
产率(%) 43.9 50.6 86.2 93.0 92.3 91.6
SU YANG TI SHENG
PART FOUR
04
2025
备考演练
真题解读
题型解读
基础练习
备考演练
Fe2O3+3H2SO4 Fe2(SO4)3+ 3H2O
5. (2024·深圳)铁黄(FeOOH)是一种颜料,以某硫铁矿废渣(主要成分Fe2O3,含有少量的SiO2,其余成分不考虑)为原料,制取铁黄,以下是制取工艺流程。
注:铁黄不与水反应,SiO2不与水和H2SO4反应
(1)过程Ⅰ的化学方程式为 Fe2O3+3H2SO4 Fe2(SO4)3+,滤渣Ⅰ中的物质有 SiO2 (填化学式)。
SiO2
(2)过程Ⅱ的操作名称为 过滤 。
(3)过程Ⅲ中的化学方程式为FeSO4+2NaOH Fe(OH)2↓+Na2SO4,该反应属于 复分解 反应(填基本反应类型)。
过滤
复分解
(4)①FeOOH随着温度的升高,可以加热分解成Fe2O3,写出其反应的化学方程式 FeOOH Fe2O3+H2O ;
②温度不同时,生成的Fe2O3颜色如下表:
温度/℃ 400 700 750 800
颜色 橘红 鲜红 鲜红 暗红
如果希希同学想获得鲜红的Fe2O3,应把温度控制在 7 00℃- 。
FeOOH Fe2O3+H2O
700℃- 750℃
6. (2023·广州)制盐在我国有着悠久的历史。某盐湖水样品含有NaCl、Na2SO4及少量MgSO4和CaSO4,某小组从中获取NaCl和Na2SO4的主要过程如图1。
(1)“除杂1”应依次加入的两种试剂是 Ca(OH)2 、 Na2CO3 ,“除杂2”应加入的试剂是 HCl 。[除杂限选试剂:HCl、HNO3、Na2CO3、Ca(OH)2]
Ca(OH)2
Na2CO3
HCl
(2)将“溶液A”在80 ℃蒸发浓缩至有少量固体析出。
①该小组分析溶解度曲线图2,推测析出的少量固体是NaCl,但检验后却发现是Na2SO4。请作出合理解释: 溶液中硫酸钠的含量比氯化钠高,硫酸钠先达到饱和析出 。
②该小组停止蒸发浓缩,经 降温结晶 、
过滤得到大量Na2SO4固体及母液;将母液中
的NaCl分离出来,操作是 加热蒸发溶剂至
有较多晶体析出,趁热过滤,洗涤 。
溶液中硫酸钠的含量比
氯化钠高,硫酸钠先达到饱和析出
降温结晶
加热蒸发溶剂至有
较多晶体析出,趁热过滤,洗涤
(3)设计由硫磺(单质硫)生产Na2SO4的转化路径,依次写出反应的化学方程式: S+O2 SO2、SO2+2NaOH Na2SO3+H2O、2Na2SO3+O2 2Na2SO4 。(提示:常见+4价硫的化合物可与O2化合为+6价硫的化合物)
S+O2 SO2、SO2+2NaOH Na2SO3+
H2O、2Na2SO3+O2 2Na2SO4
7. (2024·湖北)某工厂在粗盐的提纯过程中产生大量“盐泥”[主要成分为Mg(OH)2、BaSO4和NaCl]。利用“盐泥”制备硫酸镁晶体的工艺流程如图所示。
已知:两种物质在不同温度时的溶解度如下表。
温度/℃ 0 20 40 60 80
NaCl溶解度/g 35.7 36.0 36.6 37.3 38.4
MgSO4溶解度/g 22. 33.7 44.5 54.6 55.8
(1)20 ℃时,NaCl的溶解度为 36.0 g。
(2)“反应器”中反应的化学方程式为 M g(OH)2+H2SO4 MgSO4+2H2O 。
(3)“过滤器1”产生的“滤渣”为 硫酸钡 。
36.0
Mg(OH)2+ H2SO4
MgSO4+2H2O
硫酸钡
(4)“结晶槽”中获得硫酸镁晶体的方法是 冷却(或降温) 结晶。
(5)从结晶槽中获得的硫酸镁晶体表面附着有杂质,需用试剂洗去。为避免晶体损失,最适宜的洗涤试剂是 饱和硫酸镁溶液 。
冷却(或降温)
饱和硫酸镁溶液
8. (2024·贵州)贵州蕴藏丰富的铝、锰、锌、铁、铜等矿产资源。合理开采、充分利用这些矿产资源,可实现“富矿精开”。
Ⅰ.精准识矿
(1)金属的性质与存在形式。
①铝具有很好的抗腐蚀性,因为铝在空气中能与氧气反应形成一层致密的氧化铝薄膜,反应的化学方程式为 4Al+3O2 2A 。
4Al+3O2
2Al2O3
②分别在放有锰片、铜片的试管中加入稀硫酸,锰片表面有气泡产生,铜片表面无明显变化。由此可知金属活动性:锰 强 (填“强”或“弱”)于铜。
③在放有锌片的试管中加入硫酸铜溶液,观察到的现象是 锌片附着一层红色固体,溶液由蓝色变成无色 。
多数金属的化学性质比较活泼,它们主要以化合物的形式存在于自然界。如菱锌矿(ZnCO3)、铝土矿(Al2O3)、菱锰矿(MnCO3)等。
强
锌片附
着一层红色固体,溶液由蓝色变成无色
Ⅱ.精深用矿
(2)工业上用赤铁矿(Fe2O3)炼铁,CO与Fe2O3反应的化学方程式为 Fe2O3+3CO 2Fe+3CO2 。炼铁时,加入菱锰矿可制得冶炼锰钢的材料。锰钢用作高铁的钢轨,利用了锰钢的 硬度大、耐腐蚀 性能。
Fe2O3+3CO 2Fe+3CO2
硬度大、
耐腐蚀
(3)用某菱锰矿为原料制备高附加值新型电池材料Mn3O4的流程如图1。
已知:菱锰矿中除MnCO3外,还有SiO2;MnCO3能与稀硫酸发生复分解反应,SiO2不溶于水也不与稀硫酸反应;氨水呈碱性。
①过滤器中得到的滤渣是 SiO2 ;
②反应器中,MnSO4溶液与O2反应可生成锰的氧化物,如MnO2、Mn2O3、Mn3O4。发生的反应之一是6MnSO4+6H2O+O2 2Mn3O4↓+6X,X的化学式是 H2SO4 ;
SiO2
H2SO4
③70℃时,在反应器中保持通入的O2和MnSO4溶液的质量不变,只改变MnSO4溶液的溶质质量分数,测得生成含锰元素的固体中锰元素的质量分数与MnSO4溶液的溶质质量分数之间的关系如图2。由图可知,当MnSO4溶液的溶质质量分数为5.1%时,可获得高纯度的Mn3O4,当MnSO4溶液的溶质质量分数为其它数值时,Mn3O4纯度降低,原因可能是 MnSO4溶液的溶质质量分数不同,生成不同的锰的氧化物 。
MnSO4溶液的溶质质量分数不同,生成不同的
锰的氧化物
9. (2024·福建)排放含磷废水会使水体富营养化。为除去废水中的磷,某小组开展下列研究。
Ⅰ.制备吸附剂
【实验1】往桑枝木炭中加入Fe2(SO4)3溶液,浸泡后再加入NaOH
溶液,调节溶液的pH,经系列操作制得吸附剂A和吸附剂B。
(1)使用 pH试纸 可测定溶液的pH。
(2)Fe2(SO4)3溶液和NaOH溶液反应生成Fe(OH)3沉淀和Na2SO4,反应
的化学方程式为 Fe2(SO4)3+6NaOH 2Fe(OH)3↓+。
pH试纸
Fe2(SO4)3+6NaOH 2Fe(OH)3↓+ 3Na2SO4
Ⅱ.研究吸附剂的性能
【实验2】为比较两种吸附剂的除磷性能,25 ℃时,分别取含磷浓度为7.5 mg·L-1的两份等量含磷废水,将废水的pH均调至6,用两种吸附剂进行控制单一变量实验,结果如表(吸附量是指每克吸附剂吸附的废水中磷元素的质量)。
实验 编号 实验条件 实验结果 吸附剂 吸附剂 质量/g 废水的pH 吸附时 间/min 吸附率/% 吸附量/
(mg·g-1)
① A 0.2 6 x 75.7 1.42
② B y 6 260 98.1 1.84
(3)上表中x= 260 ,y= 0.2 。
260
0.2
【实验3】为研究废水的pH对吸附剂A除磷性能的影响,设计实验方案。
(4)该实验方案为 将废水的pH调成不同大小,控制其他条件相同,分别用吸附剂A进行除磷实验,测定吸附率和吸附量 。
将废水的pH调成不同大小,控制其他条件相同,
分别用吸附剂A进行除磷实验,测定吸附率和吸附量
Ⅲ.研究吸附剂的应用
含磷废水的净化处理过程如图所示。
(5)从实验2数据判断,“吸附剂X”应选择吸附剂 B (填“A”或“B”),除磷效果较好。
(6)从以上净水过程可以归纳出物质分离的一般思路:
明确混合物中的物质→( 分析各物质的性质差异 )→确定物质的分离方法。
B
分析各物质的性质差异
10. (2024·常州)兴趣小组对我国的太空舱制取氧气系统(其剖面如图所示)进行了研究性学习。
Ⅰ.多角度认识制氧原理电源
(1)太空舱制氧系统中电源A极是 负 极;将燃着的蜡烛放入b管收集的气体中,看到燃烧 更旺 。
(2)太空舱制氧原理的化学方程式为 2H2O 2H2↑+O2↑ ,反应过程中种类和数目均没有发生变化的微粒是 H、O(用符号表示)。
负
更旺
2H2O 2H2↑+O2↑
H、O
(3)太空舱制氧过程中消耗的水和生成的氧气的质量关系是 A (填字母)。
A
Ⅱ.多措施提高制氧效率
【查阅资料】
提高电解效率的措施主要包括:增强水的导电性、改变电解温度、设置超声波场等。
【讨论分析】
(4)用30%的KOH溶液代替水进行电解,增大了水中 离子 的浓度,增强了水的导电性。
(5)升高电解温度能提高制氧效率的原因之一:温度升高,微粒 运动速率加快。
离子
运动
速率加快
(6)如图分别为两种不同条件下不锈钢电极表面的气泡直径分布情况图。
①气泡覆盖在电极表面使电解反应界面 减小 (填“增大”或“减小”),降低了电解效率。
减小
②超声波振动能提高电解效率的原因是 超声波振动能减少电极表面的气泡 。
超声波振动能减少电极表
面的气泡
同课章节目录
