中考二轮复习 专题6 化学方程式计算专题 课件(共58张PPT)
文档属性
| 名称 | 中考二轮复习 专题6 化学方程式计算专题 课件(共58张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-14 10:09:52 | ||
图片预览











文档简介
(共58张PPT)
第二部分 题型训练
第二部分
专题六
专题六 化学方程式计算专题
CONTENTS
目录
题型解读
01
KAO DIAN DUI BIAO
02
ZHEN TI JIE DU
真题解读
基础练习
03
ZHI SHI GOU JIAN
SU YANG TI SHENG
PART ONE
01
2025
题型解读
真题解读
题型解读
基础练习
1. 题型分析
新课标的学业质量要求中提出:能依据质量守恒定律并用化学方程式表征简单的化学反应,结合真实情境中物质的转化进行简单计算;课标要求中考计算题结合真实情境的数据,解决真实情景问题,更体现化学计算的真实意义。而在近几年中考题出现了以图像、表格及实验流程为载体的化学计算题,这类题的特点是利用数学方法将化学实验数据进行处理和表达,常常以坐标曲线、图像、表格等形式将解题信息呈现。解答此类题目时,要求学生能够对图像、表格进行科学分析,从中获取有用信息,并结合化学知识将有用信息应用到解决实际问题中。
2. 解题策略
(1)方程式简单计算的步骤
①设未知数;
②根据题意写出相关的化学方程式,并配平;
③根据题目找出已知与未知物质的质量,并算出它们的质量比,标在相应化学式的正下方;
④列出比例式;
⑤求出未知数;
⑥写出简要答案。
(2)方程式计算解题注意事项
①化学方程式所表示的反应物、生成物的质量关系是进行化学计算的基础,在化学方程式中各物质的化学式一定要书写正确,一定要配平化学方程式或关系式中某元素原子的数目一定要相等,相对分子质量的计算一定要准确;
②化学方程式中的各物质均指纯净物,参加计算的各物质的质量也必须是纯净物的质量;
③题目出现的“适量”“恰好反应”“完全反应”“足量”“充分反应”等词语,要正确理解,一般来说:
“适量”“恰好反应”和“完全反应”——两种(或多种)反应物之间按一定量比恰好完全反应,反应物无剩余。
“足量”“充分反应”——一种反应物完全反应,无剩余;另一种反应物可能完全反应,也可能过量。
④各物质的单位要统一。
(3)化学方程式的简单计算解题微技能
微技能1 寻找纯净物质量
①通过理解题意,直接找出化学反应方程式中相关纯净物质量;
②题目没有直接找到纯净物质量,可以尝试利用质量守恒定律,找出气体或者沉淀的质量;
③纯净物的质量=混合物的质量×该纯净物的质量分数;
④溶质质量=溶液质量×溶质质量分数。
【例题1】小杨同学取50.0 g硫酸铜溶液样品置于烧杯中,逐滴加入氢氧化钠溶液,加入氢氧化钠溶液质量和生成沉淀质量的关系如图所示,求样品溶液中溶质硫酸铜的质量时,直接代入化学方程式中纯净物是 Cu(OH)2 ,其质量为 4.9 g 。
Cu(OH)2
4.9 g
【例题2】为测定某过氧化氢溶液的溶质质量分数,实验中记录的相关数据如下。
反应前物质的质量 完全反应后物质的质量 过氧化氢溶液质量 二氧化锰质量 固体与液体混合物质量 氧气质量
34.0 g 0.1 g 33.3 g g
请计算:能直接代入化学方程式中纯净物是 O2,其质量为 0.8 。
O2
0.8 g
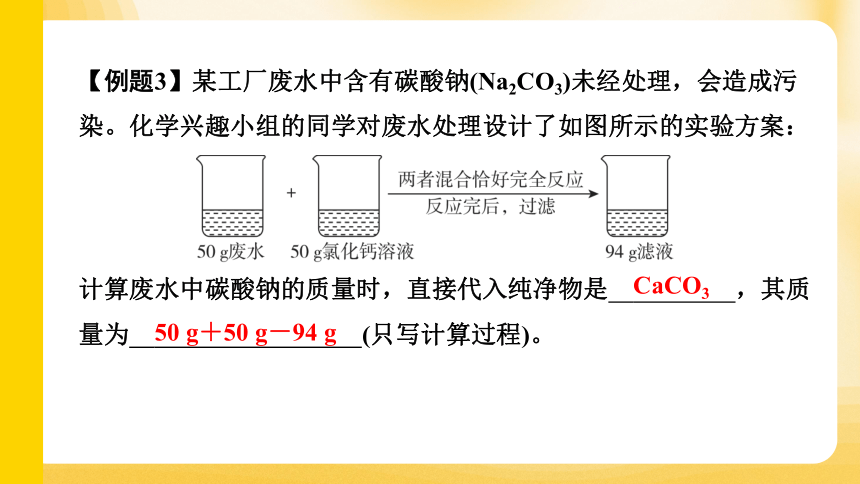
【例题3】某工厂废水中含有碳酸钠(Na2CO3)未经处理,会造成污染。化学兴趣小组的同学对废水处理设计了如图所示的实验方案:
计算废水中碳酸钠的质量时,直接代入纯净物是 CaCO3 ,其质量为 50 g+50 g-94 g (只写计算过程)。
CaCO3
50 g+50 g-94 g
【例题4】实验室欲测定一瓶稀H2SO4的溶质质量分数。现取50 g溶液样品,将20%的NaOH溶液逐滴加入到样品中,滴加过程pH的变化如图所示。
求反应后所得硫酸钠的质量时,直接代入化学方程式中纯净物是 NaOH ,其质量为 40 g×20% (只写计算过程)。
NaOH
40 g×20%
【例题5】工业上用赤铁矿石(主要成分是氧化铁)与一氧化碳在高温条件下冶炼生铁。现有40 t含氧化铁80%的赤铁矿石,求该矿石理论上能冶炼铁的质量时,直接代入化学方程式中纯净物是 Fe2O3 ,其质量为 40 t×80% 。
Fe2O3
40 t×80%
微技能2 计算反应物或生成物的质量分数
① 混合物中某物质的质量分数= ×100%
② 溶质质量分数= × 100%
【例题6】(2024·云南)为测定某过氧化氢溶液的溶质质量分数,实验中记录的相关数据如下。
反应前物质的质量 完全反应后物质的质量 过氧化氢溶液质量 二氧化锰质量 固体与液体混合物质量 氧气质量
34.0 g 0.1 g 33.3 g g
请计算:
(1)如表中氧气的质量为 0.8 g g。
解:(1)依据质量守恒定律可知:生成氧气质量=34.0 g+0.1 g-33.3 g=0.8 g。
0.8 g
2H2O2 2H2O+O2↑
68 32
x 0.8 g
=
x=1.7g
过氧化氢溶液的溶质质量分数= ×100%=5%
答:该过氧化氢溶液的溶质质量分数为5%。
(2)该过氧化氢溶液的溶质质量分数。
解:(2)设该过氧化氢溶液中溶质的质量为x。
ZHEN TI JIE DU
PART TWO
02
2025
真题解读
真题解读
题型解读
基础练习
【例题】(2024·广东)科研人员提出一种回收利用铝冶炼产生的废渣赤泥(含Fe2O3)的新方法,助力产业逐“绿”前行。应用新方法从赤泥中提取铁的装置示意图如图1所示。
(1)Fe2O3中铁元素的化合价是 +3 ,铁、氧元素的质量比为 7∶3 。
【详解】Fe2O3中氧元素的化合价为-2,设铁元素的化合价为x,根据化合价原则,化合物中各元素化合价代数和为零,可得:2x+(-2)×3=0,解得:x=+3,所以铁元素的化合价是:+3;铁、氧元素质量比为(56×2)∶(16×3)=7∶3。
+3
7∶3
(2)应用新方法从赤泥中提取铁发生反应的化学方程式:
3H2+Fe2O3 3H2O+2Fe。
①以该方法处理某赤泥样品的实验数据如图2所示。据图计算,反应从开始至10分钟,提取铁的质量为 2.58 g;
②我国每年产生赤泥约9000万吨,假设赤泥中Fe2O3的质量分数为30%,用新方法处理9000万吨赤泥,理论上可提取铁 1890 万吨(写出计算过程);
③传统方法通常使用CO还原Fe2O3,新方法能使产业更加绿色环保的原因是 产物是水,不会加剧温室效应 (写一种)。
2.58
1890
产物是水,不会加剧温室效应
【详解】(2)应用新方法从赤泥中提取铁发生反应的化学方程式:3H2+Fe2O3 3H2O+2Fe。
①以该方法处理某赤泥样品的实验数据如图2所示。由图可知,开始时,样品的质量为15.0 g,其中铁的质量分数为28.0%,则样品中铁的质量为:15.0 g×28.0%=4.2 g,反应至10分钟后,样品的质量为9.0 g,其中铁的质量分数为18.0%,则样品中铁的质量为:9.0 g×18.0%=1.62 g,所以提取铁的质量为:4.2 g-1.62 g=2.58 g。②我国每年产生赤泥约9000万吨,假设赤泥中Fe2O3的质量分数为30%,则氧化铁的质量为:9000万吨×30%=2700万吨;
设理论上可提取铁的质量为x。
3H2+Fe2O3 3H2O+2Fe
160
112
2700万吨
x
=
x=1890万吨
所以用新方法处理9000万吨赤泥,理论上可提取铁1890万吨。
③传统方法通常使用CO还原Fe2O3生成Fe和CO2,二氧化碳的大量排放会加剧温室效应,新方法能使产业更加绿色环保的原因是产物是水,不会加剧温室效应(合理即可)。
JI CHU LIAN XI
PART THREE
03
2025
基础练习
真题解读
题型解读
基础练习
有关化学方程式的简单计算常见类型
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Ca-40 Cl-35.5 S-32
Na-23 Mg-24 Al-27 K-39 Fe-56 Cu-64 Zn-65 Ag-108 Ba-137
类型1 实验叙述型
1. (2023·荆州)实验室里,常用锌和稀硫酸反应制取氢气。现有100 g某稀硫酸恰好与13 g锌完全起反应,试回答:
(1)混有一定量空气的氢气遇明火会发生爆炸,因此点燃氢气之前一定要 验纯 。
验纯
(2)计算这种稀硫酸中溶质的质量分数。(要求写出计算过程)
解:设反应的硫酸中溶质的质量为x。
Zn+H2SO4 ZnSO4+H2↑
65 98
13 g x
= x=19.6 g
硫酸中溶质的质量分数: ×100%=19.6%。
答:这种稀硫酸中溶质的质量分数为19.6%。
2. (2024·达州)化学兴趣小组的同学做实验时不慎把稀盐酸洒在实验室的磨石地板上,发现有气泡冒出。查阅资料得知,磨石中含有碳酸钙,同学们用同种磨石进行了如下实验(假设磨石中的其它成分不参与反应,也不溶于水,生成的气体全部逸出)。
请完成下列问题:
(1)生成二氧化碳的质量为 4.4 g。
4.4
(2)计算反应后烧杯内溶液的溶质质量分数(写出计算过程)。
解:(2)设参加反应的碳酸钙质量为x,
生成氯化钙的质量为y。
CaCO3+2HCl CaCl2+H2O+CO2↑
100 111 44
x y 4.4 g
= , = x=10 g,y=11.1 g
则反应后溶液的质量为:10 g+105.4 g-4.4 g=111 g,所以反应后烧杯内溶液的溶质质量分数为: ×100%=10%。
答:反应后烧杯内溶液的溶质质量分数为10%。
类型2 简单图像型
3. (2023·深圳)定性实验和定量实验是化学中常见的两种实验方法。
(1)铝和氧气生成致密的 氧化铝薄膜 。
(2)打磨后的铝丝放入硫酸铜溶液中发生反应,出现的反应现象: 铝丝表面有红色物质析出,溶液由蓝色变无色 。
氧化铝薄膜
铝丝表面有红色物质析出,溶液由蓝色变无色
(3)如图是探究白磷燃烧条件的实验:
从图中得知白磷燃烧的条件是 与氧气充分接触 。
与氧气充分接触
(4)某同学向相同体积的5%H2O2分别加入氧化铁和二氧化锰做催化剂,现象如下表:
催化剂 现象
MnO2 有大量气泡
Fe2O3 少量气泡
根据气泡生成多少可以得到什么化学启示: 其他条件相同的情况下,二氧化锰对过氧化氢的催化效果更好 。
其他条件相同的情况
下,二氧化锰对过氧化氢的催化效果更好
(5)某同学在H2O2溶液中加入MnO2做催化剂时,反应生成气体的质量与时间的关系如图所示,求反应90 s时消耗H2O2的质量。(写出计算过程)
解:(5)由图可知反应90 s时,产生氧气为
1.60 g,设消耗H2O2的质量为x。
2H2O2 2H2O+O2↑
68 32
x 1.60 g
= x=3.40 g
答:反应90 s时消耗H2O2的质量为3.40 g。
4. (2023·江西)如表是碳酸钙D3片标签的部分信息。化学社团为测定该药片中碳酸钙的量是否与标签相符,进行实验:取8片药片,研碎后逐渐加入质量分数为7.3%的稀盐酸,充分反应。实验相关数据如图所示(假设其他成分不参加反应)。
碳酸钙D3片
【成分】碳酸钙、维生素D3、辅料
【规格】每片含碳酸钙1.25 g
【用法】口服,嚼食
【用量】每日一次,一次一片
【贮藏】室温密封保存
(1)配制7.3%的稀盐酸,量取时需要用到胶头滴管和 量筒 (填一种仪器)。
(2)恰好完全反应时消耗稀盐酸的质量为 100 g。
量筒
100
(3)计算每片药片中碳酸钙的质量并判断是否与标签相符。(写出计算过程)
解:(3)100 g质量分数为7.3%的稀盐酸中溶质的质量
为100 g×7.3%=7.3 g,设8片钙片中碳酸钙的质量为x。
CaCO3+2HCl CaCl2+H2O+CO2↑
100 73
x 7.3 g
= x=10 g
则每片药片中碳酸钙的质量为10 g÷8=1.25 g。
答:每片药片中碳酸钙的质量为1.25 g,与标签相符。
(4)科学用药,健康生活。下列说法正确的有 BD (填字母,双选)。
A. 钙是人体中的常量元素,故服用钙片越多越好
B. 钙片嚼食服用,可使碳酸钙与胃酸反应更充分
C. 钙片需密封保存,是因为室温下碳酸钙易分解
D. 饮用牛奶、豆浆,也可补充人体所需的钙元素
BD
类型3 坐标曲线分析型
5. (2021·广东)胆矾(CuSO4·5H2O,相对分子质量为250)广泛应用于生产生活中。
(1)农药波尔多液由胆矾和石灰乳等配制而成。不能用铁桶来配制波尔多液,因为铁的金属活动性比铜的 强 (填“强”或“弱”)。
强
(2)将25.0 g胆矾放在坩埚内加热,固体质量与成分随温度变化的曲线如图。
①加热至 650 ℃时,CuSO4开始分解;
650
②加热至1 000℃时,CuO开始分解,生成Cu2O与一种能使带火星的木条复燃的气体,该气体为 O2 。CuO完全分解时产生该气体的质量为 0.8 g;
O2
0.8
③根据胆矾分解的化学方程式CuSO4·5H2O CuSO4+5H2O,计算图中x的值(写出计算过程);
解:③设硫酸铜的质量为x。
CuSO4·5H2O CuSO4+5H2O
250 160
25.0 g x
=
x=16.0 g
答:x的值16.0。
④下列物质均可作为炼铜的原料。理论上,冶炼等质量的下列物质得到铜最多的是 d (填字母)。
a.CuSO4·5H2O b.CuSO4 c.CuO d.Cu2O
d
6. (2023·菏泽)某化学兴趣小组利用数字化实验装置(图1)对中和反应再探究,在烧杯中加入100 g未知浓度的稀硫酸,向其中滴加4%的氢氧化钠溶液,实验数据经处理后绘制出图像(图2)。请分析图像完成下列问题。
(1)稀硫酸和氢氧化钠溶液发生的反应是 放热 (填“吸热”或“放热”)反应。
放热
(2)计算稀硫酸的溶质质量分数。(写出计算过程)
解:(2)恰好反应时,消耗氢氧化钠质量为100 g×4%=4 g;
设稀硫酸的溶质质量分数为x。
2NaOH+H2SO4 Na2SO4+2H2O
80 98
4 g 100 g x
=
x=4.9%
答:稀硫酸的溶质质量分数为4.9%。
类型4 表格分析数据型
7. (2020·广东)某实验小组探究了溶质的质量分数对H2O2分解速率的影响。实验装置如图1所示,用注射器加入不同浓度的H2O2溶液(见下表),实验中使用传感器装置测算生成O2的质量(圆底烧瓶内气压变化在安全范围),绘制氧气质量随时间变化的曲线,如图2所示。
实验编号 H2O2的质量分数(%) H2O2溶液的体积(mL) 对应曲线
Ⅰ 3.4 10.0 a
Ⅱ 2.4 10.0 b
Ⅲ 1.7 10.0 c(待绘制)
(1)实验前需准备不同浓度的H2O2溶液,若要配制100.0 g质量分数为2.4%的H2O2溶液,需质量分数为30%的H2O2溶液 8.0 g。
(2)根据实验探究目的,从曲线a、b中,可得出的结论是 H2O2的溶质质量分数越大,分解越快 。
8.0
H2O2的溶
质质量分数越大,分解越快
(3)计算实验Ⅰ条件下H2O2完全分解所得氧气的质量,并写出具体计算过程(1.5~5.0% H2O2溶液的密度取值1.0 g/mL)。
解:(3)生成氧气的质量为0.16 g.参与反应的过氧化氢质量=10 mL×1.0 g/mL×3.4%=0.34 g。设生成氧气的质量为n,
2H2O2 2H2O+O2↑
68 32
0.34 g n
=
n=0.16 g
答:实验Ⅰ条件下H2O2完全分解所得氧气的质量为0.16 g。
(4)在如图2中画出曲线c的大致位置及趋势。
第(4)题答案图
8. (2024·烟台)化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数。先将10 g样品放入质量为50 g的锥形瓶中,再逐滴加入稀盐酸充分反应(如图所示)。反应过程中测得滴加稀盐酸的总质量与充分反应后锥形瓶及瓶内剩余物质总质量的数据如表所示。
(该石灰石中杂质不溶解于水,也不与酸反应)
加入稀盐酸的总质量/g 0 10 25 35
锥形瓶及瓶内剩余物质总质量/g 60.00 69.12 82.8 92.36
回答下列问题:
(1)10 g该石灰石样品与稀盐酸恰好完全反应时,消耗的稀盐酸的总质量是30.00 g,产生二氧化碳的总质量是 2.64 g。
2.64
(2)该样品中碳酸钙的质量分数为多少?(写出计算过程)
解:(2)设该样品中碳酸钙的质量分数为x。
CaCO3+2HCl CaCl2+H2O+CO2↑
100 44
10 g x 2.64 g
=
x=60%
答:该样品中碳酸钙的质量分数为60%。
(3)这种测定方法产生误差的原因可能是 稀盐酸中的氯化氢挥发导致装置减少的质量偏大 (写1条)。
稀盐酸中的氯化氢挥发导
致装置减少的质量偏大
类型5 综合类型
9. (2023·广东)羰基铁粉在国防军工领域有重要应用,我国是少数几个掌握其生产技术的国家之一。制备羰基铁粉的过程如图1所示。
(1)Fe(CO)5中碳、氧元素的质量比为 3∶4 。
3∶4
(2)反应1的化学方程式为 Fe+5CO Fe(CO)5,用100 kg含铁96%的海绵铁,理论上可制备Fe(CO)5的质量是多少?(写出计算过程)
解:(2)100 kg含铁96%的海绵铁中铁的质量为100 kg×96%=96 kg。
设理论上可制备Fe(CO)5的质量是x。
Fe+5CO Fe(CO)5
56 196
96 kg x
= x=336 kg
答:理论上可制备Fe(CO)5的质量是336 kg。
(3)反应2的化学方程式为Fe(CO)5 Fe+5CO↑。196 kg Fe(CO)5分解生成羰基铁粉的质量随时间的变化如图2所示,在t1时,剩余 98 kg Fe(CO)5未分解;在 t3 时,Fe(CO)5恰好完全分解。
(4)制备羰基铁粉过程中循环利用的物质是 CO 。
98
t3
CO
10. (2022·广东)铁铜双金属粉末可用于生产机械零件。利用还原铁粉和CuSO4溶液制备该产品的工艺流程如图1所示。
(1)“搅拌”时发生的反应利用了铁的金属活动性比铜的 强 (填“强”或“弱”)。
(2)“过滤”后滤液的主要成分是 FeSO4 (写化学式)。
强
FeSO4
(3)若用该工艺制备了1 000 g铁铜双金属粉末产品,其中Cu单质的质量分数为19.2%。计算置换这些Cu单质所需还原铁粉的质量(写出计算过程)。
解:(3)解:设需要铁的质量是x。
Fe+CuSO4 FeSO4+Cu
56 64
x 1 000 g×19.2%
= x=168 g
(4)“干燥还原”可在不同的温度下进行,产品中氧元素的质量分数随温度的变化如图2所示。若(3)中产品是在500 ℃时干燥还原后得到的,则其中最多含Fe元素 804 g(产品中只含三种元素)。
804
第二部分 题型训练
第二部分
专题六
专题六 化学方程式计算专题
CONTENTS
目录
题型解读
01
KAO DIAN DUI BIAO
02
ZHEN TI JIE DU
真题解读
基础练习
03
ZHI SHI GOU JIAN
SU YANG TI SHENG
PART ONE
01
2025
题型解读
真题解读
题型解读
基础练习
1. 题型分析
新课标的学业质量要求中提出:能依据质量守恒定律并用化学方程式表征简单的化学反应,结合真实情境中物质的转化进行简单计算;课标要求中考计算题结合真实情境的数据,解决真实情景问题,更体现化学计算的真实意义。而在近几年中考题出现了以图像、表格及实验流程为载体的化学计算题,这类题的特点是利用数学方法将化学实验数据进行处理和表达,常常以坐标曲线、图像、表格等形式将解题信息呈现。解答此类题目时,要求学生能够对图像、表格进行科学分析,从中获取有用信息,并结合化学知识将有用信息应用到解决实际问题中。
2. 解题策略
(1)方程式简单计算的步骤
①设未知数;
②根据题意写出相关的化学方程式,并配平;
③根据题目找出已知与未知物质的质量,并算出它们的质量比,标在相应化学式的正下方;
④列出比例式;
⑤求出未知数;
⑥写出简要答案。
(2)方程式计算解题注意事项
①化学方程式所表示的反应物、生成物的质量关系是进行化学计算的基础,在化学方程式中各物质的化学式一定要书写正确,一定要配平化学方程式或关系式中某元素原子的数目一定要相等,相对分子质量的计算一定要准确;
②化学方程式中的各物质均指纯净物,参加计算的各物质的质量也必须是纯净物的质量;
③题目出现的“适量”“恰好反应”“完全反应”“足量”“充分反应”等词语,要正确理解,一般来说:
“适量”“恰好反应”和“完全反应”——两种(或多种)反应物之间按一定量比恰好完全反应,反应物无剩余。
“足量”“充分反应”——一种反应物完全反应,无剩余;另一种反应物可能完全反应,也可能过量。
④各物质的单位要统一。
(3)化学方程式的简单计算解题微技能
微技能1 寻找纯净物质量
①通过理解题意,直接找出化学反应方程式中相关纯净物质量;
②题目没有直接找到纯净物质量,可以尝试利用质量守恒定律,找出气体或者沉淀的质量;
③纯净物的质量=混合物的质量×该纯净物的质量分数;
④溶质质量=溶液质量×溶质质量分数。
【例题1】小杨同学取50.0 g硫酸铜溶液样品置于烧杯中,逐滴加入氢氧化钠溶液,加入氢氧化钠溶液质量和生成沉淀质量的关系如图所示,求样品溶液中溶质硫酸铜的质量时,直接代入化学方程式中纯净物是 Cu(OH)2 ,其质量为 4.9 g 。
Cu(OH)2
4.9 g
【例题2】为测定某过氧化氢溶液的溶质质量分数,实验中记录的相关数据如下。
反应前物质的质量 完全反应后物质的质量 过氧化氢溶液质量 二氧化锰质量 固体与液体混合物质量 氧气质量
34.0 g 0.1 g 33.3 g g
请计算:能直接代入化学方程式中纯净物是 O2,其质量为 0.8 。
O2
0.8 g
【例题3】某工厂废水中含有碳酸钠(Na2CO3)未经处理,会造成污染。化学兴趣小组的同学对废水处理设计了如图所示的实验方案:
计算废水中碳酸钠的质量时,直接代入纯净物是 CaCO3 ,其质量为 50 g+50 g-94 g (只写计算过程)。
CaCO3
50 g+50 g-94 g
【例题4】实验室欲测定一瓶稀H2SO4的溶质质量分数。现取50 g溶液样品,将20%的NaOH溶液逐滴加入到样品中,滴加过程pH的变化如图所示。
求反应后所得硫酸钠的质量时,直接代入化学方程式中纯净物是 NaOH ,其质量为 40 g×20% (只写计算过程)。
NaOH
40 g×20%
【例题5】工业上用赤铁矿石(主要成分是氧化铁)与一氧化碳在高温条件下冶炼生铁。现有40 t含氧化铁80%的赤铁矿石,求该矿石理论上能冶炼铁的质量时,直接代入化学方程式中纯净物是 Fe2O3 ,其质量为 40 t×80% 。
Fe2O3
40 t×80%
微技能2 计算反应物或生成物的质量分数
① 混合物中某物质的质量分数= ×100%
② 溶质质量分数= × 100%
【例题6】(2024·云南)为测定某过氧化氢溶液的溶质质量分数,实验中记录的相关数据如下。
反应前物质的质量 完全反应后物质的质量 过氧化氢溶液质量 二氧化锰质量 固体与液体混合物质量 氧气质量
34.0 g 0.1 g 33.3 g g
请计算:
(1)如表中氧气的质量为 0.8 g g。
解:(1)依据质量守恒定律可知:生成氧气质量=34.0 g+0.1 g-33.3 g=0.8 g。
0.8 g
2H2O2 2H2O+O2↑
68 32
x 0.8 g
=
x=1.7g
过氧化氢溶液的溶质质量分数= ×100%=5%
答:该过氧化氢溶液的溶质质量分数为5%。
(2)该过氧化氢溶液的溶质质量分数。
解:(2)设该过氧化氢溶液中溶质的质量为x。
ZHEN TI JIE DU
PART TWO
02
2025
真题解读
真题解读
题型解读
基础练习
【例题】(2024·广东)科研人员提出一种回收利用铝冶炼产生的废渣赤泥(含Fe2O3)的新方法,助力产业逐“绿”前行。应用新方法从赤泥中提取铁的装置示意图如图1所示。
(1)Fe2O3中铁元素的化合价是 +3 ,铁、氧元素的质量比为 7∶3 。
【详解】Fe2O3中氧元素的化合价为-2,设铁元素的化合价为x,根据化合价原则,化合物中各元素化合价代数和为零,可得:2x+(-2)×3=0,解得:x=+3,所以铁元素的化合价是:+3;铁、氧元素质量比为(56×2)∶(16×3)=7∶3。
+3
7∶3
(2)应用新方法从赤泥中提取铁发生反应的化学方程式:
3H2+Fe2O3 3H2O+2Fe。
①以该方法处理某赤泥样品的实验数据如图2所示。据图计算,反应从开始至10分钟,提取铁的质量为 2.58 g;
②我国每年产生赤泥约9000万吨,假设赤泥中Fe2O3的质量分数为30%,用新方法处理9000万吨赤泥,理论上可提取铁 1890 万吨(写出计算过程);
③传统方法通常使用CO还原Fe2O3,新方法能使产业更加绿色环保的原因是 产物是水,不会加剧温室效应 (写一种)。
2.58
1890
产物是水,不会加剧温室效应
【详解】(2)应用新方法从赤泥中提取铁发生反应的化学方程式:3H2+Fe2O3 3H2O+2Fe。
①以该方法处理某赤泥样品的实验数据如图2所示。由图可知,开始时,样品的质量为15.0 g,其中铁的质量分数为28.0%,则样品中铁的质量为:15.0 g×28.0%=4.2 g,反应至10分钟后,样品的质量为9.0 g,其中铁的质量分数为18.0%,则样品中铁的质量为:9.0 g×18.0%=1.62 g,所以提取铁的质量为:4.2 g-1.62 g=2.58 g。②我国每年产生赤泥约9000万吨,假设赤泥中Fe2O3的质量分数为30%,则氧化铁的质量为:9000万吨×30%=2700万吨;
设理论上可提取铁的质量为x。
3H2+Fe2O3 3H2O+2Fe
160
112
2700万吨
x
=
x=1890万吨
所以用新方法处理9000万吨赤泥,理论上可提取铁1890万吨。
③传统方法通常使用CO还原Fe2O3生成Fe和CO2,二氧化碳的大量排放会加剧温室效应,新方法能使产业更加绿色环保的原因是产物是水,不会加剧温室效应(合理即可)。
JI CHU LIAN XI
PART THREE
03
2025
基础练习
真题解读
题型解读
基础练习
有关化学方程式的简单计算常见类型
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Ca-40 Cl-35.5 S-32
Na-23 Mg-24 Al-27 K-39 Fe-56 Cu-64 Zn-65 Ag-108 Ba-137
类型1 实验叙述型
1. (2023·荆州)实验室里,常用锌和稀硫酸反应制取氢气。现有100 g某稀硫酸恰好与13 g锌完全起反应,试回答:
(1)混有一定量空气的氢气遇明火会发生爆炸,因此点燃氢气之前一定要 验纯 。
验纯
(2)计算这种稀硫酸中溶质的质量分数。(要求写出计算过程)
解:设反应的硫酸中溶质的质量为x。
Zn+H2SO4 ZnSO4+H2↑
65 98
13 g x
= x=19.6 g
硫酸中溶质的质量分数: ×100%=19.6%。
答:这种稀硫酸中溶质的质量分数为19.6%。
2. (2024·达州)化学兴趣小组的同学做实验时不慎把稀盐酸洒在实验室的磨石地板上,发现有气泡冒出。查阅资料得知,磨石中含有碳酸钙,同学们用同种磨石进行了如下实验(假设磨石中的其它成分不参与反应,也不溶于水,生成的气体全部逸出)。
请完成下列问题:
(1)生成二氧化碳的质量为 4.4 g。
4.4
(2)计算反应后烧杯内溶液的溶质质量分数(写出计算过程)。
解:(2)设参加反应的碳酸钙质量为x,
生成氯化钙的质量为y。
CaCO3+2HCl CaCl2+H2O+CO2↑
100 111 44
x y 4.4 g
= , = x=10 g,y=11.1 g
则反应后溶液的质量为:10 g+105.4 g-4.4 g=111 g,所以反应后烧杯内溶液的溶质质量分数为: ×100%=10%。
答:反应后烧杯内溶液的溶质质量分数为10%。
类型2 简单图像型
3. (2023·深圳)定性实验和定量实验是化学中常见的两种实验方法。
(1)铝和氧气生成致密的 氧化铝薄膜 。
(2)打磨后的铝丝放入硫酸铜溶液中发生反应,出现的反应现象: 铝丝表面有红色物质析出,溶液由蓝色变无色 。
氧化铝薄膜
铝丝表面有红色物质析出,溶液由蓝色变无色
(3)如图是探究白磷燃烧条件的实验:
从图中得知白磷燃烧的条件是 与氧气充分接触 。
与氧气充分接触
(4)某同学向相同体积的5%H2O2分别加入氧化铁和二氧化锰做催化剂,现象如下表:
催化剂 现象
MnO2 有大量气泡
Fe2O3 少量气泡
根据气泡生成多少可以得到什么化学启示: 其他条件相同的情况下,二氧化锰对过氧化氢的催化效果更好 。
其他条件相同的情况
下,二氧化锰对过氧化氢的催化效果更好
(5)某同学在H2O2溶液中加入MnO2做催化剂时,反应生成气体的质量与时间的关系如图所示,求反应90 s时消耗H2O2的质量。(写出计算过程)
解:(5)由图可知反应90 s时,产生氧气为
1.60 g,设消耗H2O2的质量为x。
2H2O2 2H2O+O2↑
68 32
x 1.60 g
= x=3.40 g
答:反应90 s时消耗H2O2的质量为3.40 g。
4. (2023·江西)如表是碳酸钙D3片标签的部分信息。化学社团为测定该药片中碳酸钙的量是否与标签相符,进行实验:取8片药片,研碎后逐渐加入质量分数为7.3%的稀盐酸,充分反应。实验相关数据如图所示(假设其他成分不参加反应)。
碳酸钙D3片
【成分】碳酸钙、维生素D3、辅料
【规格】每片含碳酸钙1.25 g
【用法】口服,嚼食
【用量】每日一次,一次一片
【贮藏】室温密封保存
(1)配制7.3%的稀盐酸,量取时需要用到胶头滴管和 量筒 (填一种仪器)。
(2)恰好完全反应时消耗稀盐酸的质量为 100 g。
量筒
100
(3)计算每片药片中碳酸钙的质量并判断是否与标签相符。(写出计算过程)
解:(3)100 g质量分数为7.3%的稀盐酸中溶质的质量
为100 g×7.3%=7.3 g,设8片钙片中碳酸钙的质量为x。
CaCO3+2HCl CaCl2+H2O+CO2↑
100 73
x 7.3 g
= x=10 g
则每片药片中碳酸钙的质量为10 g÷8=1.25 g。
答:每片药片中碳酸钙的质量为1.25 g,与标签相符。
(4)科学用药,健康生活。下列说法正确的有 BD (填字母,双选)。
A. 钙是人体中的常量元素,故服用钙片越多越好
B. 钙片嚼食服用,可使碳酸钙与胃酸反应更充分
C. 钙片需密封保存,是因为室温下碳酸钙易分解
D. 饮用牛奶、豆浆,也可补充人体所需的钙元素
BD
类型3 坐标曲线分析型
5. (2021·广东)胆矾(CuSO4·5H2O,相对分子质量为250)广泛应用于生产生活中。
(1)农药波尔多液由胆矾和石灰乳等配制而成。不能用铁桶来配制波尔多液,因为铁的金属活动性比铜的 强 (填“强”或“弱”)。
强
(2)将25.0 g胆矾放在坩埚内加热,固体质量与成分随温度变化的曲线如图。
①加热至 650 ℃时,CuSO4开始分解;
650
②加热至1 000℃时,CuO开始分解,生成Cu2O与一种能使带火星的木条复燃的气体,该气体为 O2 。CuO完全分解时产生该气体的质量为 0.8 g;
O2
0.8
③根据胆矾分解的化学方程式CuSO4·5H2O CuSO4+5H2O,计算图中x的值(写出计算过程);
解:③设硫酸铜的质量为x。
CuSO4·5H2O CuSO4+5H2O
250 160
25.0 g x
=
x=16.0 g
答:x的值16.0。
④下列物质均可作为炼铜的原料。理论上,冶炼等质量的下列物质得到铜最多的是 d (填字母)。
a.CuSO4·5H2O b.CuSO4 c.CuO d.Cu2O
d
6. (2023·菏泽)某化学兴趣小组利用数字化实验装置(图1)对中和反应再探究,在烧杯中加入100 g未知浓度的稀硫酸,向其中滴加4%的氢氧化钠溶液,实验数据经处理后绘制出图像(图2)。请分析图像完成下列问题。
(1)稀硫酸和氢氧化钠溶液发生的反应是 放热 (填“吸热”或“放热”)反应。
放热
(2)计算稀硫酸的溶质质量分数。(写出计算过程)
解:(2)恰好反应时,消耗氢氧化钠质量为100 g×4%=4 g;
设稀硫酸的溶质质量分数为x。
2NaOH+H2SO4 Na2SO4+2H2O
80 98
4 g 100 g x
=
x=4.9%
答:稀硫酸的溶质质量分数为4.9%。
类型4 表格分析数据型
7. (2020·广东)某实验小组探究了溶质的质量分数对H2O2分解速率的影响。实验装置如图1所示,用注射器加入不同浓度的H2O2溶液(见下表),实验中使用传感器装置测算生成O2的质量(圆底烧瓶内气压变化在安全范围),绘制氧气质量随时间变化的曲线,如图2所示。
实验编号 H2O2的质量分数(%) H2O2溶液的体积(mL) 对应曲线
Ⅰ 3.4 10.0 a
Ⅱ 2.4 10.0 b
Ⅲ 1.7 10.0 c(待绘制)
(1)实验前需准备不同浓度的H2O2溶液,若要配制100.0 g质量分数为2.4%的H2O2溶液,需质量分数为30%的H2O2溶液 8.0 g。
(2)根据实验探究目的,从曲线a、b中,可得出的结论是 H2O2的溶质质量分数越大,分解越快 。
8.0
H2O2的溶
质质量分数越大,分解越快
(3)计算实验Ⅰ条件下H2O2完全分解所得氧气的质量,并写出具体计算过程(1.5~5.0% H2O2溶液的密度取值1.0 g/mL)。
解:(3)生成氧气的质量为0.16 g.参与反应的过氧化氢质量=10 mL×1.0 g/mL×3.4%=0.34 g。设生成氧气的质量为n,
2H2O2 2H2O+O2↑
68 32
0.34 g n
=
n=0.16 g
答:实验Ⅰ条件下H2O2完全分解所得氧气的质量为0.16 g。
(4)在如图2中画出曲线c的大致位置及趋势。
第(4)题答案图
8. (2024·烟台)化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数。先将10 g样品放入质量为50 g的锥形瓶中,再逐滴加入稀盐酸充分反应(如图所示)。反应过程中测得滴加稀盐酸的总质量与充分反应后锥形瓶及瓶内剩余物质总质量的数据如表所示。
(该石灰石中杂质不溶解于水,也不与酸反应)
加入稀盐酸的总质量/g 0 10 25 35
锥形瓶及瓶内剩余物质总质量/g 60.00 69.12 82.8 92.36
回答下列问题:
(1)10 g该石灰石样品与稀盐酸恰好完全反应时,消耗的稀盐酸的总质量是30.00 g,产生二氧化碳的总质量是 2.64 g。
2.64
(2)该样品中碳酸钙的质量分数为多少?(写出计算过程)
解:(2)设该样品中碳酸钙的质量分数为x。
CaCO3+2HCl CaCl2+H2O+CO2↑
100 44
10 g x 2.64 g
=
x=60%
答:该样品中碳酸钙的质量分数为60%。
(3)这种测定方法产生误差的原因可能是 稀盐酸中的氯化氢挥发导致装置减少的质量偏大 (写1条)。
稀盐酸中的氯化氢挥发导
致装置减少的质量偏大
类型5 综合类型
9. (2023·广东)羰基铁粉在国防军工领域有重要应用,我国是少数几个掌握其生产技术的国家之一。制备羰基铁粉的过程如图1所示。
(1)Fe(CO)5中碳、氧元素的质量比为 3∶4 。
3∶4
(2)反应1的化学方程式为 Fe+5CO Fe(CO)5,用100 kg含铁96%的海绵铁,理论上可制备Fe(CO)5的质量是多少?(写出计算过程)
解:(2)100 kg含铁96%的海绵铁中铁的质量为100 kg×96%=96 kg。
设理论上可制备Fe(CO)5的质量是x。
Fe+5CO Fe(CO)5
56 196
96 kg x
= x=336 kg
答:理论上可制备Fe(CO)5的质量是336 kg。
(3)反应2的化学方程式为Fe(CO)5 Fe+5CO↑。196 kg Fe(CO)5分解生成羰基铁粉的质量随时间的变化如图2所示,在t1时,剩余 98 kg Fe(CO)5未分解;在 t3 时,Fe(CO)5恰好完全分解。
(4)制备羰基铁粉过程中循环利用的物质是 CO 。
98
t3
CO
10. (2022·广东)铁铜双金属粉末可用于生产机械零件。利用还原铁粉和CuSO4溶液制备该产品的工艺流程如图1所示。
(1)“搅拌”时发生的反应利用了铁的金属活动性比铜的 强 (填“强”或“弱”)。
(2)“过滤”后滤液的主要成分是 FeSO4 (写化学式)。
强
FeSO4
(3)若用该工艺制备了1 000 g铁铜双金属粉末产品,其中Cu单质的质量分数为19.2%。计算置换这些Cu单质所需还原铁粉的质量(写出计算过程)。
解:(3)解:设需要铁的质量是x。
Fe+CuSO4 FeSO4+Cu
56 64
x 1 000 g×19.2%
= x=168 g
(4)“干燥还原”可在不同的温度下进行,产品中氧元素的质量分数随温度的变化如图2所示。若(3)中产品是在500 ℃时干燥还原后得到的,则其中最多含Fe元素 804 g(产品中只含三种元素)。
804
同课章节目录
