江苏省盐城市时杨中学2015-2016学年高二下学期期中考试化学试题
文档属性
| 名称 | 江苏省盐城市时杨中学2015-2016学年高二下学期期中考试化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 286.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-04-29 15:58:57 | ||
图片预览



文档简介
2015/2016学年度第二学期
高二年级期中考试化学试题
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Cu—64
第Ⅰ卷(选择题 共40分)
=单项选择题:本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1、用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构如下图,它属于
( http: / / www.21cnjy.com )
A.无机物 B.单质 C.高分子化合物 D.有机物
2、下列物质属于弱电解质的是
A.NaCl B.NaOH C.CH3COOH D.CO2
3、下列反应中,属于放热反应的是
A.铝粉与氧化铁的反应 B.氯化铵晶体与Ba(OH)2·8H2O的反应
C.氯酸钾的分解反应 D.盐类的水解反应
4、下列实验所用的试纸不能预先用蒸馏水润湿的是
A.用品红试纸检验SO2 B.用淀粉碘化钾试纸检验Cl2
C.用红色石蕊试纸检验NH3 D.用pH试纸测定某溶液的pH
5、某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是
A.分子中的C、H、O的个数比为1:2:3 B.分子中C、H个数比为1:2
C.该有机物的相对分子质量为14 D.该分子中肯定不含氧元素
6、已知甲醛()分子中的四个原子是共平面的,下列分子中所有原子不可能同时存在同一平面上的是
A. B.
C. D.
7、下列实验能达到测量要求的是
A. 用托盘天平称取35.20g NaCl B. 用10ml量筒量取8.50ml盐酸
C. 用25ml滴定管量取15.80ml溶液 D. 用广泛PH试纸测得溶液PH值为4.2
8、相同温度下用惰性电极电解下列物质的水溶液,一段时间后溶液酸碱性不变的是
A.Na2SO4 B.NaOH C.HCl D.CuSO4
9、下列说法不正确的是
A.ΔH<0、ΔS>0的反应在任何温度下都能自发进行
B.NH4HCO3(s)NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率
10、将0.l mol·醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(H+)和c()都减小 B.溶液的pH增大
C.醋酸电离平衡向左移动 D.溶液中c(H+)增大
不定项选择题:本题包括5小题,每小题4分 ( http: / / www.21cnjy.com ),共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11、已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.1/2H2SO4(aq)+1/2Ba(OH)2(aq)=1/2BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
12、甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图所示。下列
有关叙述正确的是
A.H+从正极区通过交换膜移向负极区
B.负极的电极反应式为:CH3OH(l)+H2O(l)-6e-===CO2(g)+6H+
C.图中b、c加入的分别是甲醇、O2
D.d导出的是CO2
13、某反应的反应过程中能量变化如图所示(图中E1表示正反应的
活化能,E2表示逆反应的活化能).对该反应的有关叙述正确的是
A.该反应的正反应为吸热反应
B.催化剂能改变反应的焓变
C.催化剂不能降低反应的活化能
D.逆反应的活化能大于正反应的活化能
14、对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.在25℃100 mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
B.0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3—)+c(H2CO3)+c(CO32—)
C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:
c(Na+)+c(H+)=c(A-)+c(Cl-)
D.0.1 mol/L的(NH4)2SO4溶液中:c(SO42—)>c(NH4+)>c(H+)>c(OH-)
15、在密闭容器中,反应2X(g)+ Y2(g) 2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是
A.图I中,甲、乙的平衡常数分别为K1、K2,则K1B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低
C.图Ⅱ中,t时间是增大了压强
D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
第Ⅱ卷(非选择题 共80分)
16、(4分)北京时间11月1日清晨5时5 ( http: / / www.21cnjy.com )8分07秒,中国“长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g) = 2H2O(l) ΔH=-571.6 kJ·mol-1?
CH4(g)+2O2(g) = CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1?
C(s)+O2(g) = CO2(g) ΔH=-393.5 kJ·mol-1?
根据上面的热化学方程式完成下列问题:
(1)根据以上反应,可推C(s)+2H2(g) = CH4(g)的焓变ΔH= 。
(2)已知H2O(l) = H2O(g) ΔH = +44.0 kJ·mol-1?
试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式: 。
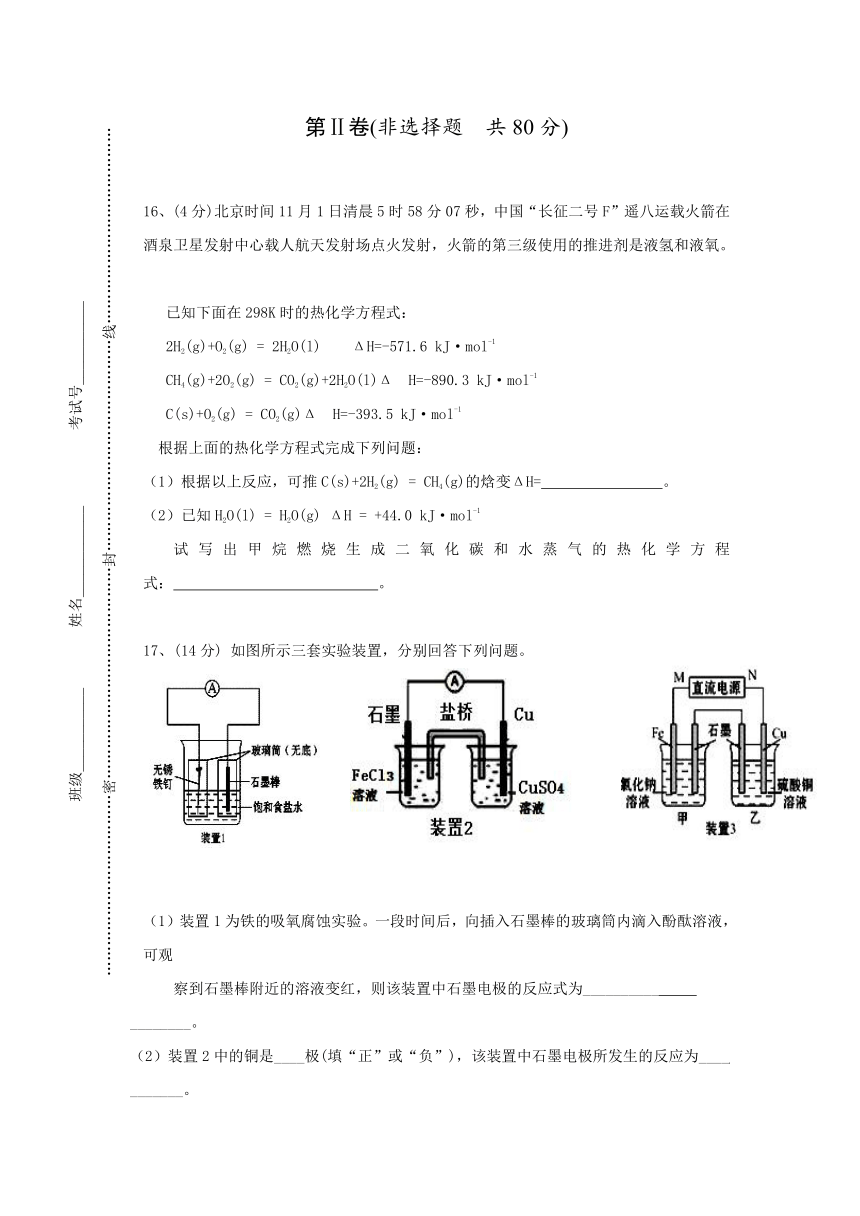
17、(14分) 如图所示三套实验装置,分别回答下列问题。
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入石墨棒的玻璃筒内滴入酚酞溶液,可观
察到石墨棒附近的溶液变红,则该装置中石墨电极的反应式为__________ ________。
(2)装置2中的铜是____极(填“正”或“负”),该装置中石墨电极所发生的反应为____ _______。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1
的CuSO4 溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附
近首先变红。
①烧杯中铁为_____极;甲烧杯中石墨电极的电极反应式为__________________。
②乙烧杯中电解反应的离子方程式为____________________。
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,甲烧杯中产生的气体在
标准状况下的体积为________ mL 。
18、(8分)氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。 在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应: N2(g)+3H2(g)2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的转化率比是 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,
密度 。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
19、(8分)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、
⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中pH值由大到小的顺序是(填序号)________________。
(2)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是(填序号)________________。
(3)将③和④按体积比1∶2混合后,混合液中各离子浓度由大到小的顺序
是________________________。
(4)同体积、同物质的量浓度的①硫酸和②醋 ( http: / / www.21cnjy.com )酸溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小关系为①_______②(填“>”、“<”或“=”)
20、(14分)使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白 ( http: / / www.21cnjy.com )醋溶液。量取10.00mL食用白醋,注入烧杯中用水稀释后转移到___________(填仪器名称)中定容,摇匀即得。
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴 作指示剂。
(3)读取盛装0.1000 mol/L NaOH 溶液的 (填仪器名称)的初始读数。
如果液面位置如右图所示,则此时的读数为 mL。
(4)滴定。当 时,停止滴定,
并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数实验数据(mL) 1 2 3 4
V(样品) 20.00 20.00 20.00 20.00
V(NaOH)(消耗) 15.95 15.00 15.05 14.95
Ⅲ.数据处理与讨论:
21、(14分)卤块的主要成分是MgC ( http: / / www.21cnjy.com )l2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁。
( http: / / www.21cnjy.com )
查阅资料得下表相关数据:
表1: 生成氢氧化物沉淀的pH 表2: 原料价格表
物质 开始沉淀 沉淀完全 物质 价格(元/吨)
Fe(OH)3 2.7 3.7 a.漂液(含25.2%NaClO) 450
Fe(OH)2 7.6 9.6﹡ b.双氧水(含30%H2O2) 2400
Mn(OH)2 8.3 9.8 c.烧碱(含98%NaOH) 2100
Mg(OH)2 9.6 11.1 d.纯碱(含99.5%Na2CO3) 600
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽。
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的 (选填试剂编号)。
(2)步骤②发生反应的离子方程式为 ;
步骤⑤中发生反应的化学方程为 。
(3)步骤③控制pH=9.8的目的是 。
(4) 若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、 和
泥三角。
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因
22、(18分)(1)下列两幅谱图 ( http: / / www.21cnjy.com )是结构简式为CH3CH2CH2OH和CH3CH(OH)CH3的两种有机化合物的1H核磁共振谱图。请判断哪一幅是CH3CH(OH)CH3的1H-NMR谱图,并说明理由。
( http: / / www.21cnjy.com )
答:
(2)写出下列有机物的结构简式
异戊烷 氯乙烷
丙烯 乙酸乙酯
(3)下图是维生素A的分子结构
( http: / / www.21cnjy.com )
维生素A中的含氧官能团是 (写名称)
维生素A的分子式是
(4)写出C3H5Cl的链状的所有同分异构体
答案
1-10 DCADB DCACB
11-15 B BC A AB D
16、(1)-74.8 kJ·mo ( http: / / www.21cnjy.com )l-1? (2)CH4(g)+2O2(g)==CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
17、(1) O2+4e-+2H2O-===4OH-
(2) 负极 Fe3++e-=Fe2+
(3) ①阳极 2H+ + 2e-===H2
②2Cu2+ + 2 H2O ===2 Cu + O2↑ +4H+ (2分) ③224 mL (2分)
18、(1) 1∶1 (2)变小 不变 (3)逆向
19、(1) ③④②① (2)⑥④⑤⑦
(3)c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
(4) >
20、Ⅰ(1)100mL容量瓶 (2) 酚酞
(3)碱式滴定管 0.60 (4)溶液由无色恰好变为红色,且半分钟内不褪色
Ⅲ(1)4.5 (2)a b
因 。
21、(1)a、c、d(各1分)
(2)2Fe2+ + ClO— + 2H+ = Cl— +2Fe3++ H2O;MgCO3 + H2O△Mg(OH)2+ CO2↑(各3分)
(3)使Mg2+以外的杂质尽可能彻底地转化为沉淀除去(2分)
(4)坩埚 (2分)
(5)Mg(OH)2(s) Mg2+ (aq)+ 2OH-(aq); NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动(3分)。
22、(1)A是CH3CH(OH)CH3的1H-NMR谱图
因为从结构上分析,CH3C ( http: / / www.21cnjy.com )H(OH)CH3有三种不同化学环境的H,而分析CH3CH2CH2OH有四种不同的H,故从图上分析,A上有三个峰,而B有四个峰,故A是CH3CH(OH)CH3的1H-NMR谱图。
略
班级___________ 姓名____________ 考试号___________
………………………………密……………………………………封……………………………………线…………………………………
A
B
电解
高二年级期中考试化学试题
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Cu—64
第Ⅰ卷(选择题 共40分)
=单项选择题:本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1、用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构如下图,它属于
( http: / / www.21cnjy.com )
A.无机物 B.单质 C.高分子化合物 D.有机物
2、下列物质属于弱电解质的是
A.NaCl B.NaOH C.CH3COOH D.CO2
3、下列反应中,属于放热反应的是
A.铝粉与氧化铁的反应 B.氯化铵晶体与Ba(OH)2·8H2O的反应
C.氯酸钾的分解反应 D.盐类的水解反应
4、下列实验所用的试纸不能预先用蒸馏水润湿的是
A.用品红试纸检验SO2 B.用淀粉碘化钾试纸检验Cl2
C.用红色石蕊试纸检验NH3 D.用pH试纸测定某溶液的pH
5、某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是
A.分子中的C、H、O的个数比为1:2:3 B.分子中C、H个数比为1:2
C.该有机物的相对分子质量为14 D.该分子中肯定不含氧元素
6、已知甲醛()分子中的四个原子是共平面的,下列分子中所有原子不可能同时存在同一平面上的是
A. B.
C. D.
7、下列实验能达到测量要求的是
A. 用托盘天平称取35.20g NaCl B. 用10ml量筒量取8.50ml盐酸
C. 用25ml滴定管量取15.80ml溶液 D. 用广泛PH试纸测得溶液PH值为4.2
8、相同温度下用惰性电极电解下列物质的水溶液,一段时间后溶液酸碱性不变的是
A.Na2SO4 B.NaOH C.HCl D.CuSO4
9、下列说法不正确的是
A.ΔH<0、ΔS>0的反应在任何温度下都能自发进行
B.NH4HCO3(s)NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率
10、将0.l mol·醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(H+)和c()都减小 B.溶液的pH增大
C.醋酸电离平衡向左移动 D.溶液中c(H+)增大
不定项选择题:本题包括5小题,每小题4分 ( http: / / www.21cnjy.com ),共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11、已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.1/2H2SO4(aq)+1/2Ba(OH)2(aq)=1/2BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
12、甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图所示。下列
有关叙述正确的是
A.H+从正极区通过交换膜移向负极区
B.负极的电极反应式为:CH3OH(l)+H2O(l)-6e-===CO2(g)+6H+
C.图中b、c加入的分别是甲醇、O2
D.d导出的是CO2
13、某反应的反应过程中能量变化如图所示(图中E1表示正反应的
活化能,E2表示逆反应的活化能).对该反应的有关叙述正确的是
A.该反应的正反应为吸热反应
B.催化剂能改变反应的焓变
C.催化剂不能降低反应的活化能
D.逆反应的活化能大于正反应的活化能
14、对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.在25℃100 mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
B.0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3—)+c(H2CO3)+c(CO32—)
C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:
c(Na+)+c(H+)=c(A-)+c(Cl-)
D.0.1 mol/L的(NH4)2SO4溶液中:c(SO42—)>c(NH4+)>c(H+)>c(OH-)
15、在密闭容器中,反应2X(g)+ Y2(g) 2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是
A.图I中,甲、乙的平衡常数分别为K1、K2,则K1
C.图Ⅱ中,t时间是增大了压强
D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
第Ⅱ卷(非选择题 共80分)
16、(4分)北京时间11月1日清晨5时5 ( http: / / www.21cnjy.com )8分07秒,中国“长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g) = 2H2O(l) ΔH=-571.6 kJ·mol-1?
CH4(g)+2O2(g) = CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1?
C(s)+O2(g) = CO2(g) ΔH=-393.5 kJ·mol-1?
根据上面的热化学方程式完成下列问题:
(1)根据以上反应,可推C(s)+2H2(g) = CH4(g)的焓变ΔH= 。
(2)已知H2O(l) = H2O(g) ΔH = +44.0 kJ·mol-1?
试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式: 。
17、(14分) 如图所示三套实验装置,分别回答下列问题。
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入石墨棒的玻璃筒内滴入酚酞溶液,可观
察到石墨棒附近的溶液变红,则该装置中石墨电极的反应式为__________ ________。
(2)装置2中的铜是____极(填“正”或“负”),该装置中石墨电极所发生的反应为____ _______。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1
的CuSO4 溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附
近首先变红。
①烧杯中铁为_____极;甲烧杯中石墨电极的电极反应式为__________________。
②乙烧杯中电解反应的离子方程式为____________________。
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,甲烧杯中产生的气体在
标准状况下的体积为________ mL 。
18、(8分)氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。 在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应: N2(g)+3H2(g)2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的转化率比是 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,
密度 。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
19、(8分)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、
⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中pH值由大到小的顺序是(填序号)________________。
(2)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是(填序号)________________。
(3)将③和④按体积比1∶2混合后,混合液中各离子浓度由大到小的顺序
是________________________。
(4)同体积、同物质的量浓度的①硫酸和②醋 ( http: / / www.21cnjy.com )酸溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小关系为①_______②(填“>”、“<”或“=”)
20、(14分)使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白 ( http: / / www.21cnjy.com )醋溶液。量取10.00mL食用白醋,注入烧杯中用水稀释后转移到___________(填仪器名称)中定容,摇匀即得。
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴 作指示剂。
(3)读取盛装0.1000 mol/L NaOH 溶液的 (填仪器名称)的初始读数。
如果液面位置如右图所示,则此时的读数为 mL。
(4)滴定。当 时,停止滴定,
并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数实验数据(mL) 1 2 3 4
V(样品) 20.00 20.00 20.00 20.00
V(NaOH)(消耗) 15.95 15.00 15.05 14.95
Ⅲ.数据处理与讨论:
21、(14分)卤块的主要成分是MgC ( http: / / www.21cnjy.com )l2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁。
( http: / / www.21cnjy.com )
查阅资料得下表相关数据:
表1: 生成氢氧化物沉淀的pH 表2: 原料价格表
物质 开始沉淀 沉淀完全 物质 价格(元/吨)
Fe(OH)3 2.7 3.7 a.漂液(含25.2%NaClO) 450
Fe(OH)2 7.6 9.6﹡ b.双氧水(含30%H2O2) 2400
Mn(OH)2 8.3 9.8 c.烧碱(含98%NaOH) 2100
Mg(OH)2 9.6 11.1 d.纯碱(含99.5%Na2CO3) 600
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽。
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的 (选填试剂编号)。
(2)步骤②发生反应的离子方程式为 ;
步骤⑤中发生反应的化学方程为 。
(3)步骤③控制pH=9.8的目的是 。
(4) 若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、 和
泥三角。
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因
22、(18分)(1)下列两幅谱图 ( http: / / www.21cnjy.com )是结构简式为CH3CH2CH2OH和CH3CH(OH)CH3的两种有机化合物的1H核磁共振谱图。请判断哪一幅是CH3CH(OH)CH3的1H-NMR谱图,并说明理由。
( http: / / www.21cnjy.com )
答:
(2)写出下列有机物的结构简式
异戊烷 氯乙烷
丙烯 乙酸乙酯
(3)下图是维生素A的分子结构
( http: / / www.21cnjy.com )
维生素A中的含氧官能团是 (写名称)
维生素A的分子式是
(4)写出C3H5Cl的链状的所有同分异构体
答案
1-10 DCADB DCACB
11-15 B BC A AB D
16、(1)-74.8 kJ·mo ( http: / / www.21cnjy.com )l-1? (2)CH4(g)+2O2(g)==CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
17、(1) O2+4e-+2H2O-===4OH-
(2) 负极 Fe3++e-=Fe2+
(3) ①阳极 2H+ + 2e-===H2
②2Cu2+ + 2 H2O ===2 Cu + O2↑ +4H+ (2分) ③224 mL (2分)
18、(1) 1∶1 (2)变小 不变 (3)逆向
19、(1) ③④②① (2)⑥④⑤⑦
(3)c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
(4) >
20、Ⅰ(1)100mL容量瓶 (2) 酚酞
(3)碱式滴定管 0.60 (4)溶液由无色恰好变为红色,且半分钟内不褪色
Ⅲ(1)4.5 (2)a b
因 。
21、(1)a、c、d(各1分)
(2)2Fe2+ + ClO— + 2H+ = Cl— +2Fe3++ H2O;MgCO3 + H2O△Mg(OH)2+ CO2↑(各3分)
(3)使Mg2+以外的杂质尽可能彻底地转化为沉淀除去(2分)
(4)坩埚 (2分)
(5)Mg(OH)2(s) Mg2+ (aq)+ 2OH-(aq); NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动(3分)。
22、(1)A是CH3CH(OH)CH3的1H-NMR谱图
因为从结构上分析,CH3C ( http: / / www.21cnjy.com )H(OH)CH3有三种不同化学环境的H,而分析CH3CH2CH2OH有四种不同的H,故从图上分析,A上有三个峰,而B有四个峰,故A是CH3CH(OH)CH3的1H-NMR谱图。
略
班级___________ 姓名____________ 考试号___________
………………………………密……………………………………封……………………………………线…………………………………
A
B
电解
同课章节目录
