2.3.1 认识氧化还原反应 课件 (共15张PPT)
文档属性
| 名称 | 2.3.1 认识氧化还原反应 课件 (共15张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 337.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-13 00:00:00 | ||
图片预览




文档简介
(共15张PPT)
第2章 元素与物质世界
第1课时 认识氧化还原反应
第3节 氧化还原反应
联想&质疑
写出下列反应的化学方程式:
1、Cu在加热条件下与O2反应:
2、CuO在加热条件下与H2反应:
3、CuSO4溶液中插入铁片:
4、CuSO4溶液与NaOH溶液混合:
Fe + CuSO4 === Cu + FeSO4
2NaOH + CuSO4 === Cu(OH)2↓ + Na2SO4
O2 +2Cu === 2CuO
△
H2 +CuO === Cu + H2 O
△
联想&质疑
标出元素化合价:
O2 +2Cu === 2CuO
H2 +CuO === Cu + H2 O
Fe + CuSO4 === Cu + FeSO4
2NaOH + CuSO4 === Cu(OH)2↓ + Na2SO4
0 0 +2-2
0 +2 0 +1
0 +2 0 +2
+1-2+1 +2+6–2 +2 –2+1 +1 +6-2
有化合价变化的反应称为:氧化还原反应
没有化合价变化的反应称为:非氧化还原反应
△
△
氧化还原反应
1、定义
反应中有元素化合价变化的化学反应称为氧化还原反应。
2、宏观特征
反应中无元素化合价变化的化学反应称为非氧化还原反应。
反应过程中有元素化合价变化
强化训练
判断下列反应是否属于氧化还原反应
属于四大基本反应中哪一类
2NO + O2 == 2NO2
CO2 + CaO = CaCO3
CaCO3 == CaO + CO2↑
2H2O2 == 2H2O + O2 ↑
Zn +CuSO4 == ZnSO4 + Cu
HCl + KOH == KCl + H2O
氧化还原反应
非氧化还原反应
非氧化还原反应
氧化还原反应
氧化还原反应
非氧化还原反应
化合反应
分解反应
分解反应
置换反应
复分解反应
化合反应
氧化还原反应与四大基本反应类型的关系
氧化还原反应
置换反应
化合反应
分解反应
复分解反应
氧化反应与还原反应
O2 +Cu === CuO
△
H2 +CuO === Cu + H2 O
△
Fe + CuSO4 === Cu + FeSO4
0 0 +2-2
0 +2 0 +1
0 +2 0 +2
反应物中元素
化合价升高
反应物中元素
化合价降低
Cu
H2
Fe
O2
CuO
CuSO4
发生氧化反应
发生还原反应
氧化反应与还原反应
1、定义
反应中所含元素化合价升高的反应。 氧化反应
反应中所含元素化合价降低的反应。 还原反应
升氧
降还
强化训练
下列变化中,属于氧化反应的是,属于还原反应的是
Cl- → Cl2
FeCl2 → FeCl3
C → CO2
KMnO4 → MnO2
HCl → H2
Mg → Mg2+
CuO → Cu
Cl- → AgCl
氧
氧
氧
还
还
氧
还
Cl
Na
失去e-
得到e-
Na+
Cl-
Na+
[ Cl ]-
失去e-
得到e-
0 0 +1 -1
2Na+Cl2===2NaCl
点燃
化合价升降的原因:电子的转移
交流&研讨
思考:在氧化还原反应中,元素化合价为什么会变化 ?
1、Na与Cl2反应
交流&研讨
2、Fe与CuSO4溶液反应
实验现象之一是电流表指针发生偏转
Fe + CuSO4==== FeSO4 + Cu
0
+2
+2
0
得到2e-
失去2e-
氧化还原反应的实质
氧化还原反应的实质
——电子的转移
原子或离子失电子
→
元素化合价升高
→
发生氧化反应
原子或离子得电子
→
元素化合价降低
→
发生还原反应
升、失、氧
降、得、还
得失电子总数相同
2Na + Cl2 ==== 2NaCl
点燃
0
0
+1
-1
失e-×2,化合价升高,氧化反应
得e-×2,化合价降低,还原反应
2Na + Cl2 ==== 2NaCl
点燃
0
0
+1
-1
2e-
双线桥
单线桥
氧化还原反应的表示方法
Fe + Cu2+ ==== Fe2+ + Cu
+2
0
+2
0
失2e-,化合价升高,氧化反应
得2e-,化合价降低,还原反应
Fe + Cu2+ ==== Fe2+ + Cu
+2
0
+2
0
2e-
注意事项
①箭头、箭尾指向化合价变化的同种元素。
②必须注明“得到”或“失去”字样。
③失去电子总数与得到电子总数相等。
注意事项
①单线桥必须画在反应物中。
②箭头指向得电子元素,箭尾指向失电子元素。
③标明电子转移的总数,不标
“得、失”。
氧化还原反应的表示方法
强化训练
用单线桥和双线桥法标出下列反应的电子转移情况:
SiO2 + 2C == Si + 2CO ↑
高温
2Na + 2H2O == 2NaOH + H2 ↑
4HCl (浓) + MnO2 == MnCl2 + Cl2 ↑ + 2H2O
Cu + 2H2SO4(浓) == CuSO4 + SO2 ↑ + 2H2O
△
△
第2章 元素与物质世界
第1课时 认识氧化还原反应
第3节 氧化还原反应
联想&质疑
写出下列反应的化学方程式:
1、Cu在加热条件下与O2反应:
2、CuO在加热条件下与H2反应:
3、CuSO4溶液中插入铁片:
4、CuSO4溶液与NaOH溶液混合:
Fe + CuSO4 === Cu + FeSO4
2NaOH + CuSO4 === Cu(OH)2↓ + Na2SO4
O2 +2Cu === 2CuO
△
H2 +CuO === Cu + H2 O
△
联想&质疑
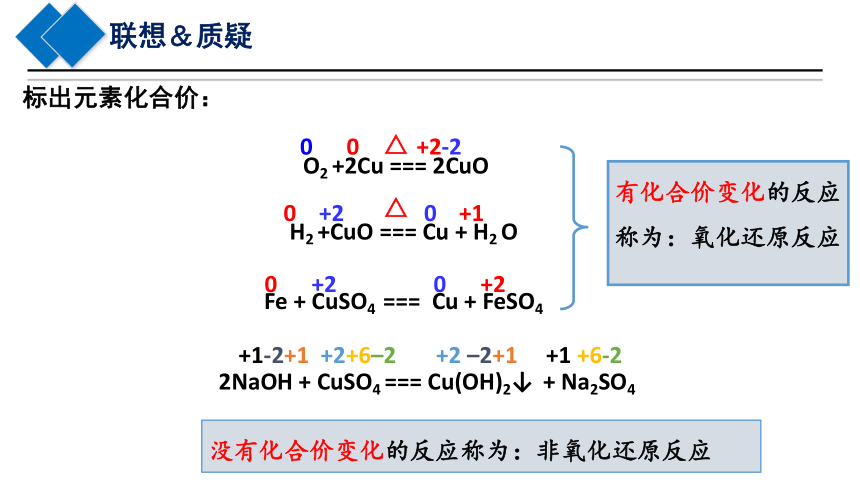
标出元素化合价:
O2 +2Cu === 2CuO
H2 +CuO === Cu + H2 O
Fe + CuSO4 === Cu + FeSO4
2NaOH + CuSO4 === Cu(OH)2↓ + Na2SO4
0 0 +2-2
0 +2 0 +1
0 +2 0 +2
+1-2+1 +2+6–2 +2 –2+1 +1 +6-2
有化合价变化的反应称为:氧化还原反应
没有化合价变化的反应称为:非氧化还原反应
△
△
氧化还原反应
1、定义
反应中有元素化合价变化的化学反应称为氧化还原反应。
2、宏观特征
反应中无元素化合价变化的化学反应称为非氧化还原反应。
反应过程中有元素化合价变化
强化训练
判断下列反应是否属于氧化还原反应
属于四大基本反应中哪一类
2NO + O2 == 2NO2
CO2 + CaO = CaCO3
CaCO3 == CaO + CO2↑
2H2O2 == 2H2O + O2 ↑
Zn +CuSO4 == ZnSO4 + Cu
HCl + KOH == KCl + H2O
氧化还原反应
非氧化还原反应
非氧化还原反应
氧化还原反应
氧化还原反应
非氧化还原反应
化合反应
分解反应
分解反应
置换反应
复分解反应
化合反应
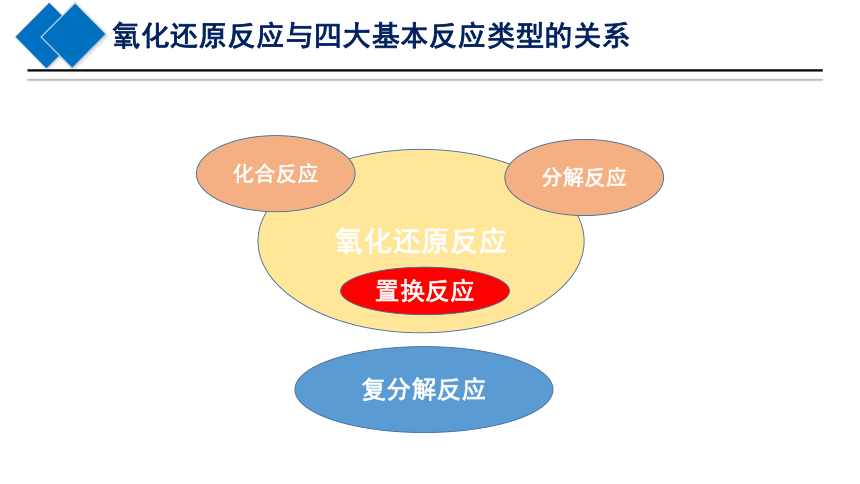
氧化还原反应与四大基本反应类型的关系
氧化还原反应
置换反应
化合反应
分解反应
复分解反应
氧化反应与还原反应
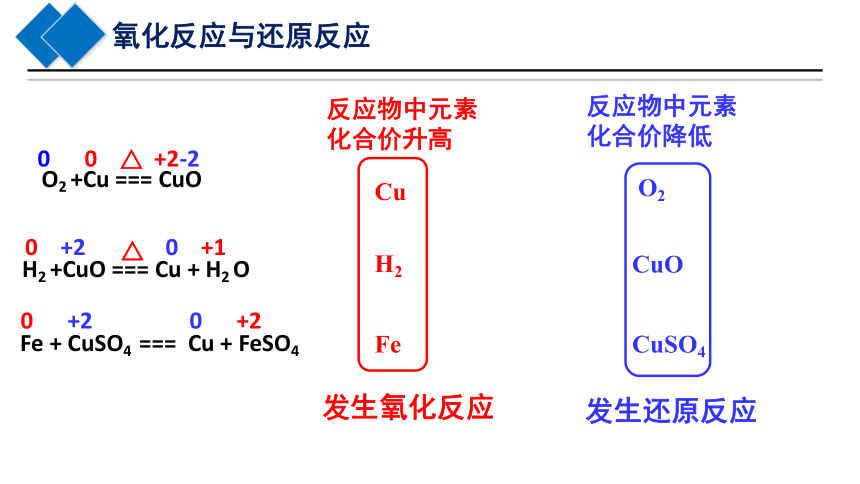
O2 +Cu === CuO
△
H2 +CuO === Cu + H2 O
△
Fe + CuSO4 === Cu + FeSO4
0 0 +2-2
0 +2 0 +1
0 +2 0 +2
反应物中元素
化合价升高
反应物中元素
化合价降低
Cu
H2
Fe
O2
CuO
CuSO4
发生氧化反应
发生还原反应
氧化反应与还原反应
1、定义
反应中所含元素化合价升高的反应。 氧化反应
反应中所含元素化合价降低的反应。 还原反应
升氧
降还
强化训练
下列变化中,属于氧化反应的是,属于还原反应的是
Cl- → Cl2
FeCl2 → FeCl3
C → CO2
KMnO4 → MnO2
HCl → H2
Mg → Mg2+
CuO → Cu
Cl- → AgCl
氧
氧
氧
还
还
氧
还
Cl
Na
失去e-
得到e-
Na+
Cl-
Na+
[ Cl ]-
失去e-
得到e-
0 0 +1 -1
2Na+Cl2===2NaCl
点燃
化合价升降的原因:电子的转移
交流&研讨
思考:在氧化还原反应中,元素化合价为什么会变化 ?
1、Na与Cl2反应
交流&研讨
2、Fe与CuSO4溶液反应
实验现象之一是电流表指针发生偏转
Fe + CuSO4==== FeSO4 + Cu
0
+2
+2
0
得到2e-
失去2e-
氧化还原反应的实质
氧化还原反应的实质
——电子的转移
原子或离子失电子
→
元素化合价升高
→
发生氧化反应
原子或离子得电子
→
元素化合价降低
→
发生还原反应
升、失、氧
降、得、还
得失电子总数相同
2Na + Cl2 ==== 2NaCl
点燃
0
0
+1
-1
失e-×2,化合价升高,氧化反应
得e-×2,化合价降低,还原反应
2Na + Cl2 ==== 2NaCl
点燃
0
0
+1
-1
2e-
双线桥
单线桥
氧化还原反应的表示方法
Fe + Cu2+ ==== Fe2+ + Cu
+2
0
+2
0
失2e-,化合价升高,氧化反应
得2e-,化合价降低,还原反应
Fe + Cu2+ ==== Fe2+ + Cu
+2
0
+2
0
2e-
注意事项
①箭头、箭尾指向化合价变化的同种元素。
②必须注明“得到”或“失去”字样。
③失去电子总数与得到电子总数相等。
注意事项
①单线桥必须画在反应物中。
②箭头指向得电子元素,箭尾指向失电子元素。
③标明电子转移的总数,不标
“得、失”。
氧化还原反应的表示方法
强化训练
用单线桥和双线桥法标出下列反应的电子转移情况:
SiO2 + 2C == Si + 2CO ↑
高温
2Na + 2H2O == 2NaOH + H2 ↑
4HCl (浓) + MnO2 == MnCl2 + Cl2 ↑ + 2H2O
Cu + 2H2SO4(浓) == CuSO4 + SO2 ↑ + 2H2O
△
△
