2.3.3 氧化还原反应的规律 课件(共14张PPT)
文档属性
| 名称 | 2.3.3 氧化还原反应的规律 课件(共14张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 19.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-13 21:41:49 | ||
图片预览






文档简介
(共14张PPT)
鲁科版 必修一 第二章 第三节氧化还原反应
第3课时 氧化还原反应的规律
学习目标
1.了解氧化还原反应的基本规律并能用规律解决问题。
2.能够对物质氧化性还原性进行比较。
3.能够利用氧化还原反应实现物质的转化。
氧化还原反应规律
电子守恒规律:
氧化剂得电子总数=还原剂失电子总数
元素化合价降低的总数=元素化合价升高的总数
应用:
氧化还原方程式的配平,氧化还原相关计算及正误判断
歧化规律:
某元素的中间价态在适宜条件下同时向较高和较低的价态转化
归中规律:
“只靠拢,不交叉”“就近变价”
价态规律:
元素处于最高价态时,只有氧化性
元素处于中间价态时,既有氧化性又有还原性
元素处于最低价态时,只有还原性
口诀:高价氧,低价还,中间价态两边转
应用:判断物质的氧化性,还原性
思考:为什么KMnO4做氧化剂?
1.某元素在化学反应中由化合态变成游离态,则该元素( )
A.一定被氧化
B.一定被还原
C.可能被氧化也可能被还原
D.以上都不是
C
2.从氮元素的化合价判断,下列物质只能具有还原性的是 ( )
A.NH3 B.NO C.NO2 D.HNO3
A
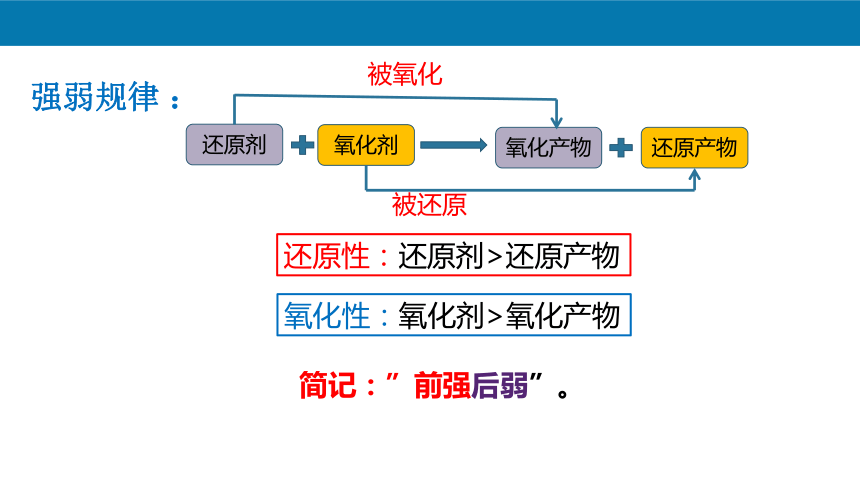
强弱规律 :
氧化剂
还原剂
还原产物
氧化产物
被氧化
被还原
还原性:还原剂>还原产物
氧化性:氧化剂>氧化产物
简记:”前强后弱”。
应用:
比较物质氧化性或还原性的强弱
判断氧化还原反应能否进行
在适宜条件下,用氧化性强的物质制备氧化性弱的物质或用还原性强的物质制备还原性弱的物质
3.已知如下反应:2HI+H2SO4(浓)===I2+SO2↑+2H2O;I2+SO2+2H2O===2HI+H2SO4(稀)。有关上述反应的结论正确的是 ( )
A.上述两个反应是相互矛盾的
B.氧化性:浓硫酸>I2>稀硫酸
C.氧化性:I2>浓硫酸>稀硫酸
D.无法比较浓硫酸、I2、稀硫酸的氧化性
B
4.根据下列反应进行判断,下列各微粒氧化能力由强到弱的顺序正确的( )
①2MnO2+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
②2FeCl3+2KI===2FeCl2+2KCl+I2
③2FeCl2+Cl2===2FeCl3
A.MnO2>Cl2>Fe3+>I2 B.Cl->Mn2+>I->Fe2+
C.MnO2>Cl2>I2>Fe3+ D.I->Fe2+>Cl->Mn2+
A
先后规律:
(1)同一种氧化剂与多种还原剂反应时,还原性强的还原剂先被氧化。
(2)同一种还原剂与多种氧化剂反应时,氧化性强的氧化剂先被还原。
谁强谁优先
应用:
判断物质的氧化性、还原性强弱
判断反应的先后顺序
5.在一定条件下,下列微粒的还原性由弱到强的顺序为Cl-由此判断,以下各反应在溶液中不能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
B.2Fe2++Cl2=== 2Fe3++2Cl-
C.I2+SO2+2H2O===4H++SO42-+2I-
D.2Br-+4H++SO42-===Br2+SO2↑+2H2O
D
①根据反应原理判断
②依据金属、非金属的活动性顺序判断
如:Fe+CuSO4=FeSO4+Cu
还原性:Fe>Cu
在反应中Fe是_____剂,
Cu是_____产物。
如:Cl2+2NaBr=2NaCl+Br2
氧化性:Cl2>Br2
在反应中Cl2是_____剂,
Br2是_____产物。
氧化性还原性强弱比较的方法
③依据反应条件和剧烈程度
当不同氧化剂分别与同一还原剂反应时,如果氧化产物价态相同,反应越容易,该氧化剂氧化性就越强
如:MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
△
氧化性: KMnO4 MnO2
>
④依据相同条件下氧化还原反应的程度判断
不同氧化剂作用于同一还原剂,氧化产物价态高的氧化性越强
如:2Fe+3Cl2==2FeCl3, Fe+S==FeS,
氧化性:Cl2 S
>
物质的氧化性和还原性受以下因素的影响
(1)温度:
浓硫酸(热)的氧化性大于浓硫酸(冷)
(2)浓度:
H2SO4(浓) 的氧化性大于 H2SO4(稀)
(3)酸碱性:
点燃
△
KMnO4的氧化性随酸性增强而增强
课堂总结
氧化还原反应的规律
(一)电子守恒规律
(二)歧化规律
(三)归中规律
(四)价态规律
(五)强弱规律
鲁科版 必修一 第二章 第三节氧化还原反应
第3课时 氧化还原反应的规律
学习目标
1.了解氧化还原反应的基本规律并能用规律解决问题。
2.能够对物质氧化性还原性进行比较。
3.能够利用氧化还原反应实现物质的转化。
氧化还原反应规律
电子守恒规律:
氧化剂得电子总数=还原剂失电子总数
元素化合价降低的总数=元素化合价升高的总数
应用:
氧化还原方程式的配平,氧化还原相关计算及正误判断
歧化规律:
某元素的中间价态在适宜条件下同时向较高和较低的价态转化
归中规律:
“只靠拢,不交叉”“就近变价”
价态规律:
元素处于最高价态时,只有氧化性
元素处于中间价态时,既有氧化性又有还原性
元素处于最低价态时,只有还原性
口诀:高价氧,低价还,中间价态两边转
应用:判断物质的氧化性,还原性
思考:为什么KMnO4做氧化剂?
1.某元素在化学反应中由化合态变成游离态,则该元素( )
A.一定被氧化
B.一定被还原
C.可能被氧化也可能被还原
D.以上都不是
C
2.从氮元素的化合价判断,下列物质只能具有还原性的是 ( )
A.NH3 B.NO C.NO2 D.HNO3
A
强弱规律 :
氧化剂
还原剂
还原产物
氧化产物
被氧化
被还原
还原性:还原剂>还原产物
氧化性:氧化剂>氧化产物
简记:”前强后弱”。
应用:
比较物质氧化性或还原性的强弱
判断氧化还原反应能否进行
在适宜条件下,用氧化性强的物质制备氧化性弱的物质或用还原性强的物质制备还原性弱的物质
3.已知如下反应:2HI+H2SO4(浓)===I2+SO2↑+2H2O;I2+SO2+2H2O===2HI+H2SO4(稀)。有关上述反应的结论正确的是 ( )
A.上述两个反应是相互矛盾的
B.氧化性:浓硫酸>I2>稀硫酸
C.氧化性:I2>浓硫酸>稀硫酸
D.无法比较浓硫酸、I2、稀硫酸的氧化性
B
4.根据下列反应进行判断,下列各微粒氧化能力由强到弱的顺序正确的( )
①2MnO2+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
②2FeCl3+2KI===2FeCl2+2KCl+I2
③2FeCl2+Cl2===2FeCl3
A.MnO2>Cl2>Fe3+>I2 B.Cl->Mn2+>I->Fe2+
C.MnO2>Cl2>I2>Fe3+ D.I->Fe2+>Cl->Mn2+
A
先后规律:
(1)同一种氧化剂与多种还原剂反应时,还原性强的还原剂先被氧化。
(2)同一种还原剂与多种氧化剂反应时,氧化性强的氧化剂先被还原。
谁强谁优先
应用:
判断物质的氧化性、还原性强弱
判断反应的先后顺序
5.在一定条件下,下列微粒的还原性由弱到强的顺序为Cl-
A.2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
B.2Fe2++Cl2=== 2Fe3++2Cl-
C.I2+SO2+2H2O===4H++SO42-+2I-
D.2Br-+4H++SO42-===Br2+SO2↑+2H2O
D
①根据反应原理判断
②依据金属、非金属的活动性顺序判断
如:Fe+CuSO4=FeSO4+Cu
还原性:Fe>Cu
在反应中Fe是_____剂,
Cu是_____产物。
如:Cl2+2NaBr=2NaCl+Br2
氧化性:Cl2>Br2
在反应中Cl2是_____剂,
Br2是_____产物。
氧化性还原性强弱比较的方法
③依据反应条件和剧烈程度
当不同氧化剂分别与同一还原剂反应时,如果氧化产物价态相同,反应越容易,该氧化剂氧化性就越强
如:MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
△
氧化性: KMnO4 MnO2
>
④依据相同条件下氧化还原反应的程度判断
不同氧化剂作用于同一还原剂,氧化产物价态高的氧化性越强
如:2Fe+3Cl2==2FeCl3, Fe+S==FeS,
氧化性:Cl2 S
>
物质的氧化性和还原性受以下因素的影响
(1)温度:
浓硫酸(热)的氧化性大于浓硫酸(冷)
(2)浓度:
H2SO4(浓) 的氧化性大于 H2SO4(稀)
(3)酸碱性:
点燃
△
KMnO4的氧化性随酸性增强而增强
课堂总结
氧化还原反应的规律
(一)电子守恒规律
(二)歧化规律
(三)归中规律
(四)价态规律
(五)强弱规律
